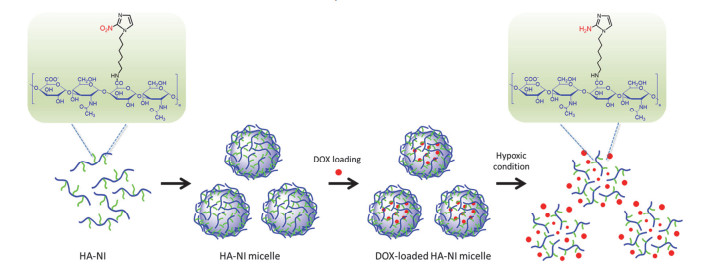
 图式 1
载药胶束的自组装行为以及在缺氧环境下胶束中药物释放的示意图
Scheme1.
Illustration of self-assembly of DOX-loaded HA-NI micelles and the drug release characteristics of micelles under hypoxic condition
图式 1
载药胶束的自组装行为以及在缺氧环境下胶束中药物释放的示意图
Scheme1.
Illustration of self-assembly of DOX-loaded HA-NI micelles and the drug release characteristics of micelles under hypoxic condition

Citation: Zhang Bei, Chang Baisong, Sun Taolei. Synthesis and Study of Hypoxia-Responsive Micelles Based on Hyaluronic Acid[J]. Acta Chimica Sinica, 2018, 76(1): 35-42. doi: 10.6023/A17070336

基于透明质酸的缺氧响应型胶束的制备及性能研究
English
Synthesis and Study of Hypoxia-Responsive Micelles Based on Hyaluronic Acid
-
Key words:
- drug delivery system
- / hypoxia-responsive
- / hyaluronic acid
- / nitroimidazole
- / micelles
-
1 引言
到目前为止, 手术切除联合局部放疗、系统化疗是临床上治疗癌症最为常用的手段[1, 2].然而, 众多高效的化疗药物如紫杉醇、阿霉素和顺铂等因其低溶解度、高毒副作用以及容易产生耐药性等不足, 给治疗方案的制定和实施带来了极大的困难, 限制了肿瘤的临床治疗效果.因此, 癌症仍然是一种严重威胁人类生命健康的全球性疾病.
针对肿瘤临床治疗的迫切需要, 以纳米材料为基础的抗癌药物载体应运而生[3~8], 它显著增强了小分子化疗药物的水溶性和体内稳定性, 改善了药代动力学特性, 在整体提高抑瘤效率的同时进一步降低了对机体的副作用.
缺氧是实体肿瘤的重要特征[9, 10].肿瘤的快速增殖造成了肿瘤组织中氧气的消耗速率远大于供给速率, 虽然肿瘤的增殖会刺激血管生成, 但这些血管在空间及微观结构上存在异常, 难以起到调节血流的作用[11], 因此造成缺氧微环境.在正常组织中氧分压约为9.3 kPa, 在肿瘤发生部位可低至0 kPa[12].肿瘤缺氧是造成不良预后的重要因素之一[13], 但肿瘤缺氧的普遍性也为发展具有缺氧响应的药物载体提供了广阔的平台.利用正常组织与肿瘤组织在氧含量上的巨大差异, 缺氧响应型药物载体可实现更为可控的释放行为.硝基咪唑(NI)类化合物是一类具有缺氧响应的化合物, 在肿瘤组织的缺氧区域, 硝基还原酶(NTR)具有更高的浓度, 在NTR与辅酶的作用下, NI可初步还原为NI自由基阴离子, NI自由基阴离子在常氧环境下重新氧化为NI, 而在缺氧环境下会进一步还原, 最终可生成氨基咪唑[14~16].
透明质酸(HA)是由D-葡萄糖醛酸及N-乙酰氨基葡萄糖通过1→4糖苷键连接组成的天然阴离子粘多糖, 可以与肿瘤表面过表达的CD44受体发生特异性相互作用, 提高肿瘤细胞对HA的结合、内吞能力[17~20]. HA具有可降解性、生物相容性、无毒性、非免疫原性等性质[21]; 且骨架上含有大量的羧基、羟基, 易于进行功能性的修饰, 因此广泛应用于靶向药物载体的制备[22~24].我们选用HA作为亲水骨架, 通过酰胺反应接枝疏水性的2-硝基咪唑(2-NI), 制备出一种具有缺氧刺激响应的靶向药物载体, 并用于负载抗癌药物阿霉素(DOX).常氧环境下, 该两亲性聚合物在疏水作用力的驱动下自组装形成胶束并保持稳定; 在缺氧环境下, NI还原成氨基咪唑, 发生了从疏水性到亲水性的转变, 因此胶束散开, 药物快速释放(图式 1).本工作采用超声法制备了空白、载药胶束, 利用DLS、AFM、TEM等表征胶束的相关性质, 并着重探究了该胶束的缺氧响应性及药物释放特性.
 图式 1
载药胶束的自组装行为以及在缺氧环境下胶束中药物释放的示意图
Scheme1.
Illustration of self-assembly of DOX-loaded HA-NI micelles and the drug release characteristics of micelles under hypoxic condition
图式 1
载药胶束的自组装行为以及在缺氧环境下胶束中药物释放的示意图
Scheme1.
Illustration of self-assembly of DOX-loaded HA-NI micelles and the drug release characteristics of micelles under hypoxic condition
2 结果与讨论
2.1 硝基咪唑衍生物接枝透明质酸的合成和表征
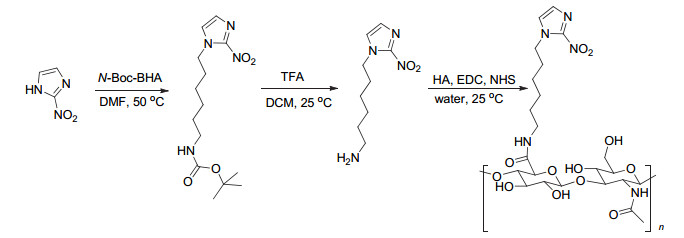
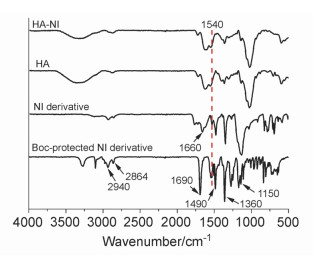
接枝聚合物的制备过程如图式 2所示, 首先以2-硝基咪唑(2-NI)和N-Boc-溴己胺(N-Boc-BHA)为原料经过两步反应制备了NI衍生物, 随后通过酰胺反应接枝到HA上.每步产物都用红外和核磁进行了表征.首先对第一步产物即Boc基团保护的NI衍生物用红外进行表征, 图 1中, 1540和1360 cm-1处分别为NO2的反对称和对称伸缩振动峰, 2940和2864 cm-1处为CH3及CH2的伸缩振动峰, 1490 cm-1处为CH3及CH2的弯曲伸缩振动峰, 1150 cm-1处为C—C的伸缩振动峰, 这些峰证实了烷烃链的引入.脱保护后1690 cm-1处酰胺键中C=O的伸缩振动峰消失, 取而代之的是1660 cm-1处NH2的伸缩振动峰.与空白HA相比, 接枝后的HA在1540 cm-1处NO2的反对称伸缩振动峰有所加强, 可初步判断接枝的成功.
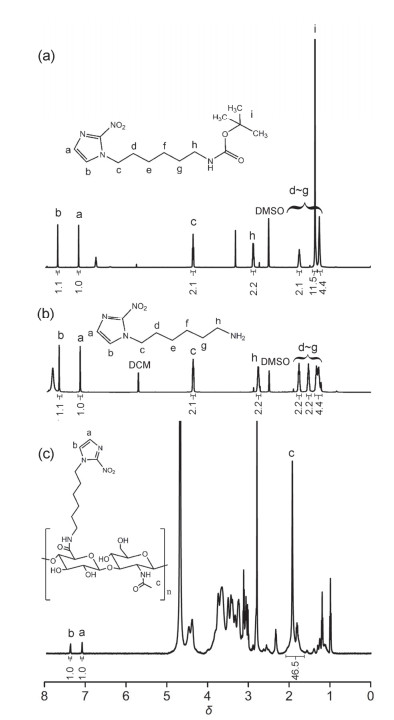
此外, 各阶段的产物还通过核磁表征, 如图 2所示.对比图 2a, 2b可以看出, δ 1.31处Boc基团的甲基质子峰已经消失, 证明了Boc基团的脱去.为进一步确认NI衍生物的合成, 对其进行了质谱测试, 结果如图S1(见Supporting Information), NI衍生物分子式为C9H16N4O2, 理论分子量为212.13, 质谱结果为213.15 [M+H]+, 是结合了一个质子的分子量, 与理论分子量相一致, 因此结合核磁图(图 2a, 2b)可证明成功合成了NI衍生物. 图 2c为HA-NI接枝聚合物的核磁图, 可以观察到在δ 7.11, 7.39处分别出现了咪唑环上的两个质子峰, 最终证实NI的成功修饰.
取代度(DS)表征HA上接枝NI的多少, 可通过核磁计算得到.计算公式如Eq. 1.[25]
其中(∫a+∫b)为图 2c中咪唑环上两个氢(NCH=C, N=CH)的积分面积和, ∫c为透明质酸上乙酰甲基氢(NHCO-CH3)的积分面积.总的来说, 取代度随着NI衍生物投料的增加而增加.本实验共设计了三个投料比, 即n(HA):n(NI)衍生物为1:0.5, 1:1和1:2.当投料比从1:0.5增加到1:1时, 取代度从3.6%增加到5.7%, 有较大的增加; 当投料比从1:1增加到1:2时, 取代度从5.7%增加到6.5%, 仅增加了0.8%.经分析可能有两个原因:首先是该接枝反应在水中进行, 而合成的NI衍生物烷烃链段较长, 一开始投料比较低即NI衍生物加入量较少时可完全溶解, 但随着投料比增加到1:2时, 可以观察到加入的NI衍生物并不能完全溶解, 故不能完全反应; 其次是随着反应的进行, 越来越多的NI接枝到HA上, 疏水作用力的增强使得聚合物链段由原来的伸展变得团缩, 羧基不易暴露在外, 降低了与氨基的反应几率, 因此取代度增加不显著.为方便描述, 将三个不同取代度的接枝聚合物分别命名为HA-NI6.5, HA-NI5.7和HA-NI3.6.
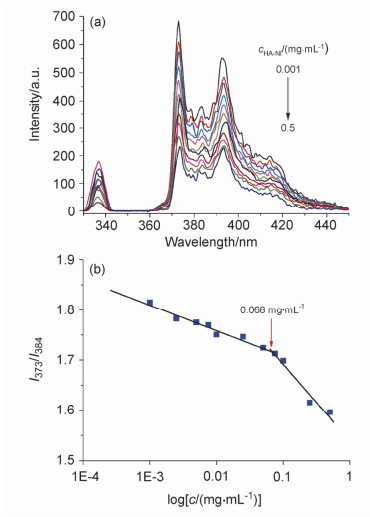
临界胶束浓度(CMC)是表征聚合物胶束稳定性的重要参数, 对用于负载药物的聚合物胶束而言, 在注射入静脉后会经历极度稀释的状态, CMC值越小表示胶束抗稀释能力越强, 即保持自身结构的能力越强, 可以有效防止负载药物的提前泄露[20].采取芘荧光探针法测定CMC, 芘是一种具有五重发射峰的疏水荧光物质, 其中一重峰(373 nm)和三重峰(384 nm)的比值随着环境极性的变化而变化, 当聚合物达到临界胶束浓度时, 进入胶束的芘所处的环境发生了极性的变化[26], 相应的I373/I384也会有一个突变, 该突变点对应的就是CMC.在图 3中可以看出HA-NI6.5的CMC值为0.068 mg/mL, 远低于一些小分子表面活性剂[27], 表明该胶束具有较强的抗稀释能力, 展示了其作为药物载体的潜力.
2.2 聚合物胶束的制备和表征
根据聚合物在水中的溶解性可以选择不同的方法制备聚合物胶束, 如超声法、透析法、乳化溶剂蒸发法、溶剂蒸发法等. HA的水溶性良好, 故选用超声法, 该方法具有操作简单、不需添加乳化剂和稳定剂等其他试剂的特点, 常用于制备HA体系的胶束[28, 29].溶胀的聚合物经过超声处理, 在疏水作用力的驱动下在水中自组装形成胶束.
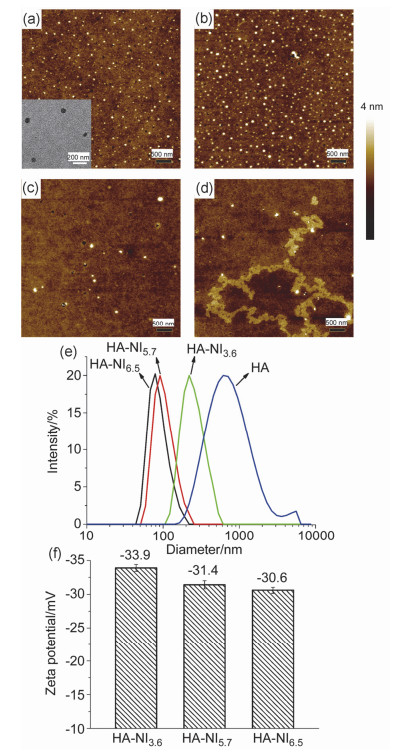
对HA-NI6.5, HA-NI5.7, HA-NI3.6以及空白HA采取了相同的超声处理, 并利用DLS, AFM和TEM表征胶束的大小和形貌.胶束的水合直径如图 4e所示, 随着接枝聚合物的取代度从3.6增加到6.5, 胶束从220 nm减小到80 nm, 取代度的增加意味着聚合物骨架上接枝了更多的NI, 在自组装时形成了更加致密的疏水内核, 胶束直径因此减小.空白HA的大小远大于接枝聚合物, 可能是HA分子链在水中形成无规线团并纠缠在了一起.胶束的形貌用AFM和TEM进行了表征, 图 4a~4c分别为HA-NI6.5, HA-NI5.7, HA-NI3.6胶束的AFM图, 图 4a中插入的是HA-NI6.5胶束的TEM图, 从图中可以看到, 聚合物胶束的大小随着取代度的减小从65 nm增加到200 nm. AFM和TEM表征的都是无水状态的胶束, 因而所得到的胶束大小比DLS的测量值小一些. 图 4d为空白HA的AFM图, 从图中可以看到没有胶束形成, 呈现为聚合物的聚集形态.
此外还测定了各取代度胶束的Zeta电位, 从图 4f中可以观察到随着取代度的增加, Zeta电位从-33.9±0.5 mV增加到-30.6±0.4 mV.接枝聚合物的负电荷主要由HA骨架上的羧基电离所提供, 取代度增加即更多的羧基与氨基反应, 因此造成Zeta电位的上升.
作为一种药物载体, 胶束在到达肿瘤部位前应具有良好的稳定性, 而胶束的稳定性可通过粒径的变化间接体现[14], 本工作通过测量一周内胶束在不同pH值或盐浓度中的粒径变化来表征其稳定性.分别测量了HA-NI6.5胶束在pH=5, 6, 7.4和盐浓度分别为0.05, 0.1, 0.15 mol·L-1环境中的粒径, 图S2(见Supporting Information)表明胶束在上述环境中均可以保持粒径基本不变, 稳定存在.
2.3 聚合物胶束的载药性能
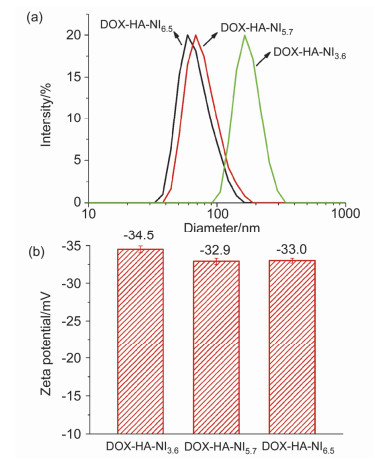
胶束的载药机理主要有两种, 一种是静电相互作用, 在pH=6.7的条件下, HA上的羧基带负电, 阿霉素(DOX)上的氨基带正电, DOX可以通过静电作用结合到HA上; 第二种是疏水相互作用, 除盐后的DOX疏水, 因而可通过疏水相互作用聚集在接枝聚合物侧链NI的周围.载药的聚合物胶束依然采用超声法制备.如图 5a所示, 与空白胶束相比, 载药胶束的粒径减小, 可能是DOX与NI发生了疏水相互作用, 使得胶束内核更加紧致, 因而粒径减小.此外还测定了载药胶束的Zeta电位值, 见图 5b, 发现载药前后胶束的电位基本保持不变, 由此可以推断药物进入胶束主要依靠疏水相互作用, 而非静电相互作用.
载药率(DL)和包封率(EE)是评价药物载体载药性能的重要指标, 可通过紫外-可见吸收光谱测量后计算得到.称取一定量的载药胶束直接溶解在有机溶剂中, 利用校准曲线可计算出具体的载药率.经计算, HA-NI6.5胶束的DL和EE分别为(6.0±0.2)%, (63.8±2.1)%; HA-NI5.7胶束的DL和EE分别为(5.7±0.2)%, (60.8±2.4)%; HA-NI3.6胶束的DL和EE分别为(2.6±0.1)%, (26.9±1.3)%.经对比可以发现, 胶束的载药性能随着取代度的增加而提高, 这也证实了前面的猜想, 取代度高意味着HA上引入了更多的NI, 疏水作用力增强, 因而可以负载更多的DOX.
2.4 聚合物胶束的缺氧响应性能
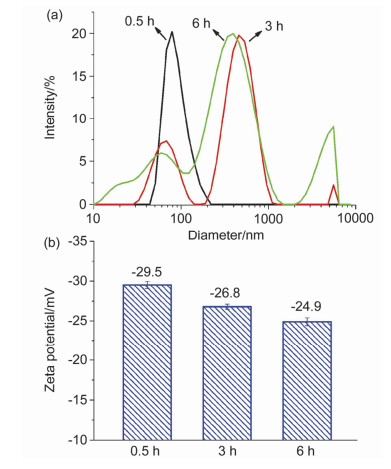
首先初步验证HA-NI6.5胶束的缺氧响应性.研究表明在肿瘤的缺氧区域, 硝基咪唑在NTR以及辅酶烟酰胺腺嘌呤二核苷酸(NADH)的作用下失去电子, 最终还原为氨基咪唑, 发生疏水到亲水的转变.基于这一原理, 我们假设自组装的胶束能对缺氧环境响应, 并在失去两亲性后散开.首先利用连二亚硫酸钠(Na2S2O4)构建一种缺氧环境[30], 图S3(见Supporting Information)显示, 在Na2S2O4加入1 h后, 水中的溶解氧降低至0.5 mg/mL, 并且这种缺氧环境在接下来的5 h内得到了良好的维持.为表征HA-NI6.5胶束在缺氧环境下的粒径变化, 分别在加入连二亚硫酸钠0.5, 3和6 h后利用DLS测量粒径.在图 6a中可以看到, 0.5 h时粒径没有发生较大变化; 3 h时粒径变大, 分布变宽, 多分散系数(PDI)由原来的0.10增加到0.42, 说明胶束发生溶胀或聚集; 6 h时粒径分布进一步变宽, PDI增加到0.86, 且有小的粒子出现, 说明溶胀的胶束已经开始解体.
利用AFM和TEM可以更直接的观察胶束形貌的变化. 图 4a中插入的TEM图表明原始的胶束形貌完整, 分布均匀, 图 7a, 7d对应的是0.5 h时胶束的AFM图和TEM图, 此时胶束形貌仍然完整; 图 7b, 7e对应的是3 h时胶束的AFM和TEM图, 这时胶束的形貌遭到破坏, 可以清晰地看到胶束的溶胀变形, 与DLS数据吻合; 图 7c, 7f对应的是6 h时胶束的AFM和TEM图, 图中胶束已经散开并连成一片, 同时在视野中几乎观察不到球形粒子.基于上述现象, 我们推断胶束在缺氧响应前后发生了这样的变化:开始时, 胶束可以维持其形貌, 随着缺氧响应的深入, 原来的疏水内核逐渐变得亲水, 失去了两亲性的胶束开始溶胀变大并慢慢散开, 直到最终达到完全散开的状态.
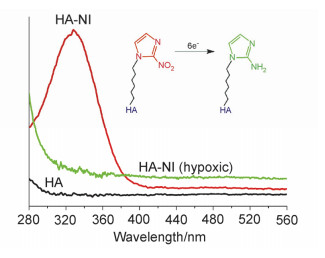
为进一步证明胶束的响应性, 分别测试了加入连二亚硫酸钠0.5, 3和6 h后胶束的Zeta电位值, 如图 6b所示, 电位随时间的增加上升, 并最终达到-24.9±0.5 mV.这是因为还原产物氨基咪唑带正电, 因此电位增加.此外还测定了响应前后聚合物胶束溶液的紫外吸收光谱, 如图 8所示, 325 nm处是硝基咪唑的特征峰, 与响应前的接枝聚合物相比, 响应后接枝聚合物于该处的特征峰消失, 意味着硝基咪唑的还原.
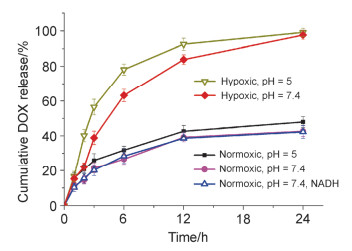
在初步证实了胶束的缺氧响应性后, 紧接着对DOX-HA-NI6.5胶束的药物释放特性进行了探究.首先在常氧环境下, PBS缓冲液中(pH=7.4)进行了载药胶束的药物释放实验, 如图 9所示, 结果表明在开始的6 h内, 释放介质中的药物浓度上升较快, 这是由于吸附在胶束表面以及没有进入胶束内核的药物通过自由扩散所引起的, 24 h后药物释放量稳定维持在40%.还对胶束在pH=5的常氧环境下的释药特性进行了研究, 图 9表明常氧环境下pH对药物释放影响不大, pH=5时的释放量略高于pH=7.4.
肿瘤的缺氧环境通过在缓冲液中加入NTR, NADH并持续通入氮气模拟.如图 9所示, 在缺氧环境下, pH=5和7.4时, 药物均可快速完全释放.前6 h内释放较快, 对应于pH=5, 7.4, 分别有78.1%, 63.2%的药物释放; 随后释放速度减缓, 并在24 h内基本完全释放.经对比发现, 在缺氧环境下, pH值越低药物释放越快.原因可能是pH值降低时, 胶束内包裹的阿霉素上的氨基质子化, 提高了在水中的溶解度, 因此在缺氧环境下胶束结构遭到破坏后可以快速地释放出来.而在加入NADH, 不通氮气的对照组中, 释药曲线显示没有快速释放的现象发生.药物释放实验再一次证实了胶束的缺氧响应性:在常氧环境下, 载药胶束稳定存在, 起到了防止突释的作用; 在缺氧环境下, 载药胶束迅速散开, 药物快速且完全地释放.总之, 该载药胶束具有缺氧响应性并具有应用于肿瘤治疗的潜力.
3 结论
通过酰胺反应在透明质酸上接枝了硝基咪唑, 并通过超声法制备了缺氧响应型聚合物胶束, 探究了该胶束的物理化学性质, 利用DLS, AFM, TEM等手段表征了聚合物胶束缺氧响应前后大小及形貌的变化, 并利用HPLC研究了胶束的药物释放特性.结果表明该聚合物胶束对缺氧具有响应性, 负载药物的胶束粒子在常氧环境下不会发生突释, 而在缺氧环境下药物可以快速完全地释放, 证明该胶束粒子具有作为抗癌药物载体的潜力, 并为药物控释体系的研究提供了新的思路.
4 实验部分
4.1 原料与仪器
2-硝基咪唑(2-NI)、三乙胺(TEA)、N-羟基琥珀酰亚胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCl)、连二亚硫酸钠(Na2S2O4)、烟酰胺腺嘌呤二核苷酸(NADH)购于阿拉丁试剂, 芘(pyrene)、硝基还原酶(NTR)购于Sigma Aldrich. 2-(叔丁氧基羰基-氨基)-溴己烷(N-Boc-溴己胺, N-Boc-BHA)购于上海韶远试剂有限公司, 透明质酸钠(HA,分子量120 kDa)购于镇江东元生物科技有限公司, 盐酸阿霉素(DOX·HCl)购于北京华奉联博化学材料有限公司, 碳酸钾、二氯甲烷、甲醇等购于国药试剂.
Mercury-300型核磁共振仪(美国Verian公司), Vertex 80V型傅立叶红外光谱仪(德国Bruker公司), micrOTOF-Q型质谱分析仪(德国Bruker公司), JY92-IIN型超声细胞破碎仪(中国宁波新芝生物科技股份有限公司), Nano-ZS90型动态光散射仪(英国Malvern公司), Multimode 8型原子力显微镜(德国Bruker公司), JEM-2100F STEM型透射电子显微镜(日本JEOL公司), UV-2550型紫外-可见吸收光谱仪(日本SHIMADZU公司), LS55型荧光分析仪(美国PerkinElmer公司), LC-20AT型高效液相色谱(日本SHIMADZU公司).
4.2 样品合成过程
4.2.1 2-NI衍生物的合成
称取0.34 g 2-NI (3 mmol)及0.83 g K2CO3 (6 mmol)加入含有5 mL N, N-二甲基甲酰胺(DMF)的圆底烧瓶, 取0.84 g N-Boc-溴己胺(N-Boc-BHA, 3 mmol)逐滴加入圆底烧瓶中, 于50 ℃, 700 r/min搅拌下反应12 h.旋干溶剂后加入15 mL乙酸乙酯, 用10 mL水萃取三次, 收集有机层, 无水Na2SO4干燥过夜, 过滤得滤液, 旋干溶剂得到淡黄色产物, 即Boc基团保护的2-NI衍生物(产率60%).将上一步产物溶于3.6 mL二氯甲烷, 加入1.8 mL三氟乙酸, 700 r/min搅拌反应2 h, 旋干溶剂, 加入甲醇并悬干, 如此反复三次, 得到黄色油状产物(产率90%).最终产物的结构用核磁和红外进行分析, 相对分子质量用质谱表征.
4.2.2 2-NI衍生物接枝透明质酸
在圆底烧瓶中加入0.1 g HA (120 kDa, 0.25 mmol), 取5 mL超纯水溶解, 加入0.192 g EDC·HCl (1 mmol), 0.115 g NHS (1 mmol), 冰浴活化30 min, 加入20 mg至80 mg (0.125~0.5 mmol) 2-NI衍生物, 室温下反应24 h.反应完毕转移至透析袋中(Mw=8000), 在甲醇/水(V: V=1:1)中透析1 d, 在水中透析2 d, 冻干得到硝基咪唑接枝的透明质酸.最终产物用核磁和红外进行结构分析.
4.3 胶束的制备和表征
空白胶束制备:取5 mg接枝后的透明质酸溶解于5 mL超纯水, 溶胀12 h制成1 mg/mL的聚合物溶液, 冰浴超声5 min(工作2 s, 间歇2 s, 粉碎机功率100 W), 3500 r/min离心15 min, 过0.45 μm滤膜即得聚合物胶束.胶束粒径分布和Zeta电位值用动态光散射仪(DLS)测量(pH=6.7).胶束的形貌用原子力显微镜(AFM)及透射电镜(TEM)表征.
胶束的稳定性:将制备的胶束粒子分散在不同pH值及盐浓度的缓冲液中并利用动态光散射仪(DLS)测量胶束在一周内的粒径变化.
载药胶束的制备:首先对盐酸阿霉素(DOX·HCl)除盐, 取5 mg DOX·HCl溶解于5 mL二甲亚砜(DMSO), 加入3 equiv三乙胺, 避光搅拌12 h.取5 mg接枝透明质酸溶解于5 mL超纯水, 溶胀12 h, 取0.5 mL DOX的DMSO溶液, 滴加入聚合物中, 充分搅拌4 h后冰浴超声10 min(工作2 s, 间歇2 s, 粉碎机功率100 W), 大量水透析一天(Mw=8000), 3500 r/min离心15 min, 过0.45 μm滤膜, 冻干即得负载DOX的聚合物胶束.胶束粒径分布和Zeta电位值用动态光散射仪(DLS)测量.
苾荧光探针法测量临界胶束浓度:配制浓度为6×10-6 mol·L-1的苾的丙酮溶液, 取1 mL加入10个棕色容量瓶中, 氮气吹干溶剂, 将制备好的1 mg/mL聚合物胶束依次稀释为0.5, 0.25, 0.1, 0.075, 0.05, 0.025, 0.01, 0.0075, 0.005, 0.0025, 0.001 mg/mL的胶束溶液, 加入10 mL棕色容量瓶中, 使苾的最终浓度为6×10-7 mol·L-1, 超声30 min后50 ℃水浴避光加热3 h, 室温振荡过夜.荧光激发波长设置为336 nm, 得到一系列第一个峰(373 nm)和第三个峰(384 nm)的比值I373/I384.以浓度的对数为横坐标, I373/I384为纵坐标作图, 转折点处即为临界胶束浓度.
4.4 药物的载药率(DL)和包封率(EE)
利用紫外-可见吸收光谱仪检测480 nm处的紫外吸光度可计算载药胶束的包封率和载药率.取一定质量冻干的载药胶束溶于甲酰胺/水(V:V=1:9)混合溶液, 避光超声0.5 h, 检测480 nm处的紫外吸光度, 可以算出药物的载药率和包封率.
4.5 缺氧响应实验
用化学还原剂Na2S2O4模拟缺氧还原环境, 在已制备的1 mg/mL的HA-NI6.5胶束溶液中加入Na2S2O4 (2 mmol·L-1), 分别于0.5, 3, 6 h取样并用DLS, AFM, TEM表征聚合物胶束粒径及形貌的变化.利用紫外-可见吸收光谱仪分析HA-NI6.5胶束响应前后的图谱, 并测定响应后HA-NI6.5的Zeta电位值.
Na2S2O4所构造缺氧环境的缺氧程度通过测量水中的溶解氧(Dissolved oxygen)表征, 利用上海雷磁JPB-607便携式溶解氧分析仪分析测定加入Na2S2O4后水中氧含量的变化, 使用前用空气校准法校准[31].
4.6 胶束释药特性
体外释药实验:取1.0 mg载药胶束溶于1 mL PBS缓冲液(pH=5, 7.4, 0.1 mol·L-1)后转移至透析袋中, 浸没于30 mL PBS缓冲液(pH=5, 7.4, 0.1 mol·L-1)中, 分别于1, 2, 3, 6, 12, 24 h取出3 mL用HPLC检测, 并补充3 mL新鲜释放介质.
缺氧环境释药实验:取1.0 mg载药胶束溶于1 mL PBS缓冲液(pH=5, 7.4, 0.1 mol·L-1)后转移至透析袋中, 浸没于30 mL PBS缓冲液(pH=5, 7.4, 0.1 mol·L-1)中, PBS缓冲液中包含100 μmol·L-1的烟酰胺腺嘌呤二核苷酸(NADH)和100 μg/mL的硝基还原酶(NTR), 期间持续通氮气保持缺氧环境.另做一组对照实验, 取1.0 mg载药胶束溶于1 mL PBS缓冲液(pH=7.4, 0.1 mol·L-1)转移至透析袋中, 浸没于30 mL PBS缓冲液(pH=7.4, 0.1 mol·L-1)中, 释放介质中加入100 μmol·L-1的NADH, 不通氮气.同样的, 分别于1, 2, 3, 6, 12, 24 h取出3 mL用HPLC检测, 并补充3 mL新鲜释放介质.释放的DOX用高效液相色谱(HPLC)定量分析, 从而画出相应的释放曲线.
-
-
[1]
Im, J. H.; Seong, J.; Lee, I. J.; Park, J. S.; Yoon, D. S.; Kim, K. S.; Lee, W. J.; Park, K. R. Cancer. Res. Treat. 2016, 48, 583. doi: 10.4143/crt.2015.091
-
[2]
Zhang, W. G.; Mao, J. H.; Zhu, W.; Jain, A. K.; Liu, K.; Brown, J. B.; Karpenb, G. H. Nat. Commun. 2016, 7, 12619. doi: 10.1038/ncomms12619
-
[3]
Zhang, P.; Qian, X. P.; Zhang, Z. K.; Li, C.; Xie, C.; Wu, W.; Jiang, X. Q. ACS. Appl. Mater. Interfaces 2017, 9, 5768. doi: 10.1021/acsami.6b14464
-
[4]
Mura, S.; Nicolas, J.; Couvreur, P. Nat. Mater. 2013, 12, 991. doi: 10.1038/nmat3776
-
[5]
Xu, T. L.; Gao, W.; Xu, L. P.; Zhang, X. J.; Wang, S. T. Adv. Mater. 2016, 29, 1603250. http://www.ncbi.nlm.nih.gov/pubmed/28026067
-
[6]
刘聪颖, 胡建华, 杨东, 杨武利, 化学学报, 2009, 67, 843. doi: 10.3321/j.issn:0567-7351.2009.08.022Liu, C. Y.; Hu, J. H.; Yang, D.; Yang, W. L. Acta Chim. Sinica 2009, 67, 843. doi: 10.3321/j.issn:0567-7351.2009.08.022
-
[7]
赵文静, 乔增莹, 段中余, 王浩, 化学学报, 2016, 74, 234. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxxb201603002&dbname=CJFD&dbcode=CJFQZhao, W. J.; Qiao, Z. Y.; Duan, Z. Y.; Wang, H. Acta Chim. Sinica 2016, 74, 234. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxxb201603002&dbname=CJFD&dbcode=CJFQ
-
[8]
胡齐, 李玉祥, 王静媛, 李亚鹏, 化学学报, 2015, 73, 416. doi: 10.3969/j.issn.0253-2409.2015.04.006Hu, Q.; Li, Y. X.; Wang, J. Y.; Li, Y. P. Acta Chim. Sinica 2015, 73, 416. doi: 10.3969/j.issn.0253-2409.2015.04.006
-
[9]
Wilson, W. R.; Hay, M. P. Nat. Rev. Cancer. 2011, 11, 393. doi: 10.1038/nrc3064
-
[10]
Zheng, X. C.; Wang, X.; Mao, H.; Wu, W.; Liu, B. R.; Jiang, X. Q. Nat. Commun. 2015, 6, 5834. doi: 10.1038/ncomms6834
-
[11]
H ckel, M.; Vaupel, P. J. Natl. Cancer. Inst. 2001, 93, 266. doi: 10.1093/jnci/93.4.266
-
[12]
Bertout, J. A.; Patel, S. A.; Simon, M. C. Nat. Rev. Cancer. 2008, 8, 967. doi: 10.1038/nrc2540
-
[13]
Harris, A. L. Nat. Rev. Cancer. 2002, 2, 38. doi: 10.1038/nrc704
-
[14]
Thambi, T.; Park, J. H.; Lee, D. S. Chem. Commun. 2016, 52, 8492. doi: 10.1039/C6CC02972H
-
[15]
Thambi, T.; Son, S.; Lee, D. S.; Park, J. H. Acta Biomater. 2016, 29, 261. doi: 10.1016/j.actbio.2015.10.011
-
[16]
Xu, K. H.; Wang, F.; Pan, X. H.; Liu, R. P.; Ma, J.; Kong, F. P.; Tang, B. Chem. Commun. 2013, 49, 2554. doi: 10.1039/c3cc38980d
-
[17]
Herrlich, P.; Sleeman, J.; Wainwright, D.; K nig, H.; Sherman, L.; Hilberg, F.; Ponta, H. Cell. Adhes. Commun. 1998, 6, 141. doi: 10.3109/15419069809004470
-
[18]
Hall, C. L.; Yang, B.; Yang, X.; Zhang, S.; Turley, M.; Samuel, S.; Lange, L. A.; Wang, C.; Curpen, G. D.; Savani, R. C.; Greenberg, A. H.; Turley, E. A. Cell 1995, 82, 19. doi: 10.1016/0092-8674(95)90048-9
-
[19]
Choi, K. Y.; Saravanakumar, G.; Park, J. H.; Park, K. Colloids Surf., B:Biointerfaces 2012, 99, 82. doi: 10.1016/j.colsurfb.2011.10.029
-
[20]
Liu, Y. H.; Sun, J.; Cao, W.; Yang, J. H.; Lian, H.; Li, X.; Sun, Y. H.; Wang, Y. J.; Wang, S. L.; He, Z. G. Int. J. Pharm. 2011, 421, 160. doi: 10.1016/j.ijpharm.2011.09.006
-
[21]
Oh, E. J.; Park, K.; Kim, K. S.; Kim, J.; Yang, J. A.; Kong, J. H.; Lee, M. Y.; Hoffman, A. S.; Hahn, S. K. J. Control. Release 2010, 141, 2. doi: 10.1016/j.jconrel.2009.09.010
-
[22]
Liu, Y. H.; Zhou, C. M.; Wang, W. P.; Yang, J. H.; Wang, H.; Hong, W.; Huang, Y. Mol. Pharm. 2016, 13, 4209. doi: 10.1021/acs.molpharmaceut.6b00870
-
[23]
Chen, Yi.; Li, H. H.; Deng, Y. Y.; Sun, H. F.; Ke, X.; Ci, T. Y. Acta Biomater. 2017, 51, 374. doi: 10.1016/j.actbio.2016.12.004
-
[24]
Šmejkalová, D.; Muthn , T.; Nešporová, K.; Hermannová, M.; Achbergerová, E.; Huerta-Angeles, G.; Svoboda, M.; Čepa, M.; Machalová, V.; Luptáková, D.; Velebn , V. Carbohydr. Polym. 2017, 156, 86.
-
[25]
Luo, Y.; Prestwich, G. D. Bioconjugate Chem. 1999, 10, 755. doi: 10.1021/bc9900338
-
[26]
Bailly, N.; Thomas, M.; Klumperman, B. Biomacromolecules 2012, 13, 4109. doi: 10.1021/bm301410d
-
[27]
Kratohvil, J. P.; Hsu, W. P.; Kwok, D. I. Langmuir 2002, 2, 256. doi: 10.1021/la00068a026
-
[28]
Song, S. S.; Chen, F.; Qi, H.; Li, F.; Xin, T. G.; Xu, J. W.; Ye, T. T.; Sheng, N. C.; Yang, X. G.; Pan, W. S. Pharm. Res. 2014, 31, 1032. doi: 10.1007/s11095-013-1225-y
-
[29]
Chen, Z. J.; He, N.; Chen, M. H.; Zhao, L.; Li, X. H. Acta Biomater. 2016, 43, 195. doi: 10.1016/j.actbio.2016.07.020
-
[30]
Lin, Q. N.; Bao, C. Y.; Yang, Y. L.; Liang, Q. N.; Zhang, D. S.; Cheng, S. Y.; Zhu, L. Y. Adv. Mater. 2013, 25, 1981. doi: 10.1002/adma.201204455
-
[31]
胡利强, 硕士论文, 湖南大学, 长沙, 2012.Hu, L. Q. M.S. Dissertation, Hunan University, Changsha, 2012
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 28
- 文章访问数: 5127
- HTML全文浏览量: 854



 下载:
下载:










 下载:
下载:

