 图1
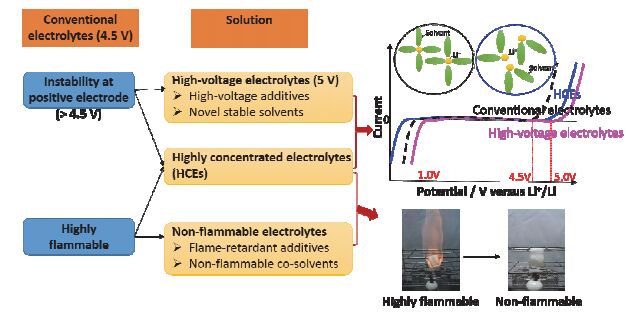
锂离子电池常规电解液的两个问题及解决措施
Figure1.
Problems and their solutions for the conventional electrolytes in lithium-ion batteries
图1
锂离子电池常规电解液的两个问题及解决措施
Figure1.
Problems and their solutions for the conventional electrolytes in lithium-ion batteries

Citation: Xia Lan, Yu Linpo, Hu Di, Chen Z. George. Research Progress and Perspectives on High Voltage, Flame Retardant Electrolytes for Lithium-Ion Batteries[J]. Acta Chimica Sinica, 2017, 75(12): 1183-1195. doi: 10.6023/A17060284

锂离子电池高电压和耐燃电解液研究进展
English
Research Progress and Perspectives on High Voltage, Flame Retardant Electrolytes for Lithium-Ion Batteries
-
Key words:
- lithium ion battery
- / electrolyte
- / high voltage
- / flame retardant
- / highly concentrated
-
1 引言
目前, 商品化锂离子电池所采用的电解液由有机溶剂以及溶于其中的LiPF6[1, 2]所组成.其中, 有机溶剂通常是以介电常数大的碳酸乙烯酯(Ethylene carbonates, EC)[3]为基础的二元或三元混合溶剂, 其中, 链状碳酸酯(碳酸二甲酯DMC、碳酸二乙酯DEC或碳酸甲乙酯EMC)、羧酸酯或醚类为共溶剂[4].这些常用溶剂具有与锂盐的溶解性好、所组成的电解液电导率高、且能够在正负极形成稳定的SEI膜等特点, 因而被认为是电解液体系溶剂的最佳选择.然而, 在锂离子电池的开发及应用的过程中, 常用碳酸酯电解液遭遇到以下两个方面的问题(如图 1).
 图1
锂离子电池常规电解液的两个问题及解决措施
Figure1.
Problems and their solutions for the conventional electrolytes in lithium-ion batteries
图1
锂离子电池常规电解液的两个问题及解决措施
Figure1.
Problems and their solutions for the conventional electrolytes in lithium-ion batteries
其一, 常规碳酸酯电解液正极稳定性差、抗氧化能力不强[5, 6], 严重阻碍了高电压正极材料的开发.为了进一步提升锂离子电池的能量密度, 人们开发了具有较高工作电压的正极材料, 主要包括高电压LiNi0.5Mn1.5O4、LiMPO4 (M=Mn、Co、V)、Li2MPO4F (M=Ni、Co)和富锂锰基固溶体xLi2MnO3•(1-x)LiMeO2 (Me=Ni、Co、Mn)等[7], 它们的充电截止电压都在4.7 V以上, 而常规的碳酸酯电解液在电位达到4.5 V时在高氧化活性的正极材料表面发生不可逆的氧化分解, 生成CO2、H2O和聚碳酸乙烯基(PEC)等产物, 引起电池胀气、电极界面组成变化、极化增大等, 从而导致高电压正极材料循环性能明显恶化等问题[8~11].因此, 开发具有正极稳定性高、抗氧化性好的高电压电解液是发展高电压正极材料的迫切需要.
其二, 常用的有机碳酸酯电解液的低闪点和易燃性是锂离子电池发生燃烧、爆炸事故的主要原因, 因此, 降低电解液可燃性是提高锂离子电池安全性的有效途径.传统的电解液体系除了含有锂盐LiPF6、高介电常数的环状碳酸乙烯酯EC外, 还包括低沸点、低粘度的线性碳酸酯溶剂如DMC、DEC或EMC等, 它们的闪点通常较低, 分别为17、33和23 ℃(表 1为常用的碳酸酯溶剂的熔沸点、闪点的比较).当电池处于过充电、短路、高热冲击等滥用的情况下, 电池内部的温度和压力均很高, 碳酸酯电解液容易被点燃, 很可能引起电池发生燃烧、甚至爆炸等危险[4, 12~16].因此, 寻找具有高闪点的共溶剂、发展耐燃电解液是提高锂离子电池电压和能量密度的同时, 保证安全性的有效途径.
Solvent DMC DEC EMC EC PC Melting point/℃ 4.6 -74.3 -53 36.4 -48.8 Boiling point/℃ 91 126 110 248 242 Flash point/℃ 17 33 23 160 132 综上所述, 研发高电压耐燃电解液作为大容量锂离子电池的关键材料是推动电动汽车、储能电站等新能源技术领域商业化应用的迫切需求.
2 高电压电解液
开发高电压电解液的技术途径主要有两种, 一是在电解液中加入少量具有钝化正极界面膜作用的高电压添加剂; 二是用具有抗氧化能力强的新型溶剂来全部或部分替代现有的抗氧化性不高的碳酸酯溶剂, 如二腈类、砜类、离子液体和氟代溶剂等[17].
2.1 高电压添加剂
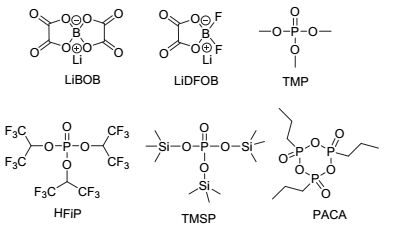
在电池的首周充电过程中, 添加剂分子参与并改善正极材料表面界面膜性质, 形成钝化的正极界面膜, 阻断电解液与正极表面的直接接触, 抑制电解液组分在充电状态下正极表面的氧化分解.目前研究的此类添加剂(各物质的结构式如图 2所示)包括:含草酸根离子的锂盐, 如二草酸硼酸锂(LiBOB)[18, 19]和二氟草酸硼酸锂(LiDFOB)[20]; 含磷化合物, 三甲基磷酸酯(TMP)[21], 三(1, 1, 1, 3, 3, 3-六氟异丙基)磷酸酯(HFiP)[22, 23], 三(三甲基硅)磷酸酯(TMSP)[24~27]和1-丙基磷酸环酐(PACA)[28]等; 一些磺酸酯, 如1, 3-丙烷磺酸内酯(PS)和硫酸亚丙酯(PCS)[29], 以及一些酸酐类化合物[30~32]等.
LiBOB作为高电压添加剂, 其作用机理是:首周充电时, LiBOB会在正极材料表面发生氧化分解、聚合反应, 形成阻抗小、厚度薄的正极界面膜, 阻止电解液中溶剂的进一步氧化, 从而明显地提高高电压正极材料的循环稳定性[18].同时, LiBOB因其阴离子BOB-在1.7 V vs. Li+/Li时发生还原分解, 容易在负极表面形成稳定的SEI膜, 故其也可以作为负极添加剂用[33, 34].与LiBOB相比, LiDFOB形成的界面膜更稳定且阻抗更低, 其原因在于LiBOB中的一个草酸根被两个F取代后, 分子的抗氧化性提高[35]. Hu等[20]研究发现高电压正极LiCoPO4在含LiDFOB添加剂电解液中显示出更好的循环性能. XPS和FTIR-ATR分析结果证实, 正极表面存在B元素、且几乎没有发现聚碳酸乙烯衍生物(PEC)的存在, 表明LiDFOB参与形成了稳定的界面膜, 大大降低了电解液中EC的氧化聚合[19].
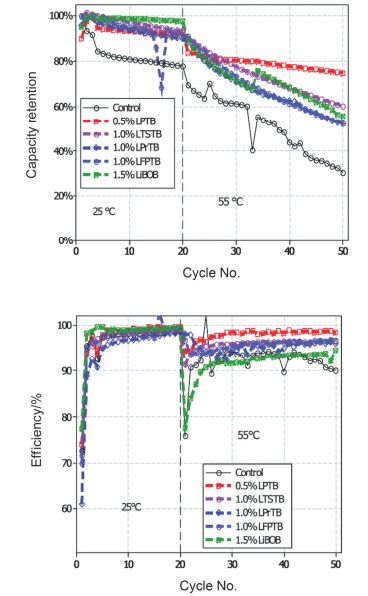
最近, Lucht等[36]设计并合成了四个新型的烷基/芳基三甲基硼酸锂, 并考察了它们作为添加剂用于高电压石墨/LiNi0.5Mn1.5O4电池. 图 3为石墨/LiNi0.5Mn1.5O4电池在不同添加剂电解液中的室温和高温55 ℃循环性能比较.从图中可以看出, 在1 mol•L-1 LiPF6/EC+EMC电解液中添加0.5~2.0 wt%的烷基/芳基三甲基硼酸锂可以明显改善高电压电池的循环稳定性和库伦效率.通过TEM、SEM、XPS和IR-ATR等非现场表征技术研究发现, 4-吡啶三甲基硼酸锂(LPTB)同时在正极和负极表面反应, 形成稳定的界面膜.具体的作用机理为:四烷基硼酸阴离子B(OR)4被正极表面的氧化物MxOy氧化生成复合物MxOy-B(OR)4, 该复合物的形成有效阻止了溶剂分子的氧化分解和金属Mn/Ni的溶解流失, 从而明显地改善了电池的电化学性能.
从目前研究进展来看, 高电压添加剂是从动力学角度出发, 通过在正极表面形成稳定的界面膜, 起到钝化作用, 从而抑制电解液中溶剂的不可逆氧化分解, 提高电池的高电压循环稳定性.然而, 研究者们甚少考察实际电池的自放电行为, 而电池的自放电与电解液及其正极界面膜在高电位下氧化分解息息相关. Passerini等[31]系统考察了FEC、LiBOB等已报道的40种高电压添加剂在Li/LiNi0.4Mn1.6O4电池中的自放电行为.研究发现, 在这40种添加剂中只有丁二酸酐(SA)能够减小自放电、电压降和容量损失, 同时提高电池的库伦效率.而其它常用高电压添加剂如LiBOB、LiDFOB以及丁二酸酐类衍生物却恶化了电池的自放电行为.由此可见, 高电压添加剂的实际应用需要综合考察的各方面因素很多, 包括高低温循环性能、库伦效率以及自放电情况等.
2.2 抗氧化性的新型溶剂
新型的抗氧化溶剂也是开发高电压电解液的重要方向之一.目前研究的抗氧化性溶剂主要包括二腈类、砜类、离子液体和氟代溶剂, 人们对这四类抗氧化性溶剂用于高电压电解液的可行性进行了大量深入的探索.
早在1994年日本三菱公司Ue等[37, 38]报道了各种有机溶剂应用于双电层电容器体系的可能性.结果发现, 二腈类溶剂如戊二腈(GLN)和己二腈(AND)的电化学窗口宽达8 V以上, 氧化分解电位为约8.3 V vs. Li+/Li, 显示出超高的正极稳定性.虽然纯二腈类溶剂具有抗氧化能力强、介电常数大且沸点闪点高等优点, 但其存在熔点高、粘度大、对隔膜的浸润能力差等缺点, 使其难以作为纯溶剂使用, 需要配合碳酸酯类溶剂混合使用.二腈类溶剂作为共溶剂时, 随着其体积百分比含量的增加, 电解液的氧化分解电位越高[39].
Nagahama等[40]考察了高电压正极材料Li2Ni0.98Co0.02PO4F在1 mol•L-1 LiBF4/EC+DMC+癸二腈电解液(25:25:50, by vol.)中的充放电曲线, 首次观察到5.3 V的充电电压平台, 但未给出其循环性能.因此, 二腈类溶剂可以作为高电压电解液的溶剂, 但是因其含C=N双键而极易在石墨或金属锂等低电位负极表面发生聚合反应, 生成的聚合产物会阻止Li+的脱嵌, 进而引起电池容量的衰减[41].为了提高二腈类电解液在石墨负极的稳定性, 研究者们通过在电解液中加入LiBOB[42, 43]、碳酸亚乙烯酯(VC)或FEC[44]等成膜添加剂, 形成稳定的SEI膜, 以期改善负极稳定性, 但实际的应用效果不太明显.
砜类是另一类具有抗氧化性的新型溶剂. 1998年, Angell等[45]考察了非环状脂肪族砜类化合物甲乙砜(EMSF)作为新型溶剂的性能, 与醚类、碳酸酯类相比, EMSF具有宽的电化学窗口, 氧化分解电位达5.89 V vs. Li+/Li, 可以作为高电压电解液的溶剂.但EMSF作溶剂或共溶剂的高电压电解液均会导致石墨的剥离.为了阻止砜在石墨中的共嵌入而破坏石墨结构, Angell等[46, 47]在电解液中引入了几种含环戊基(ESCP)及环己基取代的砜类溶剂, 这些电解液的电化学窗口超过5.5 V vs. Li+/ Li, 但电导率比EMSF作溶剂的电解液低一个数量级. Li/MCMB及Li/LiCr0.015Mn1.985O4半电池测试显示, MCMB在1 mol•L-1 LiTFSI/ESCP的电解液中容量衰减很快, 而正极循环120周后库仑效率保持在86%.由此可知, 砜类溶剂对石墨类碳材料兼容性差, 在正极上的库仑效率也不高, 因此, 寻找合适的成膜剂是提高砜类溶剂的应用的关键.在砜类电解液中加入成膜添加剂如VC[48~50]、LiBOB[51, 52]、对甲苯磺酰异氰酸酯(PTSI)[53]和六亚甲基二异氰酸酯(HDI)[54]促进稳定SEI膜的形成, 获得与常规碳酸酯电解液相当的电化学性能.随后, Amine等[55]研究了无需形成SEI膜的负极材料Li4Ti5O12在砜类溶剂中的性能, 他们在环丁砜(TMS)中加入等体积的EMC为共溶剂, 在2 C下循环了1000周后没有明显的容量损失. Xing等[56]利用分子动力学模拟研究了电解液中各溶剂组分在正负极表面的存在状态.结果显示, 1 mol•L-1 LiPF6/TMS+DMC电解液中的溶剂组分DMC离正极界面的距离比1 mol•L-1 LiPF6/EC+DMC电解液中远, 这可能是其电解液氧化稳定性提高的原因所在.
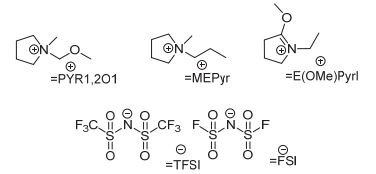
室温离子液体完全由阴、阳离子两部分组成, 阴离子通常有PF6-、TFSI-等, 阳离子包括季铵型、咪唑型和吡啶型等.它们具有挥发性极小、不燃、电化学窗口宽、溶解能力强等特点, 常被用来作为锂离子电池高性能电解液溶剂[57~63]. Borgel等[64]考察了不同类型的离子液体应用于高电压正极LiNi0.5Mn1.5O4的可行性.研究发现, 咪唑型及季铵型离子的氧化电位都在5 V以上, 但只有在环状季铵型离子液体中可以可逆的沉积锂; LiNi0.5Mn1.5O4正极在环状季铵型离子液体PP13-TFSI与PP14-TFSI中可以正常充放电, 且库仑效率均比在碳酸酯类电解液中的高.而LiNi0.5Mn1.5O4电极在咪唑型离子液体及四烷基季铵型离子液体中循环5周后, 放电容量急剧衰减.并且, 离子液体因自身粘度较大, 导致电导率低, 需要配合使用其它溶剂. Xiang等[65]报道了PP14-TFSI和环丁砜TMS混合使用的电解液应用于高电压电池.结果显示, 0.5 mol•L-1 LiDFOB/(60%)PP14-TFSI/(40%)TMS电解液的室温电导率较高(10-3 S•cm-1)且完全不燃, Li1.2Ni0.2Mn0.6O2电极在该电解液中电化学性能明显提高. Mun等[66]分别研究了高电压正极LiNi0.5Mn1.5O4在碳酸酯基和离子液体基电解液中形成的界面膜的组成.研究发现, 在碳酸酯基电解液中, 界面膜组分中的无机物较多; 而在离子液体基电解液中, 界面膜组分以有机物为主.
由于F原子具有强吸电子性, 氟代溶剂具有比常规溶剂更好的氧化稳定性, 目前已成为高电压电解液研究的热点之一. 表 2为氟代溶剂与其未氟代的常规溶剂的HOMO和LUMO能级比较.从表 2可以看出, 氟代溶剂不仅HOMO能级较小、氧化分解电位高, 可以作为高电压电解液的溶剂, 而且LUMO能级也随之降低、还原电位正移, 容易被还原.早在2010年, 日本Kitagawa等[67]首次将氟代碳酸乙烯酯(FEC)和氟代醚——1, 1, 2, 2-四氟乙基-2, 2, 3, 3-四氟丙基醚(TFTFEP)用于高电压LiCoO2正极.研究表明, 1 mol•L-1 LiPF6/FEC+TFTFEP (1:1, by vol.)氟代电解液(其中FEC介电常数大, 故电解液的离子电导率高)与常规电解液相比, LiCoO2正极在4.5~3.0 V的充放电电压区间显示出更优异的循环稳定性.近几年, Amine等[68]和Markevich等[69]均报道了FEC基氟代电解液明显提高了高电压锂离子电池的室温循环性能.随后, Amine等[70]在EC及EMC分子上引入含氟烷基, 配合使用氟代醚TFTFEP为共溶剂制备出全氟代电解液.高电压电池Li/LiNi0.5Mn1.5O4和Li4Ti5O12/ LiNi0.5Mn1.5O4采用该氟代电解液后, 它们的常温及高温循环性能得到明显提高.
 表 2
氟代溶剂与其未氟代溶剂的HOMO和LUMO能级比较[70, 73]
Table 2.
Comparison of some fluorinated solvents with its nonfluorinated counterpart solvents[70, 73]
表 2
氟代溶剂与其未氟代溶剂的HOMO和LUMO能级比较[70, 73]
Table 2.
Comparison of some fluorinated solvents with its nonfluorinated counterpart solvents[70, 73]
Structure HOMO/eV LUMO/eV 
-8.3014 0.5516 
-8.6510 0.2455 
-8.1376 0.0683 
-8.6930 -0.0988 
-7.1166 0.1622 
-9.6399 -0.0969 以金属锂片, Li4Ti5O12或Si为负极的高电压锂离子电池在氟代电解液中具有较好的循环稳定性.然而, 由于氟化之后, 含氟溶剂的还原电位升高、易被还原, 导致报道的氟代电解液与石墨类碳负极的兼容性较差, 导致电池的循环性能不佳[71].为了改善氟代电解液与石墨负极的稳定性, 同时兼顾氟代溶剂的高电压性能, Xia等[72]引入了具有还原电位较高, 但可稳定石墨负极SEI膜, 并具有成膜作用的氟代醚——1, 1, 1, 3, 3, 3-六氟异丙基甲基醚(HFPM)作为共溶剂, 制备了1 mol•L-1 LiPF6/FEC+DMC+EMC+HFPM (2:3:1:4, by vol.)氟代电解液.研究发现(如图 4), 该电解液不仅浸润性好、完全不燃, 而且装配该电解液的MCMB/ LiNi0.5Mn1.5O4实际高电压电池(型号18650, 容量1500 mAh)显示了优异的循环性能(循环200周后, 容量保持率达82%, 明显高于常规电解液的61%), 并通过了针刺实验, 展现出了较好的安全性能.
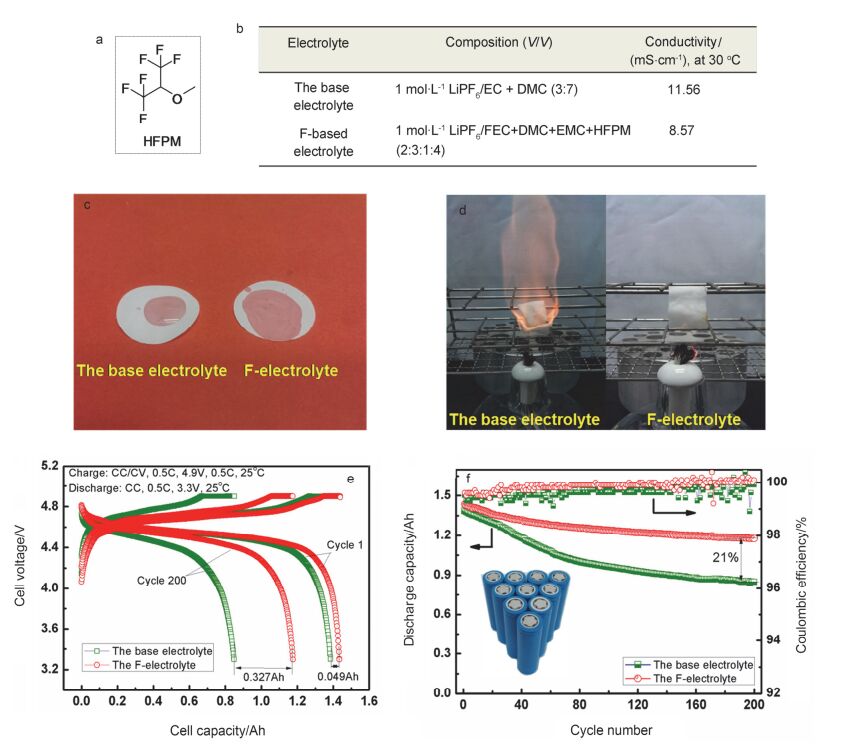 图4
(a) 1, 1, 1, 3, 3, 3-六氟异丙基甲基醚(HFPM)的结构式, (b)~(d)两种电解液的物化性质比较, (e)~(f) 18650 MCMB/LiNi0.5Mn1.5O4实际电池的室温电化学性能比较[72]
Figure4.
(a) The chemical structure of HFPM ether and (b)~(d) the physico-chemical properties of the two electrolytes. (e) Voltage profiles for the charge-discharge cycles and (f) cycling performance according to the CC-CV protocol of the 18650 MCMB/LiNi0.5Mn1.5O4battery within the voltage range of 3.3~4.9 V at the 0.5 C rate[72]
图4
(a) 1, 1, 1, 3, 3, 3-六氟异丙基甲基醚(HFPM)的结构式, (b)~(d)两种电解液的物化性质比较, (e)~(f) 18650 MCMB/LiNi0.5Mn1.5O4实际电池的室温电化学性能比较[72]
Figure4.
(a) The chemical structure of HFPM ether and (b)~(d) the physico-chemical properties of the two electrolytes. (e) Voltage profiles for the charge-discharge cycles and (f) cycling performance according to the CC-CV protocol of the 18650 MCMB/LiNi0.5Mn1.5O4battery within the voltage range of 3.3~4.9 V at the 0.5 C rate[72]
3 耐燃性电解液
众所周知, 有机碳酸酯电解液的低闪点和易燃性是锂离子电池发生燃烧、爆炸等不安全事故的根本原因[4, 74], 采用不燃性添加剂是降低电解液可燃性的有效途径[12, 13].目前研究的不燃性添加剂或共溶剂主要包括含氟溶剂[75~79]、含磷化合物[80]和离子液体[81~83]等.
3.1 阻燃添加剂
目前主要研究的阻燃添加剂为含磷的(亚)磷酸酯, 其阻燃机理为气相自由基湮灭和热阻隔机理.当温度较高时, 电解液中的阻燃剂分子气化生成含磷自由基, 该自由基可以捕获电解液中溶剂生成的氧自由基和氢氧自由基, 生成磷酸, 最终形成热阻滞层, 覆盖在电解液的表面, 从而阻止了电解液的燃烧[80].研究表明, 一些含磷化合物包括三甲基磷酸酯(TMP)[84]、甲基磷酸二甲酯(DMMP)[85]和三苯基磷酸酯(TPPi)[86]能够明显降低电解液的可燃性, 但这些磷酸酯类化合物容易在石墨负极共嵌、还原分解, 导致电池的循环性能差, 从而影响其实际大规模应用.另一些含磷化合物如六甲氧基环三磷腈(HMPN)[87]、三乙氧基磷腈-N-磷酰二乙酯(PNP)[88]等磷腈类化合物虽然与石墨类碳负极稳定性好, 但它们的阻燃效率相对较低.为了兼具高阻燃效率和兼容性, 研究者们合成了一些氟代的含磷化合物, 包括二(2, 2, 2-三氟乙基)甲基磷酸酯(TFMP)[89]、2, 2, 2-三氟乙基二乙基磷酸酯(TDP)[90, 91]等, 并考察了它们的实际应用效果[92].结果表明, 这些含氟磷化物不仅能大大降低电解液的可燃性, 而且与石墨负极电化学兼容性好.究其原因在于F原子为阻燃元素, 与P具有协同效应; 同时含氟化合物有助于在石墨负极表面形成稳定的SEI膜, 提高电极的稳定性.因此, 氟代的含磷化合物是提高锂离子电池安全性的高效、高匹配性阻燃剂.在大多数情况下, 为了使电解液完全不燃, 目前报道的阻燃剂添加量不低于15% (质量或体积比), 具体见表 3[82~95, 98].但当阻燃剂的添加量高于15%时, 不仅电解液的电化学性能将受到影响, 而且阻燃剂与石墨负极不兼容问题表现更明显.因此, 寻找高效的、高兼容性的阻燃剂显得尤为重要.最近, Xia等[95]合成了一种高效、高匹配性的阻燃剂, 五氟乙氧基环三磷腈(PFPN), 并具体考察了该阻燃剂的阻燃特性和电化学稳定性.研究发现, 只需在电解液中添加5 wt%的PFPN, 电解液就能变得完全不燃.这表明, PFPN是目前已报道的最高效的阻燃剂[82~93, 96].同时, 含PFPN的电解液能够提高LiCoO2电极在截至电压为4.5 V时的高电压循环性能.这也表明, PFPN既是一种高效的阻燃剂, 又是LiCoO2正极的高电压添加剂.随后, Feng等[97]将PFPN阻燃剂应用于钠离子电池, 该电池具有高效的阻燃性能的同时还表现出优异的电化学循环性能.
 表 3
已报道的阻燃剂性能比较[82~95, 98]
Table 3.
Numerous flame retardant additives tested in most of the standard Li-ion electrolytes with mixed results as indicated in as follows[82~95, 98]
表 3
已报道的阻燃剂性能比较[82~95, 98]
Table 3.
Numerous flame retardant additives tested in most of the standard Li-ion electrolytes with mixed results as indicated in as follows[82~95, 98]
Flame retardant additives (FRs) The amount of FRs (Totally nonflammable electrolytes) Reference 
>40 wt% [1 mol•L-1 LiPF6/EC+EMC (1:1, by weight)] [84] 
>30 wt% [1 mol•L-1 LiPF6/EC+EMC (1:1, by weight)] [90] 
>20 wt% [1 mol•L-1 LiPF6/PC+EC+EMC
(3:3:4, by weight)][93] 
>40 wt% [1 mol•L-1 LiPF6/EC+EMC+DMC
(1:1:1, by weight)][98] Several fluorinated phosphazene-based flame retardants >15 wt% [1 mol•L-1 LiPF6/EC+DMC (1:1, by weight)] [92] 
>80 wt% [1 mol•L-1 LiPF6/EC+EMC+DMC (1:1:1, by weight)] [88] 
>50 wt% [1 mol•L-1 LiPF6/EC+DMC (1:1, by weight)] [89] 
≥5 wt% [1 mol•L-1 LiPF6/EC+DMC (1:1, by vol.)] [95] 3.2 不燃或耐燃型共溶剂
有机含氟化合物具有熔点低、闪点高的特性, 人们将其作为电解液的共溶剂降低电解液的可燃性, 改善了电池的安全性. Arai等[99]首先将具有高闪点的三氟丙烯碳酸酯(TFPC)和氯代碳酸乙烯酯(ClEC)作为EC和PC的共溶剂来提高电池的安全性.随后, 他们利用不燃的含氟醚——九氟代正丁基甲基醚(MFE)制备了无闪点的电解液(NFE), 该电解液的组成为1 mol•L-1 LiBETI [LiN(SO2C2F5)2]/MFE+EMC (80:20, by vol.).装配该电解液的石墨/LiCoO2 (型号为18650圆柱电池)电池通过了针刺实验, 表现出较高的安全性[100, 101].然而, 由于含氟醚的含量≥80 vol%且锂盐难溶于其中, 大剂量的使用MFE降低了电解液的电导率(随着MFE含量从20 vol%增加至80 vol%, 相应的电解液1 mol•L-1 LiBETI/ MFE+EMC的电导率从2.39 mS•cm-1降低至0.5 mS• cm-1).为了解决这一问题, Naoi等[102, 103]使用了支链状含氟醚TMMP作为EC和DEC的共溶剂用.结果发现, 当加入TMMP的含量为50 vol%时, 电解液1 mol•L-1 LiBETI/EC+DEC+TMMP (5:45:50, by vol.)完全不燃, 使用此电解液的电池具有较好的倍率性能以及低温性能.
离子液体不仅可以应用于高电压电解液, 而且因其本身具有几乎不挥发、不燃等特点, 也常被用于制备耐燃性电解液、降低电解液的可燃性[104~106], 从而提高电池的安全性[107].然而, 由于纯离子液体基电解液的粘度较大、与隔膜等电极材料的浸润性差, 限制了锂离子在充放电过程中的快速迁移; 且大多数的离子液体与石墨类负极的兼容性较差, 因而, 离子液体较难作为单一溶剂使用.为了解决纯离子液体使用过程中产生的上述问题, 离子液体通常与碳酸酯类溶剂混合使用制备高性能电解液.其中, 碳酸酯类溶剂用来降低电解液的粘度、在石墨负极表面形成稳定的SEI膜, 离子液体作为共溶剂发挥其不燃、难燃的特性[108~110].目前报道较多的离子液体主要是吡咯型离子液体.研究发现, 通过在吡咯环上引入C-O醚键或平面结构的C=N双键可以降低离子液体的粘度、提高其自身的离子电导率[111, 112].与不含醚键的甲丙基吡咯烷阳离子型离子液体相比(2 mS•cm-1 at 20 ℃), 含C-O键的N-甲氧基乙基-N-甲基吡咯烷-双三氟甲烷磺酰亚胺阴离子(PYR1, 2O1TFSI, 如图 6)具有较小的粘度和较大的电导率(2.9 mS•cm-1 at 20 ℃); 同时, 兼具C=N双键、醚键的N-乙基-2-甲氧基吡咯烷-双氟磺酰亚胺阴离子[E(OMe)Pyrl-FSI]的室温电导率可提高至13 mS•cm-1.随后, Quinzeni和Kim等[113, 114]系统考察了上述两种离子液体(IL)与碳酸酯类溶剂(OCs)混合电解液体系的物化性质及在实际电池中的电化学性能, 如图 7所示.研究发现, 当离子液体IL在混合电解液溶剂中的含量为60 wt% or vol%时, 混合电解液完全不燃、并显示出最佳的综合性能, 其离子电导率达到最高(9 mS•cm-1 at 25 ℃), 且粘度小、电化学窗口宽(4.5 V)并与金属Li形成稳定界面. LiFePO4电池在该混合电解液中具有优异的循环稳定性, 在1 C倍率下循环250周, 容量保持率为93%[113].
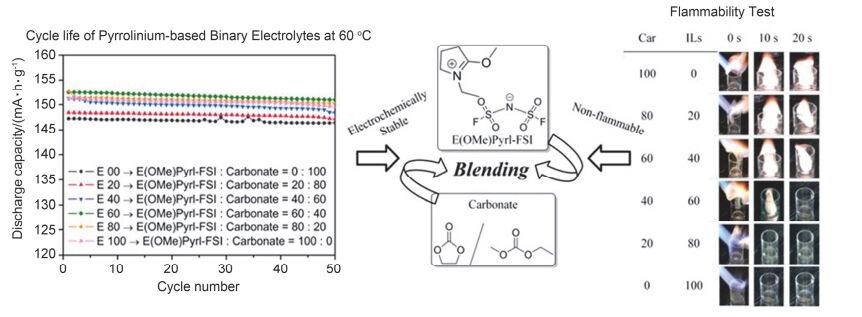 图7
离子液体-碳酸酯类溶剂二元混合电解液的可燃性测试及其在电池Li/LiFePO4中的高温60 ℃循环性能[114]
Figure7.
Left: cycle performance of the Li/LiFePO4 cells in six different electrolytes at 25 ℃; E 00 (black), E 20 (red), E 40 (blue), E 60 (green), E 80 (orange), and E 100 (pink). Right: images of the flammability tests of E 00, E 20, E 40, E 60, E 80, E 100[114]
图7
离子液体-碳酸酯类溶剂二元混合电解液的可燃性测试及其在电池Li/LiFePO4中的高温60 ℃循环性能[114]
Figure7.
Left: cycle performance of the Li/LiFePO4 cells in six different electrolytes at 25 ℃; E 00 (black), E 20 (red), E 40 (blue), E 60 (green), E 80 (orange), and E 100 (pink). Right: images of the flammability tests of E 00, E 20, E 40, E 60, E 80, E 100[114]
关于耐燃性电解液的研究, 目前主要的研究内容是将具有阻燃或不燃特性的含磷系化合物、含氟溶剂、离子液体等溶剂作为电解液的添加剂或共溶剂使用, 以降低电解液的可燃性.然而, 为了使电解液达到完全不燃的程度往往需要加入足够的量, 由于这些溶剂本身存在一些问题, 如粘度大、与石墨类负极不兼容、溶解盐的能力小、合成成本较高等, 往往导致电解液的综合性能下降.因此, 设计合成具有难燃、离子电导高、电化学性质稳定的有机溶剂是制备耐燃性、高安全性电解液的关键所在.
4 高浓度电解液
自1990年锂离子电池商品化以来, 人们普遍认为:锂离子电池电解液中有两个必不可少的组分, 即LiPF6锂盐和碳酸乙烯酯(EC)溶剂, 前者兼顾了电解液对高电导率、高电化学稳定性及高电位下钝化正极集流体Al箔等要求, 且鉴于成本和性能的综合考虑, 锂盐的浓度多为0.8~1.5 mol•L-1之间; 后者与石墨类负极兼容性好, 能在石墨类碳负极表面形成稳定、有效的SEI膜, 从而大大稳定了电池的循环性能.
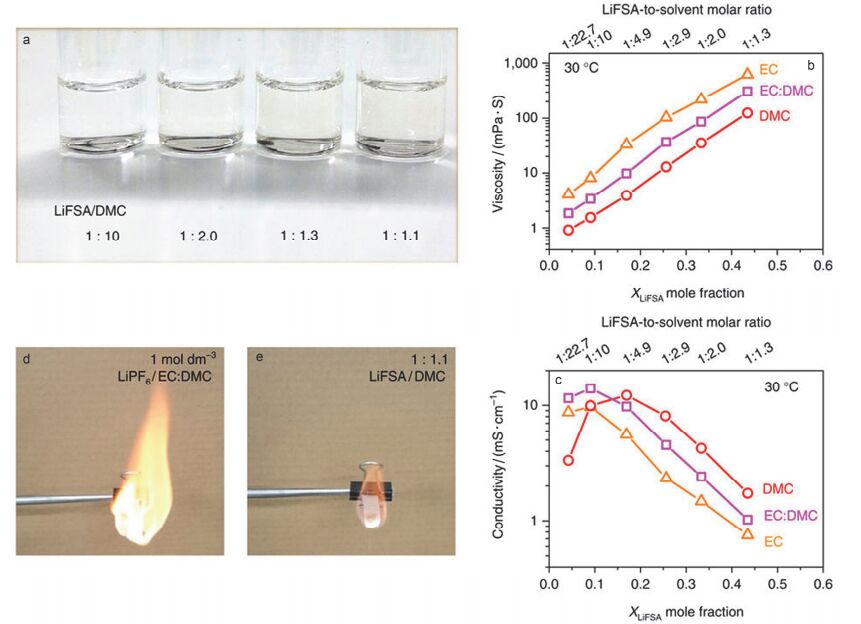
近三四年, 研究者们开发了一类电解液新体系——“超高浓度电解液”, 该类电解液中锂盐的浓度高达4 mol•L-1, 远远高于普通电解液锂盐的浓度1 mol•L-1.由于超高的锂盐含量使电解液中所有溶剂基本都与Li+直接配位, 而在普通电解液中溶剂则是以游离态和溶剂化的状态存在.这使得超高浓度电解液具有一些特殊的性能, 包括高氧化稳定性、高还原稳定性、高热稳定性、耐燃性及高电位下钝化Al正极集流体等[115, 116].研究发现, 高浓度电解液如4.45 mol•L-1 LiPF6/PC及10.8 mol•L-1 LiN(SO2F2)2/DMC (LiFSA/DMC, molar ratio=1:1.1)具有正极稳定性高(达5.5 V vs. Li+/Li)、耐燃、热稳定性高等特点(如图 8所示)[117, 118]. 5 V级高电压锂离子电池-石墨/LiNi0.5Mn1.5O4在高浓度LiFSA/DMC (1:1.1)电解液中40 ℃下100周后容量保持率为90%, 远高于电池在常规电解液中的18%, 显示出优异的高电压循环稳定性.同时, 锂盐为LiTFSI和LiFSA的超高浓度电解液在高电位下能在Al正极集流体表面形成良好的钝化膜, 从而有效抑制了以N为中心原子的锂盐如LiTFSI和LiFSA等对正极集流体Al箔的腐蚀作用[119~121].
在常规电解液中, 锂盐的浓度为1 mol•L-1.以石墨为负极的锂离子电池必须使用EC作溶剂; 而EC以外的其它溶剂如碳酸丙烯酯(PC)、醚类如二甲醚(DME)、腈类如乙腈(AN)以及亚砜类如二甲基亚砜(DMSO)等不能单独作电解液溶剂用, 其原因在于它们均不能在石墨表面形成稳定的SEI膜、且共嵌入石墨层间, 破坏石墨的层间结构, 从而引起石墨负极电化学性能的恶化[122~125].然而, 当其电解液中锂盐含量超高, 制备成超高浓度电解液时, 锂盐的阴离子优先于溶剂分子在石墨表面还原分解, 形成具有高离子电导的SEI膜, 有效抑制了溶剂分子的共嵌入, 从而大大提高了石墨负极的循环稳定性及倍率性能, 如图 9所示[126, 127].同样地, 由于超高浓度电解液与金属锂之间界面稳定性的提高, 大大改善了金属锂的可逆溶解-沉积反应, 减少了金属锂表面枝晶的形成[128~130]. Qian等[129]报道了金属Li在4.0 mol•L-1 LiFSA/DME高浓度电解液中的优异的电化学性能.他们发现, Li/Li电池在该电解液中以10 mA•cm-2电流密度循环6000周库仑效率高达99.1%, 显示出优异的循环稳定性.
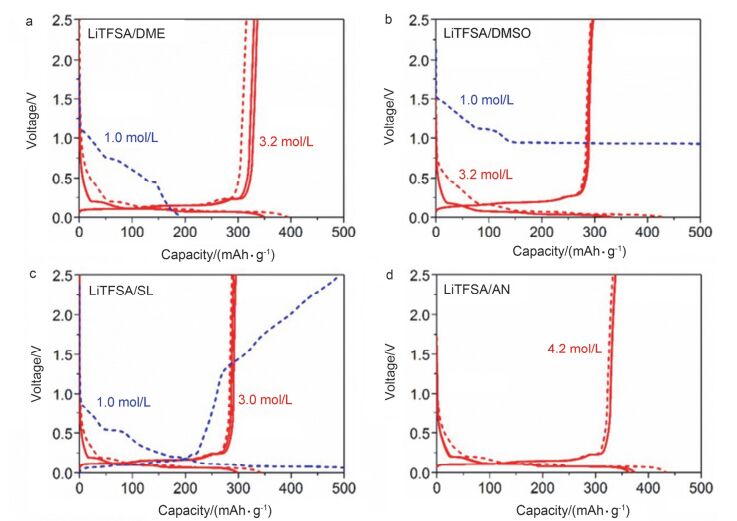 图9
电池Li/石墨在超高浓度电解液及相应的普通电解液中的充放电曲线对比[115]
Figure9.
Charge-discharge curves of natural graphite/Li metal half cells with dilute and concentrated LiTFSA electrolytes of (a) DME, (b) DMSO, (c) SL, and (d) AN at C/10 rate and 25 ℃. All the highly concentrated electrolytes correspond to the solvent/Li salt molar ratio of ca. 2. The charge-discharge test with a dilute LiTFSA/AN electrolyte was not possible because of high reactivity of AN solvent with Li metal[115]
图9
电池Li/石墨在超高浓度电解液及相应的普通电解液中的充放电曲线对比[115]
Figure9.
Charge-discharge curves of natural graphite/Li metal half cells with dilute and concentrated LiTFSA electrolytes of (a) DME, (b) DMSO, (c) SL, and (d) AN at C/10 rate and 25 ℃. All the highly concentrated electrolytes correspond to the solvent/Li salt molar ratio of ca. 2. The charge-discharge test with a dilute LiTFSA/AN electrolyte was not possible because of high reactivity of AN solvent with Li metal[115]
相比于常规电解液, 高浓度电解液因溶液中溶剂-锂盐间强的相互作用使得其具有普通电解液所无法比拟的诸多特殊性能, 如氧化还原性高、耐燃等, 但这些性能的提高是以电解液粘度增加、电导率降低及成本增加为代价的(表 4对上述的锂离子电池三类电解液基本性能进行了比较).然而, 我们也应当看到, 高浓度电解液打破了电解液制备过程中的一些现有束缚, 为高电压石墨/LiNi0.5Mn1.5O4锂离子电池、以Li金属为负极的高容量Li/S或Li-空气电池以及钠离子电池的电解液设计和开发提供新的设计思路.
 表 4
锂离子电池三类电解液的基本性能比较
Table 4.
Properties of different types of electrolyte used in lithium ion batteries
表 4
锂离子电池三类电解液的基本性能比较
Table 4.
Properties of different types of electrolyte used in lithium ion batteries
Electrolyte Typical example Viscosity/(mPa•s) Conductivity/(mS•cm-1) Electrochemical
window/VFlammability Ref. High voltage electrolytes 1 mol•L-1 LiPF6/EC+DMC (1:1 in wt%)-Sebaconitrile (50:50, by vol.) — 4.4, 25℃ ~7.5, glassy carbon electrode — [39] 1 mol•L-1 LiBF4/EC-DMC-Sebaconitrile (25:25:50, by vol.) — 1.8, 25℃ 0.4~7.0, glassy carbon electrode — [39, 40] 1 mol•L-1 Lithium bis(trifluoromethane
sulfonyl) imide (Lilm)/Ethyl methyl sulfone (EMSF)— 6.31, 25℃ 0~5.8, Pt working electrode — [45] 1.0 mol•L-1 LiTFSI/ethylmethoxyethyl sulfone (EMES) — 1.41, 25℃ 0~5.6, Pt working electrode — [47] 0.5 mol•L-1 LiTFSI/PP14-TFSI-TMS (60:40, by wt.) — 2.04, 25℃ 0~5.7, Pt working electrode Non-flammability [65] 1 mol•L-1 LiPF6/FEC-TFTFEP
(1:1, by vol.)9.44, 25℃ 3.51, 25℃ — — [67] 1 mol•L-1 LiPF6/FEC-DMC-EMC-HFPM
(2:3:1:4, by vol.)— 8.57, 30℃ 0~5.5, Pt working
electrodeNon-flammability [72] Flame
retardant electrolytes1 mol•L-1 LiPF6/ClEC-TFPC — 3~4, 25℃ — — [99] 1 mol•L-1 LiBETI-MFE/EMC (80:20, by vol.) — 0.56, 25℃ — No flash point [100] 1 mol•L-1 LiBETI/EC+DEC+TMMP (5:45:50, by vol.) — 1.0, 20℃ 0~5.6, Pt working
electrodeNon-flammability [102] 0.5 mol•L-1 LiTFSI/EC-DEC PYR1, 2O1TFSI, by vol. 25, 20℃ 7.0, 20℃ 0~4.5, Ni working
electrodeNon-flammability [113] 1 mol•L-1 LiPF6/EC-EMC (3:7, by vol.) +1 mol•L-1 LiTFSI/E(OMe)Pyrl-FSI (20:80, by wt.%) 25, 20℃ 6.9, 20℃ 1.2~4.5, glassy carbon electrode Non-flammability [114] Highly
concentrated electrolytes4.27 mol•kg-1/PC 706.5, 30℃ 0.403, 30℃ ~5.0, Pt working
electrode— [117] LiFSA/DMC 1:1.1 molar ratio 238.9, 30℃ 1.1, 30℃ >5.5 V, Al electrode Not burn [118] LiFSA/AN 1:1.5 molar ratio 153, 30℃ 3.3, 30℃ >4.5 V, Al electrode — [121] LiFSA/DME 1:1.9 molar ratio 25.1, 30℃ 7.2, 30℃ — — [126] 7 mol•L-1 LiTFSI/DOL-DME
(1:1, by vol.)72, 25℃ 0.814, 25℃ — — [128] 5 mol•L-1 LiTFSI/DME — 1.7, 25oC 0~5.0, Pt working
electrode— [129] 5 总结与展望
自锂离子电池商品化至今, 锂离子电池正、负极材料的发展迅速, 正极材料从LiCoO2到三元材料、高电压LiNi0.5Mn1.5O4、高容量富锂锰基正极材料等, 负极材料则从石墨类碳负极发展到高容量硅基负极材料, 高容量电极材料的蓬勃发展必然要求相应的电解液体系、电池工艺等的提升.然而, 相对于锂离子电池电极材料的蓬勃发展, 新型电解液的研发相对滞后.目前应用成熟的电解液体系仍然是常规碳酸酯类溶剂体系, 该电解液体系存在正极稳定性差、闪点低、易燃烧等问题.一方面, 为了提高电解液在正极的高电位下稳定性, 可以通过在电解液加入添加剂, 然而其耐受电压上限仍只有4.5 V, 进一步提高电解液的抗氧化性必须要开发新型的电解液体系.从目前的研究情况看, 氟代碳酸酯类和离子液体是高电压电解液溶剂的最佳选择, 同时需要加入合适的添加剂改善其与负极界面的稳定性.另一方面, 为了降低常规碳酸酯的电解液的可燃性, 单纯的通过添加阻燃剂很难从根本上解决其易燃问题, 亟待开发耐燃性的电解液用溶剂.在实际应用中, 当电池处于热失控状态时, 电池内部温度和压力均很高, 安全阀开启或外壳破裂时, 阻燃性电解液会以极快的速度喷出, 足以使其中低闪点的组分被点燃, 导致电池燃烧.由此可见, 含有阻燃剂的电解液并不能从根本上消除电池燃烧事故的发生.因此, 开发高闪点溶剂的电解液才可能从根本上解决电池发生燃烧的安全隐患.从目前的研究进展来看, 离子液体因具有不挥发性、不燃、温度范围宽, 且溶解能力强等优点或将成为不燃电解液的最佳选择.因此, 未来几年, 随着信息技术的发展以及新能源汽车的进一步推广, 开发新型抗氧化性溶剂、提高电极/电解液界面稳定性, 发展高电压、耐燃性电解液已成为目前电解液行业研究的重点.此外, 超高浓度电解液表现出诸多不同于常规浓度电解液的优势, 其研究的兴起必然为电解液的设计提供了新方向.
-
-
[1]
Aurbach, D.; Talyosef, Y.; Markovsky, B.; Markevich, E.; Zinigrad, E.; Asraf, L.; Gnanaraj, J. S.; Kim, H. J. Electrochim. Acta 2004, 50, 247. doi: 10.1016/j.electacta.2004.01.090
-
[2]
Markovsky, B.; Amalraj, F.; Gottlieb, H. E.; Gofer, Y.; Martha, S. K.; Aurbach, D. J. Electrochem. Soc. 2010, 157, A423. doi: 10.1149/1.3294774
-
[3]
Erickson, E. M.; Markevich, E.; Salitra, G.; Sharon, D.; Hirshberg, D.; de la Llave, E.; Shterenberg, I.; Rozenman, A.; Frimer, A.; Aurbach, D. J. Electrochem. Soc. 2015, 162, A2424. doi: 10.1149/2.0051514jes
-
[4]
Xu, K. Chem. Rev. 2004, 104, 4303. doi: 10.1021/cr030203g
-
[5]
Hu, M.; Pang, X.; Zhou, Z. J. Power Sources 2013, 237, 229. doi: 10.1016/j.jpowsour.2013.03.024
-
[6]
Xu, K. Chem. Rev. 2014, 114, 11503. doi: 10.1021/cr500003w
-
[7]
万洋, 郑荞佶, 赁敦敏, 化学学报, 2014, 72, 537. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract344469.shtmlWan, Y.; Zheng, Q.-J.; Lin, D.-M. Acta Chim. Sinica 2014, 72, 537. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract344469.shtml
-
[8]
Xing, L.; Li, W.; Wang, C.; Gu, F.; Xu, M.; Tan, C.; Yi, J. J. Phys. Chem. B 2009, 113, 16596. doi: 10.1021/jp9074064
-
[9]
Yang, L.; Ravdel, B.; Lucht, B. L. Electrochem. Solid-State Lett. 2010, 13, A95. doi: 10.1149/1.3428515
-
[10]
Kim, J.-H.; Pieczonka, N. P. W.; Li, Z.; Wu, Y.; Harris, S.; Powell, B. R. Electrochim. Acta 2013, 90, 556. doi: 10.1016/j.electacta.2012.12.069
-
[11]
Pieczonka, N. P. W.; Liu, Z.; Lu, P.; Olson, K. L.; Moote, J.; Powell, B. R.; Kim, J.-H. J. Phys. Chem. C 2013, 117, 15947. doi: 10.1021/jp405158m
-
[12]
Yao, X. L.; Xie, S.; Chen, C. H.; Wang, Q. S.; Sun, J. H.; Li, Y. L.; Lu, S. X. J. Power Sources 2005, 144, 170. doi: 10.1016/j.jpowsour.2004.11.042
-
[13]
Zhang, H. P.; Xia, Q.; Wang, B.; Yang, L. C.; Wu, Y. P.; Sun, D. L.; Gan, C. L.; Luo, H. J.; Bebeda, A. W.; Ree, T. v. Electrochem. Commun. 2009, 11, 526. doi: 10.1016/j.elecom.2008.11.050
-
[14]
Hyung, Y. E.; Vissers, D. R.; Amine, K. J. Power Sources 2003, 119-121, 383. doi: 10.1016/S0378-7753(03)00225-8
-
[15]
Mandal, B. K.; Padhi, A. K.; Shi, Z.; Chakraborty, S.; Filler, R. J. Power Sources 2006, 161, 1341. doi: 10.1016/j.jpowsour.2006.06.008
-
[16]
Shim, E.-G.; Nam, T.-H.; Kim, J.-G.; Kim, H.-S.; Moon, S.-I. J. Power Sources 2007, 172, 901. doi: 10.1016/j.jpowsour.2007.04.089
-
[17]
任岩, 文焱, 连芳, 丑卫华, 化学通报, 2015, 78, 107.Ren, Y.; Wen, Y.; Lian, F.; Qiu, W.-H. Chemistry 2015, 78, 107.
-
[18]
Dalavi, S.; Xu, M.; Knight, B.; Lucht, B. L. Electrochem. Solid-State Lett. 2011, 15, A28. doi: 10.1149/2.015202esl
-
[19]
Yang, L.; Markmaitree, T.; Lucht, B. L. J. Power Sources 2011, 196, 2251. doi: 10.1016/j.jpowsour.2010.09.093
-
[20]
Hu, M.; Wei, J.; Xing, L.; Zhou, Z. J. Appl. Electrochem. 2012, 42, 291. doi: 10.1007/s10800-012-0398-0
-
[21]
Li, Z. D.; Zhang, Y. C.; Xiang, H. F.; Ma, X. H.; Yuan, Q. F.; Wang, Q. S.; Chen, C. H. J. Power Sources 2013, 240, 471. doi: 10.1016/j.jpowsour.2013.04.038
-
[22]
von Cresce, A.; Xu, K. J. Electrochem. Soc. 2011, 158, A337. doi: 10.1149/1.3532047
-
[23]
von Cresce, A.; Xu, K. ECS Transactions 2012, 41, 17.
-
[24]
Rong, H.; Xu, M.; Xing, L.; Li, W. J. Power Sources 2014, 261, 148. doi: 10.1016/j.jpowsour.2014.03.032
-
[25]
Song, Y.-M.; Han, J.-G.; Park, S.; Lee, K. T.; Choi, N.-S. J. Mater. Chem. A 2014, 2, 9506. doi: 10.1039/C4TA01129E
-
[26]
Yan, G.; Li, X.; Wang, Z.; Guo, H.; Wang, C. J. Power Sources 2014, 248, 1306. doi: 10.1016/j.jpowsour.2013.10.037
-
[27]
Zhang, J.; Wang, J.; Yang, J.; NuLi, Y. Electrochim. Acta 2014, 117, 99. doi: 10.1016/j.electacta.2013.11.024
-
[28]
Yan, G.; Li, X.; Wang, Z.; Guo, H.; Xiong, X. J. Power Sources 2014, 263, 231. doi: 10.1016/j.jpowsour.2014.04.060
-
[29]
Felix, F.; Cheng, J.-H.; Hy, S.; Rick, J.; Wang, F. M.; Hwang, B.-J. J. Phys. Chem. C 2013, 117(44), 22619. doi: 10.1021/jp409779x
-
[30]
Lee, H.; Choi, S.; Choi, S.; Kim, H.-J.; Choi, Y.; Yoon, S.; Cho, J.-J. Electrochem. Commun. 2007, 9, 801. doi: 10.1016/j.elecom.2006.11.008
-
[31]
Tarnopolskiy, V.; Kalhoff, J.; Nádherná, M.; Bresser, D.; Picard, L.; Fabre, F.; Rey, M.; Passerini, S. J. Power Sources 2013, 236, 39. doi: 10.1016/j.jpowsour.2013.02.030
-
[32]
Bouayad, H.; Wang, Z.; Dupré, N.; Dedryvère, R.; Foix, D.; Franger, S.; Martin, J.-F.; Boutafa, L.; Patoux, S.; Gonbeau, D.; Guyomard, D. J. Phys. Chem. C 2014, 118(9), 4634. doi: 10.1021/jp5001573
-
[33]
Pieczonka, N. P. W.; Yang, L.; Balogh, M. P.; Powell, B. R.; Chemelewski, K. R.; Manthiram, A.; Krachkovskiy, S. A.; Goward, G. R.; Liu, M.; Kim, J.-H. J. Phys. Chem. C 2013, 117(44), 22603. doi: 10.1021/jp408717x
-
[34]
Xu, K.; Zhang, S.; Jow, T. R. Electrochem. Solid-State Lett. 2003, 6, A117. doi: 10.1149/1.1568173
-
[35]
Wu, Q.; Lu, W.; Miranda, M.; Honaker-Schroeder, T. K.; Lakhsassi, K. Y.; Dees, D. Electrochem. Commun. 2012, 24, 78. doi: 10.1016/j.elecom.2012.08.016
-
[36]
Xu, M.; Zhou, L.; Dong, Y.; Chen, Y.; Demeaux, J.; MacIntosh, A. D.; Garsuch, A.; Lucht, B. L. Energy Environ. Sci. 2016, 9, 1308. doi: 10.1039/C5EE03360H
-
[37]
Ue, M.; Ida, K.; Mori, S. J. Electrochem. Soc. 1994, 141, 2989. doi: 10.1149/1.2059270
-
[38]
Ue, M.; Takeda, M.; Takehara, M.; Mori, S. J. Electrochem. Soc. 1997, 144, 2684. doi: 10.1149/1.1837882
-
[39]
Nanini-Maury, E.; Światowska, J.; Chagnes, A.; Zanna, S.; Tran-Van, P.; Marcus, P.; Cassir, M. Electrochim. Acta 2014, 115, 223. doi: 10.1016/j.electacta.2013.10.087
-
[40]
Nagahama, M.; Hasegawa, N.; Okada, S. J. Electrochem. Soc. 2010, 157, A748. doi: 10.1149/1.3417068
-
[41]
Kavan L. Chem. Rev. 1997, 97, 3061. doi: 10.1021/cr960003n
-
[42]
Abu-Lebdeh, Y.; Davidson, I. J. Electrochem. Soc. 2009, 156, A60. doi: 10.1149/1.3023084
-
[43]
Abu-Lebdeh, Y.; Davidson, I. J. Power Sources 2009, 189, 576. doi: 10.1016/j.jpowsour.2008.09.113
-
[44]
Gmitter, A. J.; Plitz, I.; Amatucci, G. G. J. Electrochem. Soc. 2012, 159, A370. doi: 10.1149/2.016204jes
-
[45]
Xu, K.; Angell, C. A. J. Electrochem. Soc. 1998, 145, L70. doi: 10.1149/1.1838419
-
[46]
Sun, X.-G.; Angell, C. A. Solid State Ionics 2004, 175, 257. doi: 10.1016/j.ssi.2003.11.035
-
[47]
Sun, X.-G.; Angell, C. A. Electrochem. Commun. 2005, 7, 261. doi: 10.1016/j.elecom.2005.01.010
-
[48]
Sun, X.; Angell, C. A. Meeting Abstracts 2008, MA2008-01, 162.
-
[49]
Watanabe, Y.; Kinoshita, S.-i.; Wada, S.; Hoshino, K.; Morimoto, H.; Tobishima, S.-i. J. Power Sources 2008, 179, 770. doi: 10.1016/j.jpowsour.2008.01.006
-
[50]
Sun, X.; Angell, C. A. Electrochem. Commun. 2009, 11, 1418. doi: 10.1016/j.elecom.2009.05.020
-
[51]
Mao, L.; Li, B.; Cui, X.; Zhao, Y.; Xu, X.; Shi, X.; Li, S.; Li, F. Electrochim. Acta 2012, 79, 197. doi: 10.1016/j.electacta.2012.06.102
-
[52]
Li, C.; Zhao, Y.; Zhang, H.; Liu, J.; Jing, J.; Cui, X.; Li, S. Electrochim. Acta 2013, 104, 134. doi: 10.1016/j.electacta.2013.04.075
-
[53]
Wu, F.; Xiang, J.; Li, L.; Chen, J.; Tan, G.; Chen, R. J. Power Sources 2012, 202, 322. doi: 10.1016/j.jpowsour.2011.11.065
-
[54]
Wu, F.; Zhu, Q.; Li, L.; Chen, R.; Chen, S. J. Mater. Chem. A 2013, 1, 3659. doi: 10.1039/c3ta01182h
-
[55]
Abouimrane, A.; Belharouak, I.; Amine, K. Electrochem. Commun. 2009, 11, 1073. doi: 10.1016/j.elecom.2009.03.020
-
[56]
Xing, L.; Vatamanu, J.; Borodin, O.; Smith, G. D.; Bedrov, D. J. J. Phys. Chem. C 2012, 116, 23871. doi: 10.1021/jp3054179
-
[57]
Sakaebe, H.; Matsumoto, H. Electrochem. Commun. 2003, 5, 594. doi: 10.1016/S1388-2481(03)00137-1
-
[58]
Matsumoto, H.; Sakaebe, H.; Tatsumi, K. J. Power Sources 2005, 146, 45. doi: 10.1016/j.jpowsour.2005.03.103
-
[59]
Galiński, M.; Lewandowski, A.; Stępniak, I. Electrochim. Acta 2006, 51, 5567. doi: 10.1016/j.electacta.2006.03.016
-
[60]
Armand, M.; Endres, F.; MacFarlane, D. R.; Ohno, H.; Scrosati, B. Nat. Mater. 2009, 8, 621. doi: 10.1038/nmat2448
-
[61]
Seki, S.; Serizawa, N.; Takei, K.; Miyashiro, H.; Watanabe, M. Meeting Abstracts 2011, MA2011-02, 1277.
-
[62]
Le, M.-L.-P.; Alloin, F.; Strobel, P.; Leprêtre, J.-C.; Cointeaux, L.; Valle, C. Ionics 2012, 18, 817. doi: 10.1007/s11581-012-0688-x
-
[63]
Dokko, K.; Tachikawaa, N.; Yamauchia, K.; Tsuchiyaa, M.; Yamazakia, A.; Takashimaa, E.; Parka, J.-W.; Uenoa, K.; Sekib, S.; Serizawab, N.; Watanabea, M. J. Electrochem. Soc. 2013, 160, A1304. doi: 10.1149/2.111308jes
-
[64]
Borgel, V.; Markevich, E.; Aurbach, D.; Semrau, G.; Schmidt, M. J. Power Sources 2009, 189, 331. doi: 10.1016/j.jpowsour.2008.08.099
-
[65]
Xiang, J.; Wu, F.; Chen, R.; Li, L.; Yu, H. J. Power Sources 2013, 233, 115. doi: 10.1016/j.jpowsour.2013.01.123
-
[66]
Mun, J.; Yim, T.; Park, K.; Ryu, J. H.; Kim, Y. G.; Oh, S. M. J. Electrochem. Soc. 2011, 158, A453. doi: 10.1149/1.3560205
-
[67]
Kitagawa, T.; Azuma, K.; Koh, M.; Yamauchi, A.; Kagawa, M.; Sakata, H.; Miyawaki, H.; Nakazono, A.; Arima, H.; Yamagata, M. Electrochemistry 2010, 78, 345. doi: 10.5796/electrochemistry.78.345
-
[68]
Hu, L.; Zhang, Z.; Amine, K. Electrochem. Commun. 2013, 35, 76. doi: 10.1016/j.elecom.2013.08.009
-
[69]
Markevich, E.; Salitra, G.; Fridman, K.; Sharabi, R.; Gershinsky, G.; Garsuch, A.; Semrau, G.; Schmidt, M. A.; Aurbach, D. Langmuir 2014, 30, 7414. doi: 10.1021/la501368y
-
[70]
Zhang, Z.; Hu, L.; Wu, H.; Weng, W.; Koh, M.; Redfern, P. C.; Curtiss, L. A.; Amine, K. Energy Environ. Sci. 2013, 6, 1806. doi: 10.1039/c3ee24414h
-
[71]
Achiha, T.; Nakajima, T.; Ohzawa, Y.; Koh, M.; Yamauchi, A.; Kagawa, M.; Aoyama, H. J. Electrochem. Soc. 2010, 157, A707. doi: 10.1149/1.3377084
-
[72]
Xia, L.; Xia, Y.; Wang, C.; Hu, H.; Lee, S.; Yu, Q.; Chen, H.; Liu, Z. ChemElectroChem 2015, 2, 1707. doi: 10.1002/celc.201500286
-
[73]
Yan, G.; Li, X.; Wang, Z.; Guo, H.; Wang, J. J. Phys. Chem. C 2014, 118, 6586. doi: 10.1021/jp4119106
-
[74]
Chen, Z.; Qin, Y.; Ren, Y.; Lu, W.; Orendorff, C. E.; Roth, P.; Amine, K. Energy Environ. Sci. 2011, 4, 4023. doi: 10.1039/c1ee01786a
-
[75]
Wong, D. H. C.; Thelen, J. L.; Fu, Y.; Devaux, D.; Pandya, A. A.; Battaglia, V. S.; Balsara, N. P.; Desimone, J. M. PNAS 2014, 111, 3327. doi: 10.1073/pnas.1314615111
-
[76]
Arai, J. J. Electrochem. Soc. 2003, 150, A219. doi: 10.1149/1.1538224
-
[77]
Naoi, K.; Iwama, E.; Ogihara, N.; Nakamura, Y.; Segawa, H.; Ino, Y. J. Electrochem. Soc. 2009, 156, A272. doi: 10.1149/1.3073552
-
[78]
Naoi, K.; Iwama, E.; Honda, Y.; Shimodate, F. J. Electrochem. Soc. 2010, 157, A190. doi: 10.1149/1.3265475
-
[79]
黄倩, 严曼明, 江志裕, 化学学报, 2008, 66, 1. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract330952.shtmlHuang, Q.; Yan, M.-M.; Jiang, Z.-Y. Acta Chim. Sinica 2008, 66, 1. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract330952.shtml
-
[80]
夏兰, 博士论文, 武汉大学, 武汉, 2013.Xia, L. Ph. D. Dissertation, Wuhan University, Wuhan, 2013.
-
[81]
Choi, J.-A.; Sun, Y.-K.; Shim, E.-G.; Scrosati, B.; Kim, D.-W. Electrochim. Acta 2011, 56, 10179. doi: 10.1016/j.electacta.2011.09.009
-
[82]
潘笑容, 连芳, 关红艳, 何逸, 化学通报, 2014, 77, 752.Pan, X.-R.; Lian, F.; Guan, H.-Y.; He, Y. Chemistry 2014, 77, 752.
-
[83]
Lombardo, L.; Brutti, S.; Navarra, M. A.; Panero, S.; Reale, P. J. Power Sources 2013, 227, 8. doi: 10.1016/j.jpowsour.2012.11.017
-
[84]
Wang, X.; Yasukawa, E.; Kasuya, S. J. Electrochem. Soc. 2001, 148, A1058. doi: 10.1149/1.1397773
-
[85]
Feng, J. K.; Ai, X. P.; Cao, Y. L.; Yang, H. X. J. Power Sources 2008, 177, 194. doi: 10.1016/j.jpowsour.2007.10.084
-
[86]
Jia, H.; Wang, J. L.; Lin, F. J.; Monroe, C. W.; Yang, J.; NuLi, Y. Chem. Commun. 2014, 50, 7011. doi: 10.1039/C4CC01151A
-
[87]
Xu, K.; Ding, M. S.; Zhang, S. S.; Allen, J. L.; Jow, T. R. J. Electrochem. Soc. 2002, 149, A622 doi: 10.1149/1.1467946
-
[88]
Wu, B. B.; Pei, F.; Wu, Y.; Mao, R. J.; Ai, X. P.; Yang, H. X.; Cao, Y. L. J. Power Source 2013, 227, 106. doi: 10.1016/j.jpowsour.2012.11.018
-
[89]
Zeng, Z. Q.; Jiang, X. Y.; Wu, B. B.; Xiao, L. F.; Ai, X. P.; Yang, H. X.; Cao, Y. L. Electrochim. Acta 2014, 129, 300. doi: 10.1016/j.electacta.2014.02.062
-
[90]
Xu, K.; Ding, M. S.; Zhang, S.; Allen, J. L.; Jow, T. R. J. Electrochem. Soc. 2003, 150, A161. doi: 10.1149/1.1533040
-
[91]
Xu, K.; Zhang, S. S.; Allen, J. L.; Jow, T. R. J. Electrochem. Soc. 2003, 150, A170. doi: 10.1149/1.1533041
-
[92]
Tsujikawa, T.; Yabuta, K.; Matsushita, T.; Matsushima, T.; Hayashi, K.; Arakawa, M. J. Power Sources 2009, 189, 429. doi: 10.1016/j.jpowsour.2009.02.010
-
[93]
Zhang, S. S.; Xu, K.; Jow, T. R. J. Power Source 2003, 113, 166. doi: 10.1016/S0378-7753(02)00537-2
-
[94]
Xiang, H. F.; Xu, H. Y.; Wang, Z. Z.; Chen, C. H. J. Power Source 2007, 173, 562. doi: 10.1016/j.jpowsour.2007.05.001
-
[95]
Xia, L.; Xia, Y.-G.; Liu, Z.-P. J. Power Sources 2015, 278, 190. doi: 10.1016/j.jpowsour.2014.11.140
-
[96]
Allen, C. W.; Bedell, S.; Pennington, W. T.; Cordes, A. W. Inorg. Chem. 1985, 24, 1653. doi: 10.1021/ic00205a012
-
[97]
Feng, J. K.; An, Y. L.; Ci, L. J.; Xiong, S. L. J. Mater. Chem. A 2015, 3, 14539. doi: 10.1039/C5TA03548A
-
[98]
Zhou, D.; Li, W.; Tan, C.; Zuo, X.; Huang, Y. J. Power Sources 2008, 184, 589. doi: 10.1016/j.jpowsour.2008.03.008
-
[99]
Arai, J.; Katayama, H.; Akahoshi, H. J. Electrochem. Soc. 2002, 149, A217. doi: 10.1149/1.1433749
-
[100]
Arai, J. J. Appl. Electrochem. 2002, 32, 1071. doi: 10.1023/A:1021231514663
-
[101]
Arai, J. J. Electrochem. Soc. 2003, 150, A219. doi: 10.1149/1.1538224
-
[102]
Naoi, K.; Iwama, E.; Ogihara, N.; Nakamura, Y.; Segawa, H.; Ino, Y. J. Electrochem. Soc. 2009, 156, A272. doi: 10.1149/1.3073552
-
[103]
Naoi, K.; Iwama, E.; Honda, Y.; Shimodate, F. J. Electrochem. Soc. 2010, 157, A190. doi: 10.1149/1.3265475
-
[104]
Kim, G.-T.; Jeong, S. S.; Joost, M.; Rocca, E.; Winter, M.; Passerini, S.; Balducci, A. J. Power Sources 2011, 196, 2187. doi: 10.1016/j.jpowsour.2010.09.080
-
[105]
Kim, G.-T.; Jeong, S. S.; Xue, M.-Z.; Balducci, A.; Winter, M.; Passerini, S.; Alessandrini, F.; Appetecchi, G. B. J. Power Sources 2012, 199, 239. doi: 10.1016/j.jpowsour.2011.10.036
-
[106]
Appetecchi, G. B.; Scaccia, S.; Tizzani, C.; Alessandrini, F.; Passerini, S. J. Electrochem. Soc. 2006, 153, A1685. doi: 10.1149/1.2213420
-
[107]
Kalhoff, J.; Kim, G.-T.; Passerini, S.; Appetecchi, G. B. J. Power Energy Eng. 2016, 4, 9.
-
[108]
Yang, B.; Li, C.; Zhou, J.; Liu, J.; Zhang, Q. Electrochim. Acta 2014, 148, 39. doi: 10.1016/j.electacta.2014.10.001
-
[109]
Lombardo, L.; Brutti, S.; Navarra, M. A.; Panero, S.; Reale, P. J. Power Sources 2013, 227, 8. doi: 10.1016/j.jpowsour.2012.11.017
-
[110]
Wilken, S.; Xiong, S.; Scheers, J.; Jacobsson, P.; Johansson, P. J. Power Sources 2015, 275, 935. doi: 10.1016/j.jpowsour.2014.11.071
-
[111]
Ferrari, S.; Quartarone, E.; Mustarelli, P.; Magistris, A.; Protti, S.; Lazzaroni, S.; Fagnoni, M.; Albini, A. J. Power Sources 2009, 194, 45. doi: 10.1016/j.jpowsour.2008.12.013
-
[112]
Chen, Z.; Xi, H.; Lim, K. H.; Lee, J. Angew. Chem. Int. Ed. 2013, 52, 13392. doi: 10.1002/anie.201306476
-
[113]
Quinzeni, I.; Ferrari, S.; Quartarone, E.; Tomasi, C.; Fagnoni, M.; Mustarelli, P. J. Power Sources 2013, 237, 204. doi: 10.1016/j.jpowsour.2013.03.036
-
[114]
Kim, H.-T.; Kang, J.; Mun, J.; Oh, S. M.; Yim, T.; Kim, Y. G. ACS Sustainable Chem. Eng. 2016, 4, 497. doi: 10.1021/acssuschemeng.5b00981
-
[115]
Yamada, Y.; Yamada, A. J. Electrochem. Soc. 2015, 162, A2406. doi: 10.1149/2.0041514jes
-
[116]
Yamada, Y.; Furukawa, K.; Sodeyama, K.; Kikuchi, K.; Yaegashi, M.; Tateyama, Y.; Yamada, A. J. Am. Chem. Soc. 2014, 136, 5039. doi: 10.1021/ja412807w
-
[117]
Doi, T.; Masuhara, R.; Hashinokuchi, M.; Shimizu, Y.; Inaba, M. Electrochim. Acta 2016, 209, 219. doi: 10.1016/j.electacta.2016.05.062
-
[118]
Wang, J.; Yamada, Y.; Sodeyama, K.; Chiang, C. H.; Tateyama, Y.; Yamada, A. Nat. Commun. 2016, 7, 12032. doi: 10.1038/ncomms12032
-
[119]
Matsumoto, K.; Inoue, K.; Nakahara, K.; Yuge, R.; Noguchi, T.; Utsugi, K. J. Power Sources 2013, 231, 234. doi: 10.1016/j.jpowsour.2012.12.028
-
[120]
McOwen, D. W.; Seo, D. M.; Borodin, O.; Vatamanu, J.; Boyle, P. D.; Henderson, W. A. Energy Environ. Sci. 2014, 7, 416. doi: 10.1039/C3EE42351D
-
[121]
Yamada, Y.; Chiang, C. H.; Sodeyama, K.; Wang, J.; Tateyama, Y.; Yamada, A. ChemElectroChem 2015, 2, 1687. doi: 10.1002/celc.201500235
-
[122]
Besenhard, J. O. Carbon 1976, 14, 111. doi: 10.1016/0008-6223(76)90119-6
-
[123]
Besenhard, J. O.; Winter, M.; Yang, J.; Biberacher, W. J. Power Sources 1995, 54, 228. doi: 10.1016/0378-7753(94)02073-C
-
[124]
Arakawa, M.; Yamaki, J. J. Electroanal. Chem. 1987, 219, 273. doi: 10.1016/0022-0728(87)85045-3
-
[125]
Abe, T.; Kawabata, N.; Mizutani, Y.; Inaba, M.; Ogumi, Z. J. Electrochem. Soc. 2003, 150, A257. doi: 10.1149/1.1541004
-
[126]
Yamada, Y.; Yaegashi, M.; Abe, T.; Yamada, A. Chem. Commun. 2013, 49, 11194. doi: 10.1039/c3cc46665e
-
[127]
Sodeyama, K.; Yamada, Y.; Aikawa, K.; Yamada, A.; Tateyama, Y. J. Phys. Chem. C 2014, 118, 14091. doi: 10.1021/jp501178n
-
[128]
Suo, L.; Hu, Y.-S.; Li, H.; Armand, M.; Chen, L. Nat. Commun. 2013, 4, 1481. doi: 10.1038/ncomms2513
-
[129]
Qian, J.; Henderson, W. A.; Xu, W.; Bhattacharya, P.; Engelhard, M.; Borodin, O.; Zhang, J. G. Nat. Commun. 2015, 6, 6362. doi: 10.1038/ncomms7362
-
[130]
Ma, Q.; Fang, Z.; Liu, P.; Ma, J.; Qi, X.; Feng, W.; Nie, J.; Hu, Y.-S.; Li, H.; Huang, X.; Chen, L.; Zhou, Z. ChemElectroChem 2016, 3, 531. doi: 10.1002/celc.201500520
-
[1]
-
图 4 (a) 1, 1, 1, 3, 3, 3-六氟异丙基甲基醚(HFPM)的结构式, (b)~(d)两种电解液的物化性质比较, (e)~(f) 18650 MCMB/LiNi0.5Mn1.5O4实际电池的室温电化学性能比较[72]
Figure 4 (a) The chemical structure of HFPM ether and (b)~(d) the physico-chemical properties of the two electrolytes. (e) Voltage profiles for the charge-discharge cycles and (f) cycling performance according to the CC-CV protocol of the 18650 MCMB/LiNi0.5Mn1.5O4battery within the voltage range of 3.3~4.9 V at the 0.5 C rate[72]
图 7 离子液体-碳酸酯类溶剂二元混合电解液的可燃性测试及其在电池Li/LiFePO4中的高温60 ℃循环性能[114]
Figure 7 Left: cycle performance of the Li/LiFePO4 cells in six different electrolytes at 25 ℃; E 00 (black), E 20 (red), E 40 (blue), E 60 (green), E 80 (orange), and E 100 (pink). Right: images of the flammability tests of E 00, E 20, E 40, E 60, E 80, E 100[114]
图 9 电池Li/石墨在超高浓度电解液及相应的普通电解液中的充放电曲线对比[115]
Figure 9 Charge-discharge curves of natural graphite/Li metal half cells with dilute and concentrated LiTFSA electrolytes of (a) DME, (b) DMSO, (c) SL, and (d) AN at C/10 rate and 25 ℃. All the highly concentrated electrolytes correspond to the solvent/Li salt molar ratio of ca. 2. The charge-discharge test with a dilute LiTFSA/AN electrolyte was not possible because of high reactivity of AN solvent with Li metal[115]
表 1 常用的碳酸酯溶剂的熔沸点、闪点比较
Table 1. Comparisons of physical properties of conventional carbonates
Solvent DMC DEC EMC EC PC Melting point/℃ 4.6 -74.3 -53 36.4 -48.8 Boiling point/℃ 91 126 110 248 242 Flash point/℃ 17 33 23 160 132 表 2 氟代溶剂与其未氟代溶剂的HOMO和LUMO能级比较[70, 73]
Table 2. Comparison of some fluorinated solvents with its nonfluorinated counterpart solvents[70, 73]
Structure HOMO/eV LUMO/eV 
-8.3014 0.5516 
-8.6510 0.2455 
-8.1376 0.0683 
-8.6930 -0.0988 
-7.1166 0.1622 
-9.6399 -0.0969 Table 3. Numerous flame retardant additives tested in most of the standard Li-ion electrolytes with mixed results as indicated in as follows[82~95, 98]
Flame retardant additives (FRs) The amount of FRs (Totally nonflammable electrolytes) Reference 
>40 wt% [1 mol•L-1 LiPF6/EC+EMC (1:1, by weight)] [84] 
>30 wt% [1 mol•L-1 LiPF6/EC+EMC (1:1, by weight)] [90] 
>20 wt% [1 mol•L-1 LiPF6/PC+EC+EMC
(3:3:4, by weight)][93] 
>40 wt% [1 mol•L-1 LiPF6/EC+EMC+DMC
(1:1:1, by weight)][98] Several fluorinated phosphazene-based flame retardants >15 wt% [1 mol•L-1 LiPF6/EC+DMC (1:1, by weight)] [92] 
>80 wt% [1 mol•L-1 LiPF6/EC+EMC+DMC (1:1:1, by weight)] [88] 
>50 wt% [1 mol•L-1 LiPF6/EC+DMC (1:1, by weight)] [89] 
≥5 wt% [1 mol•L-1 LiPF6/EC+DMC (1:1, by vol.)] [95] 表 4 锂离子电池三类电解液的基本性能比较
Table 4. Properties of different types of electrolyte used in lithium ion batteries
Electrolyte Typical example Viscosity/(mPa•s) Conductivity/(mS•cm-1) Electrochemical
window/VFlammability Ref. High voltage electrolytes 1 mol•L-1 LiPF6/EC+DMC (1:1 in wt%)-Sebaconitrile (50:50, by vol.) — 4.4, 25℃ ~7.5, glassy carbon electrode — [39] 1 mol•L-1 LiBF4/EC-DMC-Sebaconitrile (25:25:50, by vol.) — 1.8, 25℃ 0.4~7.0, glassy carbon electrode — [39, 40] 1 mol•L-1 Lithium bis(trifluoromethane
sulfonyl) imide (Lilm)/Ethyl methyl sulfone (EMSF)— 6.31, 25℃ 0~5.8, Pt working electrode — [45] 1.0 mol•L-1 LiTFSI/ethylmethoxyethyl sulfone (EMES) — 1.41, 25℃ 0~5.6, Pt working electrode — [47] 0.5 mol•L-1 LiTFSI/PP14-TFSI-TMS (60:40, by wt.) — 2.04, 25℃ 0~5.7, Pt working electrode Non-flammability [65] 1 mol•L-1 LiPF6/FEC-TFTFEP
(1:1, by vol.)9.44, 25℃ 3.51, 25℃ — — [67] 1 mol•L-1 LiPF6/FEC-DMC-EMC-HFPM
(2:3:1:4, by vol.)— 8.57, 30℃ 0~5.5, Pt working
electrodeNon-flammability [72] Flame
retardant electrolytes1 mol•L-1 LiPF6/ClEC-TFPC — 3~4, 25℃ — — [99] 1 mol•L-1 LiBETI-MFE/EMC (80:20, by vol.) — 0.56, 25℃ — No flash point [100] 1 mol•L-1 LiBETI/EC+DEC+TMMP (5:45:50, by vol.) — 1.0, 20℃ 0~5.6, Pt working
electrodeNon-flammability [102] 0.5 mol•L-1 LiTFSI/EC-DEC PYR1, 2O1TFSI, by vol. 25, 20℃ 7.0, 20℃ 0~4.5, Ni working
electrodeNon-flammability [113] 1 mol•L-1 LiPF6/EC-EMC (3:7, by vol.) +1 mol•L-1 LiTFSI/E(OMe)Pyrl-FSI (20:80, by wt.%) 25, 20℃ 6.9, 20℃ 1.2~4.5, glassy carbon electrode Non-flammability [114] Highly
concentrated electrolytes4.27 mol•kg-1/PC 706.5, 30℃ 0.403, 30℃ ~5.0, Pt working
electrode— [117] LiFSA/DMC 1:1.1 molar ratio 238.9, 30℃ 1.1, 30℃ >5.5 V, Al electrode Not burn [118] LiFSA/AN 1:1.5 molar ratio 153, 30℃ 3.3, 30℃ >4.5 V, Al electrode — [121] LiFSA/DME 1:1.9 molar ratio 25.1, 30℃ 7.2, 30℃ — — [126] 7 mol•L-1 LiTFSI/DOL-DME
(1:1, by vol.)72, 25℃ 0.814, 25℃ — — [128] 5 mol•L-1 LiTFSI/DME — 1.7, 25oC 0~5.0, Pt working
electrode— [129] -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 70
- 文章访问数: 7576
- HTML全文浏览量: 1206


 下载:
下载:








 下载:
下载:

