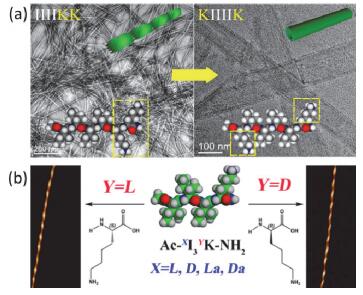
 图1
通过设计分子序列实现(a)纳米管与纳米纤维结构的转变[38]及(b)纤维手性结构的转变[39]
Figure1.
(a) Structure transition from nanofibers to nanotubes[38] and (b) chiral structure transition[39] by rational designing of molecular sequence
图1
通过设计分子序列实现(a)纳米管与纳米纤维结构的转变[38]及(b)纤维手性结构的转变[39]
Figure1.
(a) Structure transition from nanofibers to nanotubes[38] and (b) chiral structure transition[39] by rational designing of molecular sequence

Citation: Wang Juan, Zou Qianli, Yan Xuehai. Peptide Supramolecular Self-Assembly:Structural Precise Regulation and Functionalization[J]. Acta Chimica Sinica, 2017, 75(10): 933-942. doi: 10.6023/A17060272

肽超分子自组装:结构调控和功能化
English
Peptide Supramolecular Self-Assembly:Structural Precise Regulation and Functionalization
-
Key words:
- peptide
- / self-assembly
- / non-covalent interactions
- / structural precise regulation
- / functionalization
-
1 引言
生物分子自组装是生命的基础, 它在生物体中普遍存在, 从简单的脂质分子组装形成磷脂双分子层、肽链折叠形成蛋白质结构以及DNA双螺旋结构, 到更为复杂的细胞器、细胞、组织器官等, 都是由生物分子在不同尺度上分级自组装构建而成的, 这些高度协调自组装体系为生命体实现其功能性和活性提供了有利的保障.生物分子自组装过程是在动力学与热力学控制下自发形成有序聚集体的过程.该过程中, 各种非共价键力包括氢键力、静电力、疏水作用、π-π作用以及范德华力间的协同作用是决定自组装体形貌和功能的关键[1].受生物体系启发, 利用生物分子作为组装基元构筑各种尺度以及形貌的纳米结构, 一直受到人们广泛关注和研究[2].肽分子是一种较为常用的组装基元, 它由几个或多个氨基酸序列构成, 并具有很多优势比如生物兼容性、生物降解性、结构易编辑性、低免疫原性等[3~5].肽分子可自组装形成多种纳米或微米尺度的结构, 并可应用于生物医药、纳米科技、能源等多个领域[6~9].
随着科技的发展, 使得肽分子自组装的研究也面临新的挑战:不仅只局限于组装体纳米结构(以下简称为“组装结构”)的单一调控, 更要将相关研究拓展为利用肽分子分级自组装构建复杂结构的功能体系[10, 11], 即实现肽自组体纳米结构的精准调控(以下简称为“结构调控”)以及精准调控肽自组装实现功能化.因此, 本文将从这两个方面对相关研究进行综述.
2 肽分子自组装的结构调控
各种非共价键力, 包括氢键、疏水作用、静电作用、π-π堆积以及范德华力的协同作用是决定肽分子自组装结构和性质的关键[1, 12].通过调控组装基元的分子结构以及组装环境因素(包括pH、温度、浓度、外场等)可以调控这些非共价键力的相互作用, 进而实现对自组装过程的热力学和动力学控制[12].氢键作用具有高度选择性和方向性, 是诱导生物分子长程有序结构形成的关键性因素.肽分子含有许多氢键形成位点, 包括肽链骨架上的酰胺基团以及侧链上的氨基和羧基, 因此氢键在形成和稳定肽链的二级结构和蛋白质的折叠构象中起到重要作用.疏水作用是两亲性生物分子自组装的主要驱动力, 疏水作用不具有方向性, 在生物体中, 由于水分子的存在, 疏水作用往往伴随着氢键作用协同影响肽分子的自组装.静电作用和π-π堆积作用分别对荷电性的和具有芳香环类的肽分子有明显影响.但是与苯环的疏水作用不同的是, π-π作用中的苯环可以形成有序的堆积结构.范德华力是一种重要且普遍存在的非共价键力, 但它往往需要与其他非共价键力协同影响自组装过程.
肽超分子自组装的结构化以及功能化都是基于这些非共价键力的协同作用实现的; 反之, 如何通过各种因素调节这些非共价键力的作用, 成为人们实现组装结构有效调控的关键.目前, 自组装体结构调控的方式主要有两种: (1) 通过改变外部环境调控; (2) 通过组装基元分子间的相互作用调控.
2.1 外部环境调控
肽分子的自组装是在热力学和动力学协同控制下的过程:热力学上, 肽分子与溶剂间的非共价键相互作用决定了组装体的热力学稳定结构, 但是由于非共价键间弱的相互作用, 在不同的溶剂环境中, 即在不同pH、温度、对离子等动力学因素影响下, 肽分子可以通过不同的二级结构(比如β-折叠和α螺旋)构筑不同尺度的结构, 包括纳米管[13]、纳米纤维[14, 15]、微球[16]以及微米级的纤维束结构等.各种动力学因素可以有效地改变肽分子与溶剂分子的作用, 从而影响肽自组装体的形貌, 对组装动力学过程亦有重要调控作用[17, 18].
例如, Kim等[19]报道了二肽二苯丙胺酸(FF)在不同水环境中形貌与FF-水分子间相互作用的关系: XRD结果表明纳米管与纳米线的晶体结构是一致的, 而引起FF形貌不一致的原因在于所形成晶体中FF与水分子相互作用的区别.这说明FF与水分子作用程度不同, 会直接影响自组装体的形貌.因此, 增加溶液离子强度, 离子的水合效应会与FF的水合作用相竞争, 最终导致FF水合程度的改变, 从而可以有效地调控FF形貌的转变.另外, 通过增大环境湿度或增加体系中水含量[20~23], 亦可诱导肽纳米管生长为多级结构.通过调节水溶液pH[24]和温度[25], 可以获得不同形貌的自组装体. Xu等[26]引入乙腈增加水溶液的疏水性, 可以有效影响两亲性寡肽分子与水分子间的氢键作用, 从而改变所形成纤维的形貌.
简而言之, 作为一种较为广泛和常用的调控手段, 该方法主要通过改变溶剂环境包括pH、离子强度、浓度、温度等外部因素来改变组装分子与溶剂间的非共价键相互作用, 通过自组装过程的热力学和动力学控制实现肽分子组装结构的改变和调控[12].
2.2 组装基元分子间的相互作用调控
虽然仅通过改变基元分子的外部环境来改变自组装结构的方法较为普适和简单, 但该方法同时也存在较大的局限性, 即无法实现精准调控.而通过特定的分子设计[27~32], 亦或控制两种或两种以上的组装基元间的相互作用, 可以更有效地实现对组装体结构的精准调控[33~35].
2.2.1 氢键主导
氢键力是形成并稳定蛋白质/肽二级β-折叠结构的关键作用力, 亦是诱导蛋白质形成淀粉类纤维的主要因素. Xu等[36, 37]通过设计不同的肽分子序列来调控肽的自组装.例如, 对可形成螺旋纤维结构的寡肽分子I4K2的分子序列进行调整, 得到的新分子KI4K可形成纳米管结构(图 1a)[38].改变I3K分子中I序列以及K序列的手性, 亦可得到具有不同手性结构的纤维, 纤维的手性取决于K序列的性质(图 1b)[39].
 图1
通过设计分子序列实现(a)纳米管与纳米纤维结构的转变[38]及(b)纤维手性结构的转变[39]
Figure1.
(a) Structure transition from nanofibers to nanotubes[38] and (b) chiral structure transition[39] by rational designing of molecular sequence
图1
通过设计分子序列实现(a)纳米管与纳米纤维结构的转变[38]及(b)纤维手性结构的转变[39]
Figure1.
(a) Structure transition from nanofibers to nanotubes[38] and (b) chiral structure transition[39] by rational designing of molecular sequence
Yan等[40]通过向二氯甲烷中引入微量溶剂(乙醇、N, N-二甲基甲酰胺、丙酮、水)的方法, 研究了氢键作用对二肽(FF)自组装的调控能力.由于引入的微量溶剂含量较低, 可以将微量溶剂分子当作溶质分子, 这些微量溶质分子与FF分子发生共组装, 从而作为主导因素来调控二肽的自组装行为.结果发现氢键作用力在FF纤维化过程中是关键的诱导因素, 添加的具有成氢键能力的微量溶剂可以有效地影响FF分子中C=O和N—H的氢键作用; 氢键的方向性可以诱导FF分子在长程方向上的有序排列, 最终导致纳米纤维以及纳米带结构的形成.
Xu等[41]利用不同的核苷对多肽进行了分子设计和改性, 之后将得到的核苷-肽分子两两混合, 可以得到同纤维结构的凝胶, 该凝胶具有很好的生物兼容性且对蛋白酶K表现出很好的抗水解性, 在所形成的纤维结构中, 不同结构的核苷-肽分子间的氢键和疏水协同作用是使体系稳定的关键因素.
2.2.2 静电力和π-π作用主导
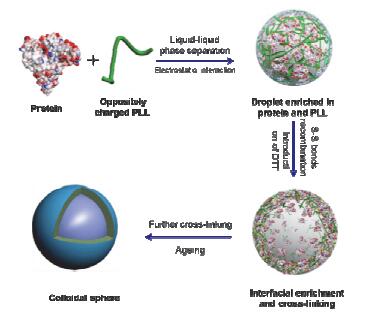
一般情况下, 疏水作用会诱导蛋白质分子聚集, 但是所形成的聚集体稳定性较差, 在体外或体内的稀释作用都会使聚集体发生解组装.近年来, 利用二元组分比如蛋白/肽和生物聚合物间的强静电作用, 可以自组装形成纳米载体, 从而提高蛋白质聚集体的稳定性, 受到人们广泛关注. Yan等[42]利用人血清白蛋白(HSA)和带有反电荷的氨基酸类聚合物(聚-L-赖氨酸, PLL)间的静电作用自组装形成球形药物载体(图 2).球体的粒径可以通过HSA和PLL浓度以及pH等因素进行调节.形成的微球载体既可负载水溶性的小分子(包括染料分子)以及生物大分子(比如葡萄聚糖、蛋白质等), 亦可负载非水溶性的分子比如尼罗红染料分子, 从而可以赋予这种基于蛋白质的生物材料不同的性质, 应用在不同领域.例如, 将光敏剂负载到微球中, 将微球表面利用聚乙二醇修饰(PEG化), 可用于肿瘤的光动力治疗[43].
利用二肽与卟啉分子共组装构筑多孔球形结构:在酸性条件下, 二肽分子中胺基质子化使二肽带有正电荷[FF]+, 而卟啉分子中磺酸基的去质子化使之带有负电荷[H4TPPS]2-, [FF]+与[H4TPPS]2-分子间的静电作用使卟啉分子形成有序的J聚集结构, 进而形成肽-卟啉纳米棒, 这些纳米棒进一步在疏水作用下形成多孔(多腔室)且具有高水化程度的球形结构(图 3a和3b).由于卟啉分子的引入, 微球可吸收光能, 因此可利用该微球捕获光能, 在微球中发生光催化反应, 在水溶液中催化还原金属盐制备无机或有机材料.例如, 原位照射微球5 min, 便可在微球表面形成约2 nm的Pt纳米粒子[44].
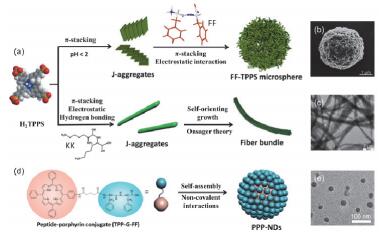 图3
(a) 卟啉分别与FF和KK形成球状与纤维结构示意图[44, 45]、(b)卟啉与FF形成的微球的SEM图、(c)卟啉与KK形成的纤维束的TEM图、(d)卟啉-肽分子自组装形成纳米点示意图及(e)纳米点的TEM图[47]
Figure3.
(a) Schematic illustration of the fabrication of spheres and fibers by assembly of TPPS with FF and KK, respectively[44, 45], (b) SEM image of the spheres assembled by TPPS and FF, (c) TEM image of the fiber bundles assembled by TPPS and KK, (d) schematic illustration of the fabrication of photothermal nanodots and (e) TEM image of the nanodots[47]
图3
(a) 卟啉分别与FF和KK形成球状与纤维结构示意图[44, 45]、(b)卟啉与FF形成的微球的SEM图、(c)卟啉与KK形成的纤维束的TEM图、(d)卟啉-肽分子自组装形成纳米点示意图及(e)纳米点的TEM图[47]
Figure3.
(a) Schematic illustration of the fabrication of spheres and fibers by assembly of TPPS with FF and KK, respectively[44, 45], (b) SEM image of the spheres assembled by TPPS and FF, (c) TEM image of the fiber bundles assembled by TPPS and KK, (d) schematic illustration of the fabrication of photothermal nanodots and (e) TEM image of the nanodots[47]
通过改变二肽的性质可以有效调控自组装结构, 用L-Lys-L-Lys (KK)代替FF与卟啉共组装后, KK-卟啉分子间的静电作用和氢键作用、以及卟啉-卟啉分子间的π-π作用协同诱导卟啉分子形成具有J聚集结构的KK-卟啉纳米棒.在短程的范德华力作用下, 纳米棒聚集成多级的长程纤维束结构, 纳米棒的进一步聚集可用Onsager理论中的平动熵和转动熵变来解释(图 3a和3c).最终形成的纤维束结构具有很好的光催化活性和光稳定性, 可用于催化还原生成Pt纳米球或Pt纳米线[45].结合全原子分子动力学模拟(MD)以及耗散粒子动力学模拟(DPD), 细化研究了卟啉与两种不同的二肽形成不同纳米结构的原因:虽然FF与KK都会诱导卟啉形成J聚集的纳米棒结构, 但是由于FF分子的强疏水性使FF更倾向于插入卟啉J聚集体内部, 而亲水的KK分子则被固定在卟啉J聚集体的表面, 从而增强了卟啉纳米棒的方向性, 并促使纳米棒定向生长成纤维束结构[46].
以上是卟啉类分子与不同的寡肽分子共组装, 通过分子间作用力的协同以形成不同的组装结构.而设计将卟啉和二肽分子通过共价键合成为一个分子后, 则可以形成有趣的纳米点, 卟啉的π-π作用以及整个分子的疏水效应是形成的纳米点的主要驱动力.肽分子中的电荷端基有效地防止了卟啉分子过快的π堆积, 从而起到了稳定纳米点的作用(图 3d和3e)[47].
在温和的条件下(室温、水溶液中)可制备稳定的金-胶原核壳微球, 制备过程中没有加入其他还原剂和稳定剂.金原子与胶原蛋白分子间的静电力以及相伴随的羟(基)脯氨酸的原位还原作用是形成金-胶原核壳微球主要原因(图 4a和4c).进一步利用这些金-胶原核壳微球的层层自组装形成薄膜可以有效地应用于细胞的黏附以及生长[48].同样利用胶原蛋白和[AuCl4]-离子间的静电作用可诱导胶原蛋白形成纤维结构, 再利用原位矿化反应在纤维表面生成Au颗粒, 从而形成具有剪切变稀即可注射性质的水凝胶(图 4b和4d)[49].
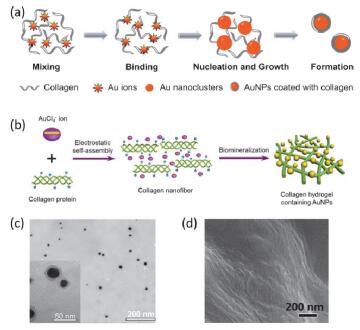 图4
(a) 金-胶原核壳微球形成示意图[48]、(b)金-胶原纤维结构形成示意图[49]、(c)金-胶原核壳微球的TEM图及(d)金-胶原纤维的SEM图.
Figure4.
(a) Schematic illustration of the fabrication of Au-collagen core-shell microspheres[48], (b) Schematic depiction of the fabrication of Au-collagen nanofibers[49], (c) TEM image of the microspheres and (d) SEM image of the fibers
图4
(a) 金-胶原核壳微球形成示意图[48]、(b)金-胶原纤维结构形成示意图[49]、(c)金-胶原核壳微球的TEM图及(d)金-胶原纤维的SEM图.
Figure4.
(a) Schematic illustration of the fabrication of Au-collagen core-shell microspheres[48], (b) Schematic depiction of the fabrication of Au-collagen nanofibers[49], (c) TEM image of the microspheres and (d) SEM image of the fibers
多金属氧簇(POM)是一种常用的具有催化、电学、光学等性质的无机杂化聚离子. Yan等[50]提出将POM引入肽自组装中, 在静电力的诱导下, 肽包裹POM形成团簇, 团簇多级自组装形成粒径约150 nm的球状结构(图 5a~5c). Li等[51]进一步探究了肽分子与POM分子性质对自组装最终形貌的影响, 结果发现:在非共价键协同作用下, 较大的POM则诱导肽形成纳米微球结构; 而在位阻效应影响下, 较小的POM会诱导肽形成纤维结构(图 5d和5e).由于POM的引入, 所形成的肽杂化纤维表面带有过量的正电荷以及大量可以与菌细胞作用的成键位点, 从而有效地增强了肽的抗菌效果[52].
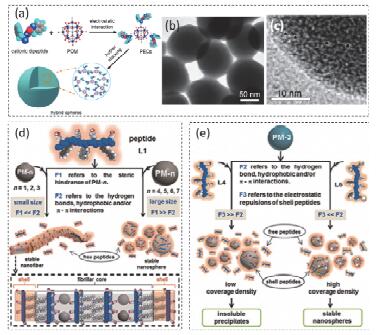 图5
肽-POM杂化纳米球的(a)形成示意图、(b) TEM图、(c)高分辨TEM图[50]及(d, e)肽与不同POM在不同非共价键力主导下形成纳米纤维和纳米球的示意图[51]
Figure5.
(a) Schematic illustration of the fabrication of peptide-POM hybrid nanospheres, (b) TEM and (c) HR-TEM images of the hybrid nanospheres[50] and (d, e) schematic depiction of the fabrication of nanofibers and nanospheres assembled by peptide with different POM[51]
图5
肽-POM杂化纳米球的(a)形成示意图、(b) TEM图、(c)高分辨TEM图[50]及(d, e)肽与不同POM在不同非共价键力主导下形成纳米纤维和纳米球的示意图[51]
Figure5.
(a) Schematic illustration of the fabrication of peptide-POM hybrid nanospheres, (b) TEM and (c) HR-TEM images of the hybrid nanospheres[50] and (d, e) schematic depiction of the fabrication of nanofibers and nanospheres assembled by peptide with different POM[51]
除了通过引入客体分子(原子、聚离子)调控自组装结构, 利用两种或多种带有相反电荷的氨基酸, 亦可达到有效调控的目的. Banerjee等[53]将手性的Fmoc-谷氨酸(Glu)与手性的赖氨酸(Lys)共组装, 结果发现, 在静电作用下, Fmoc-(L)Glu与(L)Lys可形成左手螺旋结构的纤维, 而Fmoc-(D)Glu与(D)Lys则形成右手螺旋结构的纤维, 表明组装基元的手性性质决定了超分子结构的手性性质.但是向体系添加金属离子比如Ca2+或Mg2+, 则会使纤维的手性螺旋结构转变为常见的非手性结构, 这是由于金属离子可以有效地屏蔽氨基酸间的静电作用, 从而改变纤维的结构(图 6).
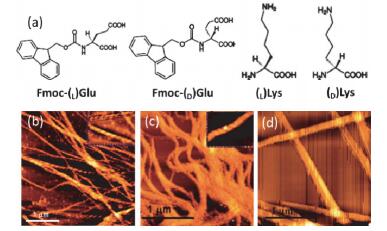 图6
(a) Fmoc-Glu与Lys分子结构示意图、(b) Fmoc-(L)Glu与(L)Lys形成的左手螺旋纤维、(c) Fmoc-(D)Glu与(D)Lys形成的右手螺旋纤维以及(d)在金属离子干扰下所形成纤维的AFM图[53]
Figure6.
(a) Chemical structures of Fmoc-Glu and Lys molecules. AFM images of (b) left handed helical fibers formed by Fmoc-(L)Glu and (L)Lys, (c) right handed helical fibers formed by Fmoc-(D)Glu and (D)Lys, and (d) straight fibers in the presence of metal ions[53]
图6
(a) Fmoc-Glu与Lys分子结构示意图、(b) Fmoc-(L)Glu与(L)Lys形成的左手螺旋纤维、(c) Fmoc-(D)Glu与(D)Lys形成的右手螺旋纤维以及(d)在金属离子干扰下所形成纤维的AFM图[53]
Figure6.
(a) Chemical structures of Fmoc-Glu and Lys molecules. AFM images of (b) left handed helical fibers formed by Fmoc-(L)Glu and (L)Lys, (c) right handed helical fibers formed by Fmoc-(D)Glu and (D)Lys, and (d) straight fibers in the presence of metal ions[53]
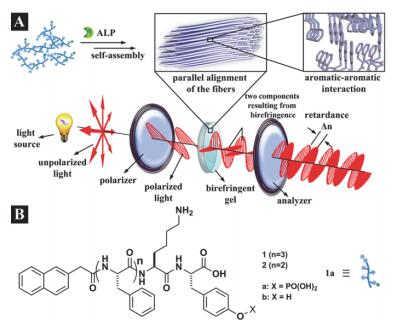
Xu研究组[54]报道了一系列利用分子间π-π堆积作用形成的凝胶体系.他们利用不同的苯环类基团包括芘基、芴基、萘基等对寡肽分子进行设计, 之后将两种不同改性的肽分子进行共组装形成纤维结构, 探讨了不同苯环基团对纤维结构的影响, 结果表明只有分子间π-π作用与氢键作用达到平衡的体系才可以形成凝胶结构.该组还利用酶诱导肽通过π-π作用形成各向异性的凝胶, 该凝胶对光有很好的偏振效果(图 7)[55].
2.2.3 共价键作用诱导
设计合适的分子, 在自组装过程中利用分子间功能基团间的共价键相互作用, 使二元或多元组分进行“融合”后, 再在非共价键相互作用的驱动下, 可调控不同纳米结构的形成.二肽(FF)分子在高温下会发生环化反应, 退火后可生成纳米带结构.引入另一组分甲酰胺后, 甲酰胺与FF间的Schiff碱反应会促使FF环化结构的生成, 从而控制纳米带结构转变为更厚的平板结构[56].而在FF体系中引入戊二醛分子后, 则由于二肽(FF)分子中氨基与戊二醛(GA)分子中醛基间的Schiff碱反应生成“哑铃”型二肽(FF-GAn-FF)[57], 进一步在油水界面上控制FF-GAn-FF成核和生长速率, 即可获得不同形貌颗粒, 包括月牙型、碗状以及球形结构(图 8a~8c)[58].形成的纳米球可以有效负载药物, 进行相关生物治疗.例如, Fei和Li等[59]将抗生血的药物包覆在FF-GA纳米球中, 在生物流体(pH)的刺激下, FF-GAn-FF分子链间的非共价键被快速破坏(响应时间5 s以内), 从而释放出药物并达到止血的目的(图 8d).
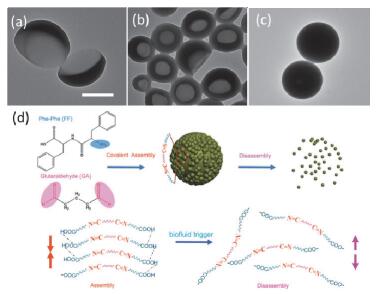 图8
由FF与GA共价键作用形成“FF-GAn-FF”继而形成的(a)月牙型、(b)碗状以及(c)球形结构的TEM图(标尺为200 nm)[58]和(d)在生物流体条件下, FF-GAn-FF分子链间的非共价键断裂引起的解组装示意图[59]
Figure8.
TEM images of (a) crescent-like, (b) bowl-like, and (c) spherical nanoparticles assembled by FF-GAn-FF, which formed by covalent interactions between FF and GA (The scale bar is 200 nm)[58] and (d) Schematic illustration of nanoparticle disassembly due to electrostatic repulsion between FF-GAn-FF units[59]
图8
由FF与GA共价键作用形成“FF-GAn-FF”继而形成的(a)月牙型、(b)碗状以及(c)球形结构的TEM图(标尺为200 nm)[58]和(d)在生物流体条件下, FF-GAn-FF分子链间的非共价键断裂引起的解组装示意图[59]
Figure8.
TEM images of (a) crescent-like, (b) bowl-like, and (c) spherical nanoparticles assembled by FF-GAn-FF, which formed by covalent interactions between FF and GA (The scale bar is 200 nm)[58] and (d) Schematic illustration of nanoparticle disassembly due to electrostatic repulsion between FF-GAn-FF units[59]
综上所述, 利用两种或两种以上的组装基元间的相互作用可以提高自组装结构的精准性, 更有利于通过特定的分子设计, 实现自组装体的功能化.
3 肽分子自组装的功能化
无论何种形貌、结构的肽自组装体, 其功能化的实现才是人们日益关注的重点.有些肽序列或组装结构本身具有功能性, 例如分子识别、光波导以及电导等.比如FF分子组装形成的纳米管具有光波导性质(图 9)[56, 60].而大多肽分子本身无功能化, 需要引入功能化的分子, 比如光敏剂等与肽分子协同作用, 从而实现自组装体的功能化.
3.1 模拟仿生光合成系统
自然光合成系统能将太阳能高效转化为化学能, 模拟和创建这类系统为人们更大程度地利用太阳能提供了机遇.在自然界中的光合成系统中, 最有效实现光捕获以及能量转移的方式即是利用蛋白质/肽与具有发色基团的、功能性的分子共组装形成的自组装体, 而如何通过精准的人工调控, 来增强光捕获、电荷分离和催化反应的持续性, 是构建模拟光合成系统的关键科学问题.
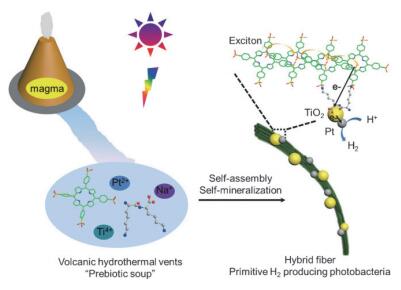
Yan等[61]利用肽与功能性分子共自组装来模拟光合成系统方面开展了一系列工作.二肽与卟啉分子自组装形成的纤维束体系很好的模拟了绿色体中菌绿素的组织模式, 纤维束中的J聚集结构增强了光吸收和能量传递能力.在模拟的类似陆地火山热液的“原始汤”即酸性pH=2.0、热70 ℃、富含矿物质(Na+, Ti4+, Pt2+)的环境中, 纤维束可作为矿化模板原位生成TiO2和Pt纳米颗粒, 在杂化纤维束上形成了捕光单元(卟啉)、反应中心(TiO2)和催化中心(Pt)的高效偶合, 从而有效地实现了可高效持续产氢的仿生系统(图 10).该工作通过结构设计利用肽与功能性分子共组装这一简单方式, 不仅在卟啉的组织结构上模拟了绿色体, 也模拟了光合产氢细菌的基本工作原则.
另外, 利用胱氨酸-金属离子矿化的自适性亦可以模拟构建绿色体的分级组织结构:金属离子可以通过配位和氢键作用介导胱氨酸矿化形成分级有序微球, 结构上类似于叶绿体基粒的堆叠.在微球形成过程中, 引入卟啉和乙醇脱氢酶分别作为光催化剂和酶催化剂, 微球可以通过配位和静电作用包封这两种客体分子, 使它们附着排布在微球中的纳米棒结构上, 且彼此邻近, 从而实现了该体系的光酶偶联反应, 该工作在结构上模拟了叶绿体基粒的分级组织结构, 功能上模拟了叶绿体中光反应和暗反应的偶联, 增强了光催化燃料生成的持续性(图 11)[62].
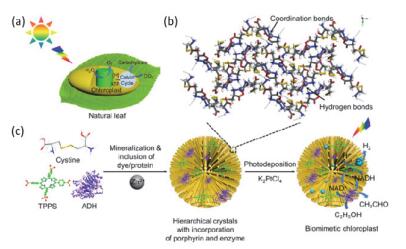 图11
(a) 自然叶绿体中光反应和暗反应的示意图、(b)分子间作用模式及(c)锌离子介导胱氨酸自组装同时包封卟啉和酶进行光酶反应构建仿生分级组织叶绿体的示意图[62]
Figure11.
(a) Schematic illustration of light reaction and dark reaction in natural chloroplast, (b) molecular interactions between peptide and Zn2+, and (c) schematic illustration of the fabrication of Zn2+-directed assembly of cystine with encapsulation of TPPS and enzyme for photoenzymatic reactions[62]
图11
(a) 自然叶绿体中光反应和暗反应的示意图、(b)分子间作用模式及(c)锌离子介导胱氨酸自组装同时包封卟啉和酶进行光酶反应构建仿生分级组织叶绿体的示意图[62]
Figure11.
(a) Schematic illustration of light reaction and dark reaction in natural chloroplast, (b) molecular interactions between peptide and Zn2+, and (c) schematic illustration of the fabrication of Zn2+-directed assembly of cystine with encapsulation of TPPS and enzyme for photoenzymatic reactions[62]
根据肽分子自组装体的结构特点, 还可以仿生比如光催化产氧.由于肽分子自组装的多样性和可控性, 在模拟生物体系(无论是结构仿生, 还是功能仿生)方面都有很大优势, 值得人们深入探究.
3.2 肿瘤治疗
利用化学药物的毒性是治疗肿瘤常用的方式之一.通过分子设计可以有效地将化学药物包载到肽自组装体中. Li等[63]利用酶响应性的树状型肽分子连接化学药物Dox, 设计的分子可自组装形成表面带负电荷的球型粒子, 由于疏水作用, Dox基团集中在粒子内部, 因此有效降低了Dox对生物体的毒性作用.在酶的刺激下, 体系发生解组装后释放出Dox, 从而达到治疗的目的.
Wang等[64]设计了一种响应性的、由肽与红紫素连接形成的小分子前体P18-PLGVRGRGD.肽链(PLGVRGRGD)可被肿瘤微环境中的明胶酶选择性地切断, 获得残留的疏水性分子(P18-PLG)可自组装形成纳米纤维(图 12a和12b).纤维结构可延长在肿瘤部位的滞留, 从而提高肿瘤部位的光声信号和治疗效果(图 12c).类似的, 利用肿瘤微环境设计响应性分子、控制分子在肿瘤环境中的自组装可为肿瘤诊断和治疗的发展提拱新的思路和方法[65].
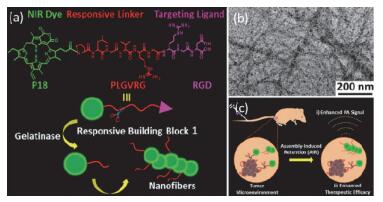 图12
(a) P18-PLGVRG-RGD分子结构、在酶响应下PLGVRG链断裂、最终自组装形成纤维结构的示意图、(b)所形成纤维的TEM图及(c)纤维在肿瘤部位滞留, 增强光声信号和治疗效果的示意图[64]
Figure12.
(a) Chemical structures of P18-PLGVRG-RGD, and schematic illustration of the formation of fibers due to the breakage of PLGVRG under enzyme stimulation. (b) TEM image of the fibers and (c) retention of fibers in tumor sites to improve photoacoustic imaging signal and tumor therapeutic efficacy[64]
图12
(a) P18-PLGVRG-RGD分子结构、在酶响应下PLGVRG链断裂、最终自组装形成纤维结构的示意图、(b)所形成纤维的TEM图及(c)纤维在肿瘤部位滞留, 增强光声信号和治疗效果的示意图[64]
Figure12.
(a) Chemical structures of P18-PLGVRG-RGD, and schematic illustration of the formation of fibers due to the breakage of PLGVRG under enzyme stimulation. (b) TEM image of the fibers and (c) retention of fibers in tumor sites to improve photoacoustic imaging signal and tumor therapeutic efficacy[64]
光动力和光热治疗是一种光辅助非侵入的肿瘤治疗方式, 在治疗肿瘤、皮肤病和微生物感染等疾病中有着重要应用.光动力和光热治疗具有操作简单、选择性高、毒副作用小等优势, 近年来得到了迅速发展, 已有一些药物被批准用于临床应用.通过引入合适的光敏剂与肽共组装[66], 一方面可实现自组装体结构的精准调控, 另一方面, 有利于提高药物的生物活性以及生物兼容性.
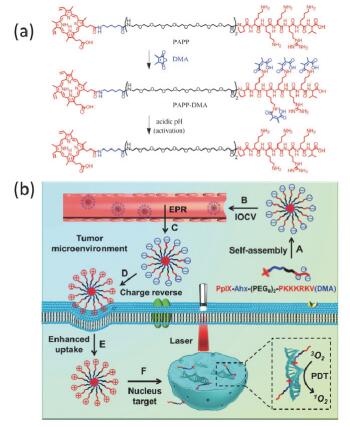
Han等[67]设计将酸酐改性的、具有核酸靶向性的肽与卟啉分子通过PEG共价键相连(PAPP-DMA), 该分子可形成表面带负电荷的纳米颗粒.粒子进入酸性的肿瘤微环境后, 由于DMA基团从PAPP-DMA分子上脱去, 使粒子表面电荷发生反转, 提高了肿瘤细胞对粒子的摄取能力.肽对核的靶向性促使粒子进入细胞核并在核内实现光动力功能(图 13).
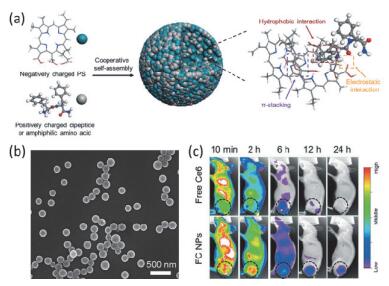
Yan等[68]利用CDP(阳离子化的FF分子)与GA分子间发生Schiff碱反应可调控形成球形颗粒, 在颗粒表面可进一步通过静电作用修饰光敏剂分子二氢卟吩(Ce6) 和肝素(Hep)分子, 即可获得平均粒径为100 nm、表面电势为-25 mV的颗粒, 颗粒可以很好地被肿瘤细胞摄取并具有较好的光动力治疗效果.考虑到GA分子对生物体的毒性, 他们将体系进行改进:直接引入Ce6与CDP共组装形成稳定的单分散纳米颗粒.组装形成的光敏剂纳米颗粒粒径可调、载药量高、对药物多重响应性释放(pH、表面活性剂以及酶响应), 并且具有增强的细胞摄取和肿瘤靶向富集的特点, 使其在体内外光动力抗肿瘤治疗中起到了明显效果, 可实现一次给药、一次光照, 便可达到几乎完全清除小鼠肿瘤的效果(图 14)[69].
Yan等[47]还利用化学键连接的卟啉-二肽复合分子自组装形成具有很好的光热效果的纳米点.纳米点结构中卟啉π-π作用所形成的J聚集结构可以有效地抑制荧光发射以及单线态氧的产生, 从而使整个纳米在光照条件下具有很高的光热转换效率, 进而用于肿瘤的光热治疗中.利用原位矿化反应制备的包含Au颗粒的可注射的水凝胶, 可作为药物载体负载药物后直接被注射并保留在肿瘤内部, 进行有效的光动力治疗[49].另外, 由于金纳米颗粒本身具有很好的光热效果, 因此, 这种胶原-金杂化水凝胶亦可用于肿瘤的光热治疗以及光热-光动力联合治疗中[70].
3.3 引入其他功能性分子
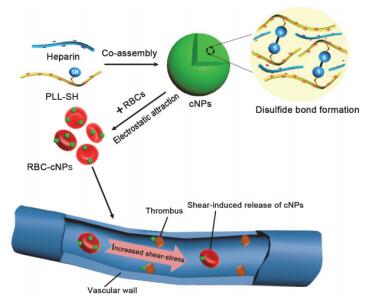
血栓一直是威胁人类健康的心血管疾病, 肝素(Hep)是常用的一种有效的抗凝药物, 但是该药物直接的静脉注射会产生病理出血等副反应, 所以其应用一直受到限制. Yan等[71]将Hep引入巯基化的PLL自组装体系中, 借助于Hep与PLL间的静电作用制备纳米颗粒, 之后将颗粒吸附在红细胞表面, 用于血管的抗栓治疗并取得了良好效果(图 15).
引入功能性酶分子诱导可实现肽自组装以及自组装体在生物体系中的应用[72~74]. Xu等[75, 76]在该方面做了系列性工作.例如, 在酶的脱磷酸作用下, 可诱导寡肽在细胞中形成纤维结构, 从而抑制肿瘤细胞的活性[77, 78].另外, 该组将D-氨基酸或糖苷引入肽分子上, 可以有效地提高肽所形成凝胶抵抗蛋白酶K的水解能力[79, 80].
其他一些具有光、电、磁的分子亦可引入肽分子自组装体系中, 并有效地增强体系的性能, 为肽自组装的功能化提供了有利支撑.
4 总结与展望
肽超分子自组装在众多交叉领域, 包括化学、材料、以及生物科学, 都有重要的研究意义.肽分子可自组装形成管、线、颗粒、纤维等多种从纳米至微米尺度的材料, 这些材料在生物医药中具有广泛应用前景.由于肽自组装过程是在各种非共价键包括氢键、π-π堆积、疏水作用、静电力以及范德华力的协同作用下实现的, 因此, 合理地调节这些力的相互作用, 便可从动力学和热力学上对自组装体结构进行调控, 从而实现自组装体功能的多样化.
虽然通过调控组装环境因素(包括pH、温度、浓度、外场等)可以很好地改变体系中非共价键的相互作用, 但是该方法过于单一且不利于自组装体功能化的实现.而通过调控组装基元的分子结构、亦或设计两种(及以上)组装基元间的共组装将更有利于获得结构可调的自组装体, 同时引入光敏剂、化药、酶等功能性分子与肽分子进行共组装, 可以有效提高肽自组装的性能, 实现材料功能的多样化.例如, 同样是利用二肽与卟啉分子进行共组装, 但是通过改变二肽分子的性质, 便可获得不同结构的自组装体, 而卟啉的引入赋予材料光捕获、以及光敏等特性, 使材料可以有效地应用于产氢、光动力治疗等领域[44, 45].
在后续对肽分子自组装的研究中, 不能只局限于对自组装体形貌结构的单一调控, 更需要进一步拓展: (1) 注重如何实现精准调控, 包括在特殊尺度上的控制、对特殊功能的调控.在分子设计过程中, 细小因素的引入或改变, 都可能对自组装体的形貌和功能产生巨大影响.利用多种手段比如分子动力学模拟, 从多尺度角度理解这些细小因素对体系内非共价键相互作用力的改变[81], 可以更有效地实现精准调控的目的. (2) 与此同时, 要关注功能化的自组装体在复杂环境比如生理环境中的组装/解组装和稳定性等问题.一方面有助于深入理解生物分子在复杂环境下的作用机制; 另一方面也为肽自组装体系在生物医药、绿色能源等多个领域的应用提供更有效的支撑.
-
-
[1]
Mahadevi, A. S.; Sastry, G. N. Chem. Rev. 2016, 116, 2775. doi: 10.1021/cr500344e
-
[2]
高玉霞, 胡君, 巨勇, 化学学报, 2016, 74, 312. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345451.shtmlGao, Y.; Hu, J.; Ju, Y. Acta Chim. Sinica 2016, 74, 312. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345451.shtml
-
[3]
Boyle, A. L.; Woolfson, D. N. Chem. Soc. Rev. 2011, 40, 4295. doi: 10.1039/c0cs00152j
-
[4]
Smith, K. H.; Tejeda-Montes, E.; Poch, M.; Mata, A. Chem. Soc. Rev. 2011, 40, 4563. doi: 10.1039/c1cs15064b
-
[5]
Fleming, S.; Ulijn, R. V. Chem. Soc. Rev. 2014, 43, 8150. doi: 10.1039/C4CS00247D
-
[6]
Hauser, C. A.; Zhang, S. Nature 2010, 468, 516. doi: 10.1038/468516a
-
[7]
De Santis, E.; Ryadnov, M. G. Chem. Soc. Rev. 2015, 44, 8288. doi: 10.1039/C5CS00470E
-
[8]
Ulijn, R. V.; Woolfson, D. N. Chem. Soc. Rev. 2010, 39, 3349. doi: 10.1039/c0cs90015j
-
[9]
Ariga, K.; Ji, Q.; Nakanishi, W.; Hill, J. P.; Aono, M. Mater. Horiz. 2015, 2, 406. doi: 10.1039/C5MH00012B
-
[10]
Yang, L.; Tan, X.; Wang, Z.; Zhang, X. Chem. Rev. 2015, 115, 7196. doi: 10.1021/cr500633b
-
[11]
Ariga, K.; Li, J.; Fei, J.; Ji, Q.; Hill, J. P. Adv. Mater. 2016, 28, 1251. doi: 10.1002/adma.201502545
-
[12]
Wang, J.; Liu, K.; Xing, R.; Yan, X. Chem. Soc. Rev. 2016, 45, 5589. doi: 10.1039/C6CS00176A
-
[13]
Hamley, I. W. Angew. Chem., Int. Ed. 2014, 53, 6866. doi: 10.1002/anie.201310006
-
[14]
Dasgupta, A.; Mondal, J. H.; Das, D. RSC Adv. 2013, 3, 9117. doi: 10.1039/c3ra40234g
-
[15]
Hauser, C. A. E.; Zhang, S. Chem. Soc. Rev. 2010, 39, 2780. doi: 10.1039/b921448h
-
[16]
Yan, X.; Cui, Y.; He, Q.; Wang, K.; Li, J.; Mu, W.; Wang, B.; Ouyang, Z.-C. Chem. Eur. J. 2008, 14, 5974. doi: 10.1002/chem.v14:19
-
[17]
Levin, A.; Mason, T. O.; Adler-Abramovich, L.; Buell, A. K.; Meisl, G.; Galvagnion, C.; Bram, Y.; Stratford, S. A.; Dobson, C. M.; Knowles, T. P. J.; Gazit, E. Nat. Commun. 2014, 5, 5219. doi: 10.1038/ncomms6219
-
[18]
Korevaar, P. A.; Newcomb, C. J.; Meijer, E. W.; Stupp, S. I. J. Am. Chem. Soc. 2014, 136, 8540. doi: 10.1021/ja503882s
-
[19]
Kim, J.; Han, T. H.; Kim, Y.-I.; Park, J. S.; Choi, J.; Churchill, D. C.; Kim, S. O.; Ihee, H. Adv. Mater. 2010, 22, 583. doi: 10.1002/adma.v22:5
-
[20]
Wang, M.; Du, L.; Wu, X.; Xiong, S.; Chu, P. K. ACS Nano 2011, 5, 4448. doi: 10.1021/nn2016524
-
[21]
Wang, Y.; Huang, R.; Qi, W.; Xie, Y.; Wang, M.; Su, R.; He, Z. Small 2015, 11, 2893. doi: 10.1002/smll.201403645
-
[22]
Li, Q.; Jia, Y.; Dai, L. R.; Yang, Y.; Li, J. B. ACS Nano 2015, 9, 2689. doi: 10.1021/acsnano.5b00623
-
[23]
Mason, T. O.; Chirgadze, D. Y.; Levin, A.; Adler-Abramovich, L.; Gazit, E.; Knowles, T. P. J.; Buell, A. K. ACS Nano 2014, 8, 1243. doi: 10.1021/nn404237f
-
[24]
Moyer, T. J.; Finbloom, J. A.; Chen, F.; Toft, D. J.; Cryns, V. L.; Stupp, S. I. J. Am. Chem. Soc. 2014, 136, 14746. doi: 10.1021/ja5042429
-
[25]
Wang, Y.; Qi, W.; Huang, R.; Yang, X.; Wang, M.; Su, R.; He, Z. J. Am. Chem. Soc. 2015, 137, 7869. doi: 10.1021/jacs.5b03925
-
[26]
Zhao, Y. R.; Deng, L.; Wang, J. Q.; Xu, H.; Lu, J. R. Langmuir 2015, 31, 12975. doi: 10.1021/acs.langmuir.5b02303
-
[27]
Cai, C. H.; Lin, J. P.; Lu, Y. Q.; Zhang, Q.; Wang, L. Q. Chem. Soc. Rev. 2016, 45, 5985. doi: 10.1039/C6CS00013D
-
[28]
Shen, Y.; Fu, X.; Fu, W.; Li, Z. Chem. Soc. Rev. 2015, 44, 612. doi: 10.1039/C4CS00271G
-
[29]
徐俊, 王治强, 张希, 化学学报, 2016, 74, 467. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345554.shtmlXu, J.; Wang, Z.; Zhang, X. Acta Chim. Sinica 2016, 74, 467. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract345554.shtml
-
[30]
邵昱, 李闯, 周旭, 陈平, 杨忠强, 李志波, 刘冬生, 化学学报, 2015, 73, 815.Shao, Y.; Li, C.; Zhou, X.; Chen, P.; Yang, Z.; Li, Z.; Liu, D. Acta Chim. Sinica 2015, 73, 815.
-
[31]
王继乾, 孙英杰, 代景茹, 赵玉荣, 曹美文, 王栋, 徐海, 物理化学学报, 2015, 31, 1365. doi: 10.3866/PKU.WHXB201505051Wang, J.; Sun, Y.; Dai, J.; Zhao, Y.; Cao, M.; Wang, D.; Xu, H. Acta Phys.-Chim. Sin. 2015, 31, 1365. doi: 10.3866/PKU.WHXB201505051
-
[32]
李惠梅, 王洁, 倪云洲, 周永丰, 颜德岳, 化学学报, 2016, 74, 415. doi: 10.3866/PKU.WHXB201511191Li, H.; Wang, J.; Ni, Y.; Zhou, Y.; Yan, D. Acta Chim. Sinica 2016, 74, 415. doi: 10.3866/PKU.WHXB201511191
-
[33]
Yuan, D.; Xu, B. J. Mater. Chem. B 2016, 4, 5638. doi: 10.1039/C6TB01592A
-
[34]
贾怡, 李琦, 李峻柏, 科学通报, 2017, 62, 469. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=kxtb201706003&dbname=CJFD&dbcode=CJFQJia, Y.; Li, Q.; Li, J. Chin. Sci. Bull. 2017, 62, 469. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=kxtb201706003&dbname=CJFD&dbcode=CJFQ
-
[35]
Li, Y.; Mao, C.; Deng, Z. Chin. J. Chem. 2017, 35, 801. doi: 10.1002/cjoc.v35.6
-
[36]
Zhou, P.; Deng, L.; Wang, Y. T.; Lu, J. R.; Xu, H. Langmuir 2016, 32, 4662. doi: 10.1021/acs.langmuir.6b00287
-
[37]
Zhao, Y. R.; Deng, L.; Yang, W.; Wang, D.; Pambou, E.; Lu, Z. M.; Li, Z. Y.; Wang, J. Q.; King, S.; Rogers, S.; Xu, H.; Lu, J. R. Chem. Eur. J. 2016, 22, 11394. doi: 10.1002/chem.201601309
-
[38]
Zhao, Y. R.; Wang, J. Q.; Deng, L.; Zhou, P.; Wang, S. J.; Wang, Y. T.; Xu, H.; Lu, J. R. Langmuir 2013, 29, 13457. doi: 10.1021/la402441w
-
[39]
Wang, M.; Zhou, P.; Wang, J. Q.; Zhao, Y. R.; Ma, H. C.; Lu, J. R.; Xu, H. J. Am. Chem. Soc. 2017, 139, 4185. doi: 10.1021/jacs.7b00847
-
[40]
Wang, J.; Liu, K.; Yan, L.; Wang, A.; Bai, S.; Yan, X. ACS Nano 2016, 10, 2138. doi: 10.1021/acsnano.5b06567
-
[41]
Yuan, D.; Du, X.; Shi, J.; Zhou, N.; Zhou, J.; Xu, B. Angew. Chem., Int. Ed. 2015, 54, 5705. doi: 10.1002/anie.201412448
-
[42]
Zhao, F. F.; Shen, G. Z.; Chen, C. J.; Xing, R. R.; Zou, Q. L.; Ma, G. H.; Yan, X. H. Chem. Eur. J. 2014, 20, 6880. doi: 10.1002/chem.201400348
-
[43]
Zhang, N.; Zhao, F. F.; Zou, Q. L.; Li, Y. X.; Ma, G. H.; Yan, X. H. Small 2016, 12, 5936. doi: 10.1002/smll.201602339
-
[44]
Zou, Q.; Zhang, L.; Yan, X.; Wang, A.; Ma, G.; Li, J.; Möhwald, H.; Mann, S. Angew. Chem., Int. Ed. 2014, 53, 2366. doi: 10.1002/anie.201308792
-
[45]
Liu, K.; Xing, R. R.; Chen, C. J.; Shen, G. Z.; Yan, L. Y.; Zou, Q. L.; Ma, G. H.; Mohwald, H.; Yan, X. H. Angew. Chem., Int. Ed. 2015, 54, 500. http://www.ncbi.nlm.nih.gov/pubmed/25377526
-
[46]
Liu, K.; Kang, Y.; Ma, G. H.; Mohwald, H.; Yan, X. H. Phys. Chem. Chem. Phys. 2016, 18, 16738. doi: 10.1039/C6CP01358A
-
[47]
Zou, Q. L.; Abbas, M.; Zhao, L. Y.; Li, S. K.; Shen, G. Z.; Yan, X. H. J. Am. Chem. Soc. 2017, 139, 1921. doi: 10.1021/jacs.6b11382
-
[48]
Xing, R. R.; Jiao, T. F.; Yan, L. Y.; Ma, G. H.; Liu, L.; Dai, L. R.; Li, J. B.; Mohwald, H.; Yan, X. H. ACS Appl. Mater. Interfaces 2015, 7, 24733. doi: 10.1021/acsami.5b07453
-
[49]
Xing, R. R.; Liu, K.; Jiao, T. F.; Zhang, N.; Ma, K.; Zhang, R. Y.; Zou, Q. L.; Ma, G. H.; Yan, X. H. Adv. Mater. 2016, 28, 3669. doi: 10.1002/adma.201600284
-
[50]
Yan, X.; Zhu, P.; Fei, J.; Li, J. Adv. Mater. 2010, 22, 1283. doi: 10.1002/adma.v22:11
-
[51]
Li, J. F.; Li, X. D.; Xu, J.; Wang, Y.; Wu, L. X.; Wang, Y. Q.; Wang, L. Y.; Lee, M.; Li, W. Chem. Eur. J. 2016, 22, 15751. doi: 10.1002/chem.201602449
-
[52]
Li, J. F.; Chen, Z. J.; Zhou, M. C.; Jing, J. B.; Li, W.; Wang, Y.; Wu, L. X.; Wang, L. Y.; Wang, Y. Q.; Lee, M. Angew. Chem., Int. Ed. 2016, 55, 2592. doi: 10.1002/anie.201511276
-
[53]
Adhikari, B.; Nanda, J.; Banerjee, A. Soft Matter 2011, 7, 8913. doi: 10.1039/c1sm05907f
-
[54]
Ma, M.; Kuang, Y.; Gao, Y.; Zhang, Y.; Gao, P.; Xu, B. J. Am. Chem. Soc. 2010, 132, 2719. doi: 10.1021/ja9088764
-
[55]
Zhou, J.; Du, X.; Gao, Y.; Shi, J.; Xu, B. J. Am. Chem. Soc. 2014, 136, 2970. doi: 10.1021/ja4127399
-
[56]
Li, Y. X.; Yan, L. Y.; Liu, K.; Wang, J.; Wang, A. H.; Bai, S.; Yan, X. H. Small 2016, 19, 2575.
-
[57]
Li, Q.; Ma, H. C.; Jia, Y.; Li, J. B.; Zhu, B. H. Chem. Commun. 2015, 51, 7219. doi: 10.1039/C5CC01554E
-
[58]
Wang, J.; Shen, G. Z.; Ma, K.; Jiao, T. F.; Liu, K.; Yan, X. H. Phys. Chem. Chem. Phys. 2016, 18, 30926. doi: 10.1039/C6CP06150H
-
[59]
Fei, J. B.; Zhang, H.; Wang, A. H.; Qin, C. C.; Xue, H. M.; Li, J. B. Adv. Healthcare Mater. 2017, 6, 1601198. doi: 10.1002/adhm.v6.7
-
[60]
Yan, X.; Li, J.; Möhwald, H. Adv. Mater. 2011, 23, 2796. doi: 10.1002/adma.201100353
-
[61]
Liu, K.; Xing, R. R.; Li, Y. X.; Zou, Q. L.; Möhwald, H.; Yan, X. H. Angew. Chem., Int. Ed. 2016, 55, 12503. doi: 10.1002/anie.201606795
-
[62]
Liu, K.; Yuan, C.; Zou, Q.; Xie, Z.; Yan, X. Angew. Chem., Int. Ed. 2017, 56, 7876. doi: 10.1002/anie.201704678
-
[63]
Li, N.; Guo, C. H.; Duan, Z. Y.; Yu, L. Z.; Luo, K.; Lu, J.; Gu, Z. W. J. Mater. Chem. B 2016, 4, 3760. doi: 10.1039/C6TB00688D
-
[64]
Zhang, D.; Qi, G. B.; Zhao, Y. X.; Qiao, S. L.; Yang, C.; Wang, H. Adv. Mater. 2015, 27, 6125. doi: 10.1002/adma.201502598
-
[65]
Liu, Y.; Zhang, D.; Qiao, Z. Y.; Qi, G. B.; Liang, X. J.; Chen, X. G.; Wang, H. Adv. Mater. 2015, 27, 5034. doi: 10.1002/adma.201501502
-
[66]
Abbas, M.; Zou, Q. L.; Li, S. K.; Yan, X. H. Adv. Mater. 2017, 29, 1605021. doi: 10.1002/adma.v29.12
-
[67]
Han, K.; Zhang, W. Y.; Zhang, J.; Lei, Q.; Wang, S. B.; Liu, J. W.; Zhang, X. Z.; Han, H. Y. Adv. Funct. Mater. 2016, 26, 4351. doi: 10.1002/adfm.v26.24
-
[68]
Ma, K.; Xing, R. R.; Jiao, T. F.; Shen, G. Z.; Chen, C. J.; Li, J. B.; Yan, X. H. ACS Appl. Mater. Interfaces 2016, 8, 30759. doi: 10.1021/acsami.6b10754
-
[69]
Liu, K.; Xing, R. R.; Zou, Q. L.; Ma, G. H.; Möhwald, H.; Yan, X. H. Angew. Chem., Int. Ed. 2016, 55, 3036. doi: 10.1002/anie.201509810
-
[70]
Sun, J. J.; Guo, Y.; Xing, R. R.; Jiao, T. F.; Zou, Q. L.; Yan, X. H. Colloids Surf., A 2017, 514, 155. doi: 10.1016/j.colsurfa.2016.11.062
-
[71]
Chen, C. J.; Li, S. K.; Liu, K.; Ma, G. H.; Yan, X. H. Small 2016, 12, 4719. doi: 10.1002/smll.v12.34
-
[72]
Qin, X.; Xie, W.; Tian, S.; Cai, J.; Yuan, H.; Yu, Z.; Butterfoss, G. L.; Khuong, A. C.; Gross, R. A. Chem. Commun. 2013, 49, 4839. doi: 10.1039/c3cc41794h
-
[73]
Webber, M. J.; Newcomb, C. J.; Bitton, R.; Stupp, S. I. Soft Matter 2011, 7, 9665. doi: 10.1039/c1sm05610g
-
[74]
Guilbaud, J.-B.; Rochas, C.; Miller, A. F.; Saiani, A. Biomacromolecules 2013, 14, 1403. doi: 10.1021/bm4000663
-
[75]
Yang, Z.; Liang, G.; Xu, B. Acc. Chem. Res. 2008, 41, 315. doi: 10.1021/ar7001914
-
[76]
Gao, Y.; Yang, Z.; Kuang, Y.; Ma, M.-L.; Li, J.; Zhao, F.; Xu, B. Biopolymers 2010, 94, 19. doi: 10.1002/bip.21321
-
[77]
Zhou, J.; Du, X.; Yamagata, N.; Xu, B. J. Am. Chem. Soc. 2016, 138, 3813. doi: 10.1021/jacs.5b13541
-
[78]
Gao, Y.; Shi, J.; Yuan, D.; Xu, B. Nat. Commun. 2012, 3, 1033. doi: 10.1038/ncomms2040
-
[79]
Li, X.; Du, X.; Li, J.; Gao, Y.; Pan, Y.; Shi, J.; Zhou, N.; Xu, B. Langmuir 2012, 28, 13512. doi: 10.1021/la302583a
-
[80]
Shi, J.; Du, X.; Yuan, D.; Zhou, J.; Zhou, N.; Huang, Y.; Xu, B. Biomacromolecules 2014, 15, 3559. doi: 10.1021/bm5010355
-
[81]
Yuan, C.; Li, S.; Zou, Q.; Ren, Y.; Yan, X. Phys. Chem. Chem. Phys. 2017, 10.1039/c7cp01923h. doi: 10.1039/c7cp01923h
-
[1]
-
图 3 (a) 卟啉分别与FF和KK形成球状与纤维结构示意图[44, 45]、(b)卟啉与FF形成的微球的SEM图、(c)卟啉与KK形成的纤维束的TEM图、(d)卟啉-肽分子自组装形成纳米点示意图及(e)纳米点的TEM图[47]
Figure 3 (a) Schematic illustration of the fabrication of spheres and fibers by assembly of TPPS with FF and KK, respectively[44, 45], (b) SEM image of the spheres assembled by TPPS and FF, (c) TEM image of the fiber bundles assembled by TPPS and KK, (d) schematic illustration of the fabrication of photothermal nanodots and (e) TEM image of the nanodots[47]
图 4 (a) 金-胶原核壳微球形成示意图[48]、(b)金-胶原纤维结构形成示意图[49]、(c)金-胶原核壳微球的TEM图及(d)金-胶原纤维的SEM图.
Figure 4 (a) Schematic illustration of the fabrication of Au-collagen core-shell microspheres[48], (b) Schematic depiction of the fabrication of Au-collagen nanofibers[49], (c) TEM image of the microspheres and (d) SEM image of the fibers
图 5 肽-POM杂化纳米球的(a)形成示意图、(b) TEM图、(c)高分辨TEM图[50]及(d, e)肽与不同POM在不同非共价键力主导下形成纳米纤维和纳米球的示意图[51]
Figure 5 (a) Schematic illustration of the fabrication of peptide-POM hybrid nanospheres, (b) TEM and (c) HR-TEM images of the hybrid nanospheres[50] and (d, e) schematic depiction of the fabrication of nanofibers and nanospheres assembled by peptide with different POM[51]
图 6 (a) Fmoc-Glu与Lys分子结构示意图、(b) Fmoc-(L)Glu与(L)Lys形成的左手螺旋纤维、(c) Fmoc-(D)Glu与(D)Lys形成的右手螺旋纤维以及(d)在金属离子干扰下所形成纤维的AFM图[53]
Figure 6 (a) Chemical structures of Fmoc-Glu and Lys molecules. AFM images of (b) left handed helical fibers formed by Fmoc-(L)Glu and (L)Lys, (c) right handed helical fibers formed by Fmoc-(D)Glu and (D)Lys, and (d) straight fibers in the presence of metal ions[53]
图 8 由FF与GA共价键作用形成“FF-GAn-FF”继而形成的(a)月牙型、(b)碗状以及(c)球形结构的TEM图(标尺为200 nm)[58]和(d)在生物流体条件下, FF-GAn-FF分子链间的非共价键断裂引起的解组装示意图[59]
Figure 8 TEM images of (a) crescent-like, (b) bowl-like, and (c) spherical nanoparticles assembled by FF-GAn-FF, which formed by covalent interactions between FF and GA (The scale bar is 200 nm)[58] and (d) Schematic illustration of nanoparticle disassembly due to electrostatic repulsion between FF-GAn-FF units[59]
图 11 (a) 自然叶绿体中光反应和暗反应的示意图、(b)分子间作用模式及(c)锌离子介导胱氨酸自组装同时包封卟啉和酶进行光酶反应构建仿生分级组织叶绿体的示意图[62]
Figure 11 (a) Schematic illustration of light reaction and dark reaction in natural chloroplast, (b) molecular interactions between peptide and Zn2+, and (c) schematic illustration of the fabrication of Zn2+-directed assembly of cystine with encapsulation of TPPS and enzyme for photoenzymatic reactions[62]
图 12 (a) P18-PLGVRG-RGD分子结构、在酶响应下PLGVRG链断裂、最终自组装形成纤维结构的示意图、(b)所形成纤维的TEM图及(c)纤维在肿瘤部位滞留, 增强光声信号和治疗效果的示意图[64]
Figure 12 (a) Chemical structures of P18-PLGVRG-RGD, and schematic illustration of the formation of fibers due to the breakage of PLGVRG under enzyme stimulation. (b) TEM image of the fibers and (c) retention of fibers in tumor sites to improve photoacoustic imaging signal and tumor therapeutic efficacy[64]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 147
- 文章访问数: 5907
- HTML全文浏览量: 2063


 下载:
下载:














 下载:
下载:

