 图 1
硼氢化钠还原法合成的纳米零价铁在不同放大倍数下的扫描透射电镜图(a, c, e) STEM明场像, (b, d, f) STEM高角度环形暗场像
Figure 1.
STEM images of nZVI synthesized by the reduction of FeCl3with NaBH4 at different magnifications: (a, c, e) BF images, (b, d, f) HAADF images
图 1
硼氢化钠还原法合成的纳米零价铁在不同放大倍数下的扫描透射电镜图(a, c, e) STEM明场像, (b, d, f) STEM高角度环形暗场像
Figure 1.
STEM images of nZVI synthesized by the reduction of FeCl3with NaBH4 at different magnifications: (a, c, e) BF images, (b, d, f) HAADF images

Citation: Huang Xiao-yue, Wang Wei, Ling Lan, Zhang Wei-xian. Heavy Metal-nZVI Reactions: the Core-shell Structure and Applications for Heavy Metal Treatment[J]. Acta Chimica Sinica, 2017, 75(6): 529-537. doi: 10.6023/A17020051

纳米零价铁与重金属的反应:“核-壳”结构在重金属去除中的作用
English
Heavy Metal-nZVI Reactions: the Core-shell Structure and Applications for Heavy Metal Treatment
-
1 引言
重金属是指在标准状态下单质密度大于5000 kg/m3的金属元素, 包括铜、锰、镉、铬、锌、铅、镍等, 约有45种.此外, 砷、硒为类金属元素, 其化学性质及在环境中迁移行为均与重金属元素相似, 故常将其归入重金属元素[1, 2].近年来, 我国重金属污染事件频发, 环境介质如土壤、沉积物、地下水中重金属污染物超标也常见于报道[3, 4].重金属污染是各种污染中比较难于治理的一种, 这一是因为重金属离子的化学形态非常复杂:一些重金属元素, 如铜、镉、铅等在水环境中以阳离子的形式存在, 而砷、铬、硒等元素则在水环境中以含氧阴离子(如AsO33-、AsO43-、CrO42-、Cr2O72-、SeO32-、SeO42-等)形式存在.含氧阴离子中的重金属元素大部分呈现多价态特征, 并且价态和存在形态受pH和氧化还原电位影响较大[5, 6].这些重金属离子对环境条件非常敏感, 当环境氧化还原条件发生变化时, 同种元素的不同价态离子之间会发生相互转化, 易在水体中迁移且难被土壤等自然吸附介质吸附.二是因为重金属离子进入环境后不能被生物降解, 只能通过多种形态转化和迁移, 并能通过食物链富集, 长时间威胁生物包括人类的生命健康.三是因为重金属离子在水、土壤等介质中的浓度很低, 不易治理, 但却可在人体内累积, 从而对人体的多种器官和系统的功能造成不可逆转的损害, 甚至可能诱发癌症[7, 8].这些特点使得重金属污染的治理和修复既复杂又困难.目前主要治理技术是, 通过调节pH值、氧化还原电位或投加高比表面积有效吸附介质等降低其含量.很多技术存在高能耗、高费用、处理不达标、普适性差等问题而难以广泛应用[9~13].对于土壤和水体等大量处理对象, 重金属污染修复更缺乏经济且高效实用技术.因此, 从大量环境介质中除去形态复杂、浓度低且危害严重的重金属, 是当前环境科学技术研究中尚待解决的重大难题.
在众多纳米材料中, 纳米零价铁凭借其独特的结构和性质, 高反应活性及良好的环境相容性脱颖而出, 成为最早被工程化应用于环境修复的纳米材料之一.大量实验表明, 纳米零价铁能够有效去除铜、砷、铬、镉、铅、镍、锌等多种重金属污染物, 并具有速率快, 处理效果好等优点[14, 15], 在重金属处理领域具有广阔的应用前景.纳米零价铁分离多种重金属的反应速率明显高于普通铁基材料(铁氧化物或普通尺度零价铁粉), 处理容量是活性炭、氧化铝、沸石和离子交换树脂等材料的10~1000倍[16, 17].团队的长期工程实践表明, 该材料在工业、矿山等多种高浓度重金属混合废水的处理、土壤及地下水重金属修复等方面有广泛的应用前景.但研究中发现, 复杂环境体系下重金属存在形态多样, 纳米零价铁与重金属的反应活性受环境条件影响较大.因而需要通过深入研究, 揭示纳米零价铁的关键影响因素和作用机理, 为完善和发展高效的处理体系提供理论依据, 从而建立高效的处理方法.随着原子级分辨率显微成像技术的发展, 使得直观观测纳米颗粒的结构及化学反应过程中的变化成为了可能.本文结合笔者所在团队所做的研究工作, 讨论了纳米零价铁独特的“核-壳”结构及其在重金属去除中发挥的作用.研究运用了原子级分辨率的球差校正扫描透射电镜(Cs-STEM), 配合高灵敏度的X射线能谱仪(XEDS), 旨在更好地了解纳米零价铁的精细结构及其与重金属的微观反应过程和机理.在深入理论研究的同时, 通过“小试—中试—工程”逐级放大的方法, 对纳米零价铁处理重金属废水的可行性进行系统论证.
2 纳米零价铁的结构与性质
2.1 形貌特征
纳米零价铁的合成方法多种多样, 包括液相还原法、气相还原法、溅射法、蒸发凝聚法、气相热分解法、机械球磨法等[18~22].大量研究表明, 合成方法对纳米零价铁的结构和形貌有显著影响[23~25].其中, 硼氢化钠还原铁盐制备纳米零价铁设备简单, 无需高温高压, 是实验室研究最常采用的方法. 图 1是不同放大倍数下硼氢化钠还原法合成的纳米零价铁的扫描透射电镜图(STEM图).
 图 1
硼氢化钠还原法合成的纳米零价铁在不同放大倍数下的扫描透射电镜图(a, c, e) STEM明场像, (b, d, f) STEM高角度环形暗场像
Figure 1.
STEM images of nZVI synthesized by the reduction of FeCl3with NaBH4 at different magnifications: (a, c, e) BF images, (b, d, f) HAADF images
图 1
硼氢化钠还原法合成的纳米零价铁在不同放大倍数下的扫描透射电镜图(a, c, e) STEM明场像, (b, d, f) STEM高角度环形暗场像
Figure 1.
STEM images of nZVI synthesized by the reduction of FeCl3with NaBH4 at different magnifications: (a, c, e) BF images, (b, d, f) HAADF images
图中1a, 1c和1e为STEM明场像(bright-field, BF), 此种成像模式的衬度类似于一般透射电镜像, 能够提供高分辨率的形貌、结构信息. 图 1b, 1d和图 1f为STEM高角度环形暗场像(high-angle annular dark-field, HAADF), 此种模式通过收集高角度散射电子成像, 图像的亮度与原子序数的平方成正比, 为化学衬度像.从低放大倍数的图像(图 1a和1b)中可以看出, 硼氢化钠还原法合成的纳米零价铁多为球形颗粒, 粒径集中分布在20~100 nm之间, 并且在磁力和静电力的作用下聚集成链状.当放大倍数较大时(图 1c~1f), 可以清楚地看到, 无论是BF像还是HAADF像, 单个纳米零价铁颗粒的内核区域和外壳区域都存在明显的衬度差异, 说明内核和外壳的结构及化学组成存在显著差异, 即纳米零价铁具有典型的“核-壳”结构, 与笔者所在团队的高分辨XPS的研究结果十分吻合.纳米零价铁的“核-壳”结构是由于零价铁在环境中自发的氧化过程生成的铁氧化物层包裹在零价铁外部而形成的.根据经典的铁氧化模型[26, 27]可以推断, 常温条件下零价铁表面自然形成的铁氧化物壳层厚度将介于2~4 nm之间, 图中观察到新制备的纳米零价铁的壳层厚度约为2 nm, 与理论值吻合.
2.2 化学组成及精细结构
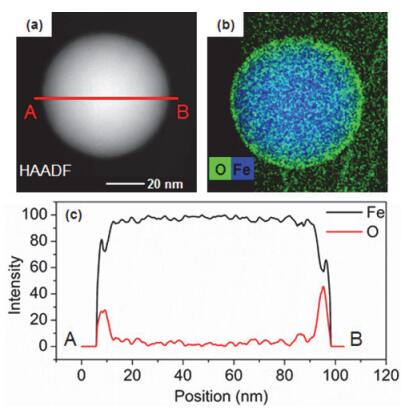
许多研究运用拉曼光谱、XPS、XANES等表面分析手段来进一步研究纳米零价铁精细结构, 尤其是氧化层的组成结构.研究结果表明, 纳米零价铁表面的氧化层与块状铁表面致密的钝化膜有明显区别, 颗粒大小、合成方法和保存条件等对其组成结构存在较大影响[25, 28].例如, 溅射法合成的纳米零价铁氧化层主要为γ-Fe2O3或未完全氧化的Fe3O4[22]; 气体还原法合成的纳米零价铁氧化层主要由Fe3O4组成[24]; 而液相还原法合成的纳米零价铁氧化层化学组成与FeOOH相似[15, 24].上述表面分析方法得到的是整体样本的平均结果, 与之相比, STEM结合XEDS、EELS等化学分析手段能够对单个纳米颗粒进行精确分析, 直观地描绘元素组成、价态及分布, 空间分辨率可达纳米级[29~31]. 图 2b为STEM-XEDS面扫所得的元素面分布图.从图中可以看出, 铁元素集中在纳米零价铁颗粒内部区域, 靠近颗粒外表面的信号强度大大减弱; 而氧元素(绿色表示)则集中分布在纳米零价铁颗粒的外表面, 颗粒内部氧元素信号较弱. STEM-XEDS线扫描(图 2c)进一步印证了元素面分布的结果.从颗粒外部沿A→B路径进行线扫描可以发现, 铁元素浓度由外至内逐渐增强, 并在颗粒内部达到稳定; 氧元素信号则由弱增强再迅速减弱, 信号强度在外壳和内核的界面处达到最大值. STEM-XEDS分析结果证明了纳米零价铁颗粒是由零价铁核及包裹在核外的铁氧化物层构成的. XPS和EELS等化学分析手段进一步表明, 铁氧化物层是由靠近Fe0-O界面的混合二价/三价铁氧化物和靠近水相界面的三价铁氧化物组成[25, 32~34].
2.3 水化学性质
2.4 纳米尺寸效应
2.3.1 pH值和氧化还原电位
零价铁具有较强的还原性(EΘ(Fe2+/Fe0))=-0.44 V), 加入水中后可自发地与溶解氧或水直接发生反应.
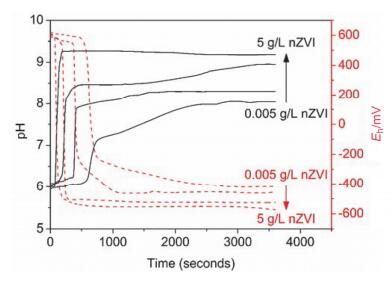
上述反应将消耗水中的氢离子或产生氢氧根离子, 使溶液的pH值上升.此外, 随着溶解氧及其他氧化性物质的消耗, 溶液的氧化还原电位也将显著下降. 图 3为去离子水中投加不同剂量(0.005, 0.05, 0.5和5 g/L)纳米零价铁后pH值和氧化还原电位(Eh)的变化曲线.从图中可以看出, 纳米零价铁的加入使pH值上升了2~3个单位, 最终稳定在pH 7.5~9.5的范围内. pH值的迅速上升使体系维持在碱性范围内, 有利于金属阳离子的吸附和沉淀.与此同时, 随着纳米零价铁的加入, 体系的氧化还原电位也迅速下降, 最终维持在-400~-600 mV的强还原性范围内, 有利于重金属的还原去除.此外, 在反应过程中产生的一系列腐蚀产物(如Fe2+、Fe(OH)2、FeOOH、Fe3O4、绿锈等)既能吸附重金属, 也可通过沉淀/共沉淀作用达到重金属去除的目的.
2.3.2 Zeta电位
在水中, 覆盖在零价铁表面的铁氧化物会因为质子化/去质子化作用而使表面带电, 如式(3) 和式(4) 所示.
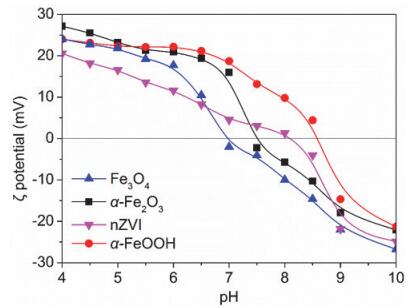
纳米零价铁表面的带电量及带电性质, 能够指示颗粒与颗粒、颗粒与带电离子间的相互作用, 是衡量纳米零价铁稳定性和反应活性的重要参数. Zeta(ζ)电位, 即主体溶液与附着在分散粒子上的流体稳定层之间的电位差, 可以通过电动现象直接测得, 因此常被选作指示铁氧化物及纳米零价铁表面带电特性的参数.由式(3) 和(4) 可知, 颗粒表面的带电性质与主体溶液的pH值直接相关, 其中净质子电量为0时的pH值称为颗粒的等电点(IEP).在等电点前后, 胶体颗粒的带电性质将发生改变. 图 4是纳米零价铁及三种常见铁氧化物(α-Fe2O3, Fe3O4及α-FeOOH)的ζ电位随pH值的变化曲线.由图可知, 纳米零价铁的等电点约为8.1, α-Fe2O3和Fe3O4的等电点低于纳米零价铁, 分别为6.9和7.5, 而α-FeOOH的等电点则高于纳米零价铁, 约为8.6. pH值在一定程度上决定了纳米零价铁的表面带电性质, 进而影响其与重金属离子的亲和性及相互作用.具体来说, 当pH值低于等电点时, 颗粒表面带正电, 纳米铁与阴离子亲和力较强, 有利于AsO43-、SeO32-等阴离子的去除; 当pH值高于等电点时, 颗粒表面带负电, 纳米铁与阳离子亲和力较强, 有利于Cu2+、Pb2+等金属阳离子的去除.
2.4.2 表面原子比例
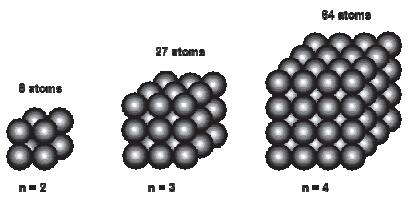
随着颗粒尺寸的减小, 比表面积增加的同时, 颗粒表面原子所占的百分数也会显著地增加. 图 5为零价铁颗粒的示意图, 假设颗粒为立方体, 每条边的原子数为n, 原子总数为n3, 则其外表面原子所占的百分数(D)可以通过式(6) 进行计算.
由式(6) 可知, 表面原子比例随原子总数(即颗粒尺寸)的增加而迅速下降.对于一个原子总数为8(23)的颗粒, 所有的原子都是表面原子, 可以与溶液中的污染物直接接触, 而当原子总数增加到27(33)和64(43)时, 表面原子比例分别下降到96.2%和87.5%.当颗粒尺寸较大时(如粒径>1 μm), 只有小部分表面原子能与污染物直接接触, 而大部分原子被包裹在颗粒内部, 导致反应效率和材料有效利用率较低.铁原子直径约为0.25 nm, 由此可以粗略的估算出平均粒径为50 nm的纳米铁颗粒表面原子约占3%, 而平均粒径为500 μm的微米铁颗粒表面原子仅占0.0003%.与微米铁相比, 纳米铁表面原子比例大幅提高, 表面原子配位不足导致大量的悬空键和不饱和键, 表面能增大, 从而具有更强烈的趋势与其他原子或分子发生反应, 使其与污染物反应时具有更高的活性.
2.4.1 比表面积
溶解态重金属与铁的反应, 首先发生在铁-水接触表面, 属于界面反应, 因此, 零价铁的表面性质将直接影响反应的进行.一般来说, 材料的比表面积越大, 材料与污染物的有效接触面积也越大, 反应速率将相应得以提高.对直径为d的球形颗粒来说, 比表面积(specific surface area, SSA)可以通过下式进行计算:
其中, ρ表示固体颗粒的密度.从式(5) 不难看出, 颗粒尺寸越小, 其比表面积越大.实验室湿法合成的纳米零价铁平均粒径在50 nm左右, 其理论计算所得的比表面积约为15000 m2/kg, 而渗透性反应墙中常用的零价铁填料(平均粒径约500 μm)的理论比表面积仅为15 m2/kg.实际上, 由于零价铁颗粒并非光滑的规则球体, 其真实比表面积可能高于理论计算值. 表 1列举了实验室通过BET法测定的纳米零价铁和不同粒径零价铁粉的比表面积, 由表可知, 纳米零价铁的比表面积比普通微米级零价铁粉大2~3个数量级, 这也使得纳米零价铁与污染物的接触更加充分, 反应速度加快, 大大提高了反应效率.
3 纳米零价铁与重金属的反应
3.1 反应机理及过程
3.2 反应实例
3.1.2 反应过程
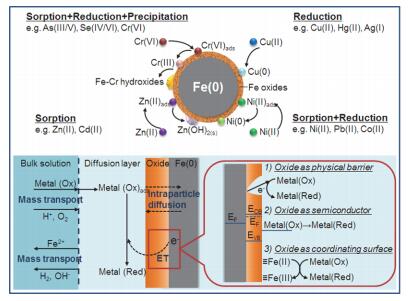
溶液中的重金属离子与纳米零价铁的反应属于非均相反应, 整个反应过程可视作传质过程、界面反应和固相反应过程三部分.溶解态的重金属离子首先需要扩散穿过液膜到达纳米零价铁表面, 通过静电作用/表面络合作用吸附到表面, 然后通过沉淀、还原等作用被进一步固定.覆盖在零价铁外部的铁氧化壳层对还原过程中的电子传递有很大的影响, 从核心的零价铁到表面的重金属可能存在三种电子传递途经[35]: (1) 电子直接通过颗粒表面缺陷(如空穴、晶界等)进行传递; (2) 铁氧化物层由混合二价/三价铁氧化物构成, 可视为半导体, 介导电子传递; (3) 纳米零价铁表面的二价铁作为电子供体, 为重金属的还原提供电子.
3.1.1 反应机理
纳米零价铁独特的“核-壳”结构和物理、化学性质使其能够通过多种作用实现重金属的分离、富集和稳定, 并具有去除容量大、去除效率高、污泥量少、二次污染小等优点.纳米零价铁与重金属的作用机理主要包括吸附、还原和沉淀/共沉淀三种.首先, 水中的纳米零价铁氧化物壳被羟基官能团(—OH)所覆盖, 能够通过静电作用和表面络合作用吸附重金属离子, 将其固定于纳米铁表面.其次, 纳米零价铁核心部分的Fe0是较强的还原剂, 能够作为电子供体, 将氧化性强于Fe(Ⅱ)的重金属离子还原到较低价态(例如, 金属单质等稳定态).再次, Fe0腐蚀使整个体系呈碱性, 尤其是纳米零价铁表面, OH-浓度较高, 有利于重金属离子的表面沉淀.另外, 铁腐蚀产生的Fe(Ⅱ)和Fe(Ⅲ)还能与As((Ⅲ/Ⅴ))等含氧阴离子发生共沉淀作用, 实现污染物的去除.
Li等[14]运用XPS和XRD等研究了多种重金属离子与纳米零价铁反应后在纳米零价铁表面的存在形态, 结果发现重金属的最终价态和主要去除机理与标准氧化还原电位(E0)的高低有关.当某金属的E0比Fe0的高(正)很多时, 该金属主要通过还原作用被纳米铁去除, 如Cu(Ⅱ)、Hg(Ⅱ)、Ag(Ⅰ)等; 当某金属的E0比Fe0的更低(负)或接近时, 该金属主要通过吸附作用被去除, 如Zn(Ⅱ)、Cd(Ⅱ)等; 当某金属的E0比Fe0的稍高(正)时, 该金属可通过吸附、还原的双重作用被去除, 如Ni(Ⅱ)、Co(Ⅱ)、Pb(Ⅱ)等.纳米零价铁与几种常见的重金属反应机理图见图 6.
3.2.3 纳米零价铁工程应用案例
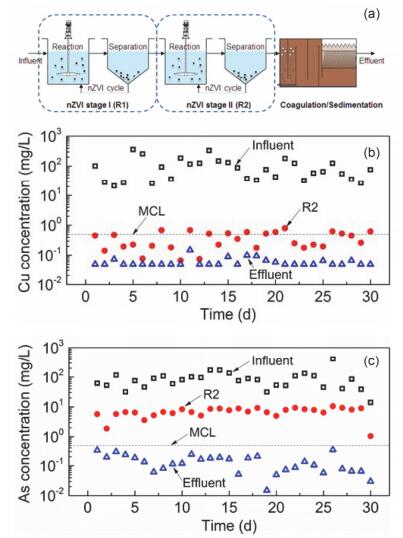
与土壤/地下水原位修复应用相比, 将纳米零价铁应用于地表水(如重金属工业废水)领域存在诸多挑战:反应要在适宜的反应器内完成, 水力停留时间有限, 反应后产物要求固液分离; 当待处理废水水质复杂且波动较大时, 还要考虑系统能否稳定运行等.因此, 本研究团队提出了以“反应—分离—回用”为核心的纳米零价铁反应器模型.该反应器由反应区、分离区(固液分离)及污泥回流系统(回用纳米零价铁)组成, 采用全混合搅拌釜式反应器(Continuous Stirred Tank Reactor, CSTR)作为反应区, 竖流式沉淀池(或斜板沉淀池)作为分离区, 沉降于分离区底部的污泥通过泵进行回流.分别构建了实验室规模(流量: 0.2~6.0 L/h)、中试规模(400~2500 L/h)及工程规模(300~1000 m3/d)的实体废水处理装置, 系统地研究了纳米零价铁处理重金属工业废水的可行性.具备了小试、中试研究的经验后, 团队以某冶炼厂生产废水作为研究对象, 开展工程应用研究.采用“两级纳米零价铁并联+曝气混凝沉淀”工艺组合(图 9a), 验证纳米零价铁用于大规模重金属废水处理的有效性.工程调试期间(127天)的监测结果表明:废水中主要污染物砷、铜平均浓度分别从110 mg/L、103 mg/L降至0.29 mg/L、0.16 mg/L, 低于废水处理设计排放标准, 平均去除率均超过99.7%;其它重金属(如Co、Cr、Ni、Pb、Zn等)浓度均降至0.01 mg/L左右, 远低于相应排放标准; 废水中Se、Sb、Au、Tl等元素也几乎被完全去除[16].结合调试期间纳米零价铁的消耗量及废水中重金属离子的累积截留量, 本工程条件下纳米零价铁除砷、除铜负荷分别达245 mg-As/g-nZVI和226 mg-Cu/g-nZVI, 总体重金属去除负荷超过500 mg-重金属/g-nZVI, 优于多数重金属离子吸附材料或离子交换材料. 图 9b和9c为连续一个月内的运行监测数据.系统进水Cu浓度平均值为89.14 mg/L, 一级反应器(R1) 出水Cu浓度平均值为2.39 mg/L, 二级反应器(R2) 出水Cu浓度平均值为0.59 mg/L, nZVI工艺Cu去除率为99.3%;系统进水As浓度平均值为107.10 mg/L, 一级反应器出水As浓度平均值为28.32 mg/L, 二级反应器出水As浓度平均值为10.83 mg/L, nZVI工艺的As去除率为89.9%.部分纳米零价铁悬浮物因难以在沉淀区沉降而随出水流出反应器, 导致部分固定在纳米颗粒表面的As、Cu等重金属污染物流出沉淀区, 降低了去除效率.故采用曝气混凝沉淀法对二级反应器出水进行再处理, 以去除残余悬浮物从而进一步提高出水水质.经过曝气混凝沉淀处理后, 出水中As、Cu平均浓度低于0.3 mg/L, 所有重金属污染物总浓度均低于国家排放标准.一个月内废水处理量最大值363 m3/d, 最小值125 m3/d, 共处理废水9519 m3, 纳米零价铁消耗量为0.46 kg/m3.从药剂使用成本角度分析, 本研究采用的“反应—分离—回用”型纳米零价铁反应器通过不断循环、回用纳米材料, 提高了其利用率, 减少了新鲜药剂的投加量, 从而降低了成本.此外, 通过反复循环, 废水中有回收价值的重金属离子(如Cu(Ⅱ)、Ag(Ⅰ)、Au(Ⅲ)等)被富集浓缩, 使污泥产物具有极高的回收价值, 可抵消部分处理成本, 甚至可能成为企业的另一种创收方式.以本工程为例, 处理过程产生的污泥作为富金矿被再次返回该冶炼厂冶炼过程的最前端, 真正实现了废水中有价金属的回收再利用.
3.2.1 纳米零价铁和微米铁对重金属去除效果比较
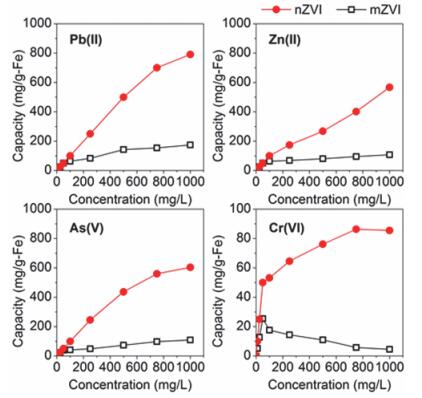
图 7比较了相同投加量的纳米零价铁和400目的微米铁粉在相同时间内对4种常见重金属的去除效果.向初始pH值为6的不同初始浓度(50~1000 mg/L)的重金属溶液中分别投加1 g/L的纳米零价铁和等量的微米铁, 置于摇床在室温(25 ℃)下反应24 h后, 测定溶液中剩余的重金属浓度, 计算出单位质量的零价铁对重金属的去除容量, 并绘于图中.实验所用纳米零价铁和微米铁的基本性质参见表 1, 纳米零价铁的比表面积约为400目微米铁粉的100倍.由图 7可知, 纳米零价铁对Pb(Ⅱ)、Zn(Ⅱ)、As(Ⅴ)、Cr(Ⅵ)的最大负荷分别可达790.9、567.1、603.6及86.3 mg/g-Fe, 远高于微米铁的去除容量.值得一提的是, 微米铁对Cr(Ⅵ)的去除效果很差, 当Cr(Ⅵ)浓度较高时, 微米铁与Cr(Ⅵ)的反应受到抑制, 甚至完全停止.这主要是因为Cr(Ⅵ)被还原生成的Cr(OH)3及Cr-Fe复合物覆盖在微米铁表面, 使微米铁迅速钝化, 阻碍了进一步的反应[36, 37].与微米铁相比, 纳米铁比表面积更大, 表面活性更高, 钝化现象得以改善, 对高浓度的Cr(Ⅵ)也有不错的去除效果.综上, 纳米零价铁和普通微米铁粉相比优势在于: (1) 比表面积大, 表面活性高, 与重金属的反应速率和去除容量都高于微米铁; (2) 颗粒表面铁氧化物膜结构不同, 纳米零价铁表面缺陷多, 更有利于还原反应中的电子传递, 因而与污染物的反应更加彻底; (3) 纳米零价铁表面活性点位多, 抗钝化能力优于微米铁; (4) 纳米零价铁颗粒尺寸小, 能有效分散悬浮在水中, 与污染物接触更加充分, 混合条件对传质的影响没有微米铁大.
3.2.2 纳米零价铁与Ni(Ⅱ)的反应
Ni(Ⅱ)可以通过吸附和还原的双重作用被纳米零价铁有效去除[30, 38], Ni(Ⅱ)与纳米零价铁的反应为研究纳米零价铁的结构、性质及与重金属的反应过程提供了很好的例证. Li等[38]的XPS研究发现, Ni(Ⅱ)与纳米零价铁反应时首先在物理吸附的作用下被束缚到纳米零价铁表面, 然后通过化学吸附被进一步固定, 并逐步还原为Ni0.其反应过程如下.
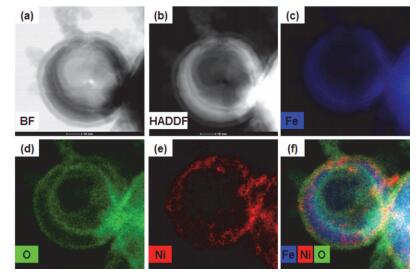
在此研究基础上, STEM配合XEDS、EELS等化学分析手段使得直观观察单个纳米零价铁颗粒与Ni(Ⅱ)的相互作用过程成为可能.将浓度为100 mg/L的Ni(Ⅱ)溶液与1 g/L纳米零价铁混合, 置于摇床中常温反应24 h, 高速离心分离出反应后的纳米颗粒进行表征. HAADF像、BF像和STEM-XEDS面扫描, 得到单个反应后颗粒的形貌及元素分布图(图 8).由STEM的BF像和HAADF像(图 8a和8b)可见, 反应后的纳米零价铁由实心的球形颗粒变为了外部有壳, 内部中空的结构.从铁元素分布图(图 8c)可以看到, 纳米零价铁核心部分的铁元素信号变得很弱, 甚至完全消失, 只剩下外围圆环状铁元素分布图样.由铁元素分布图可以推断, 在与Ni(Ⅱ)反应的过程中, 纳米零价铁核心部分的Fe0作为电子供体, 为Ni(Ⅱ)还原提供电子, 自身被氧化为Fe(Ⅱ)而逐步消耗, 进而形成空腔. 图 8d是氧元素分布图, 从图中可以看出氧元素主要集中在铁圆环的内外表面处, 说明反应剩余的Fe0被内外两层铁氧化物包裹.从镍元素分布图(图 8e)和铁、氧、镍三种元素叠加分布图(图 8f)中可以看到, 镍元素分布在中空结构的外壳中, 并以颗粒外表面分布居多, 说明Ni(Ⅱ)被吸附到纳米零价铁表面后, 大部分在颗粒表面处得到电子被还原固定.
Kirkendall现象[39, 40]能够很好地解释纳米零价铁与Ni(Ⅱ)反应时中空颗粒的形成过程. Kirkendall现象是指两种扩散速率不同的金属间彼此扩散时, 并不是直接发生原子交换, 而是通过空穴的移动来平衡质量迁移, 因此会在扩散速率快的金属中形成大的孔或空腔.具体来说, 纳米零价铁与Ni(Ⅱ)反应过程中, 铁离子迅速由核向氧化层外扩散, 空穴向内移动以平衡铁的扩散, 随着未填充的空隙聚结, 最终在纳米铁核中形成了空腔. STEM-XEDS元素分布图与Kirkendall现象完全吻合, 表明了STEM联合其他化学分析方法是研究纳米零价铁与污染物作用机理、物质扩散和电子传递的有力手段.
4 结论与展望
综上所述, 纳米零价铁独特的“核-壳”结构及物理、化学性质使之能够通过吸附、还原、沉淀等多种作用实现重金属的分离、富集和固定.与微米铁相比, 纳米零价铁具有比表面积大、表面活性高、重金属去除容量大、不易钝化等优点.溶解态的重金属污染物与纳米零价铁的反应属于界面反应, 界面结构及性质对反应的进行有较大影响.高分辨率的STEM配合高灵敏的XEDS能够提供直观可见的物理图像及化学成分分析, 空间分辨率可达原子级(~0.1 nm), 为研究纳米零价铁与重金属污染物的界面反应过程创造了有利条件.该项技术有望从原子尺度揭示纳米零价铁与重金属作用机理, 并对反应产物进行三维重构, 深入了解反应过程中物质扩散及电子传递过程, 为研究纳米零价铁与污染物作用创造一个崭新的视角.
在完善纳米零价铁与重金属反应理论的基础上, 将其应用于实际重金属污染物处理和重金属污染修复也是研究的重点.纳米零价铁技术实际应用中涉及的问题主要有: (1) 材料的大规模制备及成本控制; (2) 针对不同环境介质(如废水、土壤、底泥等)中重金属污染物的可行性工艺研发及配套设备开发; (3) 工艺运行过程中的调控参数及稳态控制; (4) 纳米材料潜在生态风险及规避方法.随着纳米材料制备技术的不断进步, 纳米零价铁的生产效率已大幅提高, 生产成本也大幅下降, 为其大规模环境应用提供了保障.本课题组已将纳米零价铁技术应用于多个高浓度复杂重金属废水处理的中试研究, 均取得了良好的重金属处理效果.在中试研究的基础上, 建立了首个纳米零价铁用于大规模工业废水处理的成功工程案例, 处理能力可达500~1000立方米/天, 是目前国内报道的最大规模的纳米零价铁应用项目.除重金属处理外, 纳米零价铁用于稀贵金属的高效富集、回收也是今后研究的重点.随着纳米零价铁技术的不断成熟和完善, 期待不久的将来, 微小的纳米颗粒能够发挥更大的作用, 取得新的突破.
-
-
[1]
Agarwal, S. K. Heavy Metal Pollution, APH publishing, New Delhi, 2009.
-
[2]
Asrari, E. Heavy Metal Contamination of Water and Soil:Analysis, Assessment, and Remediation Strategies, CRC Press, 2014.
-
[3]
傅建捷, 王亚韡, 周麟佳, 张爱茜, 江桂斌, 化学进展, 2011, 23, 1756. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxjz201108020&dbname=CJFD&dbcode=CJFQFu, J. J.; Wang, Y. W.; Zhou, L. J.; Zhang, A. Q.; Jiang, G. B. Prog. Chem. 2011, 23, 1756(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxjz201108020&dbname=CJFD&dbcode=CJFQ
-
[4]
Rodríguez-Lado, L.; Sun, G.; Berg, M.; Zhang, Q.; Xue, H.; Zheng, Q.; Johnson, C. A. Science 2013, 341, 866. doi: 10.1126/science.1237484
-
[5]
Cullen, W. R.; Reimer, K. J. Chem. Rev. 1989, 89, 713. doi: 10.1021/cr00094a002
-
[6]
Kotas, J.; Stasicka, Z. Environ. Pollut. 2000, 107, 263. doi: 10.1016/S0269-7491(99)00168-2
-
[7]
Järup, L. Brit. Med. Bull. 2003, 68, 167. doi: 10.1093/bmb/ldg032
-
[8]
Goyer, R.; Golub, M.; Choudhury, H.; Hughes, M.; Kenyon, E.; Stifelman, M. In US Environmental Protection Agency, Risk Assessment Forum, Vol. 1200, Washington, DC, 2004.
-
[9]
El Samrani, A. G.; Lartiges, B. S.; Villiéras, F. Water Res. 2008, 42, 951. doi: 10.1016/j.watres.2007.09.009
-
[10]
Matlock, M. M.; Howerton, B. S.; Atwood, D. A. Water Res. 2002, 36, 4757. doi: 10.1016/S0043-1354(02)00149-5
-
[11]
Fu, F.; Wang, Q. J. Environ. Manage. 2011, 92, 407. http://www.ncbi.nlm.nih.gov/pubmed/21138785
-
[12]
刘艳, 梁沛, 郭丽, 卢汉兵, 化学学报, 2005, 63, 312. doi: 10.3321/j.issn:0251-0790.2005.02.021Liu, Y.; Liang, P.; Guo, L.; Lu, H. B. Acta Chim. Sinica 2005, 63, 312(in Chinese). doi: 10.3321/j.issn:0251-0790.2005.02.021
-
[13]
万芹方, 任亚敏, 王亮, 姜海洲, 邓大超, 柏云, 夏传琴, 化学学报, 2011, 69, 1780. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract340352.shtmlWan, Q. F.; Ren, Y. M.; Wang, L.; Jiang, H. Z.; Deng, D. C.; Bai, Y.; Xia, C. Q. Acta Chim. Sinica 2011, 69, 1780(in Chinese). http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract340352.shtml
-
[14]
Li, X. Q.; Zhang, W. X. J. Phys. Chem. C 2007, 111, 6939. doi: 10.1021/jp0702189
-
[15]
Yan, W. L.; Herzing, A. A.; Kiely, C. J.; Zhang, W. X. J. Contam. Hydrol. 2010, 118, 96. doi: 10.1016/j.jconhyd.2010.09.003
-
[16]
Li, S. L.; Wang, W.; Liang, F. P.; Zhang, W. X. J. Hazard. Mater. 2017, 322, 163. doi: 10.1016/j.jhazmat.2016.01.032
-
[17]
Hua, M.; Zhang, S. J.; Pan, B. C.; Zhang, W. M.; Lv, L.; Zhang, Q. -X. J. Hazard. Mater. 2012, 211, 317. http://www.ncbi.nlm.nih.gov/pubmed/22018872
-
[18]
Choi, C. J.; Dong, X. L.; Kim, B. K. Mater. Trans. 2001, 42, 2046. doi: 10.2320/matertrans.42.2046
-
[19]
Crane, R.; Dickinson, M.; Popescu, I.; Scott, T. Water Res. 2011, 45, 2931. doi: 10.1016/j.watres.2011.03.012
-
[20]
Glavee, G. N.; Klabunde, K. J.; Sorensen, C. M.; Hadjipanayis, G. C. Inorg. Chem. 1995, 34, 28. doi: 10.1021/ic00105a009
-
[21]
Karlsson, M.; Deppert, K.; Wacaser, B.; Karlsson, L.; Malm, J. O. Appl. Phys. A 2005, 80, 1579. doi: 10.1007/s00339-004-2987-1
-
[22]
Kuhn, L. T.; Bojesen, A.; immermann, L.; Nielsen, M. M. J. Phys.:Condens. Matter 2002, 14, 13551. doi: 10.1088/0953-8984/14/49/311
-
[23]
Carpenter, E.; Calvin, S.; Stroud, R.; Harris, V. Chem. Mater. 2003, 15, 3245. doi: 10.1021/cm034131l
-
[24]
Nurmi, J. T.; Tratnyek, P. G.; Sarathy, V.; Baer, D. R.; Amonette, J. E.; Pecher, K.; Wang, C.; Linehan, J. C.; Matson, D. W.; Penn, R. L. Environ. Sci. Technol. 2005, 39, 1221. doi: 10.1021/es049190u
-
[25]
Wang, C.; Baer, D. R.; Amonette, J. E.; Engelhard, M. H.; Antony, J.; Qiang, Y. J. Am. Chem. Soc. 2009, 131, 8824. doi: 10.1021/ja900353f
-
[26]
Zhdanov, V. P.; Kasemo, B. Chem. Phys. Lett. 2008, 452, 285. doi: 10.1016/j.cplett.2008.01.006
-
[27]
Wang, C. M.; Baer, D. R.; Thomas, L. E.; Amonette, J. E.; Antony, J.; Qiang, Y.; Duscher, G. J. Appl. Phys. 2005, 98, 094308. doi: 10.1063/1.2130890
-
[28]
Wang, Q.; Kanel, S. R.; Park, H.; Ryu, A.; Choi, H. J. Nanopart. Res. 2009, 11, 749. doi: 10.1007/s11051-008-9524-7
-
[29]
Ling, L.; Pan, B. C.; Zhang, W. X. Water Res. 2015, 71, 274. doi: 10.1016/j.watres.2015.01.002
-
[30]
Ling, L.; Zhang, W. X. Environ. Sci. Technol. Lett. 2014, 1, 209. doi: 10.1021/ez4002054
-
[31]
Ling, L.; Zhang, W. X. J. Am. Chem. Soc. 2015, 137, 2788. doi: 10.1021/ja510488r
-
[32]
Chen, G. Sep. Purif. Technol. 2004, 38, 11. doi: 10.1016/j.seppur.2003.10.006
-
[33]
Grosvenor, A.; Kobe, B.; McIntyre, N. Surf. Sci. 2004, 572, 217. doi: 10.1016/j.susc.2004.08.035
-
[34]
Liu, A.; Zhang, W. X. Analyst 2014, 139, 4512. doi: 10.1039/C4AN00679H
-
[35]
Scherer, M. M.; Balko, B. A.; Tratnyek, P. G. The Role of Oxides in Reduction Reactions at the Metal-Water Interface, ACS Symposium Series, American Chemical Society, 1998.
-
[36]
Loyaux-Lawniczak, S.; Refait, P.; Ehrhardt, J. J.; Lecomte, P.; Génin, J. M. R. Environ. Sci. Technol. 2000, 34, 438. doi: 10.1021/es9903779
-
[37]
Melitas, N.; Chuffe-Moscoso, O.; Farrell, J. Environ. Sci. Technol. 2001, 35, 3948. doi: 10.1021/es001923x
-
[38]
Li, X. Q.; Zhang, W. X. Langmuir 2006, 22, 4638. doi: 10.1021/la060057k
-
[39]
Fan, H. J.; Gösele, U.; Zacharias, M. Small 2007, 3, 1660. doi: 10.1002/(ISSN)1613-6829
-
[40]
Yin, Y.; Rioux, R. M.; Erdonmez, C. K.; Hughes, S.; Somorjai, G. A.; Alivisatos, A. P. Science 2004, 304, 711. doi: 10.1126/science.1096566
-
[1]
-
表 1 不同来源零价铁的比表面积比较
Table 1. Specific surface areas of iron particles from different sources

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 117
- 文章访问数: 5009
- HTML全文浏览量: 1800


 下载:
下载:








 下载:
下载:

