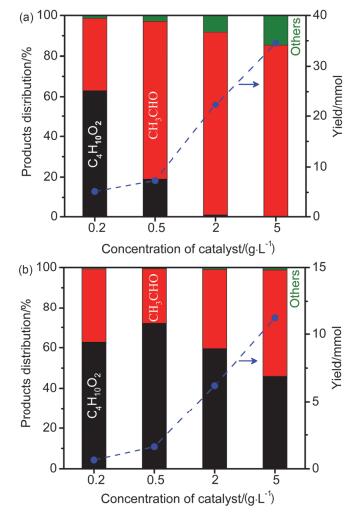
 图 3
不同浓度Pt/P25 (a)和Pt/rutile (b)光催化氧化牺牲剂乙醇产量和产物分布.光源, 125W高压汞灯.反应时间6 h.
Figure 3.
Yield of product and product distribution over different concentrations of Pt/P25 (a) and Pt/rutile (b). light, 125 W high pressure Hg lamp. Reaction time, 6 h.
图 3
不同浓度Pt/P25 (a)和Pt/rutile (b)光催化氧化牺牲剂乙醇产量和产物分布.光源, 125W高压汞灯.反应时间6 h.
Figure 3.
Yield of product and product distribution over different concentrations of Pt/P25 (a) and Pt/rutile (b). light, 125 W high pressure Hg lamp. Reaction time, 6 h.

Citation: Meng Chao, Wang Hua, Wu Yubin, Fu Xianzhi, Yuan Rusheng. Study on Selective Photocatalytic Oxidation of Ethanol During TiO2 Promoted Water-Splitting Process[J]. Acta Chimica Sinica, 2017, 75(5): 508-513. doi: 10.6023/A16110641

二氧化钛光解水过程中乙醇选择性光催化氧化反应研究
English
Study on Selective Photocatalytic Oxidation of Ethanol During TiO2 Promoted Water-Splitting Process
-
Key words:
- photocatalytic
- / titanium dioxide
- / ethanol
- / hydroxyl radicals
- / 2, 3-butanediol
-
1 引言
二氧化钛是光催化反应中应用最广泛的明星材料, 尤其在降解有机污染物[1~3]和光解水[4]等方面一直发挥着不可替代的重要作用.在纯水体系中二氧化钛几乎不能全解水产生氢气和氧气, 但是在水中引入牺牲剂乙醇或甲醇可以大幅度提高催化产氢效率[5, 6].目前已有很多研究报道负载不同金属或半导体对二氧化钛光解水产氢效率的影响, 但是针对体系内牺牲剂的功能作用与基元反应机制的相关探索却相对较少.因此, 从非材料设计角度阐述固-液界面化学反应路径与机理对于设计高效小分子醇参与的光解水体系具一定指导意义.
乙醇是光解水过程中最常见的小分子醇牺牲剂, 其氧化过程需要两电子转移过程并最终产生乙醛[7~11], 乙醛很容易从二氧化钛表面脱附至溶液中而避免进一步氧化.朱珍平课题组[12~17]发现二氧化钛可高效氧化乙醇至2, 3-丁二醇, 并且深入讨论了催化反应机理以及反应底物的耐受范围.该报道表明:以Pt/Rutile为催化剂时, 2, 3-丁二醇的选择性可以高达96%, 而采用Pt/P25为催化剂时, 2, 3-丁二醇的选择性几乎为0%. P25和金红石对乙醇氧化的选择性存在显著差异, 但对该现象的本质来源问题一直未有研究进行系统探讨.我们考虑不同体系固-液反应过程中自由基的迁移问题可能是控制反应选择性的一个关键因素, 并因此导致不同产物的反应取向, 理解并明确醇类分子的自由基反应历程对于有效解析醇-水光催化产氢体系具积极作用.据此, 本文以Pt/P25和Pt/R-800为光催化剂, 乙醇为典型牺牲剂, 系统探究了光解水过程中牺牲剂乙醇的氧化机理.结果表明, 乙醇和乙醛在溶液中发生有机光化学反应生成•CH(OH)CH3自由基并偶联至终端产物2, 3-丁二醇.另一方面, 不同晶相TiO2产生羟基自由基在溶液中的扩散迁移距离对有机光化学反应具直接影响.
2 结果与讨论
2.1 光催化反应及自由基判别
2.2 羟基自由基浓度对反应的影响
前述实验和讨论说明2, 3-丁二醇的产生主要是由于乙醛和乙醇发生有机光化学产生的•CH(OH)CH3自由基偶联产生, 并非二氧化钛表面产生的•CH(OH)CH3自由基偶联.为了进一步研究乙醇在不同晶相二氧化钛上的反应过程以及产物2, 3-丁二醇的选择性差异, 我们采用光解水反应典型的高压汞灯(该灯的发射波长数据为图s4) 作为灯源重新进行光催化氧化乙醇的试验.当用Pt/P25为催化剂时, 催化剂浓度较高时(5 g/L), 产物中没有检测到2, 3-丁二醇(图 3a), 与朱珍平报道的结果一致.而随着催化剂浓度减小时, 2, 3-丁二醇的选择性逐渐升高.当Pt/P25的浓度降低到很低时(0.2 g/L), 2, 3-丁二醇的选择性可高达60%多.如果用Pt/R-800为催化剂, Pt/R-800的浓度较高时(5 g/L), 2, 3-丁二醇的选择性大约为45%(图 3b), 但是随着催化剂的浓度逐渐减小, 直到很低浓度时(0.2 g/L), 2, 3-丁二醇的选择性并没有大幅度变化.
 图 3
不同浓度Pt/P25 (a)和Pt/rutile (b)光催化氧化牺牲剂乙醇产量和产物分布.光源, 125W高压汞灯.反应时间6 h.
Figure 3.
Yield of product and product distribution over different concentrations of Pt/P25 (a) and Pt/rutile (b). light, 125 W high pressure Hg lamp. Reaction time, 6 h.
图 3
不同浓度Pt/P25 (a)和Pt/rutile (b)光催化氧化牺牲剂乙醇产量和产物分布.光源, 125W高压汞灯.反应时间6 h.
Figure 3.
Yield of product and product distribution over different concentrations of Pt/P25 (a) and Pt/rutile (b). light, 125 W high pressure Hg lamp. Reaction time, 6 h.
2.3 机理讨论
已有大量文献报道就锐钛矿(P25的主要晶相)TiO2催化活性高于金红石相进行不同探索与机理阐述, 多数认为锐钛矿活性突出的根源在于其具有更宽带隙[28], 更慢的载流子复合速率[29, 30], 更快的载流子迁移速率[31], 更深的体相激发[32]和不同的表面活性物种[33, 34].然而, Choi课题组[35]却给出了不同解释, 认为锐钛矿表面产生的•OHs从锐钛矿表面迁移至溶液并变成•OHf, 金红石体系中的表面•OHs却不能从催化剂表面移动至溶液中而只能停留在表面.
基于本文已获得的实验事实和Choi的论点, 我们认为二氧化钛光催化氧化乙醇体系的可能机理如图 4所示:二氧化钛颗粒在乙醇水溶液中是均匀分散的, 当催化剂为Pt/P25且催化剂浓度较低时(0.2 g/L), 催化剂颗粒之间的距离相对较大, P25表面产生羟基自由基游离到溶液中的空间区域太小, 不能覆盖整个溶液体系, 所以溶液体系可有效发生有机光化学反应而生成2, 3-丁二醇(图 4a); 当催化剂的浓度较大时(0.5 g/L), 催化剂颗粒之间的距离相对较小, 不同催化剂颗粒羟基自由基的游离区域叠加足以覆盖整个溶液体系, 所以有机光化学反应产生的•CH(OH)CH3自由基中间产物很容易与溶液中的羟基自由基碰撞并被氧化为乙醛或其他过氧化产物, 而导致2, 3-丁二醇的生成受阻(图 4b); 当催化剂为Pt/R-800时, 由于R-800产生的表面羟基自由基的反应只能局限于催化剂表面, 不能有效游离进入溶液体系, 所以无论催化剂的浓度大还是小(颗粒之间的空间距离短还是长), 溶液中有机光化学反应都可顺利发生(图 4, c, d), 所以2, 3-丁二醇的选择性并不很明显依赖催化剂浓度.虽然, 光催化反应过程受大量物理化学参数如比表面积, 颗粒大小等影响, 但本文从羟基自由基相对固-液界面的空间游离程度与反应概率的角度阐释了乙醇氧化过程, 可为光解水或乙醇重整反应体系的解析与设计提供新见解.
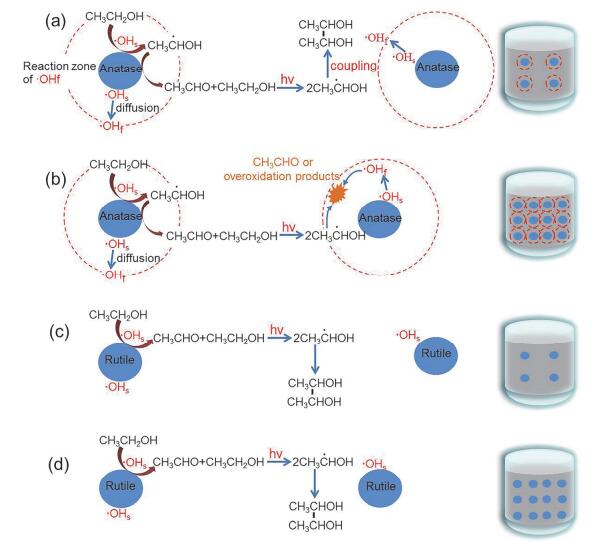 图 4
光解水过程中乙醇牺牲剂可能的氧化机理. (a)当Pt/P25 (80% anatase)浓度低时; (b)当Pt/P25浓度高时; (c)当Pt/R-800浓度低时; (d)当Pt/R-800浓度高时
Figure 4.
Proposed mechanism of the possible oxidation pathways of sacrificial ethanol during water splitting. (a) the concentration of Pt/P25 (80% anatase) is low; (b) the concentration of Pt/P25 is high; (c) the concentration of Pt/R-800 is low; (d) the concentration of Pt/R-800 is high.
图 4
光解水过程中乙醇牺牲剂可能的氧化机理. (a)当Pt/P25 (80% anatase)浓度低时; (b)当Pt/P25浓度高时; (c)当Pt/R-800浓度低时; (d)当Pt/R-800浓度高时
Figure 4.
Proposed mechanism of the possible oxidation pathways of sacrificial ethanol during water splitting. (a) the concentration of Pt/P25 (80% anatase) is low; (b) the concentration of Pt/P25 is high; (c) the concentration of Pt/R-800 is low; (d) the concentration of Pt/R-800 is high.
2.1.2 EPR自由基判别
关于小分子醇被光催化氧化为相应的醛或酮的路径有很多种解释, 如双电子转移[18], 激发的电子通过导带注入到甲醇或空穴直接转移到甲醇[6]等.徐东升课题组[19]报道了Ni/CdS在可见光作用下直接光催化氧化乙醇脱氢生成相应的醛或酮.杨学明课题组[5, 6]开展了小分子醇氧化的微观反应动力学研究, 为理解小分子醇在光催化剂表面氧化提供了思路.但因受实验条件限制, 目前原位的微观反应动力学研究局限于固体催化剂表面, 不能推广到水溶液中, 所以这类研究因不能有效的捕获到催化剂在溶液体系中产生的自由基而无法解释溶液体中微观反应机理.
有文献报道了羟基自由基可以与乙醇反应生成•CH(OH)CH3自由基[20~22].吴伟明博士用甲醇作为底物, TiO2或ZnO作为催化剂, 通过EPR实验证明了甲醇是与•OH自由基而不是光生空穴反应生成•CH2OH自由基[23].当用无法产生羟基自由基的光催化剂如PbBi2Nb2O9或CdS时(E价带(PbBi2Nb2O9)=2.3 V vs. RHE[24]; E价带(CdS)=1.9 V vs. RHE[25]; E (•OH/H2O)=2.7 V vs. RHE[26]), 在紫外光照下就无法检测到•CH2OH自由基.采用DMPO (dimethyl pyridine N-oxide)作为自由基捕获剂研究乙醇氧化过程的中间产物.起初我们用波长大于370 nm的光源进行试验, 无论是Pt/P25还是Pt/R-800作为催化剂, 在纯乙醇溶剂中没有检测到•OH自由基和•CH(OH)CH3自由基(图 1, a, d).当Pt/P25或Pt/R-800加入到纯水中, 检测到了强度比为1:2:2:1的四重峰, 该峰可归属为典型的•DMPO-OH特征峰[27](图 1, b, e).在乙醇与水的混合溶液中, Pt/P25或Pt/R-800体系中均可以检测到•DMPO-CH(OH)CH3自由基的信号(图 1, c, f和图s3), 但不能检测到羟基自由基的存在, 说明•CH(OH)CH3自由基可能是由羟基自由基夺取乙醇上的氢而生成.当把乙醛加入到乙醇溶液中时, 并没有检测到•CH(OH)CH3自由基(图 1, g).用λ>300 nm的光源照射含有乙醛的乙醇溶液可以检测到强度极低的•CH(OH)CH3自由基信号(图 1, h).
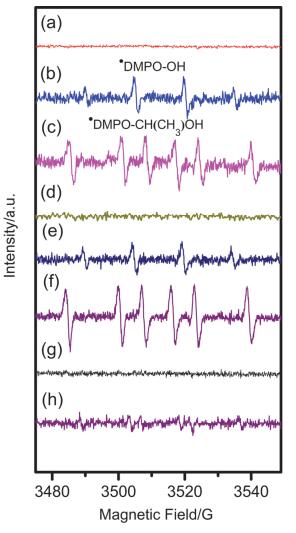 图 1
紫外光下反应体系中含有DMPO的电子顺磁共振光谱.条件:光照时间均为180 s, Pt/P25在纯乙醇中(a), 在纯水中(b)和含乙醇的水溶液中(c); Pt/R-800在乙醇中(d), 在纯水中和在含乙醇的水溶液中(e和f); 乙醛和乙醇的混合溶液中, λ>370 nm (g)和λ>300 nm (h)
Figure 1.
EPR spectra of the reaction mixture containing DMPO under UV irradiation (λ > 370 nm). Condition: irradiation time: 180 s, Pt/P25 in ethanol (a), in water without and with ethanol (b and c); Pt/R-800 in ethanol (d), in water without and with ethanol (e and f); acetaldehyde in ethanol solution using light wavelength > 370 nm (g) and > 300 nm (h).
图 1
紫外光下反应体系中含有DMPO的电子顺磁共振光谱.条件:光照时间均为180 s, Pt/P25在纯乙醇中(a), 在纯水中(b)和含乙醇的水溶液中(c); Pt/R-800在乙醇中(d), 在纯水中和在含乙醇的水溶液中(e和f); 乙醛和乙醇的混合溶液中, λ>370 nm (g)和λ>300 nm (h)
Figure 1.
EPR spectra of the reaction mixture containing DMPO under UV irradiation (λ > 370 nm). Condition: irradiation time: 180 s, Pt/P25 in ethanol (a), in water without and with ethanol (b and c); Pt/R-800 in ethanol (d), in water without and with ethanol (e and f); acetaldehyde in ethanol solution using light wavelength > 370 nm (g) and > 300 nm (h).
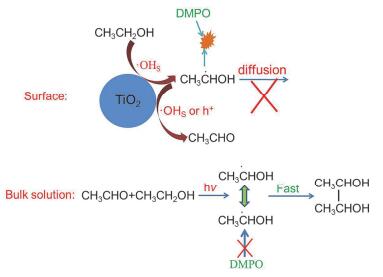
基于上述催化反应与自由基捕获结果, 二氧化钛氧化乙醇的机理可归纳如下:二氧化钛在小于385 nm波长光激发下产生电子-空穴对, 其中空穴与二氧化钛的表面羟基或吸附水发生氢化反应生成•OHs自由基, •OHs自由基与乙醇反应生成•CH(OH)CH3自由基, •CH(OH)CH3自由基再与空穴或•OHs自由基反应生成乙醛.中间产物•CH(OH)CH3自由基不能产生2, 3-丁二醇可能因为催化剂表面相邻吸附位点上的•CH(OH)CH3自由基不可自由迁移, 在没有外来的•CH(OH)CH3参与的情况下, 该自由基与相邻位点上的自由基发生偶联反应产生2, 3-丁二醇的概率较低.而有机光化学反应生成2, 3-丁二醇的过程与非均相二氧化钛体系不同.在光照下, 溶液体系中乙醇与乙醛很容易发生有效碰撞, 产生两分子•CH(OH)CH3, 这些自由基可经碰撞偶联产生2, 3-丁二醇.此时, 处于溶液中的两分子化合物已经发生反应, DMPO与它们发生反应生成•DMPO-CH(OH)CH3的速率竞争不过两分子•CH(OH)CH3自由基的偶联速率, 因此很难通过电子顺磁共振光谱检测到•DMPO-CH(OH)CH3.
2.1.1 光催化反应
当用波长为300 nm<λ<700 nm的光源, Pt/P25为催化剂时, 经8 h光照后, 乙醇的主要氧化产物为乙醛, 乙酸、缩醛和二氧化碳等副产物仅占不足4%的含量, (表 1, Entry 1).当采用Pt/R-800为催化剂时, 2, 3-丁二醇的选择性可达35%(表 1, Entry 2), 与Pt/P25催化剂的反应现象完全不同.该反应规律与朱珍平课题组[12]的相关报道相似, 即金红石可以选择性氧化乙醇生成2, 3-丁二醇, 而P25只能将乙醇氧化为乙醛或其过氧化产物.为验证该条件下乙醇与乙醛是否发生有机光化学反应, 将0.5 mL 40%的乙醛加入到乙醇水溶液中, 经300 nm<λ<700 nm波长的光波照射后, 在产物中检测到了大量的2, 3-丁二醇(表 1, Entry 3).上述结果说明有机光化学反应在无催化剂λ>300 nm的光激发下可有效发生.因此, 我们又分别测试了固体催化剂Pt/TiO2(Pt/P25和Pt/R-800) 和乙醛-乙醇溶液体系的紫外可见吸收光谱.结果表明, Pt/P25和Pt/R-800均可吸收小于385 nm的光(图s1), 然而含有乙醛的乙醇溶液只能吸收小于370 nm的光(图s2).为了排除有机光化学反应对光催化反应的干扰, 我们采用370 nm的截止滤光片滤去小于370 nm的光波(λ>370 nm), 此时, 无论是以Pt/P25还是Pt/R-800为催化剂的反应体系, 还是含有乙醛的乙醇溶液, 光照后均无2, 3-丁二醇产物生成(表 1, 4~6).上述实验表明, 2, 3-丁二醇主要是由乙醇、乙醛经有机光化学反应生成•CH(OH)CH3自由基进而偶联获得, TiO2光催化氧化乙醇的反应步骤可能不是主要原因.
Entry Cat. λ/nm Yield/μmol Selectivity/% 2, 3-Butanediol Acetaldehyde Others 1 P25 >300 1023 — 96 <4 2 Rutile >300 243 35 63 2 3 No >300 185 75 — 25 4 P25 >370 92 ND 98 3 5 Rutile >370 54 ND >99 trace 6 No >370 — ND trace — aGeneral reaction conditions: 30 vol% aqueous ethanol solution, 10 mL; Pt/TiO2, 20 mg, containing 0.4% (wt) Pt; light, A 300 W Xenon lamp; reaction duration, 8 h. 表 1 牺牲剂乙醇的光催化氧化反应a
Table 1. Photocatalytic oxidation of ethanol3 结论
TiO2可高效氧化乙醇至2, 3-丁二醇生成的重要前驱体•CH(OH)CH3自由基, 发生于固体催化剂表面的•CH(OH)CH3自由基间的直接偶联或脱附至溶液体系的可能性都较低, 进而不足以生成2, 3-丁二醇.据此, 本文还结合游离态羟基自由基和表面态羟基自由基的不同反应特征, 理论解释了不同晶相二氧化钛在乙醇氧化选择性上产生明显差异的可能本质原因, 该研究为固-液界面羟基自由基表面迁移行为对催化反应的影响提供了一定思路与见解.
4 实验部分
4.1 试剂
P25是从德国Degussa公司购买的商品化TiO2, 其中含有80%的锐钛矿相和20%的金红石相.金红石是通过将P25在高温管式炉中用空气煅烧800 ℃保持6 h制得, 命名R-800.二者的粉末衍射测试结果见图s5.自旋捕获剂5, 5-二甲基吡咯啉-1-氮-氧化物(DMPO), 分析纯, 购自美国Alfa Aesar公司.其他所用试剂均为分析纯.
4.2 Pt/TiO2制备方法
采用原位光还原法制备Pt负载TiO2:光反应器为200 mL圆柱形夹套反应器, 反应时通过夹套的冷凝水控制反应液温度在10 ℃左右, 光源为125 W高压汞灯, 内置于光反应器.反应液体积[V(H2O):V(CH3OH)=7:3]为100 mL, TiO2和H2PtCl6溶液按设计的量加入(0.4% (wt) Pt), 并通过磁力搅拌器搅拌均匀.反应前整个体系由机械泵抽真空, 然后冲入高纯氮气, 此过程重复几次, 以便将体系内的氧气除尽.最后反应在真空条件下进行.采用JY电感耦合等离子体发射光谱仪测定催化剂中Pt元素的含量.催化剂Pt/P25和Pt/R-800中Pt元素的真实质量含量分别为0.29%, 0.25%.准备待测液:配制8 mL的王水(V浓盐酸:V浓硝酸=3:1), 称取2 mg的Pt/P25并将其溶于5 mL王水中, 充分溶解后进行抽滤, 保留滤液, 从滤液中取出200 μL于100 mL容量瓶中, 再向容量瓶中加入5 mL的王水, 并加水至100 mL刻度线, 充分摇匀.同理, Pt/R-800也按上述方法配制.
4.3 光催化剂表征
紫外-可见漫反射光谱(UV-Vis-DRS):固体粉末样品在装有小积分球的Varian Cary 500 Scan型UV-Vis-NIR分光光度计上测定样品的漫反射光谱, 以BaSO4为参比, 扫描范围200~800 nm.漫反射满足Kubelka-Munk方程式: F(R)=(1-R∞)2/(2R∞)=K/S.式中K为吸收系数, 代表意义与吸收光谱中的吸收系数相同; S为散射系数; R为无限厚样品的反射系数R的极限值.
样品的晶相结构采用Bruker D8 Advance型X射线粉末衍射仪进行表征, Cu靶Kα射线(λ=0.15406 nm), 加速电压和工作电流分别为40 kV和40 mA.扫描范围分别为2θ=10°~80°, 扫描步长为0.02°, 扫描速度为0.2 (°)/min.
样品的电子顺磁共振谱在Brucker ESP 300E电子顺磁共振仪上测定.测试条件:室温, 中心磁场3512 G, 微波频率9.79 GHz, 工作功率5.05 mW.采用自旋捕集剂5, 5-二甲基-1-吡咯啉-氮-氧化物(DMPO水溶液, 0.053 mol/L)捕获光照时催化剂样品表面生成的活性物种(羟基自由基), 样品粉末均匀地分散在DMPO溶液中(2 g•L-1).体系中有乙醇的实验将20 μL乙醇加入到1 mL上述混合液, 乙醛和乙醇的混合溶液中乙醛与乙醇的体积比为1:1 (20 μL乙醇, 20 μL乙醛, 1 mL水).用毛细管取微量溶液放入仪器样品腔中进行分析, 采集数据过程中用氙灯光源照射样品.
4.4 光催化反应及活性评价
2.1节中涉及的反应均在Schlenk反应器里进行, 反应前先抽真空.羟基自由基浓度对反应的影响部分:光催化反应器为200 mL圆柱形内照式夹套反应器, 通过夹套的冷凝水控制反应液温度在10 ℃左右, 光源为直型125 W高压汞灯.反应前整个体系由机械泵抽真空, 之后开启搅拌器、气体循环泵并开灯.气相产物和液相产物由FID(氢火焰离子检测器)和TCD(热导池检测器)分析.
-
-
[1]
潘超, 顾忠泽, 董丽, 化学学报, 2009, 67, 1981. doi: 10.3321/j.issn:0567-7351.2009.17.007Pan, C.; Gu, Z.-Z.; Dong, L. Acta Chim. Sinica 2009, 67, 1981. doi: 10.3321/j.issn:0567-7351.2009.17.007
-
[2]
吕学钧, 许宜铭, 王智, 赵进才, 吴烨铤, 化学学报, 2004, 62, 1455. doi: 10.3866/PKU.WHXB20041211Lv, X.-J.; Xu, Y.-M.; Wang, Z.; Zhao, J.-C.; Wu, Y.-D. Acta Chim. Sinica 2004, 62, 1455. doi: 10.3866/PKU.WHXB20041211
-
[3]
李跃军, 曹铁平, 王长华, 邵长路, 化学学报, 2011, 69, 2597. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract340757.shtmlLi, Y.-J.; Cao, T.-P.; Wang, C.-H.; Shao, C.-L. Acta Chim. Sinica 2011, 69, 2597. http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract340757.shtml
-
[4]
万中全, 郑树楠, 贾春阳, 延卫, 化学学报, 2009, 67, 403. doi: 10.3321/j.issn:0251-0790.2009.02.035Wan, Z.-Q.; Zheng, S.-N.; Jia, C.-Y.; Yan, W. Acta Chim. Sinica 2009, 67, 403. doi: 10.3321/j.issn:0251-0790.2009.02.035
-
[5]
Guo, Q.; Xu, C.-B.; Ren, Z.-F.; Yang, W.-S.; Ma, Z.-B.; Dai, D.-X.; Fan, H.-J.; Minton, T. K.; Yang, X.-M. J. Am. Chem. Soc. 2012, 134, 13366. doi: 10.1021/ja304049x
-
[6]
Xu, C.-B.; Yang, W.-S.; Ren, Z.-F.; Dai, D.-X.; Guo, Q.; Minton, T. K.; Yang, X.-M. J. Am. Chem. Soc. 2013, 135, 19039. doi: 10.1021/ja4114598
-
[7]
Bamwenda, G. R.; Tsubota, S.; Nakamura, T.; Haruta, M. J. Photochem. Photobiol. A 1995, 89, 177. doi: 10.1016/1010-6030(95)04039-I
-
[8]
Idriss, H.; Seebauer, E. G. J. Mol. Catal. A: Chem. 2000, 152, 201. doi: 10.1016/S1381-1169(99)00297-6
-
[9]
Llorca, J.; Homs, N.; Sales, J.; Piscina, P. R. D. L. J. Catal. 2002, 209, 306. doi: 10.1006/jcat.2002.3643
-
[10]
Murdoch, M.; Waterhouse, G. I. N.; Nadeem, M. A.; Metson, J. B.; Keane, M. A.; Howe, R. F.; Llorca, J.; Idriss, H. Nat. Chem. 2011, 3, 489.
-
[11]
Meng, C.; Yang, K.; Fu, X.-Z.; Yuan, R.-S. ACS Catal. 2015, 5, 3760. doi: 10.1021/acscatal.5b00644
-
[12]
Lu, H.-Q.; Zhao, J.-H.; Li, L.; Gong, L.-M.; Zheng, J.-F.; Zhang, L.-X.; Wang, Z.-J.; Zhang, J.; Zhu, Z.-P. Energy Environ. Sci. 2011, 4, 3384. doi: 10.1039/c1ee01476e
-
[13]
Yang, P.-J.; Zhao, J.-H.; Cao, B.-Y.; Li, L.; Wang, J.-Z.; Tian, X.-X.; Jia, S.-P.; Zhu, Z.-P. ChemCatChem 2015, 7, 2384. doi: 10.1002/cctc.201500326
-
[14]
Wang, J.; Yang, P.-J.; Cao, B.-Y.; Zhao, J.-H.; Zhu, Z.-P. Appl. Surf. Sci. 2015, 325, 86. doi: 10.1016/j.apsusc.2014.10.143
-
[15]
Lu, H.-Q.; Zhao, B.-B.; Zhang, D.; Lv, Y.-L.; Shi, B.-P.; Shi, X. C.; Wen, J.; Yao, J.-F.; Zhu, Z.-P. J. Photochem. Photobiol. A 2013, 272, 1. doi: 10.1016/j.jphotochem.2013.08.021
-
[16]
Cao, B.-Y.; Zhang, J.; Zhao, J.-H.; Wang, Z.-J.; Yang, P.-J.; Zhang, H.-X.; Li, L.; Zhu, Z.-P. ChemCatChem 2014, 6, 1673. doi: 10.1002/cctc.v6.6
-
[17]
Li, N.; Yan, W. J.; Yang, P.-J.; Zhang, H.-X.; Wang, Z.-J.; Zheng, J.-F.; Jia, S.-P.; Zhu, Z.-P. Green Chem. 2016, 18, 6029. doi: 10.1039/C6GC00883F
-
[18]
Ohno, T.; Izumi, S.; Fujihara, K.; Masaki, Y.; Matsumura, M. J. Phys. Chem. B 2000, 104, 6801. doi: 10.1021/jp993184g
-
[19]
Chai, Z.-G.; Zeng, T.-T.; Li, Q.; Lu, L.-Q.; Xiao, W.-J.; Xu, D.-S. J. Am. Chem. Soc. 2016, 138, 10128. doi: 10.1021/jacs.6b06860
-
[20]
Shimizu, Y.; Sugimoto, S.; Kawanishi, S.; Suzuki, N. Bull. Chem. Soc. Jpn. 1991, 64, 3607. doi: 10.1246/bcsj.64.3607
-
[21]
Asmus, K. D.; Mockel, H.; Henglein, A. J. Phys. Chem. 1973, 77, 1218. doi: 10.1021/j100629a007
-
[22]
Sun, L. Z.; Bolton, J. R. J. Phys. Chem. 1996, 100, 4127. doi: 10.1021/jp9505800
-
[23]
Wu, W.-M.; Wen, L.-R.; Shen, L.-J.; Liang, R.-W.; Yuan, R.-S.; Wu, L. Appl. Catal. B 2013, 130~131, 163.
-
[24]
Wu, W.-M.; Liu, G.; Liang, S.-J.; Chen, Y.; Shen, L.-J.; Zheng, H.-R.; Yuan, R.-S.; Hou, Y.-D.; Wu, L. J. Catal. 2012, 290, 13. doi: 10.1016/j.jcat.2012.02.005
-
[25]
Xu, Y.; Schoonen, M. A. A. Am. Mineral. 2000, 85, 543. doi: 10.2138/am-2000-0416
-
[26]
Fujishima, A.; Zhang, X.; Tryk, D. A. Surf. Sci. Rep. 2008, 63, 515. doi: 10.1016/j.surfrep.2008.10.001
-
[27]
Li, R.-G.; Weng, Y.-X.; Zhou, X.; Wang, X.-L.; Mi, Y.; Chong, R.-F.; Han, H.-X.; Li, C. Energy Environ. Sci. 2015, 8, 2377. doi: 10.1039/C5EE01398D
-
[28]
Kavan, L.; Gratzel, M.; Gilbert, S. E.; Klemenz, C.; Scheel, J. J. Am. Chem. Soc. 1996, 118, 6716. doi: 10.1021/ja954172l
-
[29]
Yamakata, A.; Ishibashi, T. A.; Onishi, H. Chem. Phys. 2007, 339, 133. doi: 10.1016/j.chemphys.2007.05.010
-
[30]
Xu, M.; Gao, Y.; Moreno, E. M.; Kunst, M.; Muhler, M.; Wang, Y.; Idriss, H.; Wçll, C. Phys. Rev. Lett. 2011, 106, 138302. doi: 10.1103/PhysRevLett.106.138302
-
[31]
Tang, H.; Prasad, K.; Sanjines, R.; Schmid, P. E.; Levy, F. J. Appl. Phys. 1994, 75, 2042. doi: 10.1063/1.356306
-
[32]
Luttrell, T.; Halpegamage, S.; Tao, J.; Kramer, A.; Sutter, E.; Batzill, M. Sci. Rep. 2014, 4, 4043.
-
[33]
Goto, H.; Hanada, Y.; Ohno, T.; Matsumura, M. J. Catal. 2004, 225, 223. doi: 10.1016/j.jcat.2004.04.001
-
[34]
Bui, T. D.; Kimura, A.; Ikeda, S.; Matsumura, M. J. Am. Chem. Soc. 2010, 132, 8453. doi: 10.1021/ja102305e
-
[35]
Kim, W.; Tachikawa, T.; Moon, G. H.; Majima, T.; Choi, W. Angew. Chem., Int. Ed. 2014, 53, 14036. doi: 10.1002/anie.v53.51
-
[1]
-
图 1 紫外光下反应体系中含有DMPO的电子顺磁共振光谱.条件:光照时间均为180 s, Pt/P25在纯乙醇中(a), 在纯水中(b)和含乙醇的水溶液中(c); Pt/R-800在乙醇中(d), 在纯水中和在含乙醇的水溶液中(e和f); 乙醛和乙醇的混合溶液中, λ>370 nm (g)和λ>300 nm (h)
Figure 1 EPR spectra of the reaction mixture containing DMPO under UV irradiation (λ > 370 nm). Condition: irradiation time: 180 s, Pt/P25 in ethanol (a), in water without and with ethanol (b and c); Pt/R-800 in ethanol (d), in water without and with ethanol (e and f); acetaldehyde in ethanol solution using light wavelength > 370 nm (g) and > 300 nm (h).
图 4 光解水过程中乙醇牺牲剂可能的氧化机理. (a)当Pt/P25 (80% anatase)浓度低时; (b)当Pt/P25浓度高时; (c)当Pt/R-800浓度低时; (d)当Pt/R-800浓度高时
Figure 4 Proposed mechanism of the possible oxidation pathways of sacrificial ethanol during water splitting. (a) the concentration of Pt/P25 (80% anatase) is low; (b) the concentration of Pt/P25 is high; (c) the concentration of Pt/R-800 is low; (d) the concentration of Pt/R-800 is high.
表 1 牺牲剂乙醇的光催化氧化反应a
Table 1. Photocatalytic oxidation of ethanol
Entry Cat. λ/nm Yield/μmol Selectivity/% 2, 3-Butanediol Acetaldehyde Others 1 P25 >300 1023 — 96 <4 2 Rutile >300 243 35 63 2 3 No >300 185 75 — 25 4 P25 >370 92 ND 98 3 5 Rutile >370 54 ND >99 trace 6 No >370 — ND trace — aGeneral reaction conditions: 30 vol% aqueous ethanol solution, 10 mL; Pt/TiO2, 20 mg, containing 0.4% (wt) Pt; light, A 300 W Xenon lamp; reaction duration, 8 h. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 25
- 文章访问数: 2972
- HTML全文浏览量: 836


 下载:
下载:



 下载:
下载:

