 图 1
可见光有机小分子光催化剂催化多烯环化反应
Figure 1.
Visible-light-mediated organocatalytic cyclization of polyenes
图 1
可见光有机小分子光催化剂催化多烯环化反应
Figure 1.
Visible-light-mediated organocatalytic cyclization of polyenes

Citation: Yang Zhongbo, Li Sujia, Luo Sanzhong. Total Synthesis of (±)-Hongoquercin A via Visible-Light-Mediated Organocatalytic Polyene Cyclization[J]. Acta Chimica Sinica, 2017, 75(4): 351-354. doi: 10.6023/A16110591

(±)-Hongoquercin A全合成:可见光促进有机催化多烯环化策略
-
关键词:
- 全合成
- / 萜类化合物
- / Hongoquercin A
- / 可见光诱导
- / 阳离子自由基多烯环化
English
Total Synthesis of (±)-Hongoquercin A via Visible-Light-Mediated Organocatalytic Polyene Cyclization
-
Key words:
- total synthesis
- / terpenoid
- / Hongoquercin A
- / visible-light-driven
- / cation radical polyene cyclization
-
1 引言
萜烯作为世界上数量最庞大的天然产物家族之一, 广泛存在于生物体内.很多萜类化合物具有重要的生理活性, 是研究天然产物和开发新药的重要来源; 同时萜类化合物往往具有非常新奇的多环骨架核心结构.因此萜类化合物的全合成研究一直受到化学家关注[1].在生物体内, 萜烯是由它的前体 (多烯化合物) 在相应的酶作用下, 通过碳正离子机制经由一步环化步骤来高效构建萜烯的多环骨架核心结构的[2].受此启发, 目前基于碳正离子机制的化学催化多烯不对称环化反应的研究已经有了一定程度的发展[3], 而基于自由基机制的多烯环化催化反应却方兴未艾[4].目前大多数的例子中都需要当量及以上的金属化合物或者自由基引发剂来启动基于自由基多烯环化反应, 并且很多例子中产率不高, 这在很大程度上限制了这类方法学在萜烯全合成上的应用.另一方面, 得益于可见光引发的有机光催化方法学的蓬勃发展, 近年来可见光化学逐渐崭露头角, 开始成为化学家们在合成化学领域的又一得力助手[5].特别在天然产物全合成中, 也有一些以可见光催化化学策略为关键步的报道[6].
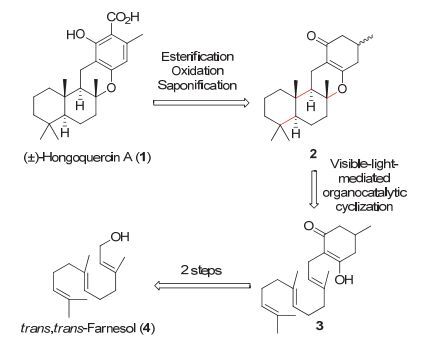
最近, 我们[7]报道了可见光引发有机小分子催化自由基多烯环化反应.该方法底物适用范围广、反应条件温和、操作简单, 而且还具有优良的化学选择性.进一步的工作中, 我们希望将此方法应用于萜类天然产物的仿生全合成中.如图 1所示, 该反应可以适用于以链状1, 3-二羰基结构单元为终端的多烯底物, 高产率和高非对映选择性地实现一步构建多环结构.其中催化量的路易斯酸促进底物烯醇化, 是反应成功的关键.同时我们也注意到, 将链状1, 3-二羰基结构进一步拓展到环状1, 3-二羰基将有望增进产物结构的多样性, 并有利于后续的衍生转化, 适用于目标天然产物的合成.我们选择一种倍半萜类天然产物 (±)-Hongoquercin A (1) 为目标分子.它是在1998年由Roll等[8]从一种未命名的陆生真菌中分离提取的, 它表现出对methicillinresistant金黄色葡萄球菌和vancomycin-resistant肠球菌的抗菌性.目前有三例关于该天然产物的全合成报道, 包括Mori[9]和Hsung[10]两个课题组基于碳正离子策略的报道, 以及Yu和Baran[11]合作的基于C—H活化官能化策略的全合成.本文报道以我们发展的可见光有机小分子光催化多烯环化为核心步骤[12]的 (±)-Hongoquercin A全合成工作.
2 结果与讨论
2.1 (±)-Hongoquercin A的逆合成分析
(±)-Hongoquercin A (1) 的逆合成分析路线如图 2所示.受Hsung课题组[10]工作启发, 我们设想1可以由四环中间体2通过羰基α-酯化、氧化芳构化和皂化反应得到; 而四环中间体2多环结构可以由我们发展的自由基多烯环化反应方法学一步构建.多烯底物3恰恰就是以环状1, 3-二酮结构为终端, 可通过市售的反式, 反式-金合欢醇 (trans, trans-farnesol, 4) 简单转化得到.
2.2 (±)-Hongoquercin A的全合成
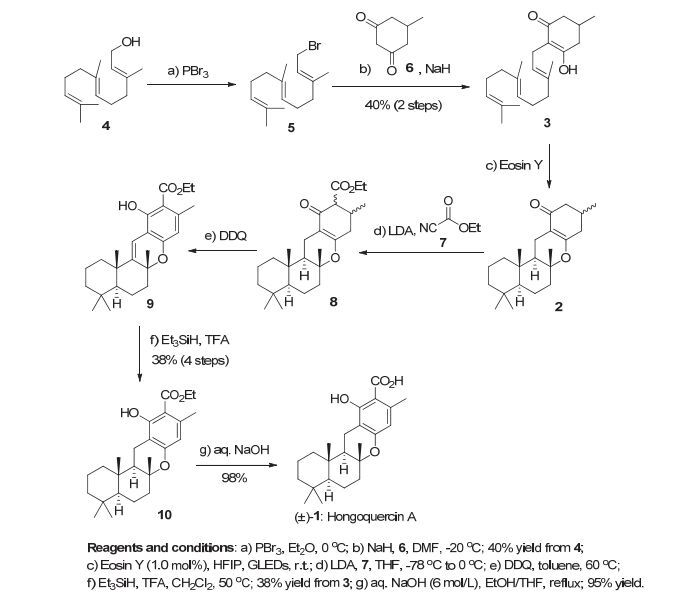
(±)-Hongoquercin A的全合成路线如图 3所示.首先, 我们从商品化的原料反式, 反式-金合欢醇 (4) 出发, 在溴化试剂PBr3作用下定量转化为相应的烯丙基溴化合物5, 之后其与环状二酮6在NaH条件下构建碳碳键得到多烯中间体3(两步40%产率).参照我们之前在有机小分子光催化剂催化多烯环化中的反应条件, 我们尝试一步完成四环中间体2的构建.由于化合物3倾向于形成烯醇式 (在CDCl3中烯醇式大约占80%), 故而在反应体系中并不需要额外加入催化量的弱路易斯酸[6], 只需以曙红 (1.0 mol%) 为光敏剂、六氟异丙醇为溶剂, 在绿色LED灯照射2 h就可以得到目标中间体2(核磁鉴定大约60%产率), 所得到化合物2为一对甲基位置的非对映异构体, 可在芳构化步骤消除.在该步骤中, 由于3中的烯醇式羟基亲核性太强 (多烯中间体3在室温环境下放置两天就会完全变质), 所以除了生成四环产物2之外, 还伴随着未完全关环的副产物.这些副产物和2极性非常相近导致不好分离, 可直接粗略过柱处理, 在后续转化中分离除去.接下去, 在LDA作用下, 由酯基化试剂7酯化得到β-酮酯中间体8.后者在DDQ做氧化剂条件下芳构化形成脱氢中间体9[13], 除了预期的芳构化外, 苄基位也发生了脱氢氧化.核磁分析证实芳构化反应产物9为单一构象产物.进一步经负氢试剂Et3SiH得到同样是单一构象的中间体10, 在此步骤对产物进行纯化, 四步总收率38%.最后经由一步简单的皂化反应就可以得到最终产物 (±)-Hongoquercin A.该合成总共7步, 总产率14.4%, 全程无需保护基团.
3 结论
利用有机小分子光催化自由基多烯环化策略, 我们发展出一条简洁高效的仿生合成路线, 完成了 (±)-Hongoquercin A的全合成.该路线的关键步是基于自由基机制多烯环化反应一步高化学选择性地构建萜烯多环骨架结构.本工作所描述的合成策略预期在其它萜烯天然产物全合成上也能有所作为.
-
-
[1]
(a) Nicolaou, K. C.; Vourloumis, D.; Wissinger, N.; Baran, P. S. Angew. Chem. Int. Ed. 2000, 39, 44.(b) Nicolaou, K. C.; Montagnon, T.; Snyder, S. A. Chem. Commun. 2003, 551.(c) Nicolaou, K. C.; Edmonds, D. J.; Bulger, P. G. Angew. Chem. Int. Ed. 2006, 45, 7134.(d) Maimone, T. J.; Baran, P. S. Nat. Chem. Biol. 2007, 3, 396.
-
[2]
For a recent review, see:(a) Yoder, R. A.; Johnston, J. N. Chem. Rev. 2005, 105, 4730; For early contributions, see:(b) Johnson, W. S.; Kinnel, R. B. J. Am. Chem. Soc. 1966, 88, 3861.(c) Tamelen, E. E. V.; McCormick, J. P. J. Am. Chem. Soc. 1969, 91, 1847.
-
[3]
For selected examples in this field, see:(a) Ishihara, K.; Nakamura, S.; Yamamoto, H. J. Am. Chem. Soc. 1999, 121, 4906.(b) Ishihara, K.; Ishibashi, H.; Yamamoto, H. J. Am. Chem. Soc. 2001, 123, 1505.(c) Ishibashi, H.; Ishihara, K.; Yamamoto, H. J. Am. Chem. Soc. 2004, 126, 11122.(d) Surendra, K.; Corey, E. J. J. Am. Chem. Soc. 2012, 134, 11992.(e) Zhao, Y.-J.; Li, B.; Tan, L.-J. S.; Shen, Z.-L.; Loh, T.-P. J. Am. Chem. Soc. 2010, 132, 10242.(f) Sakakura, A.; Ukai, A.; Ishihara, K. Nature 2007, 445, 900.(g) Rendler, S.; MacMillan, D. W. C. J. Am. Chem. Soc. 2010, 132, 5027.(h) Knowles, R. R.; Lin, S.; Jacobsen, E. N. J. Am. Chem. Soc. 2010, 132, 5030.(i) Mullen, C. A.; Campbell, A. N.; Gagn, M. R. Angew. Chem. Int. Ed. 2008, 47, 6011.(j) Sethofer, S. G.; Mayer, T.; Toste, F. D. J. Am. Chem. Soc. 2010, 132, 8276.(k) Schafroth, M. A.; Sarlah, D.; Krautwald, S.; Carreira, E. M. J. Am. Chem. Soc. 2012, 134, 20276.
-
[4]
For a recent review, see:(a) Justicia, J.; Álvarez de Cienfuegos, L.; Campaña, A. G.; Miguel, D.; Jakoby, V.; Gansäuer, A.; Cuerva, J. M. Chem. Soc. Rev. 2011, 40, 3525. For selected examples, see:(b) Rendeler, S.; MacMillan, D. W. C. J. Am. Chem. Soc. 2010, 132, 5027.(c) Handa, S.; Pattenden, G. J. Chem. Soc., Perkin Trans. 11999, 843.(d) Kates, S. A.; Dombroski, M. A.; Snider, B. B. J. Org. Chem. 1990, 55, 2427.(e) Zoretic, P. A.; Fang, H.; Ribeiro, A. A. J. Org. Chem. 1998, 63, 4779.(f) Morcillo, S. P.; Miguel, D.; Resa, S.; Martín-Lasanta, A.; Millán, A.; Choquesillo-Lazarte, D.; Gar-cía-Ruiz, J. M.; Mota, A. J.; Justicia, J.; Cuerva, J. M. J. Am. Chem. Soc. 2014, 136, 6943.(g) Gu, S.; Yan, Y.-L.; Zhao, H.-W.; Zhu, N.-Y.; Yang, D. Angew. Chem. Int. Ed. 2002, 41, 3014.(h) Heinemann, C.; Demuth, M. J. Am. Chem. Soc. 1999, 121, 4894.(i) Bunte, J. O.; Rinne, S.; Schäfer, C.; Neumann, B.; Stammlerb, H.-G.; Mattaya, J. Tetrahedron Lett. 2003, 44, 45.
-
[5]
For recent selected reviews on the field of photocatalysis in photochemical synthesis, see: (a) Skubi, K. L. ; Blum, T. R. ; Yoon, T. P. Chem. Rev. 2016, 116, 10035. (b) Romero, N. A. ; Nicewicz, D. A. Chem. Rev. 2016, 116, 10075. (c) Corrigan, N. ; Shanmugam, S. ; Xu, J. ; Boyer, C. Chem. Soc. Rev. 2016, 45, 6165. (d) Shaw, M. H. ; Twilton, J. ; MacMillan, D. W. C. J. Org. Chem. 2016, 81, 6898. For reviews on the field of visible-light photoredox catalysis, see: (e) Ding, K. ; Xiao, W. ; Wu, L. -Z. Acta Chim. Sinica 2017, 75, 5(in Chinese). (丁奎岭, 肖文精, 吴骊珠, 化学学报, 2017, 75, 5. )(f) Pei, P. Zhang, F. ; Yi, H. ; Lei, A. Acta Chim. Sinica 2017, 75, 15(in Chinese). (裴朋昆, 张凡, 易红, 雷爱文, 化学学报, 2017, 75, 15. )(g) Wang, D. ; Zhang, L. ; Luo, S. Acta Chim. Sinica 2017, 75, 22(in Chinese). (王德红, 张龙, 罗三中, 化学学报, 2017, 75, 22. )(h) Zhong, J. -J. ; Meng, Q. -Y. ; Chen, B. ; Tung, C. -H. ; Wu, L. -Z. Acta Chim. Sinica 2017, 75, 34(in Chinese). (钟建基, 孟庆元, 陈彬, 佟振合, 吴骊珠, 化学学报, 2017, 75, 34. )(i) Zhang, J. ; Chen, Y. Acta Chim. Sinica 2017, 75, 41(in Chinese). (张晶, 陈以昀, 化学学报, 2017, 75, 41. )(j) Guan, B. ; Xu, X. ; Wang, H. ; Li, X. Chin. J. Org. Chem. 2016, 36, 1564(in Chinese). (关保川, 许孝良, 王红, 李小年, 有机化学, 2016, 36, 1564. )(k) Sun, X. ; Yu, S. Chin. J. Org. Chem. 2016, 36, 239(in Chinese). (孙晓阳, 俞寿云, 有机化学, 2016, 36, 239. )(l) Schultz, D. M. ; Yoon, T. P. Science 2014, 343, 1239176. (m) Prier, C. K. ; Rankic, D. A. ; MacMillan, D. W. C. Chem. Rev. 2013, 113, 5322. (n) Xuan, J. ; Lu, L. -Q. ; Chen, J. -R. ; Xiao, W. -J. Eur. J. Org. Chem. 2013, 6755. (o) Narayanam, J. M. R. ; Stephenson, C. R. J. Chem. Soc. Rev. 2011, 40, 102. (p) Zeitler, K. Angew. Chem. Int. Ed. 2009, 48, 9785.
-
[6]
For recently selected reviews on the field of applications of visible light photoredox catalysis in natural product synthesis, see: (a) Nicholls, T. P. ; Leonori, D. ; Bissember, A. C. Nat. Prod. Rep. 2016, 33, 1248. (b) Kärkäs, M. D. ; Porco, J. A. , Jr. ; Stephenson, C. R. J. Chem. Rev. 2016, 116, 9683. (c) Tan, F. ; Xiao, W. Acta Chim. Sinica 2015, 73, 85(in Chinese). (谭芬, 肖文精, 化学学报, 2015, 73, 85. )
-
[7]
Yang, Z.; Li, H.; Zhang, L.; Zhang, M.-T.; Cheng, J.-P.; Luo, S. Chem. Eur. J. 2015, 21, 14723. doi: 10.1002/chem.201503118
-
[8]
(a) Roll, D. M.; Manning, J. K.; Carter, G. T. J. Antibiot. 1998, 51, 635. For fermentation studies, see:(b) Abbanat, D. A.; Singh, M. P.; Greenstein, M. J. Antibiot. 1998, 51, 708.
-
[9]
Tsujimori, H.; Bando, M.; Mori, K. Eur. J. Org. Chem. 2000, 297.
-
[10]
Kurdyumov, A. V.; Hsung, R. P. J. Am. Chem. Soc. 2006, 128, 6272. doi: 10.1021/ja054872i
-
[11]
Rosen, B. R.; Simke, L. R.; Thuy-Boun, P. S.; Dixon, D. D.; Yu, J.-Q.; Baran, P. S. Angew. Chem. Int. Ed. 2013, 52, 7317. doi: 10.1002/anie.201303838
-
[12]
For reviews on the field of photochemical reactions as key steps in natural product synthesis, see:(a) Bach, T.; Hehn. J. P. Angew. Chem. Int. Ed. 2011, 50, 1000.(b) Hoffmann. N. Chem. Rev. 2008, 108, 1052.(c) Iriondo-Alberdi, J.; Greaney, M. F. Eur. J. Org. Chem. 2007, 4801.
-
[13]
For recently selected examples on the field of applications of DDQ as aromatization reagent in natural product synthesis, see:(a) Li, H.; Chen, Q.; Lu, Z.; Li, A. J. Am. Chem. Soc. 2016, 138, 15555.(b) Yang, P.; Yao, M.; Li, J.; Li, Y.; Li, A. Angew. Chem. Int. Ed. 2016, 55, 6964.(c) Zhou, S.; Chen, H.; Luo, Y.; Zhang, W.; Li, A. Angew. Chem. Int. Ed. 2015, 54, 6878.
-
[1]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 33
- 文章访问数: 1569
- HTML全文浏览量: 332


 下载:
下载:


 下载:
下载:

