 图 1
几种常见的含呋喃的稠环结构式
Figure 1.
Structures of several furan-containing fused ring
图 1
几种常见的含呋喃的稠环结构式
Figure 1.
Structures of several furan-containing fused ring

Citation: Liu Ye, Yuan Jun, Zou Yingping, Li Yongfang. Research Progress of the FuranContaining Fused Ring Conjugated Organic Molecules and Polymers[J]. Acta Chimica Sinica, 2017, 75(3): 257-270. doi: 10.6023/A16090495

呋喃稠环类共轭有机分子和聚合物研究进展
English
Research Progress of the FuranContaining Fused Ring Conjugated Organic Molecules and Polymers
-
1 引言
呋喃是最简单的含氧五元杂环化合物, 能够从植物中提取, 具有很好的可再生性和可降解性[1].与噻吩相比, 虽然化学结构有些类似, 但由于氧的电负性比硫大, 使得呋喃的电子和光电性质与噻吩有些差别, 同时, 由于氧原子的半径比硫原子的小, 导致位阻也相应的减小, 使得呋喃稠环化合物具有更好的共轭性和平面性.呋喃及其衍生物具有蓝色荧光及较高的量子效率, 易于作发光材料, Bendikov组[2]首次制备了一系列的呋喃齐聚物, 与类似的噻吩齐聚物相比, 呋喃齐聚物具有更高的荧光量子效率, 更高的刚性及溶解性, 最近唐先忠课题组[3]设计并合成了一种以偶氮基呋喃 (EFNFC) 为共轭桥结构的新型生色团分子, 发现其光学性能和热学性能都较好.
图 1为常见的呋喃稠环的基本结构单元, 这些结构单元都被大量地运用在了有机光电材料中, 其中又以苯并二呋喃研究和应用最多, 基于苯并二呋喃的共轭聚合物给体光伏材料在聚合物太阳电池中表现出了优良的性质, 应用前景广阔.
下面我们将按基于呋喃稠环的共轭有机分子 (呋喃稠环小分子化合物) 和基于呋喃稠环的共轭聚合物 (含呋喃稠环的聚合物) 进行分类介绍它们的合成、性质及应用的研究进展.
2 呋喃稠环小分子化合物
2011年, Takimiya研究组[4]以3, 7-二溴-2, 6-二甲氧基萘为原料, 先与乙酸酐反应生成酯, 再通过Sonogashira偶联, 然后在碳酸铯 (CS2CO3) 作用下构建呋喃环, 合成了线型萘并二呋喃NDF和苯取代的萘并二呋喃DPh-NDF (M1), 如图 2所示, 并将它们与噻吩和硒吩的类似物进行对比, 其中, NDF的带隙Eg(3.4 eV) 比其噻吩和硒吩的类似物高0.4 eV, M1的带隙 (3.4 eV) 比其噻吩和硒吩的类似物高0.4 eV, 以这些材料制备场效应晶体管 (FETs), 结果表明, NDF衍生物的空穴迁移率低 (0.6 cm2•V-1•s-1), 可以归因于NDF在薄膜状态下取向不同导致降低了载流子迁移率.同时M1和其相应噻吩和硒吩的类似物与C60的双层膜展现出了典型的有机太阳电池 (OSCs) 的特点, 其中由于M1的最高占据分子轨道 (HOMO) 能级 (-5.5 eV) 较低, 比相应噻吩和硒吩的类似物要低0.2 eV, 使得其开路电压 (Voc) 为三者中最高 (0.69 V), 同时获得了1.31%的能量转换效率 (PCE), 相应噻吩和硒吩的类似物的PCE分别为0.98%和0.83%.
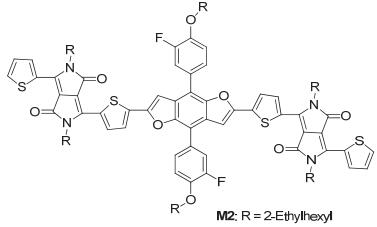
最近, Qian等[5]以苯并二呋喃 (BDF) 为核, 引入苯上带有氟和烷氧链的基团得到了BDF的衍生物, 并与吡咯并吡咯二酮 (DPP) 反应得到了如图 3的小分子化合物M2, M2的HOMO能级为-5.79 eV, 最低未占分子轨道 (LUMO) 能级为-3.77 eV, Eg为2.02 eV, 其噻吩类似物的HOMO能级为-5.80 eV, LUMO能级为-3.83 eV, 带隙为1.97 eV, 采用空间电荷限制电流 (SCLC) 法测得M2薄膜的空穴迁移率达到3.7×10-4 cm2•V-1•s-1, 电子迁移率达到5.0×10-4 cm2•V-1•s-1, 应用在OSC中PCE达到5.5%, 对应的短路电流Jsc=11.4 mA•cm-2, Voc=0.80 V, 填充因子FF=0.60, M2的效率是其噻吩类似物的两倍, 这主要是因为其Jsc是噻吩类似物 (Jsc=5.5 mA• cm-2) 的两倍导致的, M2形貌较好, 有利于激子和电荷的分离, 同时M2的溶解性也要优于噻吩类似物.
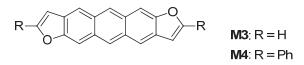
2012年, Nakano等[6]以2, 6-二甲氧基蒽为原料合成了反式蒽并[2, 3-b:6, 7-b']二呋喃anti-ADF (M3) 和二苯取代的反式蒽并[2, 3-b:6, 7-b']二呋喃衍生物DPh-ADF (M4), 如图 4所示, 其合成方法也是邻位乙酰氧基和炔基在碱性条件下构建呋喃环. M3的HOMO能级为-5.1 eV, 与其噻吩和硒吩的类似物的HOMO能级 (-5.0 eV) 相似; M4的FET迁移率为0.6 cm2•V-1•s-1.
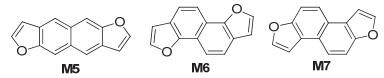
随后, Nakano等[7]发现, 角状的萘并二呋喃 (NDF) 系列的电子结构和它们对应的萘并二噻吩 (NDT) 系列明显不同 (如图 5), 这主要是由于不同最外层芳香环的电子对角状NDF和对应的NDT差异明显, 这种差异的本质可以归因于呋喃和噻吩的芳香性及电负性不同, 且强烈地影响到了整体稠环的电子结构. NDF1 (M5) 的HOMO能级为-5.5 eV, LUMO能级为-2.1 eV, 其类似的噻吩结构的HOMO能级为-5.3 eV, LUMO能级为-2.3 eV; 角状结构NDF3 (M6) 与M5相比, HOMO能级更低一点为-5.6 eV, LUMO能级相同, 而类似的角状噻吩结构的能级都比M6低, 且HOMO能级降到了-5.8 eV, NDF3 (M7) 能级与M6的相似, 但M7的噻吩相似化合物与M6的噻吩相似化合物的能级都要高一些.
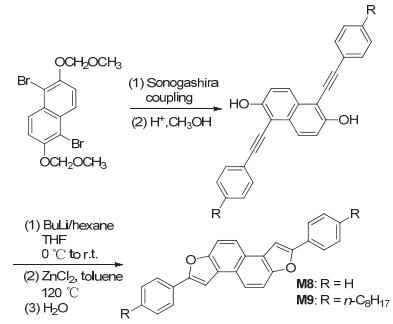
Nakamura研究组[8]以邻位羟基和炔基在碱性条件构建呋喃环, 合成了新型萘并呋喃衍生物DPNDF (M8) 和C8-DPNDF (M9) 的半导体材料 (如图 6), 测试单晶状态下迁移率, 发现基于M8的场效应晶体管 (FET) 的空穴迁移率为1.3 cm2•V-1•s-1, 这是相应的噻吩类似物的1.6倍[9], 烷基链的M9器件的单晶FET空穴迁移率则高达3.6 cm2•V-1•s-1, 同时拥有高的开关比, 这些主要是由于呋喃上氧原子的半径较小, 使得它有紧密的晶体排列, 以及分子间共轭大π轨道而具有小的重组能. M8的HOMO能级为-5.48 eV, M9由于带给电子性的烷基链, 所以其HOMO能级比M8的略高, 达到-5.42 eV.
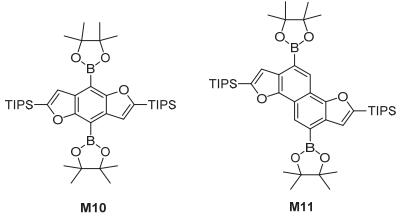
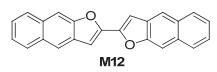
Nakano等[10]合成了如图 7所示的两类α-硅基保护的苯或萘并[1, 2-b:4, 5-b']二呋喃硼酸酯取代物 (M10和M11), 在溴化铜的作用下, 硼酸酯可以转换为溴, 这使得其可以作为半导体材料合成的中间单体得到应用.
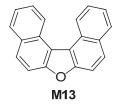
Niimi等[11]合成了2, 2-联萘并[2, 3-b]呋喃 (M12), 如图 8所示, 将它作为有机半导体材料应用于OFETs、有机发光二极管 (OLEDs) 和OSCs中.其FET空穴和电子迁移率分别为0.1和0.04 cm2•V-1•s-1, 应用于OLED得到了蓝绿色的荧光发射, 量子效率为0.88;由于其较低的HOMO能级 (-5.6 eV), 在OSC中用作给体材料得到了器件的Voc高达0.99 V, 得到的PCE为1.15%.其噻吩类似物的HOMO能级更低, 达到-5.73 eV, Eg为2.99 eV与M12的 (3.00 eV) 相近.
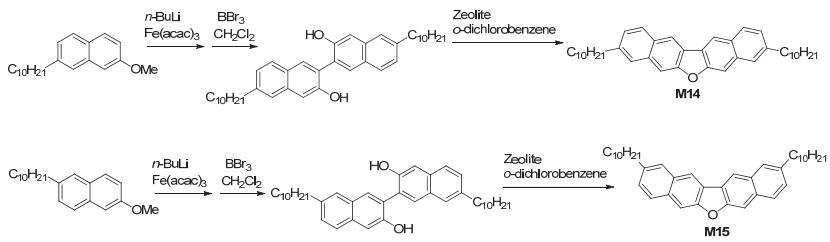
Takeya研究组[12]合成了如图 9所示的二萘基[2, 3-b:2', 3'-d]呋喃衍生物DNF-U (M13), 由于两个外侧苯环间C—H键之间的相互排斥, 该分子具有扭曲的π电子体系, 单晶FET空穴迁移率达1.0 cm2•V-1•s-1.
随后, 该组通过先偶联后脱甲基, 再通过两个羟基脱水构建出呋喃环, 合成出了二萘基[2, 3-b:2', 3'-d]呋喃的衍生物C10-DNF-VW (M14) 和C10-DNF-VV (M15)[13], 如图 10, 它们都发出深蓝色的荧光, 对应的单晶FET空穴迁移率分别为1.1 cm2•V-1•s-1和1.3 cm2•V-1•s-1.
Suraru等[14]以2, 6-Br2-NDI为起始原料, 通过和邻溴苯酚的分子间偶联得到了如图 11的双苯呋喃并萘结构的衍生物anti-BfDI (M16), 得到FET迁移率为0.06 cm2•V-1•s-1.
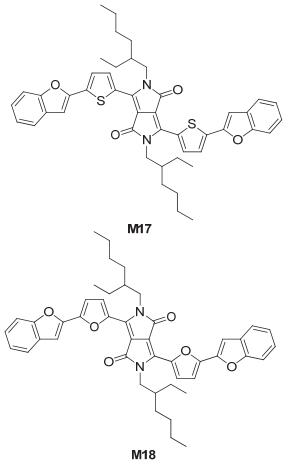
Roncali研究组[15]以苯并呋喃为给体 (D) 单元、DPP为受体 (A) 单元合成了如图 12所示的小分子化合物BFT (M17) 和BFF (M18), M17的HOMO能级为-5.71 eV, LUMO能级为-3.85 eV, Eg为1.76 eV, M18的HOMO能级为-5.69 eV, LUMO能级为-3.86 eV, Eg为1.81 eV; 它们与C60受体制备的双层OSC, M17器件得到的Jsc为7.9 mA•cm-2、Voc为0.72 V、FF为0.39, 达到2.5%的效率, 经过70 ℃, 10 min退火处理后, 其Jsc达到10.01 mA•cm-2, Voc达到0.81 V, FF为0.35, PCE达到3.13%; M18器件的PCE仅为0.30%(Jsc为1.60 mA• cm-2、Voc为0.51 V、FF为0.28), 经过退火处理后, PCE提高到0.80%(Jsc达到3.30 mA•cm-2, Voc达到0.60 V, FF为0.39).
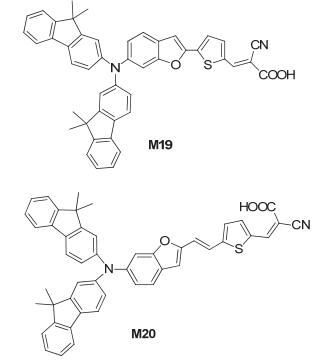
Kang研究组[16]合成了含苯并呋喃的有机染料 (M19和M20), 如图 13所示, 并制备了基于这两种染料的染料敏化太阳电池 (DSSCs) 器件, 其中没有乙烯基桥结构的M19器件获得的性能参数为: Jsc=14.39 mA•cm-2, Voc=0.70 V, FF=0.66, PCE=6.65%; M20器件获得的性能参数为: Jsc=11.43 mA•cm-2, Voc=0.67 V, FF=0.62, PCE=4.70%.
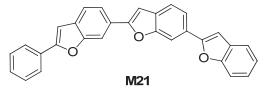
Anderson研究组[17]合成了如图 14所示的苯并呋喃三聚体 (M21), 以其作为发光层制备了单层和双层OLED器件, 结果表明, 双层OLED的性质要优于单层器件, 对于双层器件, 在电压和电流分别为11 V和0.17 mA时, 获得0.23 lm/W的最大流明效率和33 cd/m2的亮度.
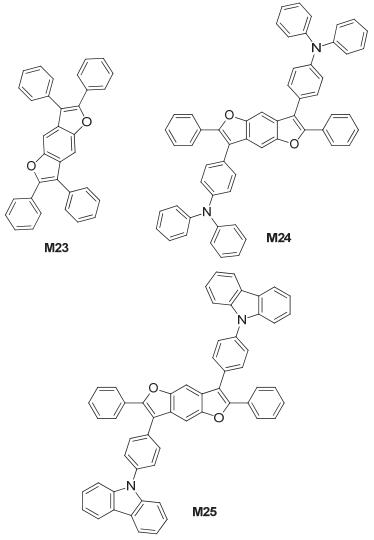
2005年, Hwu等[18]合成了二烯基桥联的苯并呋喃衍生物 (M22), 如图 15所示, 发现其具有高发光量子效率、好的热稳定性以及可以升华的性质.将其掺杂到9, 10-二 (2-萘基) 蒽主体材料中, 制备出了蓝光OLED, 器件启亮电压为3.6 V, 在15.5 V时得到的最大亮度为53430 cd/m2, 流明效率为2.03 lm/W, 最大外量子效率为3.75%, 这些数据说明, 呋喃稠环化合物在制备高效蓝光电致发光材料上具有很大的潜力.
Nakamura研究组[19, 20]合成了三种四芳基取代的苯并[1, 2-b:4, 5-b']二呋喃衍生物TPBDF、DPABDF和CZBDF (M23、M24和M25), 如图 16所示, M23和M24用作OLED的空穴传输材料, 制备了绿光器件, 所得到的流明效率分别为2.6 lm/W和2.2 lm/W, 用渡越时间法 (TOF) 测得的空穴迁移率分别为6.4×10-4 cm2•V-1•s-1和2.8×10-3 cm2•V-1•s-1, 在BDF的侧链引入咔唑基团得到M25, 其HOMO能级为-5.52 eV, LUMO能级为-2.20 eV, 测得M25的TOF空穴迁移率为3.7×10-3 cm2•V-1• s-1, 电子迁移率为4.4×10-3cm2•V-1•s-1, 这些结果充分证明呋喃稠环衍生物是一类优良的空穴传输材料.
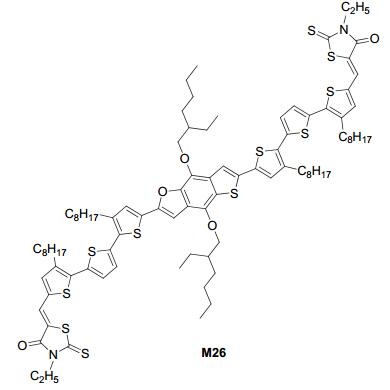
最近, 我们课题组[21]报道了基于噻吩苯并呋喃 (TBF) 的不对称小分子R3T-TBFO (M26), 如图 17所示, 其SCLC空穴迁移率达到1.37×10-4 cm2•V-1•s-1, 电子迁移率达到9.88×10-4 cm2•V-1•s-1, 经过热退火和溶剂蒸汽退火处理后太阳电池转换效率达到6.32%, 其对应的Jsc=9.87 mA•cm-2, Voc=0.89 V, FF=0.72.
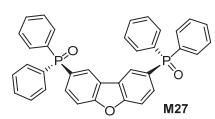
Sapochak研究组[22]合成出2, 8位连接两个二苯氧膦基的二苯并[b, d]呋喃衍生物 (M27), 如图 18所示, 二苯并呋喃衍生物比苯并二呋喃衍生物三线态能量更高, 所以常用作OLED材料, 该二苯并[b, d]呋喃衍生物的三线态能级ET=3.14 eV, 并用作发光层中的电子传输材料和空穴阻挡材料制备了蓝光OLED, 当使用20% FIrpic掺杂, 在电流和电压分别为70 mA•cm-2和3.6 V时, 获得10.1%的最高外量子效率和25.9 lm/W的最大流明效率.
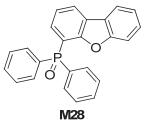
Xu研究组[23]合成了二苯基氧膦与二苯并[b, d]呋喃衍生物o-DBFPPO (M28), 如图 19, 其三线态能级ET=3.15 eV, 以其制备了蓝光OLED, 启亮电压为2.6 V, 流明效率36 lm/W, 外量子效率15.5%.
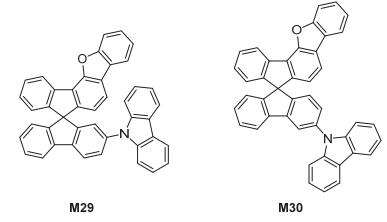
2012年, Lee研究组[24]合成了两种二苯并[b, d]呋喃小分子材料BFF1和BFF2 (M29和M30), 如图 20, 它们的热稳定性较好, M29和M30的三线态能级分别为2.70 eV和2.71 eV, HOMO能级分别为-6.06 eV和-6.09 eV, LUMO能级分别为-2.53 eV和-2.54 eV, 以它们制备了绿光OLED, 最大外量子效率分别为19.7%和18.6%.
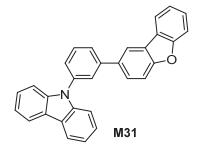
随后, Lee研究组[25]通过苯环的间位取代将咔唑和二苯并[b, d]呋喃连接起来, 制备出CzDBF (M31), 如图 21. M31的三线态能级为2.82 eV, 以其制备的OLED的最大外量子效率为23.9%, 亮度为18 cd/m2.
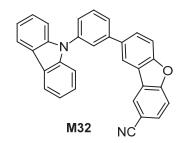
Li研究组[26]通过在M31上引入强吸电子基团CN基合成了m-CzOCN (M32), 如图 22, 其三线态能量为2.89 eV, 较高的三线态能量使得其可以用作蓝光OLED的主体材料, 基于M32制作的OLED的流明效率为21.9 lm/W, 外量子效率为15.3%, 并且器件具有稳定性高的特点, M32的噻吩类似物的流明效率为23.4 lm/W, 外量子效率为23.3%.
3 含呋喃稠环的聚合物
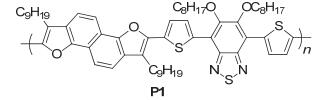
我们课题组[27]在2012年报道了呋喃环上带烷基链的NDF衍生物, 以该衍生物为给体单元, 合成得到了聚合物PNDFTBT (P1), 如图 23, 测得其HOMO能级为-5.27 eV, LUMO能级为-3.50 eV, Eg为1.77 eV, 利用SCLC法测得平均空穴迁移率达到了7.4×10-2 cm2• V-1•s-1, FET空穴迁移率为1.3×10-2 cm2•V-1•s-1, 应用在OSC中得到了4.5%的转换效率, 对应的Jsc=9.96 mA•cm-2, Voc=0.73 V, FF=0.618, 这是首次将含NDF衍生物的聚合物应用在OSC中.
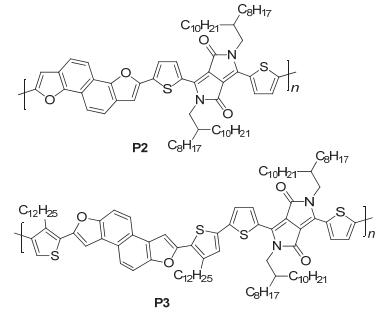
Wang研究组[28]以NDF3为给体单元, DPP为受体单元制备了聚合物PNDF3-T-DPP和PNDF3-BT-DPP (P2和P3), 如图 24, P2和P3的HOMO/LUMO能级分别为-5.18 eV/-3.57 eV和-5.17 eV/-3.54 eV, 它们用作OFET的活性层时, P2的FET空穴迁移率为0.24 cm2•V-1•s-1, 经退火处理后达到0.56 cm2•V-1•s-1, P3的空穴迁移率为0.11 cm2•V-1•s-1, 经退火处理后达到0.35 cm2•V-1•s-1, 这比相应的含噻吩基聚合物的迁移率要高三个数量级.
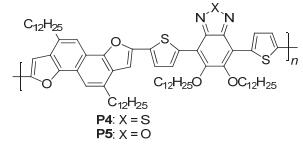
随后, 该研究组[29]继续以NDF3为给体单元, BT或苯并噁二唑 (BO) 为受体单元制备了聚合物P (NDF3-BT)和P (NDF3-BO) (P4和P5), 如图 25, P4的HOMO能级为-5.29 eV, LUMO能级为-3.46 eV, Eg为1.83 eV, FET空穴迁移率为0.26 cm2•V-1•s-1, 其噻吩类似物的HOMO能级为-5.32 eV, LUMO能级为-3.46 eV, Eg为1.86 eV, 空穴迁移率为0.27 cm2•V-1•s-1; P5的HOMO能级为-5.35 eV, LUMO能级为-3.46 eV, Eg为1.90 eV, 空穴迁移率为0.20 cm2•V-1•s-1, 其噻吩类似物的HOMO能级为-5.39 eV, LUMO能级为-3.47 eV, Eg为1.92 eV, FET空穴迁移率为0.32 cm2•V-1•s-1.
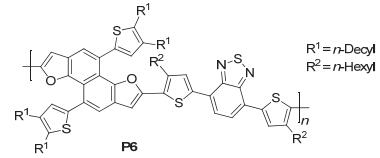
研究表明, 在对BDT结构单元进行修饰时, 将二维共轭结构引入到BDT骨架上, 可以得到更低的HOMO能级和更高的电荷迁移率, 这样可能得到性能更好的化合物[30~33].由于BDF结构单元与BDT结构单元的性质类似, 研究人员在BDF上引入噻吩和苯等芳香基团, 得到二维BDF衍生物, 拓宽BDF类材料的吸收范围并使得其共轭性得到增加. Sun研究组[34]以NDF3的衍生物为给体单元, 二噻吩苯并噻二唑 (DTBT) 为受体单元, 制备了聚合物PNDFT-DTBT (P6), 如图 26. P6的HOMO能级为-5.35 eV, LUMO能级为-3.44 eV, 基于P6制备的太阳电池 (BHJ) 表现出优良的光伏性质, 得到的性能参数为: Jsc=8.21 mA•cm-2, Voc=0.89 V, FF=0.72, PCE=5.22%.
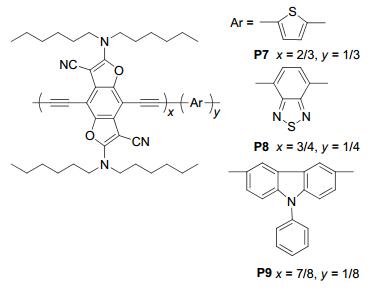
2010年, Li等[35]首次合成了以BDF衍生物与噻吩、苯并噻二唑或咔唑衍生物的共聚物PBT、PBB和PBP (P7、P8和P9), 如图 27所示, 它们在250~700 nm的范围内存在一定强度的吸收, 并且它们的能量带隙都较小, P7为1.86 eV (HOMO能级-5.06 eV, LUMO能级-3.20 eV), P8为1.64 eV (HOMO能级-5.25 eV, LUMO能级-3.61 eV), P9为1.82 eV (HOMO能级-5.18 eV, LUMO能级-3.36 eV).但它们应用在太阳电池上有最高效率的P7也只达到0.59% (Jsc=3.10 mA•cm-2, Voc=0.53 V, FF=0.35), 可能与其分子量不高有关.
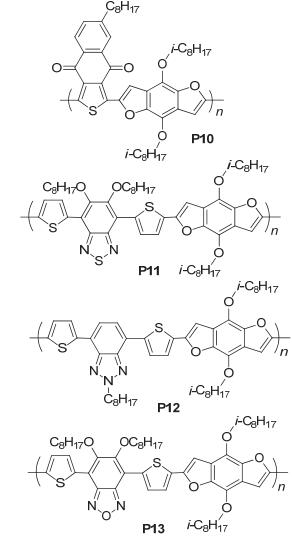
我们课题组[36]通过在BDF核上引入烷氧链得到了烷氧基的BDF衍生物, 并以该衍生物为给体单元与萘并[2, 3-c]噻吩-4, 9-酮 (NTDO) 为受体单元合成得到聚合物PBDFNTDO (P10), 如图 28, 测得该聚合物的SCLC空穴迁移率达到5.0×10-3 cm2•V-1•s-1, HOMO能级和LUMO能级分别为-5.33 eV和-3.40 eV, 应用在太阳电池上得到了4.71%的转化效率, 对应的Jsc=9.14 mA•cm-2, Voc=0.87 V, FF=0.59, 其Voc较高主要是因为P10的HOMO能级较低, 其效率接近噻吩类似物 (2.27%) 的两倍, 表明BDF衍生物是很好的给体单元.后来我们组[37]又将BDF衍生物与不同的受体单元共聚得到三种聚合物: PBDFDODTBT、PBDFDTBTz和PBDFDTBO (P11、P12和P13), 如图 28, P11与PC71BM混合得到了高的SCLC空穴迁移率: 6.72×10-2 cm2• V-1•s-1, P12和P13的SCLC空穴迁移率分别为3.69×10-3和2.25×10-4cm2•V-1•s-1, 这主要是由于P11的结构平面性大并且π-π堆积紧密导致的, 将它们应用在太阳电池上, 三者的HOMO、LUMO能级值比较相近 (P11: HOMO能级-5.12 eV, LUMO能级-3.38 eV, P12: HOMO能级-5.02 eV, LUMO能级-3.06 eV, P13: HOMO能级-5.19 eV, LUMO能级-3.49 eV), 但由于其构筑P12的电子受体单元吸电子能力较弱, P12的薄膜吸收比其他两者要蓝移60 nm, P11获得的最高效率为4.5%, 其对应的性能参数为: Jsc=9.87 mA•cm-2, Voc=0.69 V, FF=0.653, 而P12和P13得到的效率分别为1.24% (Jsc=4.92 mA•cm-2, Voc=0.44 V, FF=0.575) 和2.88% (Jsc=5.04 mA•cm-2, Voc=0.82 V, FF=0.70), 这主要可能是由于相对较低的空穴迁移率和蓝移的吸收所导致的.
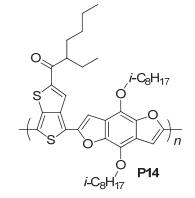
随后我们组[38]又报道了以带烷氧链的BDF衍生物为给体单元, 噻吩并[3, 4-b]噻吩 (TT) 为受体单元的D-A型聚合物PBDFTT-C (P14), 如图 29, 该聚合物具有较好的溶解性, 并且它的HOMO能级较低为-5.27 eV, LUMO能级为-3.69 eV, 在300 nm到840 nm范围有一个比较强的吸收, 能隙为1.48 eV, 测得SCLC空穴迁移率为5.4×10-3 cm2•V-1•s-1, 经过170 ℃退火处理后, SCLC空穴迁移率提高到了7.0×10-3 cm2•V-1•s-1, 将其应用在太阳电池中, 在没有添加1, 8-二碘辛烷 (DIO) 时的效率仅为2.35%, 添加3% DIO作为添加剂后获得4.4%的效率, 对应的Jsc=10.45 mA•cm-2, Voc=0.66 V, FF=0.64, 这主要是由于加入添加剂后共混膜的给/受体相分离尺寸变小, 膜表面形貌更好, 有利于电荷的分离和传输, 使得FF和Jsc得到提高.
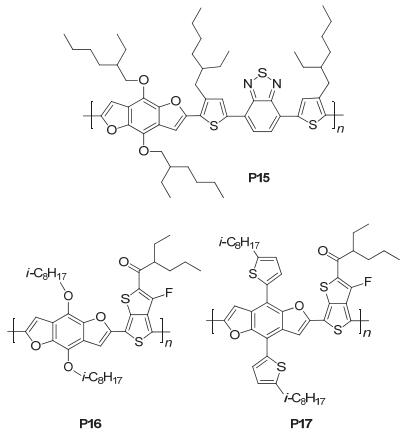
Hou研究组[39]以BDF衍生物为给体单元, 噻吩为π桥, DTBT为受体单元, 合成了一种窄带隙聚合物PBDFDTBT (P15), P15的HOMO能级-5.12 eV, LUMO能级-3.38 eV, 测得SCLC空穴迁移率为8.96×10-4cm2•V-1•s-1, 将其应用在太阳电池中, 经过退火处理后, 得到的性能参数为: Jsc=11.77 mA•cm-2, Voc=0.78 V, FF=0.546, PCE=5.01%.随后, 该组[40]又以不同BDF衍生物为给体单元, 通过对TT进行修饰, 引入强吸电子的氟原子得到TT-CF为受体单元, 进行聚合得到聚合物PBDFTT-CF-O和PBDFTT-CF-T (P16和P17), 如图 30, P16的HOMO能级-4.98 eV, LUMO能级-3.18 eV, Eg为1.80 eV, P17的HOMO能级-5.21 eV, LUMO能级-3.20 eV, Eg为2.01 eV; 测得P16和P17与PC71BM共混的SCLC空穴迁移率分别为5.76×10-2 cm2•V-1•s-1和0.128cm2•V-1•s-1, 可以看出P17的空穴迁移率要明显高于P16的, 这说明二维结构有利于分子的电荷传输; 并研究了它们应用在太阳电池中的相关性能, P16得到的性能参数为: Jsc=13.87 mA•cm-2, Voc=0.63 V, FF=0.597, PCE=5.22%, P17得到的性能参数为: Jsc=13.04 mA•cm-2, Voc=0.78 V, FF=0.598, PCE=6.26%, 表明P17上带有烷基噻吩基团形成的二维共轭结构使得其比带有烷氧基的P16的分子间的平面性和共轭性更强, 获得的HOMO能级更低、空穴迁移率更高, 最终导致P17的效率高于P16.
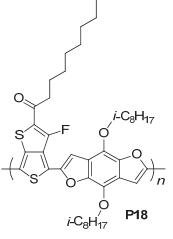
2014年, 我们课题组与斯坦福大学戴宏杰教授课题组[41]合作将含苯并二呋喃基聚合物用在了近红外Ⅱ生物成像上.以苯并二呋喃为D单元合成D-A交替共聚物pDA (P18), 如图 31, 该聚合物的荧光发射波长在约1050 nm, 具有较大的斯托克斯位移 (约400 nm) 和高荧光量子产率 (约1.7%), 这个荧光量子产率要远远高于碳纳米管[42](约0.4%), 使得在一个更短的曝光时间 (约20 ms) 内获得动态影像, 同时, 可实时跟踪小鼠后肢动脉血流量, 这表明呋喃稠环基聚合物在高时间和高空间分辨率的NIR-Ⅱ成像上也有很大的应用前景.
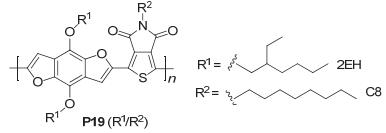
Beaujuge研究组[43]通过用不同的烷氧基取代合成不同的BDF衍生物作为给体单元, 与噻吩[3, 4-c]并吡咯-4, 6-酮 (TPD) 作为受体单元聚合得到聚合物P19, 如图 32, 并制备了基于该聚合物的太阳电池, 研究发现, 当TPD上的烷基链不同时, 其溶解性和电池性能都有所不同, 所连的直链有8个碳时, 聚合物的溶解性较好, 而连的直链碳为7、9或10个碳时, 所得到的聚合物溶解性较差, 使得它们的Jsc降低, 导致它们的效率较低, 所以PBDFTPD(2EH/C8) (P19) 获得了最好的效率, 该聚合物的分子间没有明显的π-π堆积, 即没有明显的自组装, 其在没有任何添加剂的条件下得到的性能参数为: Jsc=11.2 mA•cm-2, Voc=0.97 V, FF=0.68, PCE=7.4%, 但在使用了1-氯萘 (CN)5%作为添加剂后, 该聚合物电池的效率反而有所下降, 这主要是由于加入CN作为添加剂后, 聚合物与PC71BM共混膜的形貌发生了变化, 减弱了膜的分散性所导致的.同时, 他们还合成了与P19类似的噻吩聚合物来比较BDF衍生物与BDT衍生物的性能, 在无任何添加剂的条件下, P19类似的噻吩聚合物的PCE达到了7.0%, 在使用了5%的CN作为添加剂后PCE达到了7.1%, 效率都比P19的略低, 同时, P19和其噻吩类似物的SCLC空穴迁移率分别为2.3×10-4cm2•V-1•s-1和1.9×10-4 cm2•V-1•s-1, P19和其噻吩类似物的LUMO能级相同 (-3.44 eV), 但P19的HOMO能级 (-5.41 eV) 比其噻吩类似物的 (-5.29 eV) 低, 使得P19拥有更高的Voc, 表明BDF衍生物是一种良好的电子给体材料.随后, Mateker等[44]研究发现, BDT与TPD所得到的聚合物在同一平面上, BDF与TPD所得到的聚合物不在同一平面上, P19的光稳定性比其噻吩类似物的稍差.
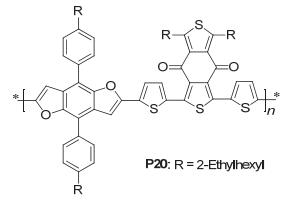
Huo研究组[45]通过在BDF上引入2-乙基己基苯得到BDF衍生物与T1聚合, 得到聚合物PBDF-T1 (P20), 如图 33, 该聚合物具备二维结构, 使得共轭性更强, 有利于电荷的传输, P20的FET空穴迁移率 (0.014 cm2• V-1•s-1) 是其噻吩类似物的两倍, P20的HOMO/LUMO能级为-5.43 eV/-3.54 eV, 其噻吩类似物的HOMO/LUMO能级为-5.32 eV/-3.52 eV, 基于P20的太阳电池, 当无任何添加剂时, 得到2.64%的效率, 通过添加1%的DIO添加剂效率增加到9.43%, 其对应的性能参数为: Jsc=13.28 mA•cm-2, Voc=0.92 V, FF=0.774, 这主要归因于加了添加剂后P20的电荷迁移率有所提高.其噻吩类似物在聚合物太阳电池中达到了8.12%的效率, 对应的性能参数为: Jsc=13.13 mA•cm-2, Voc=0.86 V, FF=0.718.
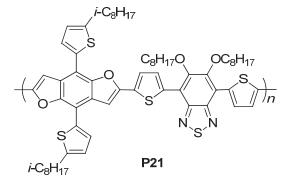
我们课题组[46]通过在BDF核上引入噻吩烷基链得到了BDF衍生物BDFT, 并与受体单元DTBT聚合得到了聚合物PBDFTDTBT (P21), 如图 34, 该聚合物在薄膜状态下得到了一个较宽的吸收带, 从300 nm到730 nm都有吸收, P21的HOMO能级、LUMO能级和Eg分别为-5.21 eV、-3.11 eV和2.10 eV.将其应用在太阳电池中得到的性能参数为: Jsc=12.04 mA•cm-2, Voc=0.76 V, FF=0.65, PCE=6.0%, 其较高的Jsc与FF主要得益于其良好的空穴迁移率.用在FETs中[47], 空穴迁移率达到0.05 cm2•V-1•s-1, 开关比为4.6×105.
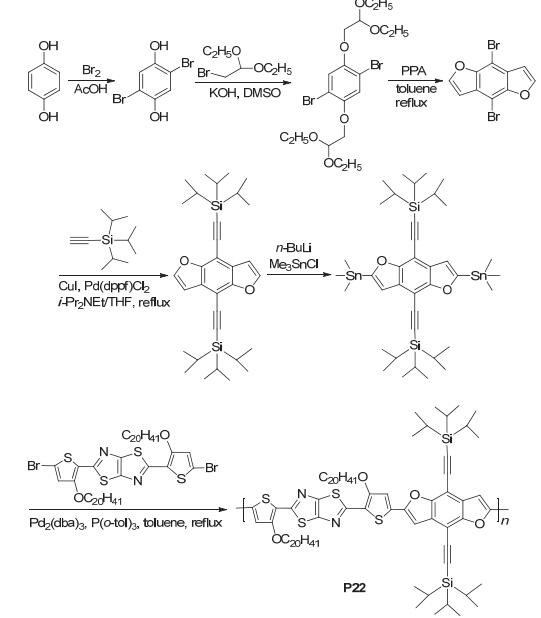
Tang等[48]改进了合成BDF核的方法, 如图 35所示, 使得合成条件更加温和, 制备出了含BDF衍生物的聚合物P22, 其HOMO能级为-5.31 eV, LUMO能级为-3.61 eV, 将其应用在太阳电池中得到的性能参数为: Jsc=9.81 mA•cm-2, Voc=0.80 V, FF=0.587, PCE=4.61%, 这比相应的噻吩类似物的PCE=4.33% (Jsc=9.77 mA•cm-2, Voc=0.89 V, FF=0.498) 要略高[49], 对比发现, 主要是P22的FF要高于噻吩类似物的, 这可能是因为氧原子的半径比硫的小, 堆积紧密, 电荷迁移率提高所导致.
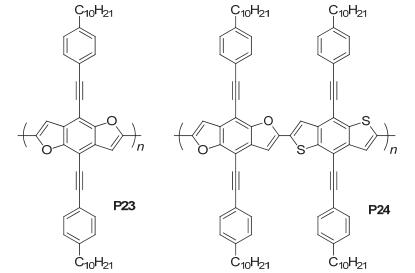
Sista等[50]在BDF上引入苯乙炔癸基, 设计合成了一种新的聚合物P23, 同时与他们之前所制备的噻吩类似物的聚合物[51]进行对比.此外, 还设计合成了BDF和BDT单元交替的聚合物P24(图 36), 研究发现P23 (-5.39 eV) 和P24 (-5.30 eV) 的HOMO能级比P23噻吩类似物 (-5.10 eV) 的HOMO能级低, 这是因为氧原子半径较小、电负性较强, 较弱的C—O共价键使得呋喃单元有较弱的给电子性, 所以导致BDF单元的HOMO能级更低, P23和P24的LUMO能级分别为-3.32 eV和-3.26 eV, P23噻吩类似物的LUMO能级为-3.05 eV, 当m(polymer):m(PC71BM)=1:1时, 测得P23和P24的电池效率分别为1.19% (Jsc=3.71 mA• cm-2, Voc=0.83 V, FF=0.39) 和0.64% (Jsc=2.13 mA• cm-2, Voc=0.81 V, FF=0.37), P23比P24效率高的主要原因是P24的骨架上拥有不同的氧原子和硫原子, 导致聚合物的共轭性降低.此外, 在BDF上引入sp杂化的吸电子性强的腈基碳, 在侧链上用二烃基氨修饰, 可提高电荷的迁移率[52, 53].
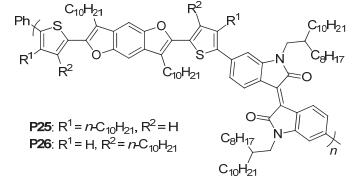
和传统的在苯环上引入基团不同, Kobilka等[54]在BDF核的呋喃环上引入了烷基基团, 并与在噻吩的不同位置取代有烷基链的基团相连, 得到了一种富电子的Tin/outBDF单元, 为了研究它们的光伏性能的变化, 作者设计合成了两种聚合物PToutBDFID和PTinBDFID (P25和P26), 如图 37, P25和P26拥有相同的HOMO能级 (-5.7 eV)、LUMO能级 (-3.8 eV) 和Eg(1.9 eV), 电池性能P25 (PCE=0.301%, Jsc=1.306 mA•cm-2, Voc=0.641 V, FF=0.36) 比P26 (PCE=0.590%, Jsc=1.66 mA•cm-2, Voc=0.7366 V, FF=0.486) 要差.
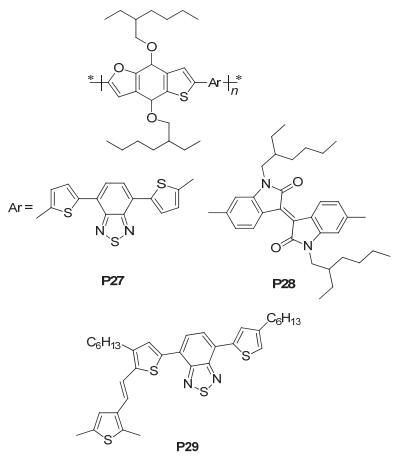
Aeschi等[55]合成出了噻吩[2, 3-f]苯并呋喃 (TBF) 衍生物, 并将其与不同的受体单元聚合, 得到了三种聚合物12a、12b、12c (P27、P28和P29), 如图 38所示, P27、P28和P29的HOMO/LUMO能级分别为-5.15 eV/ -2.78 eV、-5.19 eV/-3.44 eV和-5.34 eV/-2.96 eV, 测得P27、P28和P29的SCLC迁移率分别为1.83× 10-5 cm2•V-1•s-1、1.12×10-5 cm2•V-1•s-1和1.77×10-6 cm2•V-1•s-1, 但它们应用在太阳电池上的效果并不太理想, 其中P27得到的性能参数为: Jsc=4.73 mA•cm-2, Voc=0.60 V, FF=0.38, PCE=1.08%; P28: Jsc=0.79 mA• cm-2, Voc=0.59 V, FF=0.30, PCE=0.14%; P29: Jsc=1.31 mA•cm-2, Voc=0.61 V, FF=0.39, PCE=0.31%.
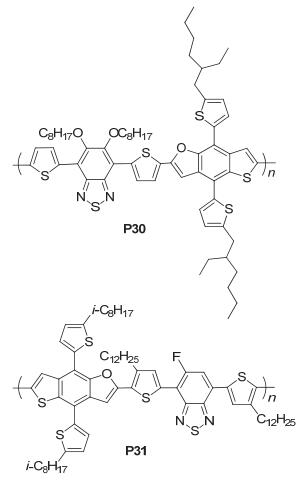
我们组[56]对TBF为核的相关衍生物做了一系列的研究, 2014年报道了在TBF核上引入噻吩烷基链的TBF衍生物并与烷氧基苯并噻二唑衍生物聚合, 得到了聚合物PTBFTDTBT (P30), 如图 39, 该聚合物具有分子量大、吸光范围广和溶解性好等优点, 其HOMO能级为-5.20 eV, LUMO能级为-3.57 eV, 测得P30的SCLC空穴迁移率为2×10-3 cm2•V-1•s-1, 经过150 ℃退火10 min处理后, 空穴迁移率增加到了1.53×10-2 cm2•V-1•s-1, 将其应用在太阳电池中, 得到的效率高达6.42%, 其对应的性能参数为: Jsc=13.51 mA•cm-2, Voc=0.78 V, FF=0.61;随后, 通过在苯并噻二唑上引入氟和在噻吩上引入烷基链来探究不同的受体单元对TBF衍生物的影响, 合成出了聚合物TBFBT[57] (P31), 测得HOMO/LUMO能级为-5.11 eV/-3.49 eV, 应用在太阳电池中得到了4.1%的效率, 当添加3%的DIO后, 测得SCLC空穴迁移率2.2×10-3 cm2•V-1•s-1, 效率增加到6.1%, 其对应的Jsc=14.4 mA•cm-2, Voc=0.68 V, FF=0.62.
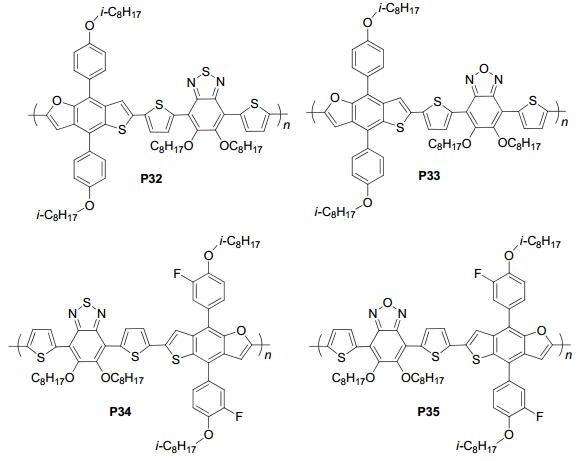
2015年, 我们课题组[58]又报道了在TBF核上引入带烷氧链苯基团的TBFP, 将其与不同的受体单元聚合, 得到了PTBFP-BT和PTBFP-BO (P32和P33), 如图 40, 它们与PC71BM混合得到的SCLC空穴迁移率分别为9.12×10-4cm2•V-1•s-1和2.49×10-4cm2•V-1•s-1, P32和P33的HOMO/LUMO能级分别为-5.47 eV/-3.55 eV和-5.61 eV/-3.65 eV, 将它们应用在太阳电池中获得的性能参数分别为: P32: PCE=6.02%, Jsc=12.57 mA•cm-2, Voc=0.71 V, FF=0.68, P33: PCE=4.41%, Jsc=9.79 mA•cm-2, Voc=0.81 V, FF=0.56, 这主要是因为P32的空穴迁移率更高并且形貌更好导致其Jsc和FF更高.随后, 通过在TBFP的苯环上引入强吸电能力的氟原子合成出了两种聚合物TBFPF-BT和TBFPF-BO[59] (P34和P35), 如图 40, P34和P35的HOMO/LUMO能级分别为-5.28 eV/-3.60 eV和-5.38 eV/-3.69 eV, 测得P34和P35的SCLC空穴迁移率分别为2.70×10-5cm2•V-1•s-1和2.55×10-5cm2• V-1•s-1, 将它们应用在太阳电池中, 添加1% DIO后P34和P35分别得到了6.8% (Jsc=12.12 mA•cm-2, Voc=0.80 V, FF=0.71) 和5.98% (Jsc=10.35 mA•cm-2, Voc=0.89 V, FF=0.65) 的效率, 可见氟原子的引入大大提高了其转化效率.
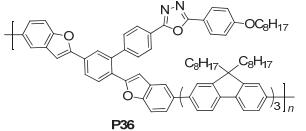
Zhang等[60]合成了一种无定型态的苯并呋喃-联三芴交替共聚物PBF-OXD (P36), 如图 41, 该共聚物具有良好的光热稳定性, 单层蓝光发光二极管具有稳定的蓝光发射, 启亮电压为5.3 V, 最大亮度1400 cd/m2, 最大发光效率0.95 cd/A.
4 总结与展望
呋喃稠环衍生物具有载流子迁移率高、荧光量子效率高和溶解性好的特点, 特别是基于BDF单元的共轭有机小分子和共轭聚合物给体光伏材料普遍具有较低的HOMO能级、较高的空穴迁移率和较宽的光学吸收, 其中许多材料表现出高的光伏效率, 在相同条件下有些材料甚至比基于BDT单元的光伏材料性能更好, 表现出良好的前景[61].但也存在稳定性差、不易制备和合成产率低等缺点, 在一定程度上限制了其发展和应用.从目前研究来看, 未来呋喃稠环化合物的研究主要集中在以下几个方面: (1) 设计合成新的呋喃稠环化合物, 目前研究较多的是BDF单元结构的呋喃稠环化合物; (2) 设计合成稳定的呋喃稠环体系, 呋喃稠环存在一定的稳定性的问题, 增大共轭性有利于增加其稳定性; (3) 发展并拓展呋喃稠环基有机/聚合物的应用, 目前, 呋喃稠环化合物较多的运用在光电领域, 其聚合物在生物近红外成像上也表现出了优良的性能, 所以对呋喃稠环化合物也可以进行其它应用研究; (4) 优化合成路线, 呋喃在未成稠环前稳定性较差, 给合成带来一定难度, 可以考虑最后并出呋喃环, 同时, 使路线更简单、更绿色.
-
-
[1]
Gidron, O.; Dadvand, A.; Sheynin, Y.; Bendikov, M.; Perepichka, D. F. Chem. Commun. 2011, 47, 1976. doi: 10.1039/C0CC04699J
-
[2]
Gidron, O.; Diskin-Posner, Y.; Bendikov, M. J. Am. Chem. Soc. 2010, 132, 2148. doi: 10.1021/ja9093346
-
[3]
陈垒, 唐翔, 贾坤, 唐先忠, 有机化学, 2016, 36, 2197. doi: 10.6023/cjoc201601005Chen, L.; Tang, X.; Jia, K.; Tang, X. Z. Chin. J. Org. Chem. 2016, 36, 2197. doi: 10.6023/cjoc201601005
-
[4]
Nakano, M.; Mori, H.; Shinamura, S.; Takimiya, K. Chem. Mater. 2011, 24, 190.
-
[5]
Qian, D.; Liu, B.; Wang, S.; Himmelberger, S.; Linares, M.; Vagin, M.; Salleo, A. J. Mater. Chem. A 2015, 3, 24349. doi: 10.1039/C5TA06501A
-
[6]
Nakano, M.; Niimi, K.; Miyazaki, E.; Osaka, I.; Takimiya, K. J. Org. Chem. 2012, 77, 8099. doi: 10.1021/jo301438t
-
[7]
Nakano, M.; Shinamura, S.; Houchin, Y.; Osaka, I.; Miyazaki, E.; Takimiya, K. Chem. Commun. 2012, 48, 5671. doi: 10.1039/c2cc31546g
-
[8]
Mitsui, C.; Soeda, J.; Miwa, K.; Tsuji, H.; Takeya, J.; Nakamura, E. J. Am. Chem. Soc. 2012, 134, 5448. doi: 10.1021/ja2120635
-
[9]
Shinamura, S.; Osaka, I.; Miyazaki, E.; Nakao, A.; Yamagishi, M.; Takeya, J.; Takimiya, K. J. Am. Chem. Soc. 2011, 133, 5024. doi: 10.1021/ja110973m
-
[10]
Nakano, M.; Shinamura, S.; Sugimoto, R.; Osaka, I.; Miyazaki, E.; Takimiya, K. Org. Lett. 2012, 14, 5448. doi: 10.1021/ol302521d
-
[11]
Niimi, K.; Mori, H.; Miyazaki, E.; Osaka, I.; Kakizoe, H.; Takimiya, K.; Adachi, C. Chem. Commun. 2012, 48, 5892. doi: 10.1039/c2cc31960h
-
[12]
Nakahara, K.; Mitsui, C.; Okamoto, T.; Yamagishi, M.; Miwa, K.; Sato, H.; Takeya, J. Chem. Lett. 2013, 42, 654. doi: 10.1246/cl.130133
-
[13]
Nakahara, K.; Mitsui, C.; Okamoto, T.; Yamagishi, M.; Matsui, H.; Ueno, T.; Hirose, Y. Chem. Commun. 2014, 50, 5342. doi: 10.1039/C3CC47577H
-
[14]
Suraru, S. L.; Burschka, C.; Würthner, F. J. Org. Chem. 2013, 79, 128.
-
[15]
Ripaud, E.; Demeter, D.; Rousseau, T.; Boucard-Cétol, E.; Allain, M.; Po, R.; Leriche, P.; Roncali, J. Dyes Pigm. 2012, 95, 126. doi: 10.1016/j.dyepig.2012.03.021
-
[16]
Jung, I.; Lee, J. K.; Song, K. H.; Song, K.; Kang, S. O.; Ko, J. J. Org. Chem. 2007, 72, 3652. doi: 10.1021/jo0625150
-
[17]
Anderson, S.; Taylor, P. N.; Verschoor, G. L. Chem.-Eur. J. 2004, 10, 518. doi: 10.1002/(ISSN)1521-3765
-
[18]
Hwu, J. R.; Chuang, K. S.; Chuang, S. H.; Tsay, S. C. Org. Lett. 2005, 7, 1545. doi: 10.1021/ol050196d
-
[19]
Tsuji, H.; Mitsui, C.; Ilies, L.; Sato, Y.; Nakamura, E. J. Am. Chem. Soc. 2007, 129, 11902. doi: 10.1021/ja074365w
-
[20]
Tsuji, H.; Mitsui, C.; Sato, Y.; Nakamura, E. Adv. Mater. 2009, 21, 3776. doi: 10.1002/adma.v21:37
-
[21]
Qiu, B.; Yuan, J.; Zou, Y.; He, D.; Peng, H.; Li, Y.; Zhang, Z. Org. Electron. 2016, 35, 87. doi: 10.1016/j.orgel.2016.05.010
-
[22]
Vecchi, P. A.; Padmaperuma, A. B.; Qiao, H.; Sapochak, L. S.; Burrows, P. E. Org. Lett. 2006, 8, 4211. doi: 10.1021/ol0614121
-
[23]
Han, C.; Xie, G.; Xu, H.; Zhang, Z.; Xie, L.; Zhao, Y.; Huang, W. Adv. Mater. 2011, 23, 2491. doi: 10.1002/adma.201100322
-
[24]
Jeon, S. O.; Lee, J. Y. J. Mater. Chem. 2012, 22, 10537. doi: 10.1039/c2jm30473b
-
[25]
Lee, C. W.; Yook, K. S.; Lee, J. Y. Org. Electron. 2013, 14, 1009. doi: 10.1016/j.orgel.2013.01.025
-
[26]
Deng, L.; Li, J.; Wang, G. X.; Wu, L. Z. J. Mater. Chem. C. 2013, 1, 8140. doi: 10.1039/c3tc31893a
-
[27]
Liu, B.; Chen, X.; He, Y.; Xiao, L.; Li, Y.; Zhou, K.; Zou, Y. RSC Adv. 2013, 3, 5366. doi: 10.1039/c3ra40268a
-
[28]
Shi, S.; Xie, X.; Gao, C.; Shi, K.; Chen, S.; Yu, G.; Wang, H. Macromolecules 2014, 47, 616. doi: 10.1021/ma402107n
-
[29]
Shi, S.; Shi, K.; Chen, S.; Qu, R.; Wang, L.; Wang, M.; Wang, H. J. Polym. Sci., Part A:Polym. Chem. 2014, 52, 2465. doi: 10.1002/pola.v52.17
-
[30]
Huo, L.; Hou, J.; Zhang, S.; Chen, H. Y.; Yang, Y. Angew. Chem., Int. Ed. 2010, 49, 1500. doi: 10.1002/anie.200906934
-
[31]
Huo, L.; Liu, T.; Sun, X.; Cai, Y.; Heeger, A. J.; Sun, Y. Adv. Mater. 2015, 27, 2938. doi: 10.1002/adma.v27.18
-
[32]
Yuan, J.; Zou, Y.; Cui, R.; Chao, Y. H.; Wang, Z.; Ma, M.; Xiao, D. Macromolecules 2015, 48, 4347. doi: 10.1021/acs.macromol.5b00564
-
[33]
Qiu, B.; Yuan, J.; Xiao, X.; He, D.; Qiu, L.; Zou, Y.; Li, Y. ACS Appl. Mater. Interfaces 2015, 7, 25237. doi: 10.1021/acsami.5b07066
-
[34]
Li, S.; Yuan, Z.; Deng, P.; Sun, B.; Zhang, Q. Polym. Chem. 2014, 5, 2561. doi: 10.1039/c3py01458d
-
[35]
Li, H.; Jiang, P.; Yi, C.; Li, C.; Liu, S. X.; Tan, S.; Decurtins, S. Macromolecules 2010, 43, 8058. doi: 10.1021/ma101693d
-
[36]
Chen, X.; Liu, B.; Zou, Y.; Xiao, L.; Guo, X.; He, Y.; Li, Y. J. Mater. Chem. 2012, 22, 17724. doi: 10.1039/c2jm32843g
-
[37]
Liu, B.; Chen, X.; Zou, Y.; Xiao, L.; Xu, X.; He, Y.; Li, Y. Macromolecules 2012, 45, 6898. doi: 10.1021/ma301053q
-
[38]
Liu, B.; Chen, X.; Zou, Y.; He, Y.; Xiao, L.; Xu, X.; Li, Y. Polym. Chem. 2013, 4, 470. doi: 10.1039/C2PY20580G
-
[39]
Huo, L.; Huang, Y.; Fan, B.; Guo, X.; Jing, Y.; Zhang, M.; Hou, J. Chem. Commun. 2012, 48, 3318. doi: 10.1039/c2cc17708k
-
[40]
Huo, L.; Ye, L.; Wu, Y.; Li, Z.; Guo, X.; Zhang, M.; Hou, J. Macromolecules 2012, 45, 6923. doi: 10.1021/ma301254x
-
[41]
Hong, G.; Zou, Y.; Antaris, A. L.; Diao, S.; Wu, D.; Cheng, K.; Wu, J. Z. Nat. Commun. 2014, 5.
-
[42]
Hong, G.; Lee, J. C.; Robinson, J. T.; Raaz, U.; Xie, L.; Huang, N. F.; Dai, H. Nat. Med. 2012, 18, 1841. doi: 10.1038/nm.2995
-
[43]
Warnan, J.; Cabanetos, C.; Labban, A. E.; Hansen, M. R.; Tassone, C.; Toney, M. F.; Beaujuge, P. M. Adv. Mater. 2014, 26, 4357. doi: 10.1002/adma.v26.25
-
[44]
Mateker, W. R.; Heumueller, T.; Cheacharoen, R.; Sachs-Quintana, I. T.; McGehee, M. D.; Warnan, J.; Bazan, G. C. Chem. Mater. 2015, 27, 6345. doi: 10.1021/acs.chemmater.5b02341
-
[45]
Huo, L.; Liu, T.; Fan, B.; Zhao, Z.; Sun, X.; Wei, D.; Yu, M.; Liu, Y.; Sun, Y. Adv. Mater. 2015, 27, 6969. doi: 10.1002/adma.201503023
-
[46]
Liu, B.; Qiu, B.; Chen, X.; Xiao, L.; Li, Y.; He, Y.; Zou, Y. Polym. Chem. 2014, 5, 5002. doi: 10.1039/C4PY00392F
-
[47]
Huang, W.; Yang, B.; Sun, J.; Liu, B.; Yang, J.; Zou, Y.; Gao, Y. Org. Electron. 2014, 15, 1050. doi: 10.1016/j.orgel.2014.02.020
-
[48]
Bian, L.; Hai, J.; Zhu, E.; Yu, J.; Liu, Y.; Zhou, J.; Tang, W. J. Mater. Chem. A 2015, 3, 1920. doi: 10.1039/C4TA06140C
-
[49]
Shi, Q.; Fan, H.; Liu, Y.; Hu, W.; Li, Y.; Zhan, X. Macromolecules 2011, 44, 9173. doi: 10.1021/ma2019683
-
[50]
Sista, P.; Huang, P.; Gunathilake, S. S.; Bhatt, M. P.; Kularatne, R. S.; Stefan, M. C.; Biewer, M. C. J. Polym. Sci., Part A:Polym. Chem. 2012, 50, 4316. doi: 10.1002/pola.v50.20
-
[51]
Sista, P.; Nguyen, H.; Murphy, J. W.; Hao, J.; Dei, D. K.; Palaniappan, K.; Dastoor, P. C. Macromolecules 2010, 43, 8063. doi: 10.1021/ma101709h
-
[52]
Xiang, A.; Li, H.; Chen, S.; Liu, S. X.; Decurtins, S.; Bai, M.; Liao, J. Nanoscale 2015, 7, 7665. doi: 10.1039/C5NR00402K
-
[53]
Li, Z.; Li, H.; Chen, S.; Froehlich, T.; Yi, C.; Schönenberger, C.; Borguet, E. J. Am. Chem. Soc. 2014, 136, 8867. doi: 10.1021/ja5034606
-
[54]
Kobilka, B. M.; Dubrovskiy, A. V.; Ewan, M. D.; Tomlinson, A. L.; Larock, R. C.; Chaudhary, S.; Jeffries-EL, M. Chem. Commun. 2012, 48, 8919. doi: 10.1039/c2cc34070d
-
[55]
Aeschi, Y.; Li, H.; Cao, Z.; Chen, S.; Amacher, A.; Bieri, N.; Liu, S. X. Org. Lett. 2013, 15, 5586. doi: 10.1021/ol402787d
-
[56]
Fan, L.; Cui, R.; Guo, X.; Qian, D.; Qiu, B.; Yuan, J.; Li, Y.; Huang, W.; Yang, J.; Liu, W.; Xu, X.; Li, L.; Zou, Y. J. Mater. Chem. C 2014, 2, 5651. doi: 10.1039/c4tc00738g
-
[57]
Cui, R.; Zou, Y.; Xiao, L.; Hsu, C. S.; Keshtov, M. L.; Godovsky, D. Y.; Li, Y. Dyes Pigm. 2015, 116, 139. doi: 10.1016/j.dyepig.2015.01.021
-
[58]
Qiu, B.; Cui, R.; Yuan, J.; Peng, H.; Zhang, Z.; Li, Y.; Zou, Y. Phys. Chem. Chem. Phys. 2015, 17, 17592. doi: 10.1039/C5CP02127H
-
[59]
He, D.; Qiu, L.; Zhang, Z.; Li, Y.; Pan, C.; Zou, Y. RSC Adv. 2016, 6, 62923. doi: 10.1039/C6RA09791J
-
[60]
Zhang, H.; Guo, E.; Fang, Y.; Ren, P.; Yang, W. J. Polym. Sci., Part A:Polym. Chem. 2009, 47, 5488. doi: 10.1002/pola.v47:20
-
[61]
潘雪雪, 霍利军, 有机化学, 2016, 36, 687. doi: 10.6023/cjoc201512028Pan, X. X.; Huo, L. J. Chin. J. Org. Chem. 2016, 36, 687. doi: 10.6023/cjoc201512028
-
[1]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 18
- 文章访问数: 3247
- HTML全文浏览量: 633





 下载:
下载:








































 下载:
下载:

