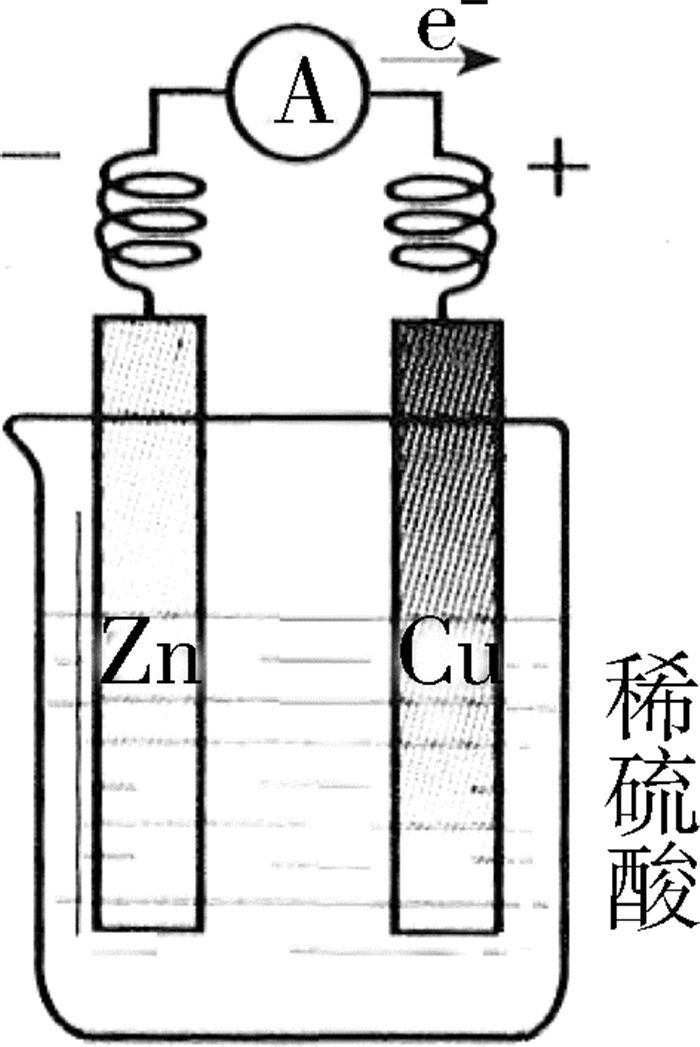
 图 1
铜锌单液原电池
Figure 1.
opper-zinc (mercury) single liquid primary battery
图 1
铜锌单液原电池
Figure 1.
opper-zinc (mercury) single liquid primary battery

Citation: WANG Jin-Long, JV Dong-Sheng. Discussion on Problems of Copper-Zinc Primary Battery[J]. Chinese Journal of Chemical Education, 2016, 37(21): 75-77. doi: 10.13884/j.1003-3807hxjy.2014090040

有关铜锌原电池的问题讨论
English
Discussion on Problems of Copper-Zinc Primary Battery
-
Key words:
- copper-zinc primary battery
- / bubble
- / electrode potential
- / electrolytic bridge
- / corrosion of zinc
- / self-discharge
-
1 提出问题
利用铜锌原电池讲解原电池工作原理,是中学化学实验教学的传统经典案例[1-2]。然而,在实验过程中正极铜片上产生气泡的同时,负极锌片上也有气泡产生。面对锌片上为什么产生气泡的疑问,接受咨询的许多教师不约而同地将锌片不纯作为首要因素。虽然承认在实验中无法避免锌片上的气泡,但在假设使用纯度极高的锌也会产生气泡原因的追问下,他们认为这种现象与原电池反应原理相悖。事实果真如此吗?这“异常”的气泡与后续“化学反应原理”模块中的铜锌原电池之间又存在着怎样的联系[3-5]?为此,作如下分析说明。
2 原电池工作原理
电化学上将化学能转化为电能的装置称为原电池。原电池工作原理既包括电极材料与电解质溶液间的氧化还原反应,也包括通过一定的方法(装置、电极材料、电解质溶液等)将负极释放出的电子尽可能多地提供到外电路形成电流,以改变化学能转化为电能的效率。
2.1 铜锌硫酸型原电池
(1)普通的氧化还原反应
将金属锌放入稀硫酸中,可以看到锌表面不断有气泡冒出,并放出热量,其化学反应方程式如下:
在此反应中,锌原子把电子直接给了在溶液中与之接触的氢离子,被氧化成锌离子,进入溶液;而氢离子在锌片上直接得到电子被还原成氢气(相当于短路,所以反应时有热量放出),得不到电流。从原电池的角度分析,这是一种无效的化学反应,在实际应用中应尽量避免。
(2)铜锌单液相原电池
如图 1所示,将铜片与锌片用导线连接(导线中间接入一个电流表),平行插入盛有稀硫酸的烧杯中,观察到铜片和锌片上均有气泡冒出,电流表指针发生偏转,说明利用这个装置能将化学能转化为电能。
负极反应(锌):Zn-2e-→Zn2+,
2H++2e-→H2↑
正极反应(铜):2H++2e-→H2↑
此时,对于锌片的变化,苏教版教材描述为“可以看到锌片不断溶解”[3],而人教版教材只字未提[4],这直接导致中学教师将锌片上的气泡视为“异常”现象,便顺理成章地将其解释为锌不纯所致。至此,可作如下推论:氢离子在铜片上析氢的同时也在锌(不纯)片上析氢。
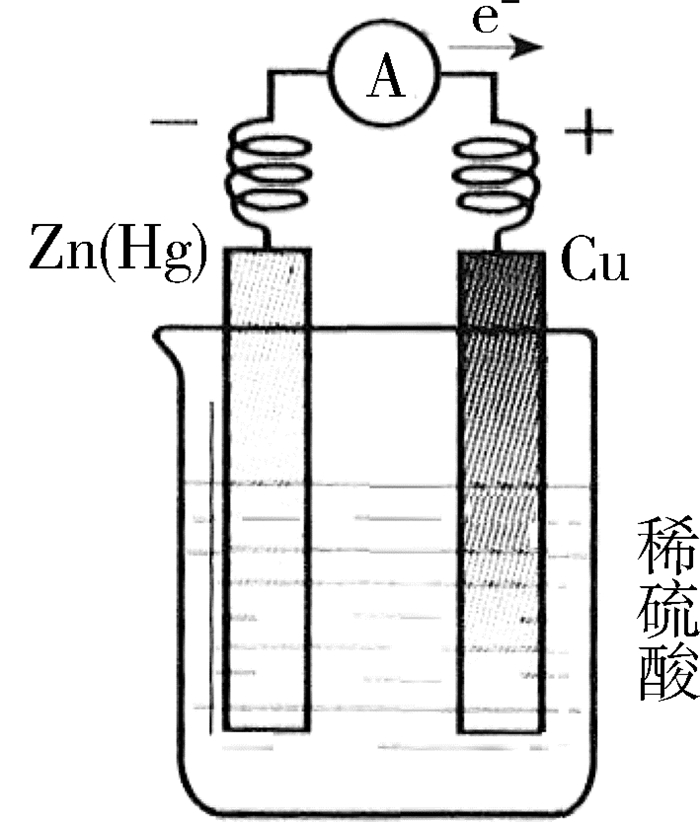
(3)铜锌(汞)单液相原电池
如图 2所示,在铜锌单液相原电池的基础上,将锌片放入氯化汞溶液中片刻,取出、洗净,锌片表面覆盖有一层锌汞合金(简称锌汞齐),进行同样的实验。实验中观察到铜电极上有气泡冒出,锌(汞)电极上没有气泡,电流表指针发生偏转,说明利用这个装置能将化学能转化为电能。
负极反应(锌汞合金):Zn-2e-→Zn2+
正极反应(铜):2H++2e-→H2↑
上述事例说明,通过原电池装置可以将普通的氧化还原反应设计为原电池。比较2种原电池反应的现象,不禁要问,在均形成电流的情况下为什么锌(汞)电极上没有气泡产生?
上述3个化学反应能自发进行的原因是相同的,即ΔE=E(H+/H2)-E(Zn2+/Zn)=0-(-0.76)=0.76(V)(暂不考虑析氢的速率),但由于氢离子在金属锌、铜、汞表面析氢时存在着超电极电位(反电极电位),其超电极电位依次为0.7、0.23、0.78 V[6],提高了析氢的“门槛”,所以相对于单独的锌,铜锌原电池易与稀硫酸反应;锌(汞)电极上没有气泡产生,是因为氢离子在汞表面有较高的超电极电位。
人们不仅关注如何将化学能转化为电能,而且追求其转化效率,也就是让锌释放出的电子尽可能多地传输到外电路形成电流而避免氢离子直接在锌片上得到电子,利用锌(汞)做电极具有明显的优势。例如,在相当长的时期内,人们利用氯化汞与干电池的锌皮表面形成锌汞齐薄层,抑制锌的腐蚀,减少自放电[7]。但由于废旧电池中的金属汞对自然环境(地下水资源)的危害极大,目前这种生产工艺已遭淘汰。
综上所述,试作出如下推断:锌(汞)电极可减少氢离子直接在负极得到电子的可能,但这种方法已遭淘汰。
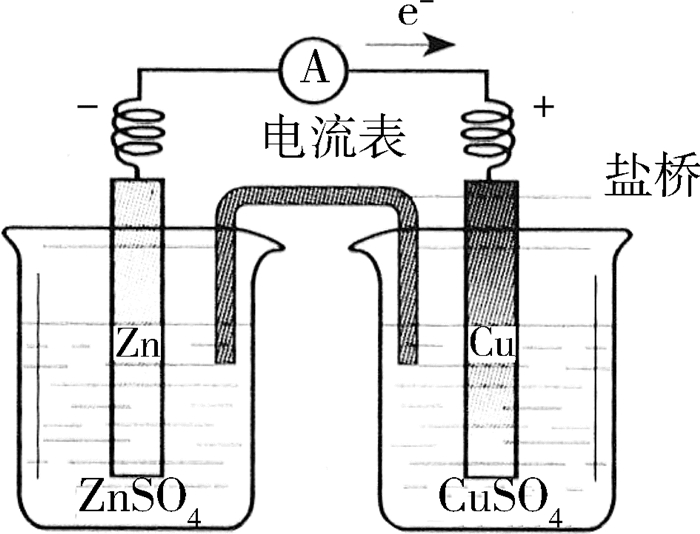
2.2 铜锌双液相原电池
如图 3所示,用一个充满电解质的盐桥,将置有铜片的硫酸铜溶液与置有锌片的硫酸锌溶液连接起来。然后将铜片与锌片用导线连接,并在中间串联一个电流表。实验中观察到电流表指针发生偏转,说明这个装置是一种原电池。
负极反应(锌):Zn-2e-→Zn2+
正极反应(铜):Cu2++2e-→Cu
依据实验现象,可作出如下推论:虽然双液相原电池装置比较复杂,但它的转化效率更高[4],原因就在于负极材料与相对应的盐溶液接触,避免了其自放电的可能,且原电池的工作时间长,形成的电流也稳定许多。
3 铜锌双液相原电池的改进
如果将连接电极的导线称为电子通路,那么盐桥就是电解质溶液的离子通路。通过盐桥将2个独立的半电池连接起来,为离子的迁移提供“桥梁”。制作盐桥需要使用琼脂或琼胶作凝固剂,但琼脂自身是非离子型物质,需要同时掺入电解质。具体做法如下:将2 g琼脂和4 g KCl放入100 mL蒸馏水中,加热煮沸后,趁热倒入U型管中,冷却即制得盐桥。
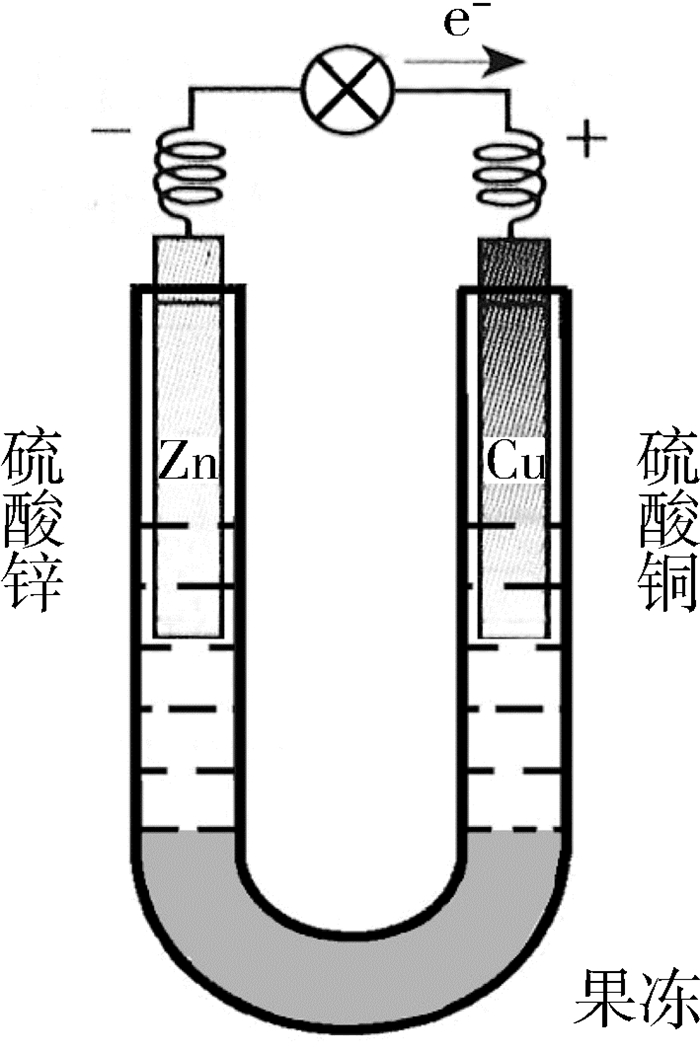
儿童食品果冻的主要成分是琼脂,可以使用果冻制作盐桥对原实验装置作适当的改进。
如图 4所示,将半粒喜之郎牌香橙味果冻(每袋6粒)和2 mL饱和氯化钾溶液放入U型管中,用沸水浴加热1 min后,冷却,果冻凝聚成型。在U型管的两端分别放入饱和硫酸锌溶液、锌片与饱和硫酸铜溶液、铜片。然后将铜片与锌片用导线连接,并在中间串联一个音乐贺卡。实验中贺卡发出音乐声,说明这个装置是一种原电池。
改进后的实验设计不仅简化了原电池装置,制作盐桥的材料易得,而且琼脂凝胶的用量减少,电池内阻减小,提高了原电池的效率。同时,使用生活物品果冻、贺卡进行实验,会使学生对科学研究产生亲近感。
4 问题讨论
面对由于锌不纯造成其表面出现气泡的说法,问题是气泡只是因为锌片不纯吗?假设这种观点成立,那么采用纯度极高的锌就应该没有气泡了。然而,锌与硫酸直接接触,虽然存在超电极电位(0.7 V),但仍存在一定的电极电位差(0.76 V-0.7 V=0.06 V),氢离子能够在锌片上析氢,也就是氢离子同时在锌片和铜片上析氢不存在任何理论障碍(暂不考虑析氢的速率)。在寻找到纯度极高的锌之前,不妨改变一下解决问题的思路:如果将纯或不纯锌与酸的直接反应描述为锌的腐蚀,那么铜锌硫酸型原电池(必修模块)与铜锌双液相原电池(选修模块)的递进脉络就清晰可见。教师可以理直气壮地告诉学生,气泡是锌电极副反应的产物,它浪费了电极材料(锌),如何避免产生气泡以提高原电池的工作效率呢?会在以后的学习中告诉大家。同时,建议中学化学教材将铜锌硫酸型原电池中“锌片上产生气泡”的现象明确地描述出来。
5 结论
在铜锌硫酸型原电池中,无论金属锌纯与不纯(不含汞),负极锌片上都有气泡(氢气)冒出。这是正常的实验现象,也是一种宝贵的教学资源。
6 教学启示
(1)电化学反应原理只受一个因素所制约的实例是很少的。如锌与其他金属单质构成原电池时,其反应限度的变化不能一概而论。
(2)人们必须经历多个样例才能获得对化学概念的全面理解。铜锌原电池、干电池、水果电池、燃料电池,包括蓄电池等,都是学生认识和掌握电化学原理的学习素材。
(3)只注重知识点的内部属性(内涵),忽视甚至排斥同类化学原理中不同知识点间的联系、区别与转换(外延),常会形成顾此失彼、非黑即白的片面认识,如溴乙烷的消去反应[8]、铁的析氢腐蚀等[9]。
-
-
[1]
王祖浩.普通高中课程标准实验教科书:化学2(必修). 4版.南京:江苏教育出版社, 2007:40-41
-
[2]
宋心琦.普通高中课程标准实验教科书:化学2(必修). 2版.北京:人民教育出版社, 2007:40-41
-
[3]
王祖浩.普通高中课程标准实验教科书:化学反应原理(选修). 2版.南京:江苏教育出版社, 2007:12-13
-
[4]
宋心琦.普通高中课程标准实验教科书:化学反应原理(选修4). 3版.北京:人民教育出版社, 2007:71-72
-
[5]
王磊, 陈光巨.普通高中课程标准实验教科书:化学反应原理(选修). 3版.济南:山东科学技术出版社, 2007:21
-
[6]
严宣申.中学化学教学参考, 1991(Z1):10 http://www.cnki.com.cn/Article/CJFDTotal-ZHHJ1991Z1003.htm
-
[7]
无汞电池[EB/OL].[2014-08-15].http://baike.so.com/doc/1579657.html
-
[8]
王金龙, 丁爱军.化学教育, 2009, 30(2):62-64 http://www.hxjy.org/CN/abstract/abstract1671.shtml
-
[9]
王金龙, 鞠东胜.化学教育, 2016, 37(9):58-61 http://www.hxjy.org/CN/abstract/abstract9913.shtml
-
[1]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 6611
- HTML全文浏览量: 2571


 下载:
下载:



 下载:
下载:

