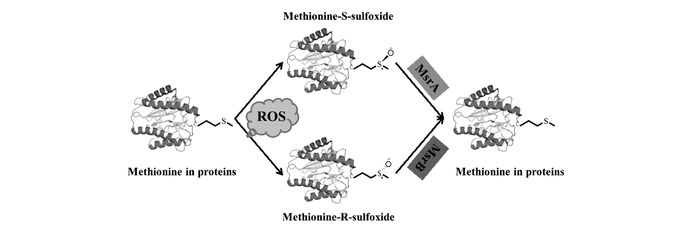
 图1
蛋氨酸的氧化还原途径[7]
Figure1.
Redox pathway of methionine[7]
图1
蛋氨酸的氧化还原途径[7]
Figure1.
Redox pathway of methionine[7]

Citation: XU Yulin, LIU Chunrong. Research Progress on Fluorescence Detection of Methionine Sulfoxide/Methionine Sulfoxide Reductases[J]. Chinese Journal of Applied Chemistry, 2018, 35(1): 21-27. doi: 10.11944/j.issn.1000-0518.2018.01.170338

蛋氨酸亚砜/蛋氨酸亚砜还原酶荧光检测研究进展
English
Research Progress on Fluorescence Detection of Methionine Sulfoxide/Methionine Sulfoxide Reductases
-
生物体内氧气在正常代谢时经过不完全还原可生成活性氧化合物(ROS,Reactive Oxygen Species),主要包括超氧阴离子自由基(O2·-)、过氧化氢(H2O2)、过氧亚硝基阴离子(ONOO-)、次氯酸(HClO)、单线态氧(1O2)和羟基自由基(HO·)等[1-2]。ROS可以与一系列生物分子作用,引起氧化损伤或者影响许多信号转导过程,调控细胞增殖、分化和凋亡,同时,ROS也与一系列的疾病,如心脑血管疾病、癌症、阿尔兹海默症以及渐冻症(ALS)等疾病的发生、发展和治疗密切相关。
细胞内主要的两种含硫氨基酸半胱氨酸(Cys)和蛋氨酸(Met)对活性氧非常敏感,其硫原子极易被氧化。近年来关于半胱氨酸(Cys)荧光检测的综述已见报道[3],本文重点介绍蛋氨酸及其还原酶的荧光检测。在生理条件下,蛋白质蛋氨酸残基可被活性氧氧化修饰,生成两种立体构型(R-,S-)的蛋白质蛋氨酸亚砜(MetO)残基。由于过氧化氢对蛋氨酸的氧化速率仅为半胱氨酸的25%,蛋白质半胱氨酸残基的氧还依赖型可逆氧化修饰一直以来被认为是活性氧信号转导的中枢机制。然而,近些年的研究表明强力活性氧物种如次氯酸等对半胱氨酸和蛋氨酸的氧化速率基本相当,且有证据表明蛋白质蛋氨酸亚砜化可以调控蛋白质的结构和功能并影响相关的信号通路,蛋白质蛋氨酸亚砜化及其生理功能和病理功能的研究也越来越受到科学家们的关注[4]。
蛋氨酸亚砜还原酶(Msrs)是目前唯一确定的蛋白质蛋氨酸亚砜残基特征性还原酶,能够将蛋氨酸亚砜还原为蛋氨酸,起到调节蛋白质的功能、调控相关信号通路、修复氧化损伤蛋白、防止氧化应激等作用[5](图 1)。如果体内存在过量的活性氧,蛋氨酸亚砜也可进一步氧化生成蛋氨酸砜(MetO2),并使其氧化损伤程度加大,影响一系列的生理和病理过程[6]。目前,关于蛋白质蛋氨酸残基亚砜化的研究尚处于起步阶段,其详细调控机制、生理学功能和病理学功能等尚不十分明确,蛋白质蛋氨酸亚砜化(MetO)和Msrs活性检测方法的发展对这些研究工作具有非常重要的意义。荧光分析法具有操作简单、灵敏度高、选择性好、不需破坏细胞等优点,被广泛应用于活体内重要物质的研究,目前已有数个课题组尝试将荧光分析法用于检测细胞蛋白质蛋氨酸亚砜化和Msrs活性。本文将对MetO和Msrs的结构和催化机理进行初步介绍,并对最近发展的MetO及Msrs荧光探针进行了小结和展望。
1 蛋氨酸亚砜简介
Met又称甲硫氨酸,是人体必需氨基酸之一,参与蛋白质的合成,是蛋白质的重要组成氨基酸之一。如前所述,由于低价硫原子极易被氧化,大多数ROS对蛋白质的作用被认为是由Met残基与Cys残基介导的。在生理和病理条件下,ROS能氧化蛋白质Met残基生成两种MetO,即R-MetO和S-MetO(图 1)[7]。相较于蛋白质Cys残基的氧化产物,作为一种更为稳定的氧化产物,MetO是氧化应激的重要标志物之一,也是更具有吸引力的氧化应激评估生物标志物[6]。同时,蛋白质蛋氨酸亚砜化也是一种重要的蛋白质翻译修饰,可以作为蛋白质功能调控开关,影响某些信号通路以及相关的细胞活动和生理活动[8-10]。例如,有证据表明蛋白质Met残基的定点可逆亚砜化可以调控钙调蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinase,CaMKII)的活性和肌动蛋白聚合[4]。然而,由于目前尚未发现能够与MetO发生特异性化学反应的分子,有效的定量检测体内和体外蛋白质MetO含量的检测方法仅有一例基因编码型(genetically coded)荧光探针,其特异性抗体也尚未被发现,这大大限制了蛋白质Met残基亚砜化研究的进行。
2 蛋氨酸亚砜还原酶简介
蛋氨酸亚砜还原酶(Msrs)又称甲硫氨酸亚砜还原酶,是一种重要的抗氧化酶和修复蛋白,广泛存在于大多数原核和真核生物中如细菌和人类等。目前,生物体内已经发现的也是研究最多的Msrs主要有蛋氨酸亚砜还原酶A(MsrA)和蛋氨酸亚砜还原酶B(MsrB)两种[11]。MsrA能够特异性地还原蛋白质和游离的S-MetO,而MsrB只能还原蛋白质中的R-MetO(图 1)。此外,科学家们在原核和单细胞真核生物中分离到了只能还原游离MetO的游离蛋氨酸R型亚砜还原酶(fRMsr);在细菌中分离到的二甲亚砜还原酶家族中的含有钼辅因子的部分成员如生物素亚砜还原酶(biotin sulfoxide reductase,BisC)也被发现可以承担Msrs的功能并还原游离的S-MetO;而最近几年从细菌周质中分离鉴定的一种钼酶则可还原几乎所有类型的MetO,包括蛋白质中的和游离的(R-,S-)MetO,是细菌外壁对抗有害蛋白质过氧化的“致命武器”。
2.1 蛋氨酸亚砜还原酶催化机理
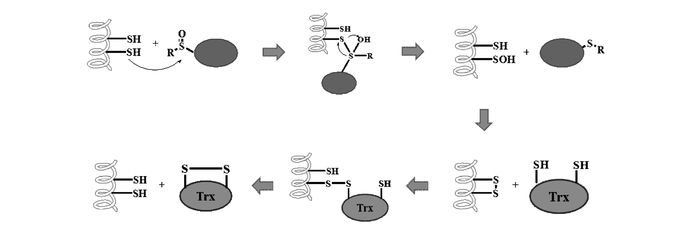
尽管MsrA和MsrB的结构和序列不同,但是它们的催化机理相似,主要包括3个过程:首先Msrs中具有催化活性的巯基与MetO发生亲核反应生成次磺酸中间体,MetO被还原为Met;然后次磺酸基团与Msrs中另一个巯基发生反应生成Msrs内二硫键;最后二硫键被还原剂硫氧还蛋白(Trx)还原,Msrs的结构和功能恢复,继续参加下一个催化循环(图 2)[5, 12-13]。此外,谷氧还蛋白/谷胱甘肽也可以还原某些特定的Msrs二硫键并使其结构与功能恢复;而二硫苏糖醇(DTT)则常被用作Msrs体外再生试剂。
2.2 蛋氨酸亚砜还原酶与衰老和疾病的关系
研究表明,细胞、植物和果蝇中过表达的MsrA可提高其机体的抗氧化应激能力[14-16],体内MsrA过表达的果蝇的寿命是正常果蝇的两倍,而MsrB过表达则对果蝇的寿命无影响[17]。MsrA的含量也与细胞衰老和老化有关,随着细胞的衰老和动物的老龄化,MsrA的表达会下降[18],这种下降与老化过程中氧化蛋白质的积累有关,改善机体MsrA的表达水平将有望用于临床对抗衰老。Msrs的表达水平和活力与许多神经退行性疾病(帕金森症[19-20]、阿兹海默症[21-22])和癌症[23]等的发生、发展以及治疗密切相关。有效的检测MsrsA活性的工具对于这些疾病的早期诊断、病理研究以及药物开发具有十分重要的意义。
传统的Msrs活性检测的方法主要有:高效液相色谱[24]、液闪计数仪法[25]和液质联用[26]。这些方法大都存在操作复杂,破坏细胞结构等缺点。荧光分析法则是一种常用的活性分子快速、原位、实时检测方法,可高时空分辨地快速检测被分析物,避免破坏生物样品,可克服传统检测方法的缺陷。
3 荧光探针的发展
3.1 蛋氨酸亚砜荧光探针的发展
由于除了Msrs外,科学家们尚未发现其他的可以特异性地与MetO反应的化学物质,Gladyshev等[13, 27]基于Msrs还原MetO的反应机理,通过基因编码发展了目前唯一的蛋白质MetO荧光探针MetSOx和MetROx。硫氧还蛋白中的一个Cys残基突变为丝氨酸后,通过基因编码的方式分别与荧光蛋白、Msrs依次接连形成潜在的探针底物。根据Msrs的催化机制,他们设想探针底物与MetO反应将按以下途径进行:MetO与探针底物的Msr部分反应并在Msr内部生成二硫键,随之与Trx部分的巯基反应,在Msr部分和Trx部分之间形成二硫键,由于Trx中另外一个半胱酸残基已被突变为丝氨酸,Msr部分和Trx部分之间的二硫键将有可能是稳定的二硫键。他们希望这个跨蛋白二硫键能改变荧光蛋白的荧光性质并由此实现MetO的荧光检测。在对一系列不同发射波长的荧光蛋白进行筛选后,作者发现只有酵母黄色荧光蛋白cpYFP6的性质随Msr-Trx之间二硫键的形成而发生变化。
基于此,通过基因编码分别在cpYFP6的N端连接MsrA、MrsB,C端连接相对应的Trx1、Trx3可以合成得到荧光传感器MetSOx和MetROx,分别检测S-MetO和R-MetO(图 3)。探针MetSOx存在两个荧光激发波长(425和505 nm),对应同一个荧光发射波长(510~516 nm)。而当S-MetO加入与探针作用并形成Msr-Trx二硫键之后,505 nm波长激发对应的荧光发射强度增加,405 nm波长激发对应的荧光发射强度基本不变。利用二者荧光强度比值(F505/F425)的变化,可实现S-MetO的荧光检测(F505/F425随着S-MetO浓度的增加而增加)。与MetSOx相类似,MetROx也存在两个激发波长(410和500 nm)以及相对应的同一个发射波长(510~516 nm),与R-MetO反应后,410 nm波长激发对应的荧光发射强度增加,500 nm波长激发对应的荧光发射强度降低,F500/F410随着R-MetO浓度的增加而降低。MetSOx和MetROx对MetO的检测具有响应时间短(<3 min),灵敏性高的优点。MetSOx检测游离的和蛋白质中的蛋氨酸亚砜的半饱和浓度均为1.0 μmol/L,而MetROx对蛋白质中和游离的MetO的半饱和浓度分别为1.0和450 μmol/L,这与MrsA可同时还原蛋白质中和游离的MetO,而MrsB只能还原蛋白质中的MetO的理论相一致。同时,这两个探针对各种氧化剂也显示了一定的选择性:二者基本上不与氧化型谷胱甘肽作用;对过氧化氢的影响也较弱;MetSOx对次氯酸钠具有较强的响应,而MetROx则基本不受次氯酸钠影响。
这两种荧光传感器MetSOx和MetROx分别与大肠杆菌共孵育后,加入游离的MetO进行荧光测试,MetSOx的荧光比值(F505/F425)发生明显上升,MetROx的荧光比值(F500/F410)明显下降,成功验证了它们可以应用于复杂生命体系。而移除MetO后,其荧光比值发生了相反的变化,说明胞内MetO对MetSOx和MetROx的氧化是可逆的。与MetROx相比,MetSOx对MetO具有更快的响应速度和较低的检测浓度。尽管如此,MetSOx荧光强度较弱,既无法区分MetO处理的野生型、ΔMsrA突变和ΔMsrB突变细菌细胞,也不能对哺乳动物细胞HEK293内源性的MetO进行荧光成像实验。与之相对应的是,MetROx不仅可以用于检测细胞内不同亚细胞器内源性MetO,也可以检测细胞骨架蛋白MICAL-1过表达引起蛋白质蛋氨酸亚砜化(肌动蛋白以及其他蛋白质)以及血清刺激引起的细胞内蛋白质蛋氨酸亚砜化过程。然而,该荧光传感器MetROx仍然存pH适应性差的缺点,只能在pH值为6~8之间环境下使用。
3.2 蛋氨酸亚砜还原酶荧光探针的发展
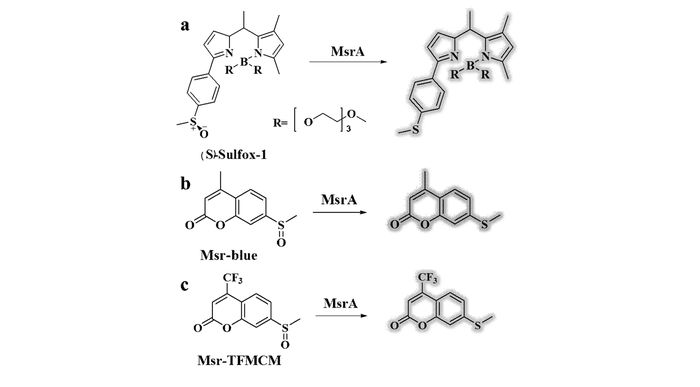
Msrs是许多生命机体中目前发现的唯一能还原MetO的酶,它将MetO还原为Met,使机体免受氧化损伤。其中,与健康疾患和老化相关的Msrs主要为MsrA。而MsrA不仅可以特异性地还原蛋白质中的S-MetO,也可以还原游离的S-MetO并生成硫醚化合物。基于此,并同时考虑到推拉电子效应——亚砜基团主要表现为拉电子效应,硫醚基团为给电子效应,根据分子内电荷转移(ICT)原理,Míšek等[7]设想通过将S-甲基亚砜基团连接到荧光团上发展MsrA的比例型荧光探针。基于该理念,他们发展了一种BODIPY-基质的比率型荧光探针(S)-Sulfox-1(图 4a)。探针(S)-Sulfox-1在542 nm处有很强的荧光发射峰,而当其被MsrA还原后,荧光发射峰红移至576 nm处。而该探针的荧光检测机制也通过HPLC-MS实验获得证实,与此前作者的设想相一致。米-门氏动力学实验则显示:MsrA与探针的反应速度为外消旋型游离MetO的2倍且不与R构型的探针底物(R)-Sulfox-1作用,这说明(S)-Sulfox-1中S-甲基亚砜是探针与MsrA反应发生的关键位点。尽管有文献[28]报道,部分亚砜能够发生外消旋化,然而在该实验[7]当中,将曝光时间延长1 h,该探针也未发生外消旋化和光降解。这些实验表明该探针具有较好的水溶性、光稳定性以及较高的灵敏性。此后,(S)-Sulfox-1也被用于活细胞内MsrA活性荧光成像实验。在与探针(S)-Sulfox-1共孵育后,人工诱导导致MsrA水平上升的大肠杆菌细胞的荧光比值(F535/F570)相较于正常大肠杆菌细胞存在显著差异。此外,(S)-Sulfox-1也被用于检测细胞生长不同阶段的MsrA活性,探针与不同生长期的大肠杆菌细胞(细胞密度OD600分别为0.5、3.5)作用后,OD600为3.5细胞的荧光比值F535/F570与OD600=0.5细胞群落相比显著降低,这说明大肠杆菌细胞的MrsA活性在其生长期呈现增长态势,与文献[29]报道一致。
基于同一设计理念,2017年Zhang等[30]通过对不同的荧光团进行考察,试图筛选出“turn-on”的MsrA活性荧光探针。他们合成了23个含有S-甲基亚砜结构的小分子荧光探针底物,并从中筛选出“turn-on”型荧光探针Msr-blue(图 4b)。探针本体荧光很弱,与MsrA作用后,荧光强度呈剂量依赖性和时间依赖性增加,最高可达100多倍。同时,探针具有很好的选择性,并不与其它典型还原剂如谷胱甘肽还原酶(GR)、硫氧还蛋白(Trx),牛血清白蛋白(BSA),抗坏血酸以及三(2-羧乙基)膦(TCEP)等作用。Msr-blue也被成功地用于细胞成像实验,检测293T细胞中MsrA活性。在此基础上,他们还将该探针用于检测老鼠各个器官中的MsrA活性,结果显示MsrA的活性呈以下趋势:肾>肝≫大脑>心脏~脾,这与文献报道的MsrA在各个器官中的表达水平趋势相一致,验证了该探针应用的潜力。同时Msr-blue也被用于研究MsrA与帕金森症(PD)之间的内在联系,研究发现6-OHDA诱导的PD模型细胞中MsrA活性降低约30%,为PD以及其它的神经退行性疾病的病理研究提供了依据。然而,该探针Msr-blue的激发和发射波长较短(335和438 nm),容易造成光损伤,光漂白和背景颜色的干扰,这大大限制了它的使用。
同年,该课题组[11]又合成了一种以三氟甲基香豆素为荧光团的探针Msr-TFMCM(图 4c),该探针相比Msr-blue探针具有更长的发射波长和更高的亲和力,理论上更有利于其在生物体内的应用。然而该探针存在较强的背景干扰,限制了其在活细胞成像中的应用。因此,激发和发射波长更长的能用于特异性的检测MsrA和MsrB的荧光探针仍亟待研究。
4 结论及展望
蛋白质蛋氨酸亚砜化是一种重要的氧化还原依赖的蛋白质翻译后修饰,不仅是细胞氧化应激的重要生物标记物之一,也可以作为蛋白质功能调控开关,影响某些信号通路以及相关的细胞活动和生理活动,与许多疾病尤其是神经退行性疾病的发生、发展和治疗密切相关。其研究也越来越受到科学家的关注。蛋白质蛋氨酸亚砜(MetO)及其还原酶─蛋氨酸亚砜还原酶(Msrs)的检测对于蛋白质蛋氨酸亚砜化的生理学和病理学功能研究具有重要的意义。荧光检测法具有操作简单、灵敏度高、选择性好、不需破坏细胞等优点,是一种理想的MetO/Msrs检测方法。目前,已有一些课题组进行了研究,发展了多个荧光探针,分别实现了胞内MetO和Msrs实时动态的检测以及动物组织器官中的Msr活性荧光成像。本文对这些研究进展进行了简单的综述。需要指出的是,该领域的研究目前尚处于起步阶段,目前MetO的探针仅有MetROx和MetSOx,且为蛋白质基质探针,存在探针合成复杂、pH适应性差和原位检测操作繁琐的缺点;已见报道的MsrA探针也仅有(S)-Sulfox-1、Msr-blue和Msr-TFMCM 3例,分别存在检测前后荧光变化不明显,对生物巯基选择性不佳,荧光激发波长和发射波长较短引起的光损伤,光漂白以及背景颜色干扰,探针本身存在较强的背景荧光干扰等缺点。简单高效的MetO小分子荧光探针,蛋氨酸亚砜化蛋白质的定点标记试剂(包括荧光标记试剂),更为高效专一的长波长MsrA荧光探针和高效高选择性MsrB荧光探针仍亟待研究。这些研究的进展将为细胞蛋白质蛋氨酸亚砜化的动态调控机制、MetO/Msrs的生理学与病理学功能研究、相关疾病尤其是神经退行性疾病的病理研究以及药物设计提供强有力的工具。
-
-
[1]
Roos G, Messens J. Protein Sulfenic Acid Formation:From Cellular Damage to Redox Regulation[J]. Free Radical Biol Med, 2011, 51(2): 314-326. doi: 10.1016/j.freeradbiomed.2011.04.031
-
[2]
Li X Y, Fang P, Mai J T. Targeting Mitochondrial Reactive Oxygen Species as Novel Therapy for Inflammatory Diseases and Cancers[J]. J Hematol Oncol, 2013, 6(1): 1-19.
-
[3]
Chen X Q, Zhou Y, Peng X J. Fluorescent and Colorimetric Probes for Detection of Thiols[J]. Chem Soc Rev, 2010, 39(6): 2120-2135. doi: 10.1039/b925092a
-
[4]
Holmström K M, Finkel T. Cellular Mechanisms and Physiological Consequences of Redox-dependent Signalling[J]. Nat Rev Mol Cell Biol, 2014, 15(6): 411-421. doi: 10.1038/nrm3801
-
[5]
王超, 姜亮, 王勇. 蛋氨酸亚砜还原酶的结构特征及与神经退行性疾病的关系[J]. 中国科学:化学, 2014,44,(4): 586-600. WANG Chao, JIANG Liang, WANG Yong. Characteristics of Methionine Sulfoxide Reductases Structure and Relationship with Neurodegenerative Diseases[J]. Sci Sin Chim, 2014, 44(4): 586-600.
-
[6]
Nakao L S, Iwai L K, Kalil J. Radical Production from Free and Peptide-Bound Methionine Sulfoxide Oxidation by Peroxynitrite and Hydrogen Peroxide/Iron(Ⅱ)[J]. FEBS Lett, 2003, 547(1/2/3): 87-91.
-
[7]
Makukhin N, Tretyachenko V, Moskovitz J. A Ratiometric Fluorescent Probe for Imaging of the Activity of Methionine Sulfoxide Reductase A in Cells[J]. Angew Chem Int Ed, 2016, 128(41): 12919-12922. doi: 10.1002/ange.201605833
-
[8]
Drazic A, Miura H, Peschek J. Methionine Oxidation Activates a Transcription Factor in Response to Oxidative Stress[J]. Proc Natl Acad Sci USA, 2013, 110(23): 9493-9498. doi: 10.1073/pnas.1300578110
-
[9]
Hung R J, Pak C W, Terman J R. Direct Redox Regulation of F-Actin Assembly and Disassembly by Mical[J]. Science, 2011, 334(6063): 1710-1713. doi: 10.1126/science.1211956
-
[10]
Erickson J R, Joiner M L A, Guan X Q. A Dynamic Pathway for Calcium-Independent Activation of CaMKⅡ by Methionine Oxidation[J]. Cell, 2008, 133(3): 462-474. doi: 10.1016/j.cell.2008.02.048
-
[11]
张良伟, 刘瑞娟, 康洁. 蛋氨酸亚砜还原酶荧光探针的设计及应用[J]. 中国科学:化学, 2017,47,1-8. ZHANG Liangwei, LIU Ruijuan, KANG Jie. A Novel Fluorescent Probe for Methionine Sulfoxide Reductases[J]. Sci Sin Chim, 2017, 47: 1-8.
-
[12]
Antoine M, Gand A, Boschi-Muller S. Characterization of the Amino Acids from Neisseria meningitidis MsrA Involved in the Chemical Catalysis of the Methionine Sulfoxide Reduction Step[J]. J Biol Chem, 2006, 281(51): 39062-39070. doi: 10.1074/jbc.M608844200
-
[13]
Péterfi Z, Tarrago L, Gladyshev V N. Practical Guide for Dynamic Monitoring of Protein Oxidation Using Genetically Encoded Ratiometric Fluorescent Biosensors of Methionine Sulfoxide[J]. Methods, 2016, 109: 149-157. doi: 10.1016/j.ymeth.2016.06.022
-
[14]
Cabreiro F, Picot C R, Perichon M. Overexpression of Methionine Sulfoxide Reductases A and B2 Protects MOLT-4 Cells Against Zinc-Induced Oxidative Stress[J]. Antioxid Redox Signaling, 2008, 11(2): 215-226.
-
[15]
Romero H M, Berlett B S, Jensen P J. Investigations into the Role of the Plastidial Peptide Methionine Sulfoxide Reductase in Response to Oxidative Stress in Arabidopsis[J]. Plant Physiol, 2004, 136(3): 3784-3794. doi: 10.1104/pp.104.046656
-
[16]
Ruan H Y, Tang X D, Chen M L. High-Quality Life Extension by the Enzyme Peptide Methionine Sulfoxide Reductase[J]. Proc Natl Acad Sci USA, 2002, 99(5): 2748-2753. doi: 10.1073/pnas.032671199
-
[17]
Shchedrina V A, Vorbrüggen G, Lee B C. Overexpression of Methionine-R-Sulfoxide Reductases has no Influence on Fruit Fly Aging[J]. Mech Ageing Dev, 2009, 130(7): 429-443. doi: 10.1016/j.mad.2009.04.003
-
[18]
Gabbita S P, Aksenov M Y, Lovell M A. Decrease in Peptide Methionine Sulfoxide Reductase in Alzheimer's Disease Brain[J]. J Neurochem, 1999, 73(4): 1660-1666.
-
[19]
Wassef R, Haenold R, Hansel A. Methionine Sulfoxide Reductase A and a Dietary Supplement S-Methyl-L-Cysteine Prevent Parkinson's-Like Symptoms[J]. J Neurosci, 2007, 27(47): 12808-12816. doi: 10.1523/JNEUROSCI.0322-07.2007
-
[20]
Oien D B, Shinogle H E, Moore D S. Clearance and Phosphorylation of Alpha-Synuclein are Anhibited in Methionine Sulfoxide Reductase a Null Yeast Cells[J]. J Mol Neurosci, 2009, 39(3): 323-332. doi: 10.1007/s12031-009-9274-8
-
[21]
Pratico D. Evidence of Oxidative Stress in Alzheimer's Disease Brain and Antioxidant Therapy[J]. Ann N Y Acad Sci, 2008, 1147(1): 70-78. doi: 10.1196/annals.1427.010
-
[22]
Dumont M, Lin M T, Beal M F. Mitochondria and Antioxidant Targeted Therapeutic Strategies for Alzheimer's Disease[J]. J Alzheimer's Dis, 2010, 20(S2): S633-S643. doi: 10.3233/JAD-2010-100507
-
[23]
Luca A D, Sanna F, Sallese M. Methionine Sulfoxide Reductase A Down-Regulation in Human Breast Cancer Cells Results in a More Aggressive Phenotype[J]. Proc Natl Acad Sci USA, 2010, 107(43): 18628-18633. doi: 10.1073/pnas.1010171107
-
[24]
Dai C B, Wang M H. Characterization and Functional Analysis of Methionine Sulfoxide Reductase A Gene Family in Tomato[J]. Mol Biol Rep, 2012, 39(5): 6297-6308. doi: 10.1007/s11033-012-1451-0
-
[25]
Brunell D, Weissbach H, Hodder P. A High-Throughput Screening Compatible Assay for Activators and Inhibitors of Methionine Sulfoxide Reductase A[J]. Assay Drug Dev Technol, 2010, 8(5): 615-620. doi: 10.1089/adt.2009.0263
-
[26]
Wu P F, Xie N, Zhang J J. Resveratrol Preconditioning Increases Methionine Sulfoxide Reductases A Expression and Enhances Resistance of Human Neuroblastoma Cells to Neurotoxins[J]. J Nutr Biochem, 2013, 24(6): 1070-1077. doi: 10.1016/j.jnutbio.2012.08.005
-
[27]
Tarrago L, Péterfi Z, Lee B C. Monitoring Methionine Sulfoxide with Stereospecific Mechanism-Based Fluorescent Sensors[J]. Nat Chem Biol, 2015, 11(5): 332-338. doi: 10.1038/nchembio.1787
-
[28]
Mislow K, Axelrod M, Rayner D R. Light-Induced Pyramidal Inversion of Sulfoxides1[J]. J Am Chem Soc, 1965, 87(21): 4958-4959. doi: 10.1021/ja00949a052
-
[29]
Moskovitz J, Rahman M A, Strassman J. Escherichia coli Peptide Methionine Sulfoxide Reductase Gene:Regulation of Expression and Role in Protecting Against Oxidative Damage[J]. J Bacteriol, 1995, 177(3): 502-507. doi: 10.1128/jb.177.3.502-507.1995
-
[30]
Zhang L W, Peng S J, Sun J Y. A Specific Fluorescent Probe Reveals Compromised Activity of Methionine Sulfoxide Reductases in Parkinson's Disease[J]. Chem Sci, 2017, 8(4): 2966-2972. doi: 10.1039/C6SC04708D
-
[1]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 8
- 文章访问数: 872
- HTML全文浏览量: 190



 下载:
下载:



 下载:
下载:

