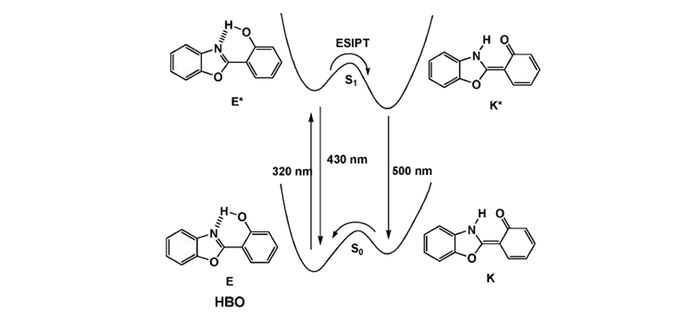
 Scheme1.
Illustration of the photophysical cycle for ESIPT
Scheme1.
Illustration of the photophysical cycle for ESIPT

Citation: WANG Dejia, XU Yongqian, SUN Shiguo, LI Hongjuan. Advanced in Fluorescent Probes Based on Excited State Intramolecular Proton Transfer[J]. Chinese Journal of Applied Chemistry, 2018, 35(1): 1-20. doi: 10.11944/j.issn.1000-0518.2018.01.170328

激发态分子内质子转移荧光探针的研究进展
English
Advanced in Fluorescent Probes Based on Excited State Intramolecular Proton Transfer
-
激发态分子内质子转移(Excited State Intramolecular Proton Transfer, ESIPT)作为荧光分子的新型传感机制,近年来受到广大科学工作者关注。由于特殊的激发态光物理过程,具有ESIPT性质的化合物在荧光探针[1-3]、发光材料[4]、激光染料[5-6]及分子逻辑门[7]等领域被广泛应用。ESIPT化合物最显著的光物理性质就是大斯托克位移(Stokes Shift)。大的斯托克位移可以有效消除染料的自吸收导致的发光淬灭,从而避免光损失和降低生命体自发光干扰,提高荧光染料的灵敏性[8]。典型的ESIPT化合物有2-(2′-羟基苯基)苯并恶唑(HBO)衍生物[9-10]、2-(2′-羟基苯基)苯并噻唑(HBT)衍生物[11-15]、2-(2′-羟基苯基)苯并咪唑(HBI)衍生物[16-17]、羟基黄酮衍生物[18-20]、邻羟基苯甲醛及萘甲醛衍生物[21-22]、蒽醌衍生物[23-24]和喹啉衍生物[25-26]等。
激发态分子内质子转移是探针分子受光激发后,电子从基态跃迁到激发态,分子内的氢质子通过分子内的氢键转移到分子内相邻近的N、O和S等杂原子上,诱导基态和激发态间烯醇式(Enol)-酮式(Keto)转换,形成互变异构体[2, 27]。ESIPT过程是一个完全可逆的循环过程。以2-(2′-羟基苯基)苯并噻唑(HBO)为例,简单介绍ESIPT分子独特的光物理过程:HBO在基态以烯醇异构体E(Enol)的形式存在,形成稳定的分子内氢键。当受到320 nm的激发光照射后,烯醇式异构体E跃迁至单线激发态E*,经过极快的分子内质子转移过程,迅速转变到酮式异构体(Keto)的单线激发态K*,此时在~500 nm出现了一个新的发射峰,相对原始的发射峰~430 nm,其表现出较大的斯托克斯位移,如Scheme 1所示。当激发态以发射荧光的方式衰减回到基态时,酮式(K)结构经过可逆的质子传递可以重新转化为原始的醇式构型[1, 3]。
荧光探针具有灵敏度高、选择性好、响应迅速、检测范围宽、操作简单等优点。另外,它与荧光显微成像技术相结合可实现对活细胞及活体中生物分子及生物过程的原位、实时在线监测,因此在化学、生命科学和临床医学等各个领域都受到了广泛的关注和研究[28-29]。常见金属离子、阴离子、中性小分子及生物大分子在生命活动中具有不同的作用,通过荧光分析手段可对它们进行检测和示踪。ESIPT作为新的传感机制,已经被广泛用于荧光探针的设计与开发,且表现出了良好的传感性能。本文基于我们课题组在ESIPT荧光探针方面的研究,对用于离子、中性小分子和生物大分子检测的ESIPT荧光探针进行了综述。
1 基于ESIPT的离子荧光探针
1.1 基于ESIPT的金属阳离子荧光探针
人体内微量金属元素缺少会导致酶的活性降低或者完全丧失,导致人类生命活动难以继续。例如,铁在人体内的主要功能与血红蛋白一起(含低价铁)参与氧的运输、转运、交换和组织呼吸过程[9];锌离子作为人体生长发育的重要组成成分,广泛地参与基因转录、神经传递,细胞免疫和运输等生命过程[30];铜离子作为人体必需的金属元素,对人体的新陈代谢起着重要的调节作用[31];其它重金属离子如Hg2+、Cd2+和Pd2+等,在低浓度时就对生物体有很强的毒性,导致人体正常生理功能絮乱,引起阿尔茨海默病、癫痫、帕金森病、缺血性中风等疾病[32]。ESIPT荧光探针用于金属离子的检测受到了广泛的关注和研究。
传统的锌离子识别方法大多数通过不同修饰的取代基直接与Zn2+作用达到检测的目的,为了改变传统的通过优化识别基团来提高选择性的方法,我们转向以荧光团修饰为切入点来调控和增强选择性。我们[33]以HBO分子为母体,通过不同的取代基修饰,设计合成了探针H-1、H-2和H-3(图 1)。在乙醇和水(体积比1:1, pH=7.2)的混合体系中加入锌离子均可引起ESIPT分子420 nm的荧光增强;同时在近红外区域产生了大斯托克斯位移荧光(850 nm),该处荧光强度变化可以很好地用于锌离子的检测。通过比较这3种化合物在两个波长下的荧光增强倍数,发现探针H-3对锌离子的灵敏度明显高于探针H-1和H-2。核磁滴定实验证明,取代基团间接影响了其对锌离子的作用。通过合理取代基修饰可以有效提高ESIPT分子检测的灵敏度和选择性,该方法比传统方法更为简单方便和有效,提高了锌离子的选择性,减少了镉离子的干扰。该方法为提高ESIPT荧光传感器的选择性提供了新的策略和思路。
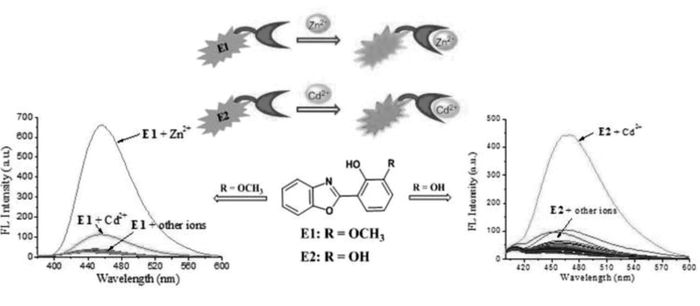
大部分检测锌离子的荧光探针往往因受到镉离子的干扰而具有较差的选择性,ESIPT分子的简单修饰可选择性地改变其对锌离子和镉离子的亲和力,从而达到区分和检测的效果。针对此,我们[34]设计合成了ESIPT荧光探针E1和E2,通过取代基的切换可以分别在水溶液中选择性和灵敏性地检测Zn2+和Cd2+(图 2)。探针E1是3′位置的羟基通过甲基取代可以选择性地用于Zn2+的检测,在乙腈/4-羟乙基哌嗪乙磺酸(CH3CN/HEPES)缓冲溶液(体积比1:1, pH=7.4)体系中,Zn2+可以和探针分子上羟基发生配位作用。在360 nm的激发波长下,除455 nm的发射峰外,在近红外区域880 nm处出现一个新的发射峰,在880 nm发射波长下探针E1的荧光强度与Zn2+的浓度呈现良好的线性关系,在近红外区可以用于锌离子的定量检测,检测限可达1.63×10-8 mol/L。同样地,Cd2+可以和探针E2分子上羟基发生配位作用。在360 nm的激发波长下,探针E2在468 nm发射强度与Cd2+浓度呈现良好的线性关系,检测限可达1.33×10-7 mol/L。通过3′位置取代基不同,探针E1和E2可以与Zn2+和Cd2+产生不同的配位方式,可用于Zn2+和Cd2+选择性检测而不相互干扰,同时可用于活细胞的荧光显微成像。这种取代基引起的ESIPT分子配位作用选择性转换,为设计其它金属离子荧光传感器提供了理论基础。
近红外光荧光探针可以避免光损伤以及短波长光散射的干扰,近年来得到广泛的研究。合理的分子设计可以诱导ESIPT分子产生近红外荧光。我们[30]在荧光母体2, 5-二(2-苯并唑)-1, 4-二羟基苯(Bis(HBO))上引入锌离子识别基团二-(2-甲基吡啶)胺(DPA),设计合成了一个双苯并恶唑衍生物Zinhbo-1(图 3)。在含体积分数5%的DMSO的HEPES缓冲溶液中,探针Zinhbo-1可以与Zn2+键合从而诱导ESIPT过程的进行,导致酮式构型的增加。543 nm的荧光发射峰强度逐渐增强,荧光量子产率达到0.052。另外,在近红外区712 nm处出现了一个新的发射峰,相比于激发波长480 nm产生较大的斯托克斯位移(230 nm),利用近红外荧光对Zn2+进行了专一性的检测。这一结果为进一步设计合成光物理、光化学性能良好的ESIPT近红外荧光分子奠定了基础。
HBO探针分子可通过与不同三价金属离子配位作用实现ESIPT的“开-关”。Pang等[9]设计合成了荧光探针1,可以在水溶液中区分三价金属离子(Al3+、Cr3+和Fe3+),如图 4所示。探针1连有两个相同的“腙席夫碱”,分子本身具有ESIPT效应,在615 nm发射波长下发出很弱的红色荧光,由于苯环上Ha存在空间位阻,当加入三价金属离子Cr3+,探针1的双“腙席夫碱”可以选择性地与Cr3+配位,导致C=N扭转远离HBO分子平面,可以实现ESIPT的“开”,在发射波长563 nm处产生明显的发射峰,发出很强的黄色荧光。而Al3+的加入可以和单侧的“腙席夫碱”发生配位作用,抑制分子内质子转移,导致ESIPT的“关”,在527 nm处产生明显的发射峰,发出强绿色荧光。通过加入不同的三价金属离子,根据配位方式的不同,实现ESIPT的“开-关”,并可以通过肉眼清楚观察到不同的荧光颜色变化,从而达到对三价金属离子Al3+、Cr3+和Fe3+选择性区分检测。此外,细胞共聚焦显微成像实验说明,探针1可用于区分和检测细胞内的Cr3+和Al3+。
ESIPT分子如HBO、HBT和HBI等衍生物因具有优异的光物理性质,如大的斯托克斯位移和与客体物质良好的键合能力,可作为荧光探针的母体。而HBI相比HBO和HBT衍生物具有更高的荧光量子产率。基于此,Ghosh课题组[16]设计合成了用于Al3+选择性检测的荧光探针2(图 5)。在乙腈溶液中,探针2羟基上氢原子通过分子内质子转移过程转移到咪唑环上的氮原子上,在445 nm处具有亮蓝色荧光发射峰。当加入Al3+后,探针分子和Al3+发生配位作用,导致ESIPT过程受阻,在412 nm处出现新的深蓝色荧光发射峰,发射强度大约增加2.3倍,通过Job Plot曲线分析,探针2和Al3+的配位比为1:1,络合常数为3.36×105 L/mol。在乙腈和水(体积比1:9)的混合体系中,探针2可以更好地检测Al3+,发射强度增加6倍,使探针2更具有实际应用能力。作用机理通过密度泛函理论(DFT)计算得到了进一步的证实。
常见ESIPT荧光探针的设计思路比较单一,往往只能通过专一的作用方式对分析物进行检测,存在许多局限性。Li课题组[31]以2-(2-羟基苯基)-9, 10-菲咪唑为母体设计合成了两种新型荧光探针3(Pi-A)和4(Pi-E),基于不同的作用机理均可以用于Cu2+的选择性检测(图 6)。探针3亚胺上的氢原子通过分子内质子转移过程转移到咪唑环上的氮原子上,发生ESIPT过程,产生很强的荧光。当加入Cu2+后,探针3与铜离子发生配位作用,亚胺基发生去质子化作用,阻碍ESIPT过程发生,导致探针3荧光淬灭。相反,探针4的羟基基团受到2-吡啶羧酸甲酯保护,使分子本身ESIPT过程受阻,分子几乎不发出荧光,加入铜离子导致羧酸酯键断裂,释放出能够提供分子内质子转移的羟基,恢复了ESIPT过程,荧光强度增强。两种探针通过与Cu2+不同的作用方式,对铜离子均有很好的选择性。铜离子浓度在0~10 μmol/L范围内,探针3和4最大发射波长下的荧光强度均与铜离子浓度呈现良好的线性关系。探针3的检测限为1.6×10-9 mol/L,探针4的检测限为1.8×10-8 mol/L。两种探针也具有很好的细胞膜渗透性,可以用于活细胞内Cu2+成像。这种通过调整ESIPT分子质子供体策略,为开发结构相似但检测性能不同的荧光探针提供了思路。
1.2 基于ESIPT的阴离子荧光探针
阴离子广泛存在于生物体中,生物体内阴离子的跨膜传递和运输都是通过特定阴离子结合蛋白完成的。阴离子在生命科学、药物化学、环境监测和疾病诊断等方面起着十分重要的作用[35-36]。由于阴离子在生命科学和化学过程中的重要作用,设计和合成能够识别阴离子的荧光传感器越来越受到人们的广泛关注。近年来,大量的研究致力于设计合成高选择性、高灵敏性识别阴离子的受体,通过受体与阴离子作用引起荧光信号响应,如荧光增强和减弱、光谱波长移动、荧光寿命改变等,从而达到选择性检测阴离子的目的。ESIPT荧光探针用于识别F-、CH3COO-、CN-、Cl-、P2O74-、ONOO-和ClO-等阴离子得到了广泛的研究。
ESIPT机理的荧光传感器检测阴离子常见的方法是阴离子与ESIPT分子质子直接作用,抑制分子内质子转移过程,从而阻断ESIPT发生。Peng课题组[37]报道了两个基于苯并恶唑衍生物的新型阴离子探针,探针5(TABO)和探针6(PUBO)。通过阴离子与探针发生相互作用,导致ESIPT过程受阻,反应机理如图 7所示。探针5(TABO)很容易与F-、CH3COO-及H2PO4-形成分子间氢键,从而阻止ESIPT过程的发生,在460 nm处的荧光增强,相对选择性比较差。对于探针6(PUBO),F-和CH3COO-能够诱导发生不同的光化学反应,产生不同的荧光变化。当加入F-时,由于F-诱导化合物分子失去质子,阻碍ESIPT的发生,在554 nm处的荧光强度降低,伴随着495 nm处荧光增强,发出很强的绿色发光;而CH3COO-的加入,更容易与探针6形成分子间氢键,分子内质子转移过程受阻,在414 nm荧光峰逐渐增强,从而发出醇式的蓝色发光。通过不同的荧光光谱变化响应可以实现对F-和CH3COO-的专一性检测。
基于同样的思路,Coswamin等[38]设计合成了基于苯并噻唑衍生物的探针7(图 8)。在乙腈/水(体积比1:1)的混合体系中,探针7在521 nm下发出很强的酮式荧光,当加入氰根离子后,其羟基邻位的醛基能够与CN-迅速地发生亲核加成反应,有效地阻断羟基向苯并噻唑上氮的质子转移,从而抑制ESIPT过程的发生。伴随着521 nm下荧光强度逐渐降低,436 nm处荧光逐渐增强,实现了对CN-的高选择性比率检测。同时探针7可以选择性地定量检测CN-而不受F-、CH3COO-等其它离子的干扰,密度泛函理论(DFT)和含时密度泛函理论(TD-DFT)理论计算进一步确认了其识别机理。
Muthyala等[39]设计合成了基于对称的方酰胺衍生物的荧光探针8,选择性检测Cl-,作用机理如图 9所示。在乙腈溶液中,探针8分子亚氨基上的氢原子可以通过分子内质子转移过程转移到邻近羰基氧上,产生ESIPT过程,分子本身荧光强度较弱。当加入Cl-后,Cl-可以和亚氨基形成分子间氢键,从而抑制了ESIPT过程,440 nm处的荧光强度增强了3倍。由于受重原子效应影响,加入Br-后荧光强度增强1.7倍,而I-的加入荧光强度几乎不发生变化。通过荧光强度的变化可以选择性地用于氯离子检测。氯离子诱导方酰胺的荧光增强型探针为今后细胞内氯离子显微成像提供了理论指导。
除了通过阴离子与探针形成分子间氢键阻碍ESIPT过程这一机理外,保护-去保护是另一种传感机理,即ESIPT质子被取代基取代,ESIPT过程被阻断,当加入检测物后使得取代基离去,从而ESIPT过程得到恢复。Pang等[40]合成了比率荧光探针9,该探针在pH=7.4的HEPES缓冲溶液中可以选择性地检测焦磷酸盐(P2O74-)(图 10)。探针9的苯并恶唑结构与锌离子的识别基团相连,与Zn2+配位后,使结构中的酚羟基失去质子,导致ESIPT过程被阻止,探针9仅在420 nm处出现发射峰。当加入除P2O74-外的其它阴离子或磷酸盐类似物ATP,该荧光发射峰基本未发生变化,只有当加入P2O74-后,P2O74-能够和探针9产生配位作用,释放出苯并恶唑结构域中的酚羟基,ESIPT过程得到恢复,荧光发射峰出现在518 nm,红移近100 nm,此时探针9主要以ESIPT的酮式结构为主。通过荧光滴定实验证明,探针9和P2O74-形成1:1的配位络合物,配合常数为9.2×107 L/mol。
基于保护-去保护机制,Sedgwick等[41]以苯硼酸酯为保护单元,设计合成了探针10,探针10的结构式如图 11所示。该分子的ESIPT过程被阻止,几乎不发出荧光。当在含有体积分数52%的甲醇缓冲溶液(pH=7.2)中加入过氧亚硝阴离子(ONOO-)后,硼酸酯被ONOO-氧化分解形成类似苯醌结构,释放出高荧光强度的N-甲基苯并噻唑质子供体,恢复了ESIPT过程,在发射波长461 nm处的荧光明显增强。当加入其它的活性氧或者活性氮自由基,除次氯酸强的氧化能力诱导荧光强度略微下降和过量的双氧水诱导荧光强度有一定增强外,荧光强度几乎保持不变。而ONOO-的加入使得荧光强度显著增强(4.5倍),探针10可作为反应型探针用于ONOO-选择性检测。细胞成像实验证明探针10可以用于内源和外源的ONOO-的检测,为研究过氧亚硝酸盐相关的病理作用提供了有效的检测方法。
最近,通过取代基的修饰,在阴离子存在下诱导ESIPT发生也有研究报道。Han等[42]通过HBT分子母体与苯偶氮基团相连合成了次氯酸根(ClO-)特异性响应的荧光探针11,如图 12所示。通过引入吸电子苯偶氮基团,探针11分子的荧光发射受到抑制,本身无荧光。当加入ClO-后,苯偶氮基团氧化除去,生成单独的HBT分子,ESIPT过程发生,在466 nm处荧光得以恢复。在466 nm处的荧光强度随着ClO-浓度的增加而逐渐增强,当ClO-浓度达到50 μmol/L时,荧光强度达到最大值并保持不变。浓度在0~12 μmol/L范围内,466 nm处的荧光强度与ClO-浓度呈现良好的线性关系,可用于ClO-的定量检测,检测限为1.322×10-8 mol/L。探针11容易制备,水溶性好,检测限低,为进一步的生物应用提供了可能。
2 基于ESIPT的中性小分子荧光探针
近年来,ESIPT机理荧光探针对中性小分子如三磷酸腺苷(ATP)、氨基酸、水合肼、双氧水和硫化氢等的检测也获得了广泛研究。ATP作为细胞能量信号分子参与许多生理过程,包括离子调节、信号传导、蛋白质运输和DNA复制和转录等[43]。氨基酸是一类具有特殊重要意义的化合物,氨基酸的缺乏会导致人体各种各样的疾病[44]。其它低浓度的生物小分子如水合肼、双氧水等对人体会产生不同程度的毒害作用,导致人体疾病的发生[45]。
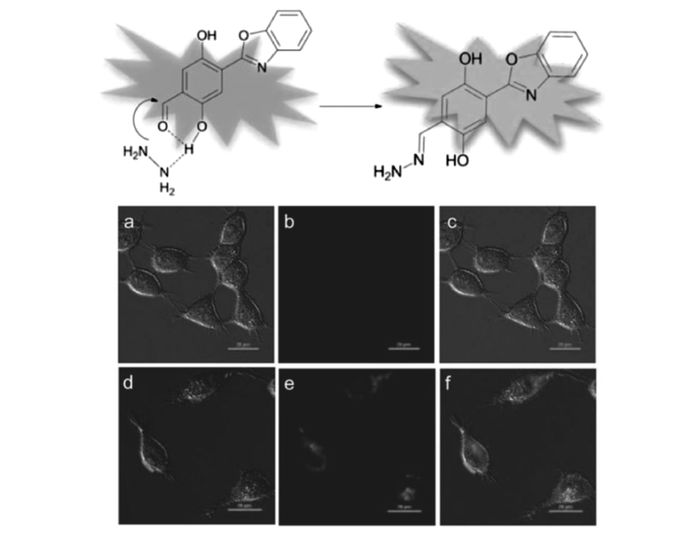
ESIPT分子易受结构以及环境变化影响,产生不同强度的醇式酮式双荧光,通过醇式和酮式荧光之间互换变化,构成比例荧光响应。我们设计合成了几种ESIPT分子羟基的保护和脱保护荧光探针,探针12[46]在CH3CN/HEPES缓冲溶液(体积比1:1,pH=7.4)中,可以选择性地用于水合肼的检测,在560 nm产生明显荧光增强,随着水合肼浓度增加产生比率的紫外吸收光谱变化。探针12分子邻近的羟基和醛基存在分子间氢键,同时与水合肼存在分子间氢键,如图 13所示,加快醛基基团和水合肼发生加成反应,改变和影响该分子ESIPT过程。ESIPT诱导的荧光变化可以快速、灵敏、选择性检测水合肼溶液和气态的水合肼,检测限为2.7×10-9 g/mL。该探针可用于海拉(Hela)细胞中水合肼检测。
最近,Chen等[47]以HBT母体设计合成了荧光增强型探针13,通过ESIPT和分子内的电荷转移(ICT)双重机理可以对水合肼进行选择性检测。在DMSO/H2O(体积比8:2)混合溶剂中,如图 14所示,当加入水合肼后,探针13的丙二腈基团还原成醛腙,阻碍了ICT,而分子内ESIPT过程发生,在510 nm产生很强的荧光增强,此探针呈现很宽的线性检测范围,检测限为2.9×10-7 mol/L。在pH值4.0~11.0范围内可以高选择性和灵敏性地检测水合肼,而不受pH值的干扰。同时,该探针可用于滤纸条上气态的水合肼检测和J774细胞内水合肼荧光成像检测。
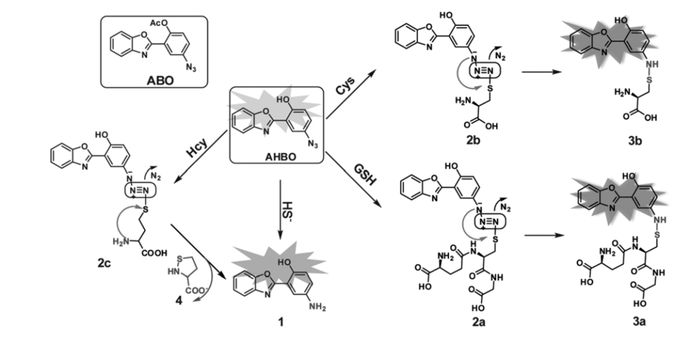
叠氮基修饰的荧光探针主要用于硫化氢的检测,而叠氮基修饰的ESIPT分子由于ESIPT分子特殊的性质而用于巯基氨基酸的检测。我们课题组设计合成了叠氮修饰的苯并恶唑衍生物的荧光探针14(AHBO)[48],通过硫醇和叠氮基反应可以选择性地检测半胱氨酸(Cys)和谷胱甘肽(GSH)(图 15)。探针分子本身由于叠氮基的存在,分子内质子转移受到抑制,导致荧光淬灭。在CH3CN/HEPES缓冲体系中(体积比1:1, pH=7.4),当加入半胱氨酸(Cys)和谷胱甘肽(GSH)后,巯基与叠氮发生亲核取代-重排反应,诱导和影响ESIPT过程,产生荧光变化,该探针可以选择性地检测Cys和GSH。随着GSH量的不断加入,在488 nm处出现新的发射峰,伴随着较大的斯托克斯位移。488 nm处荧光强度随着GSH量的增加呈现良好的线性关系,检测限为9.0×10-8 mol/L。探针14可用于谷胱甘肽定性和定量检测,且能够可视化成像活细胞内的半胱氨酸,具有很好的检测效果。尽管此探针的激发波长在紫外区域,但基于ESIPT分子内硫醇-叠氮反应可为硫醇传感器的设计提供新的策略。
HBT分子通过氨基酸的加入诱导ESIPT过程可作为氨基酸荧光探针的设计原理。Coswami课题组[49]合成了探针15,在极性质子溶剂中,探针15苯环上的羟基与邻位醛基上的氧原子形成分子内氢键,阻断了ESIPT过程的发生(图 16)。当加入巯基氨基酸(Cys和Hcy)后,巯基氨基酸能够和醛基发生加成反应成环,羟基质子能够和苯并噻唑环上的氮原子形成氢键,ESIPT过程得到了恢复,在436 nm处荧光发射峰逐渐减弱,521 nm处荧光发射峰不断增强,实现了对巯基氨基酸(Cys和Hcy)的选择性检测,而对其他氨基酸无任何响应。核磁滴定实验,DFT和TD/DFT理论计算进一步验证了该作用机理。探针15成功地用于细胞中半胱氨酸的检测。
通过取代基的改变影响探针分子的ESIPT过程用于巯基氨基酸的检测由Tang课题组首次报道[17]。在乙醇和HEPES缓冲液的混合体系中,探针16(BIHM)可以在半胱氨酸(Cys)和谷胱甘肽(GSH)存在下选择性检测高半胱氨酸(Hcy)(图 17)。探针16在350 nm波长下激发,由于分子具有ESIPT性质,在458和538 nm处呈现双波长发射。当加入高半胱氨酸后,其与探针分子反应形成六元杂环衍生物,由于取代基的改变导致产物ESIPT过程发生改变,在468 nm处出现新的发射峰,其荧光强度增强23倍,468 nm处荧光强度随着Hcy量的增加呈现良好的线性关系,检测限为9.02×10-6 mol/L。核磁滴定实验、DFT和TD/DFT理论计算进一步验证了该作用机理。探针16可以很好地用于人乳腺癌细胞(MCF-7)内高半胱氨酸的检测。
双氧水(H2O2)作为一种常见的活性氧物质,不仅作为化学品广泛地用于漂白、清洗和消毒,同时作为重要的生物分子也与许多生理过程相关,如氧化损伤防御反应以及细胞信号传导等。最近,Liu课题组[50]以染料4(1, 3-二(吡啶-2-亚氨基)异吲哚-2-醇)为母体,通过芳基硼酸酯引入设计合成了探针17。此染料作为ESIPT分子母体,具有很好的光学性质,如红色发射波长和大的斯托克斯位移,如图 18所示。芳基硼酸酯作为双氧水的识别位点保护了羟基,抑制了ESIPT过程。双氧水的加入导致芳基硼酸酯发生氧化水解,从而释放出羟基分子,ESIPT过程恢复,在580 nm处出现很强的荧光发射峰,双氧水浓度在0~100 μmol/L范围内,580 nm处荧光强度和双氧水浓度呈现良好的线性关系,检测限为9.1×10-9 mol/L。探针17可以迅速、高选择性和高灵敏性地检测双氧水,识别过程伴随红色发射荧光(585 nm)和大的斯托克斯位移(217 nm)的出现。探针17可以用于活细胞内双氧水的检测,为其它用于细胞内双氧水检测的荧光探针的设计合成提供了思路。
芳基硼酸酯作为活性氧识别基团被大家所熟知,所以通过芳基硼酸酯修饰的探针用于双氧水的检测被广泛报道。常见的检测双氧水的荧光探针水溶性往往比较差,响应时间慢,容易受到其它活性氧物质的干扰。为了克服以上问题,Li等[51]以2-(2′-羟基苯基)苯并恶唑(HBO)为母体,通过芳基硼酸酯修饰设计合成了探针18(图 19)。硼酸酯的引入对羟基进行了保护,抑制了ESIPT过程。该课题组通过引入阳离子表面活性剂(CTAB)胶束来包裹探针分子,提高了探针分子的溶解性,加快了探针分子与双氧水的反应速率。在H2O2作用下芳基硼酸酯发生氧化水解,从而释放出羟基分子,ESIPT过程得到恢复,405 nm处荧光发射强度降低,同时510 nm处发射强度增强,呈现良好的双波长比率变化,可以对双氧水分子进行有效地高选择性检测,而对其它活性氧物质几乎没有作用,达到对双氧水的专一性检测。
通过芳基硼酸酯修饰来抑制ESIPT过程发生的荧光探针用于其它物质的检测也有报道。Wang等[52]合成了具有ESIPT性质的荧光探针19,可以用于食品和药物样品中的过氧化苯甲酰(BPO)的检测(图 20)。在含有体积分数20%乙醇及0.1%二甲基甲酰胺(DMF)的PBS缓冲液(pH=7.4)中,探针19在加入BPO后,芳基硼酸酯发生氧化水解,从而释放出羟基分子,ESIPT过程恢复,在423 nm处荧光发射峰逐渐降低,而494 nm处的荧光强度逐渐增强,BPO浓度在0.5~30 μmol/L范围内,I494/I423荧光强度比值和BPO浓度有良好的线性关系,检测限为8×10-8 mol/L。探针19可以在实际样品高选择性和高灵敏性地检测BPO,对于其它活性氧自由基几乎没有响应。细胞实验进一步证明探针19具有很好的细胞膜穿透性,可以和细胞内的BPO发生反应用于细胞内的BPO成像。
硫化氢(H2S)是一种有刺激气味的有毒气体,也是一种重要的内源性气体递质,与许多生理学过程相关。Deng等[53]通过修饰能够识别硫化氢的叠氮基团,基于ESIPT原理设计合成了荧光探针20(ESIPT-HS),合成过程及作用机理如图 21所示。在含有体积分数30%二甲基亚砜(DMSO)的PBS缓冲液(pH=7.4)中,探针20本身ESIPT过程受阻,几乎无荧光,当加入H2S,叠氮基团被还原成氨基,裸露的氨基与酯基自发成环释放出荧光物质HBT,ESIPT过程得到恢复,在462 nm处的荧光强度产生400倍的增强,在0~60 μmol/L浓度范围内,462 nm下荧光强度和H2S浓度有良好的线性关系,检测限为2.21×10-6 mol/L。该检测限明显低于哺乳类动物的血浆和大脑中硫化氢的浓度,可以很好地用于生理学中硫化氢的检测。探针20展现出很好的光学性质,如400倍荧光信号增强,大的斯托克斯位移,高选择性和低细胞毒性等。探针20具有很好的细胞膜通透性,可以用于活细胞内源和外源性的H2S可视化检测。
最近,Chen课题组[54]基于保护-脱保护机制设计合成了探针21,可以用于H2S的选择性检测(图 22)。在含有体积分数10% DMF的PBS缓冲液(pH=7.4)中,探针分子本身ESIPT过程受阻,分子没有荧光,当加入H2S后,吡喃环被破坏,释放出羟基,羟基上的质子与相邻的苯并噻唑上氮发生分子内质子转移,ESIPT过程恢复。同时游离的HBT聚集,产生540 nm分子聚集诱导发光(AIE)的荧光,强度增强80倍。在0~20 μmol/L浓度范围内,540 nm处荧光强度和H2S浓度有很好的线性关系,检测限为4.1×10-8 mol/L。探针21可以进一步用于活细胞内H2S单光子和双光子显微成像,探针21可用于生物系统中H2S相关的生物学和病理学的研究。
上述基于ESIPT荧光传感器的设计原理主要有两种:一是分析物直接夺取ESIPT质子,阻断ESIPT过程;二是保护-去保护机制,即ESIPT质子被取代基取代,ESIPT过程被阻断,当加入检测物后使得取代基离去,从而ESIPT过程得到恢复。为了改变和丰富传统的优化识别基团来提高选择性的方法,我们课题组[43]通过引进镓离子和ESIPT分子进行自组装形成探针22(DHBO),探针22可以选择性地检测生物分子ATP,而对于一磷酸腺苷(AMP)、二磷酸腺苷(ADP)和其它核苷三磷酸无响应。如图 23所示,ESIPT分子的邻羟基可以与镓离子自组装,通过实验分析计算证明荧光分子DHBO和Ga自组装配比为1:3。461 nm处荧光强度和ATP浓度有很好的线性关系,检测限为5.49×10-7 mol/L,其检测限低于细胞内的ATP浓度(1~10 mmol/L),可以准确地用于体外和卵巢癌细胞(SKOV-3)内的ATP检测。通过金属离子自组装,构建一种新型自组装平台,得到了高选择性的ATP传感器。该方法比传统方法更为简单方便和有效,这种自组装策略为设计其它ESIPT荧光传感器提供了理论思路。
3 基于ESIPT的生物大分子荧光探针
生物大分子主要包括蛋白质、核酸、碳水化合物等,作为生命的基础物质,在基因表达的调节,细胞中氧化还原、电子传递、免疫保护、神经传递、学习和记忆等生命过程中起十分重要的作用。ESIPT分子对溶剂具有敏感性,生物大分子可以为其提供疏水的环境,影响分子的ESIPT过程。所以基于ESIPT荧光分子用于生物大分子的检测也被广泛报道。
蛋白质络氨酸酶(PTPs)和蛋白质络氨酸激酶(PTKs)在细胞调节和信号传导过程中起到十分重要的作用。多种疾病包括癌症、糖尿病和阿尔茨海默症均与异常的磷酸酶和激酶活性有关。Kim课题组[13]以HBT母体设计合成了用于检测蛋白质络氨酸磷酸酶(PTP)荧光探针23(图 24)。磷酸化作用抑制分子内羟基质子化作用,ESIPT受阻,仅产生烯醇式结构的荧光。当加入磷酸酶后,酶裂解反应释放出HBT分子,产生酮式和烯醇式双发射荧光。当探针23与人基因组其他磷酸酶(PTPs)同时孵育,当体系存在MKP-6(重组人MKP-6蛋白)时,535 nm处产生很强的荧光信号,加入磷酸酶(PTP)的抑制剂后,荧光增强信号完全受阻,证明MKP-6的活性是探针23水解的主要原因,荧光增强取决于酶的浓度和反应时间。荧光探针23作为增强型荧光探针,可以高选择性地响应PTP和MPK-6。
蛋白质由单体聚集成寡聚体的过程中,蛋白质会逐渐形成疏水空腔,导致局部微环境发生改变,基于ESIPT分子对极性微环境的敏感性,Jovin等[55]设计合成了荧光探针24(MFC)用于蛋白质聚集过程的检测(图 25)。在色酮分子的苯环上连接丁二酰亚胺的结构,通过丁二酰亚胺与突变的α-突触核蛋白上巯基发生发应,形成的共价键将荧光分子和α-突触核蛋白相连。在突变的α-突触核蛋白聚集过程中,逐渐形成疏水结构,导致探针分子的初始激发态(N*)和ESIPT的互变异构体(T*)荧光强度比(N*/T*)不断地减小,通过探针24的N*/T*的变化可以为α-突触核蛋白聚集过程提供连续的荧光检测。
基于同样的作用机理,Burger等[19]同样以3-羟基黄酮为母体设计合成碱基模拟物,并通过固相亚磷酰胺合成法将分子插入到寡聚核苷酸序列中,得到了荧光探针25(图 26)。当单链的DNA与其它单链形成双螺旋结构或者与蛋白质作用或者DNA出现错误配对时,荧光分子的微环境发生变化,分子的初始激发态(N*)和ESIPT的互变异构体显示出不同的比值(N*/T*)变化,探针25可以灵敏地检测DNA微环境的变化,可以很好地用于检测DNA与其它大分子的相互作用。
4 总结与展望
激发态分子内质子转移(ESIPT)分子因具有双荧光发射和较大的斯托克斯位移等诸多优点被广泛用于荧光传感器的设计。本文对用于离子(金属阳离子和阴离子)、中性小分子和生物大分子检测的ESIPT荧光探针进行了综述,分别从取代基的不同修饰对ESIPT分子影响的机制、分析物直接夺取ESIPT质子,阻断ESIPT过程的机制以及保护-去保护机制等方面进行阐述,同时介绍了ESIPT荧光分子在生物方面的应用。目前,ESIPT荧光团的发射波长较短(主要在蓝光或绿光区),不利于生物体的实时监测。另外,许多ESIPT分子易受环境的影响,比如在水溶液体系中其质子转移能力比较弱,不利于活体细胞内的检测,极大地限制了其在生物体内的应用能力。ESIPT分子开发利用还具有很大的发展空间,对于广大的科研工作者来说,设计合成理想的ESIPT荧光探针仍然是一项巨大的挑战。其面临的困难主要存在以下几个方面:1)常见的ESIPT荧光探针设计思路主要集中在保护-去保护机制上,即ESIPT分子内质子被取代基取代,ESIPT过程被阻断,当与待测物作用后,取代基离去,ESIPT过程得以恢复,发出荧光。该设计方法比较局限,检测手段比较单一,耗时长、实验操作繁琐等,往往不能达到预期的效果;2)ESIPT分子本身存在醇式和酮式双发射峰,如何利用双发射峰设计合成功能化的分子,是目前研究的重中之重,这需要我们更加深入了解结构和性质之间的关系,不断地总结和发现规律;3)ESIPT分子对极性微环境有很强的敏感性,分子很容易受周围环境的影响,如何调控和修饰ESIPT分子,使其在不影响分子功能的前提下改善和提高水溶性,广泛地应用于分子检测、细胞成像和医疗诊断等多个领域,是未来研究开发的重点。所有这些问题的研究与解决,需要不断结合其它相关领域,如能量转移、功能材料以及纳米科学等最新成果。
-
-
[1]
Lee M H, Kim J S, Sessler J L. Small Molecule-based Ratiometric Fluorescence Probes for Cations, Anions, and Biomolecules[J]. Chem Soc Rev, 2015, 44(13): 4185-4191. doi: 10.1039/C4CS00280F
-
[2]
Berezin M Y, Achilefu S. Fluorescence Lifetime Measurements and Biological Imaging[J]. Chem Rev, 2010, 110(5): 2641-2684. doi: 10.1021/cr900343z
-
[3]
Wu J S, Liu W M, Ge J C. New Sensing Mechanisms for Design of Fluorescent Chemosensors Emerging in Recent Years[J]. Chem Soc Rev, 2011, 40(7): 3483-3495. doi: 10.1039/c0cs00224k
-
[4]
Kwon J E, Park S Y. Advanced Organic Optoelectronic Materials:Harnessing Excited-State Intramolecular Proton Transfer(ESIPT) Process[J]. Adv Mater, 2011, 23(32): 3615-3642. doi: 10.1002/adma.v23.32
-
[5]
Hsieh C C, Jiang C M, Chou P T. Recent Experimental Advances on Excited-State Intramolecular Proton Coupled Electron Transfer Reaction[J]. Acc Chem Res, 2010, 43(10): 1364-1374. doi: 10.1021/ar1000499
-
[6]
Tang K C, Chang M J, Lin T Y. Fine Tuning the Energetics of Excited-State Intramolecular Proton Transfer(ESIPT):White Light Generation in a Single ESIPT System[J]. J Am Chem Soc, 2011, 133(44): 17738-17745. doi: 10.1021/ja2062693
-
[7]
Luxami V, Kumar S. Molecular Half-subtractor Based on 3, 3'-Bis(1H-benzimidazolyl-2-yl)[1, 1']binaphthalenyl-2, 2'-diol[J]. New J Chem, 2008, 32(12): 2074-2079. doi: 10.1039/b805558k
-
[8]
胡睿, 郭旭东, 杨国强. 激发态分子内质子转移化合物的性能及作为荧光化学传感器的应用研究[J]. 影像科学与光化学, 2013,31,(5): 335-348. doi: 10.7517/j.issn.1674-0475.2013.05.335HU Rui, GUO Xudong, YANG Guoqiang. Investigation on the Property of the ESIPT Compounds and Its Application as Fluorescence Chemical Sensor[J]. Imag Sci Photochem, 2013, 31(5): 335-348. doi: 10.7517/j.issn.1674-0475.2013.05.335
-
[9]
Wang J F, Li Y B, Patel N G. A Single Molecular Probe for Multi-analyte(Cr3+, Al3+ and Fe3+) Detection in Aqueous Medium and Its Biological Application[J]. Chem Commun, 2014, 50(82): 12258-12261. doi: 10.1039/C4CC04731A
-
[10]
Chu Q H, Medvetz D A, Pang Y. A Polymeric Colorimetric Sensor with Excited-State Intramolecular Proton Transfer for Anionic Species[J]. Chem Mater, 2007, 19(26): 6421-6429. doi: 10.1021/cm0713982
-
[11]
Ma J, Zhao J Z, Yang P. New Excited State Intramolecular Proton Transfer(ESIPT) Dyes Based on Naphthalimide and Observation of Long-lived Triplet Excited States[J]. Chem Commun, 2012, 48(78): 9720-9722. doi: 10.1039/c2cc35210a
-
[12]
Yang P, Zhao J Z, Wu W H. Accessing the Long-lived Triplet Excited States in Bodipy-conjugated 2-(2-Hydroxyphenyl) Benzothiazole/Benzoxazoles and Applications as Organic Triplet Photosensitizers for Photooxidations[J]. J Org Chem, 2012, 77(14): 6166-6178. doi: 10.1021/jo300943t
-
[13]
Kim T I, Kang H J, Han G. A Highly Selective Fluorescent ESIPT Probe for the Dual Specificity Phosphatase MKP-6[J]. Chem Commun, 2009, 39: 5895-5897.
-
[14]
Hu R, Feng J, Hu D H. A Rapid Aqueous Fluoride Ion Sensor with Dual Output Modes[J]. Angew Chem Int Ed, 2010, 49(29): 4915-4918. doi: 10.1002/anie.v49:29
-
[15]
Li X, Tao R R, Hong L J. Visualizing Peroxynitrite Fluxes in Endothelial Cells Reveals the Dynamic Progression of Brain Vascular Injury[J]. J Am Chem Soc, 2015, 137(38): 12296-12303. doi: 10.1021/jacs.5b06865
-
[16]
Sinha S, Chowdhury B, Ghosh P. A Highly Sensitive ESIPT-based Ratiometric Fluorescence Sensor for Selective Detection of Al3+[J]. Inorg Chem, 2016, 55(18): 9212-9220. doi: 10.1021/acs.inorgchem.6b01170
-
[17]
Tang L J, Shi J Z, Huang Z L. An ESIPT-based Fluorescent Probe for Selective Detection of Homocysteine and Its Application in Live-Cell Imaging[J]. Tetrahedron Lett, 2016, 57(47): 5227-5231. doi: 10.1016/j.tetlet.2016.10.034
-
[18]
Klymchenko A S, Shvadchak V V, Yushchenko D A. Excited-State Intramolecular Proton Transfer Distinguishes Microenvironments in Singleand Double-stranded DNA[J]. J Phys Chem B, 2008, 112(38): 12050-12055. doi: 10.1021/jp8058068
-
[19]
Dziuba D, Postupalenko V Y, Spadafora M. A Universal Nucleoside with Strong Two-band Switchable Fluorescence and Sensitivity to the Environment for Investigating DNA Interactions[J]. J Am Chem Soc, 2012, 134(24): 10209-10213. doi: 10.1021/ja3030388
-
[20]
Kenfack C A, Klymchenko A S, Duportail G. Ab Initio Study of the Solvent H-Bonding Effect on ESIPT Reaction and Electronic Transitions of 3-Hydroxychromone Derivatives[J]. Phys Chem Chem Phys, 2012, 14(25): 8910-8918. doi: 10.1039/c2cp40869d
-
[21]
Paul B K, Guchhait N. 1-Hydroxy-2-naphthaldehyde:A Prospective Excited-State Intramolecular Proton Transfer(ESIPT) Probe with Multi-faceted Applications[J]. J Lumin, 2012, 132(8): 2194-2208. doi: 10.1016/j.jlumin.2012.03.036
-
[22]
Hadjoudis E, Mavridis I M. Photochromism and Thermochromism of Schiff Bases in the Solid State:Structural Aspects[J]. Chem Soc Rev, 2004, 33(9): 579-88.
-
[23]
Han D Y, Kim J M, Kim J H. ESIPT-based Anthraquinonylcalix[4] crown Chemosensor for In3+[J]. Tetrahedron Lett, 2010, 51(15): 1947-1951. doi: 10.1016/j.tetlet.2010.02.006
-
[24]
Schmidtke S J, Underwood D F, Blank D A. Following the Solvent Directly During Ultrafast Excited State Proton Transfer[J]. J Am Chem Soc, 2004, 126(28): 8620-8621. doi: 10.1021/ja048639g
-
[25]
Chien T C, Dias L G, Arantes G M. 1-(2-Quinolyl)-2-naphthol:A New Intra-Intermolecular Photoacid Photobase Molecule[J]. J Photochem Photobiol A, 2008, 194(1): 37-48. doi: 10.1016/j.jphotochem.2007.07.012
-
[26]
SakaiK I, Takahashi S, Kobayashi A. Excited State Intramolecular Proton Transfer(ESIPT) in Six-coordinated Zinc(Ⅱ)-Quinoxaline Complexes with Ligand Hydrogen Bonds:Their Fluorescent Properties Sensitive to Axial Positions[J]. Dalton Trans, 2010, 39(8): 1989-1995. doi: 10.1039/b919613g
-
[27]
张鹏, 张有明, 林奇. 金属离子响应型荧光传感分子的设计原理及研究进展[J]. 有机化学, 2014,37,(7): 1300-1321. ZHANG Peng, ZHANG Youming, LIN Qi. Principle and the Research Progress of Fluorescent Chemosensors for Cations Recognition[J]. Chinese J Org Chem, 2014, 37(7): 1300-1321.
-
[28]
Gao M, Yu F B, Lv C J. Fluorescent Chemical Probes for Accurate Tumor Diagnosis and Targeting Therapy[J]. Chem Soc Rev, 2017, 46(8): 2237-2271. doi: 10.1039/C6CS00908E
-
[29]
Sinkeldam R W, Greco N J, Tor Y. Fluorescent Analogs of Biomolecular Building Blocks:Design, Properties, and Applications[J]. Chem Rev, 2010, 110(5): 2579-2619. doi: 10.1021/cr900301e
-
[30]
Xu, PangY. Zn2+-Triggered Excited-State Intramolecular Proton Transfer:A Sensitive Probe with Near-infrared Emission from Bis(benzoxazole) Derivative[J]. Dalton Trans, 2011, 40(7): 1503-1509. doi: 10.1039/c0dt01376e
-
[31]
Huang L Y, Gu B, Su W. Proton Donor Modulating ESIPT-based Fluorescent Probes for Highly Sensitive and Selective Detection of Cu2+[J]. RSC Adv, 2015, 5(93): 76296-76301. doi: 10.1039/C5RA14443D
-
[32]
Chen X Q, Pradhan T H, Wang F. Fluorescent Chemosensors Based on Spiroring-opening of Xanthenes and Related Derivatives[J]. Chem Rev, 2012, 112(3): 1910-1956. doi: 10.1021/cr200201z
-
[33]
Xu Y Q, Xiao L L, Zhang Y F. Substituent Effect on Fluorophores Instead of Ionophores:Its Implication in Highly Selective Fluorescent Probes for Zn2+ over Cd2+[J]. RSC Adv, 2014, 4(10): 4827-4830. doi: 10.1039/c3ra46468g
-
[34]
Xu Y Q, Xiao L L, Sun S G. Switchable and Selective Detection of Zn2+ or Cd2+ in Living Cells Based on 3'-O-substituted Arrangement of Benzoxazole-derived Fluorescent Probes[J]. Chem Commun, 2014, 50(56): 7514-7516. doi: 10.1039/C4CC02335H
-
[35]
Gale P A, Caltagirone C. Anion Sensing by Small Molecules and Molecular Ensembles[J]. Chem Soc Rev, 2015, 44(13): 4212-4227. doi: 10.1039/C4CS00179F
-
[36]
Ashton T D, Jolliffe K A, Pfeffer F M. Luminescent Probes for the Bioimaging of Small Anionic Species in Vitro and in Vivo[J]. Chem Soc Rev, 2015, 44(14): 4547-4595. doi: 10.1039/C4CS00372A
-
[37]
Wu Y K, Peng X J, Fan J L. Fluorescence Sensing of Anions Based on Inhibition of Excited-State Intramolecular Proton Transfer[J]. J Org Chem, 2007, 72(1): 62-70. doi: 10.1021/jo061634c
-
[38]
Goswami S, Manna A, Paul S. Resonance-assisted Hydrogen Bonding Induced Nucleophilic Addition to Hamper ESIPT:Ratiometric Detection of Cyanide in Aqueous Media[J]. Chem Commun, 2013, 49(28): 2912-2914. doi: 10.1039/c3cc39256b
-
[39]
Porel M, Ramalingam V, Domaradzki M E. Chloride Sensing via Suppression of Excited State Intramolecular Proton Transfer in Squaramides[J]. Chem Commun, 2013, 49(16): 1633-1635. doi: 10.1039/c3cc38767d
-
[40]
Chen W H, Xing Y, Pang Y. A Highly Selective Pyrophosphate Sensor Based on ESIPT Turn-on in Water[J]. Org Lett, 2011, 13(6): 1362-1365. doi: 10.1021/ol200054w
-
[41]
Sedgwick A C, Sun X L, Kim G. Boronate Based Fluorescence(ESIPT) Probe for Peroxynitrite[J]. Chem Commun, 2016, 52(83): 12350-12352. doi: 10.1039/C6CC06829D
-
[42]
Pan Y M, Huang J, Han Y F. A New ESIPT-based Fluorescent Probe for Highly Selective and Sensitive Detection of HClO in Aqueous Solution[J]. Tetrahedron Lett, 2017, 58(13): 1301-1304. doi: 10.1016/j.tetlet.2017.02.043
-
[43]
Xiao L L, Sun S G, Pei Z C. A Ga3+ Self-assembled Fluorescent Probe for ATP Imaging in Vivo[J]. Biosens Bioelectron, 2015, 65: 166-170. doi: 10.1016/j.bios.2014.10.038
-
[44]
Chen X Q, Zhou Y, Peng X J. Fluorescent and Colorimetric Probes for Detection of Thiols[J]. Chem Soc Rev, 2010, 39(6): 2120-2135. doi: 10.1039/b925092a
-
[45]
Fernandez A, Vendrell M. Smart Fluorescent Probes for Imaging Macrophage Activity[J]. Chem Soc Rev, 2016, 45(5): 1182-1196. doi: 10.1039/C5CS00567A
-
[46]
Xiao L L, Tu J, Sun S G. A Fluorescent Probe for Hydrazine and Its in Vivo Applications[J]. RSC Adv, 2014, 4(79): 41807-41811. doi: 10.1039/C4RA08101C
-
[47]
Chen Z, Zhong X X, Qu W B. A Highly Selective HBT-based "Turn-On" Fluorescent Probe for Hydrazine Detection and Its Application[J]. Tetrahedron Lett, 2017, 58(26): 2596-2601. doi: 10.1016/j.tetlet.2017.05.071
-
[48]
Zhang D, Yang Z H, Li H J. A Simple Excited-State Intramolecular Proton Transfer Probe Based on a New Strategy of Thiol-azide Reaction for the Selective Sensing of Cysteine and Glutathione[J]. Chem Commun, 2016, 52(4): 749-752. doi: 10.1039/C5CC07298K
-
[49]
Goswami S, Manna A, Paul S. A Turn On ESIPT Probe for Rapid and Ratiometric Fluorogenic Detection of Homocysteine and Cysteine in Water with Live Cell-Imaging[J]. Tetrahedron Lett, 2014, 55(2): 490-494. doi: 10.1016/j.tetlet.2013.11.055
-
[50]
Liu X J, Tian H H, Yang L. A Sensitive and Selective Fluorescent Probe for the Detection of Hydrogen Peroxide with a Red Emission and a Large Stokes Shift[J]. Sens Actuators B, 2018, 255: 1160-1165. doi: 10.1016/j.snb.2017.05.151
-
[51]
Li G P, Zhu D J, Liu Q. Rapid Detection of Hydrogen Peroxide Based on Aggregation Induced Ratiometric Fluorescence Change[J]. Org Lett, 2013, 15(4): 924-927. doi: 10.1021/ol4000845
-
[52]
Wang L Q, Zang Q G, Chen W S. A Ratiometric Fluorescent Probe with Excited-State Intramolecular Proton Transfer for Benzoyl Peroxide[J]. RSC Adv, 2013, 3(23): 8674-8676. doi: 10.1039/c3ra41209a
-
[53]
Deng B B, Ren M G, Kong X Q. An ESIPT Based Fluorescent Probe for Imaging Hydrogen Sulfide with a Large Turn-On Fluorescence Signal[J]. RSC Adv, 2016, 6(67): 62406-62410. doi: 10.1039/C6RA12127F
-
[54]
Chen L Y, Wu D, Lim C S. A Two-photon Fluorescent Probe for Specific Detection of Hydrogen Sulfide Based on a Familiar ESIPT Fluorophore Bearing AIE Characteristics[J]. Chem Commun, 2017, 53(35): 4791-4794. doi: 10.1039/C7CC01695F
-
[55]
Yushchenko D A, Fauerbach J A, Thirunavukkuarasu S. Fluorescent Ratiometric MFC Probe Sensitive to Early Stages of α-Synuclein Aggregation[J]. J Am Chem Soc, 2010, 132(23): 7860-7861. doi: 10.1021/ja102838n
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 233
- 文章访问数: 13653
- HTML全文浏览量: 3838

























 下载:
下载:


























 下载:
下载:

