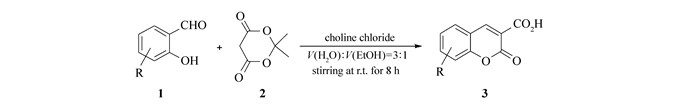
 Scheme1.
The synthetic root of coumarin-3-carboxylic acids
Scheme1.
The synthetic root of coumarin-3-carboxylic acids

Citation: XIAO Di, ZHENG Wang, WEI Xiaoyu, LANG Jian, GAO Shuangqiu, LYU Chengwei. Choline Chloride Promoted Synthesis of Coumarin-3-carboxylic Acids[J]. Chinese Journal of Applied Chemistry, 2017, 34(11): 1295-1300. doi: 10.11944/j.issn.1000-0518.2017.11.170005

氯化胆碱催化合成香豆素-3-羧酸
English
Choline Chloride Promoted Synthesis of Coumarin-3-carboxylic Acids
-
Key words:
- coumarin-carboxylic acids
- / choline chloride
- / water
- / room temperature
- / green synthesis
-
香豆素及其衍生物是一类广泛存在于自然界中的重要杂环化合物,由于具有相对分子质量小、合成方法相对简单、生物利用率高、分子内具有较大的共轭体系和刚性稠环结构等特点,在食品、医药、农药、香料、染料、光电材料和超分子识别等领域均有重要的应用[1-5]。临床上用于抗凝血和淋巴管性水肿治疗的华法林、双香豆素和新抗凝都属于香豆素类化合物[6]。香豆素-3-羧酸是香豆素的重要衍生物,也是构筑各种含有香豆素骨架的天然及合成分子的重要前体[7]。鉴于香豆素-3-羧酸的高使用价值,对其合成工艺的研究一直是热门领域[8]。目前,最简便的合成香豆素-3-羧酸的方法之一是利用水杨醛与含有活泼亚甲基的麦氏酸发生Knoevenagal缩合-分子内环化反应[9-11]。虽然在无催化剂的条件下可以实现该类化合物的合成[9, 12-14],但存在反应温度高、时间长、产率较低等问题[15]。近年来发展了多种酸性或碱性的催化体系促进该反应的进行。尤其在NaN3[16]、金合欢水萃物[17]和柠檬汁等[15]的作用下,已经实现了室温条件下高产率地合成香豆素-3-羧酸。可是在进一步优化反应条件、简化操作过程、提高产率和扩大底物适应范围等方面仍有很大的发展空间[15-16]。
绿色化学又称环境友好化学,是当今化学学科研究的前沿[18-19]。绿色合成更注重对反应溶剂的选择,水具有价廉、无毒、环境友好等优点,以水或水-有机混合溶剂作为反应介质的新策略不断涌现[20-22]。但水作为反应溶剂面临的主要问题是它对有机物的溶解性,与催化剂的兼容性和产物的分离等[23-24]。根据文献报道[25-26]和我们实验室的经验[27-28],使用无害的乙醇作为辅助溶剂可以有效改善水对底物的溶解性,促进反应进行,还可以简化产物的分离和提纯过程。另一方面,氯化胆碱与众多氢键供体形成的低共熔溶剂作为一类新型绿色反应介质已广泛应用于各种有机反应[29-31]。我们推测氯化胆碱应该能够有效地催化水相中的反应,因为它既具有季铵盐的结构可以起到相转移催化剂的作用,又可能会与水通过氢键作用形成更加高效的催化组分。综上所述,本文在实验室前期合成香豆素衍生物工作的基础上[32-33]以氯化胆碱为催化剂,在水和乙醇的混合液中促进水杨醛与麦氏酸缩合制备香豆素-3-羧酸(Scheme 1)。
1 实验部分
1.1 仪器和试剂
X-5型数字熔点仪(北京泰克仪器有限公司);Bruker TENSOR 27型红外光谱仪测定(KBr压片) (德国Bruker公司);Bruker Avance 500 MHz型核磁共振仪测定(德国Bruker公司),CDCl3或DMSO-d6为溶剂,TMS为内标。
实验中使用的水杨醛及取代的2-羟基苯甲醛均为分析纯试剂,分别购置于阿拉丁试剂有限公司和萨恩化学技术有限公司。氯化胆碱(≥98%)、四丁基溴化铵(TBAB)(≥99%)和苄基三乙基氯化铵(TEBAC)(≥98%)购置于萨恩化学技术有限公司。
1.2 实验方法
将0.0140 g(0.1 mmol)氯化胆碱和1 mL溶剂(V(H2O):V(EtOH)=3:1)加入10 mL反应管中,室温搅拌10 min后,再加入0.5 mmol水杨醛和0.0821 g(0.57 mmol)麦氏酸,继续反应8 h。反应结束后,加入1 mL体积分数为20%乙醇,100 ℃下,快速搅拌10 min以除去杂质和催化剂。充分冷却后抽滤,滤饼用适量冷的20%乙醇淋洗,抽干后不需要进一步的提纯即可得到相应的纯净产物。化合物结构数据如下:
香豆素-3-羧酸(3a):白色固体; IR(KBr), σ/cm-1:3062, 1751, 1681, 1612, 1427, 1218, 1041;1H NMR(500 MHz, CDCl3), δ:12.08(s, H), 8.96(s, 1H), 7.81~7.77(m, 2H), 7.52~7.48(m, 2H)。
6-硝基香豆素-3-羧酸(3b):黄色固体; IR(KBr), σ/cm-1:3286, 3070, 1735, 1612, 1527, 1350, 1234, 1018, 802, 740;1H NMR(500 MHz, CDCl3), δ:9.02(s, 1H), 8.69(s, 1H), 8.62(d, J=9.1 Hz, 1H), 7.66(d, J=9.1 Hz, 1H)。
6-氯香豆素-3-羧酸(3c):白色固体; IR(KBr), σ/cm-1:3042, 1748, 1688, 1555, 1471, 1345, 1248, 1008, 947, 803;1H NMR(500 MHz, CDCl3), δ:12.08(s, 1H), 8.88(s, 1H), 7.73(d, J=9.8 Hz, 2H), 7.46(d, J=8.6 Hz, 1H)。
6-溴香豆素-3-羧酸(3d):白色固体; IR(KBr), σ/cm-1:3047, 1759, 1674, 1604, 1558, 1365, 1211, 1026, 810;1H NMR(500 MHz, CDCl3), δ:12.06(s, 1H), 8.86(s, 1H), 7.89(s, 1H), 7.86(d, J=9.1 Hz, 1H), 7.39(d, J=8.8 Hz, 1H)。
6, 8-二氯香豆素-3-羧酸(3e):乳白色固体; IR(KBr), σ/cm-1:3062, 1751, 1620, 1450, 1386, 1242, 1064, 1010, 956;1H NMR(500 MHz, CDCl3), δ:8.86(s, 1H), 7.81(s, 1H), 7.67(s, 1H)。
6, 8-二溴香豆素-3-羧酸(3f):淡黄色固体; IR(KBr), σ/cm-1:3062, 1766, 1612, 1550, 1434, 1234, 987;1H NMR(500 MHz, CDCl3), δ:11.86(s, 1H), 8.82(s, 1H), 8.10(s, 1H), 7.83(s, 1H)。
6-甲基香豆素-3-羧酸(3g):白色固体; IR(KBr), σ/cm-1:3062, 1743, 1674, 1604, 1573, 1373, 1218, 1157, 1026, 817;1H NMR(500 MHz, CDCl3), δ:12.29(s, 1H), 8.89(s, 1H), 7.58(d, J=8.4 Hz, 1H), 7.52(s, 1H), 7.38(d, J=8.5 Hz, 1H), 2.48(s, 3H)。
6-甲氧基香豆素-3-羧酸(3h):黄色固体; IR(KBr), σ/cm-1:3055, 1759, 1674, 1573, 1496, 1404, 1234, 1026, 802;1H NMR(500 MHz, CDCl3), δ:12.34(s, 1H), 8.90(s, 1H), 7.42(d, J=9.1 Hz, 1H), 7.36(d, J=9.2 Hz, 1H), 7.13(s, 1H), 3.91(s, 3H)。
7-甲氧基香豆素-3-羧酸(3i):黄色固体; IR(KBr), σ/cm-1:3047, 1728, 1612, 1504, 1380, 1218, 1018, 810;1H NMR(500 MHz, DMSO-d6), δ:12.93(s, 1H), 8.71(s, 1H), 7.82(d, J=8.6 Hz, 1H), 7.02(s, 1H), 7.00(d, J=8.8 Hz, 1H), 3.88(s, 3H)。
6-羟基香豆素-3-羧酸(3j):黄色固体; IR(KBr), σ/cm-1:3417, 3178, 1728, 1573, 1496, 1380, 1249, 1049, 825;1H NMR(500 MHz, DMSO-d6), δ:13.11(s, 1H), 9.84(s, 1H), 8.64(s, 1H), 7.28(d, J=8.8 Hz, 1H), 7.19(s, 1H), 7.14 (dd, J=8.8, 1.9 Hz, 1H)。
7-羟基香豆素-3-羧酸(3k):黄色固体; IR(KBr), σ/cm-1:3139, 1712, 1615, 1559, 1490, 1371, 1260, 1218, 1120, 1056, 910, 856;1H NMR(500 MHz, DMSO-d6), δ:12.80(s, 1H), 11.07(s, 1H), 8.67(s, 1H), 7.73(d, J=8.6 Hz, 1H), 6.84(dd, J=8.6, 2.0 Hz, 1H), 6.73(d, J=1.9 Hz, 1H)。
3-氧代-3H-苯并吡喃-2-羧酸(3l):浅绿色固体; IR(KBr), σ/cm-1:3062, 1743, 1697, 1566, 1504, 1326, 1226, 1026, 956;1H NMR(500 MHz, CDCl3), δ:12.31(s, 1H), 9.71(s, 1H), 8.45(d, J=8.4 Hz, 1H), 8.25(d, J=9.0 Hz, 1H), 8.00(d, J=8.1 Hz, 1H), 7.84 (t, J=7.7 Hz, 1H), 7.71(t, J=7.5 Hz, 1H), 7.59(d, J=9.1 Hz, 1H)。
2 结果与讨论
2.1 反应条件筛选
首先,以0.5 mmol水杨醛与0.5 mmol麦氏酸在室温下的反应为模型,优化最佳反应条件,结果见表 1。在氯化胆碱的作用下,水杨醛与麦氏酸在水相中反应可以获得中等程度收率的产物(表 1, Entry 1)。根据我们实验室的经验和文献报道[25-28],使用无害的乙醇作为辅助溶剂可以有效改善水对底物的溶解性,促进反应进行。实验结果显示加入适量的乙醇或甲醇确实可以提高香豆素-3-羧酸的产率,但进一步增大乙醇的比例对反应不利(表 1, Entry 4)。考虑到乙醇更加绿色环保,使用乙醇作为辅助溶剂(表 1, Entry 2)。由于氯化胆碱具有季铵盐的结构,因此,我们又考察了具有季铵盐结构的相转移催化剂苄基三乙基氯化铵和四丁基溴化铵对反应的影响(表 1, Entries 5, 6),结果表明氯化胆碱的催化能力高于后二者。进一步研究反应温度、反应时间和原料的物料比等因素对反应的影响,发现增加麦氏酸的用量可以提高产物的产率(表 1, Entry 7)。升高反应温度不能明显改善反应的收率,但反应时间可以缩短(表 1, Entries 8, 9)。因为发展室温条件下的反应是当今绿色化学的一个重要研究方向,所以选择在室温下进行反应。在上述的反应条件下催化剂的摩尔分数可以降低到20%,而且产率略有上升(表 1, Entry 12)。最后,考察了最佳反应时间,延长反应时间产率没有明显变化,缩短反应时间对反应不利(表 1, Entries 14, 15)。综上所述,最优的反应条件是:0.5 mmol水杨醛与0.57 mmol的麦氏酸在0.1 mmol的氯化胆碱催化下,1 mL水和乙醇的混合液中室温反应8 h。
 表 1
水杨醛与麦氏酸缩合反应条件的优化
Table 1.
Screening the reaction conditions for the condensation of salicylaldehyde and Meldrum's acid
表 1
水杨醛与麦氏酸缩合反应条件的优化
Table 1.
Screening the reaction conditions for the condensation of salicylaldehyde and Meldrum's acid
Entry Molar fraction of catalyst/% Solvent Volume/mL Temperature/℃ Time/h Yield/%c 1a Choline chloride/30 H2O 1.0 25 8 81 2 Choline chloride/30 V(H2O):V(EtOH)=3:1 1.0 25 8 88 3 Choline chloride/30 V(H2O):V(MeOH)=3:1 1.0 25 8 86 4 Choline chloride/30 V(H2O):V(EtOH)=2:1 1.0 25 8 84 5 TEBAC/30 V(H2O):V(EtOH)=3:1 1.0 25 8 85 6 TBAB/30 V(H2O):V(EtOH)=3:1 1.0 25 8 82 7b Choline chloride/30 V(H2O):V(EtOH)=3:1 1.0 25 8 93 8 Choline chloride/30 V(H2O):V(EtOH)=3:1 1.0 30 8 93 9 Choline chloride/30 V(H2O):V(EtOH)=3:1 1.0 40 8 92 10 Choline chloride/30 V(H2O):V(EtOH)=3:1 0.5 25 8 91 11 Choline chloride/30 V(H2O):V(EtOH)=3:1 1.5 25 8 93 12 Choline chloride/20 V(H2O):V(EtOH)=3:1 1.0 25 8 95 13 Choline chloride/15 V(H2O):V(EtOH)=3:1 1.0 25 8 90 14 Choline chloride/20 V(H2O):V(EtOH)=3:1 1.0 25 7 93 15 Choline chloride/20 V(H2O):V(EtOH)=3:1 1.0 25 9 95 a.Entries 1~6, the reactions were carried out with salicylaldehyde/Meldrum′s acid(0.5 mmol/0.5 mmol) at room temperature; b.entries 7~15, the reactions were carried out with salicylaldehyde/Meldrum's acid(0.5 mmol/0.57 mmol); c.isolated yield. 2.2 反应的适用性探讨
在最佳反应条件下,系统地考察了不同取代的水杨醛与麦氏酸的缩合反应。由表 2可看出,该方法的底物适应范围较广,众多取代的水杨醛均能顺利地进行反应。电子效应对醛的反应活性略有影响,当苯环上连有吸电子取代基时,对应的目标化合物的产率稍有下降。当苯环上连有强吸电子基团时,例如硝基或两个氯原子,产物收率下降明显(表 2, Entries 2, 6)。含有供电子基团的醛与未取代的水杨醛活性相当(表 2, Entries 7~11)。从文献[9]综述的结果来看,在大部分反应体系中奈基的水杨醛(2-羟基-1-奈甲醛)反应活性较低,只能获得中等收率的产物。而在本实验中适当的升高反应温度到50 ℃和延长反应时间就能获得超过90%的产率(表 2, Entry 12)。由于氯化胆碱能溶于水、易于分离,所以反应结束后不需进行额外的提纯操作,只需向反应体系中再加入1 mL 20%(体积分数)乙醇并在100 ℃下搅拌10 min就可以达到去除杂质和催化剂的目的,获得纯净的目标化合物。整个合成和提纯过程简便易行。
Entrya Product Yield/%b mp/℃ 1 
95 190~192(188~190[33]) 2 
90 228~230(231~233[33]) 3 
92 187~189(158~160[33]) 4 
92 198~201(201~203[33]) 5 
88 215~216(201~203[33]) 6 
96 213~215(217~219[33]) 7 
94 169~170(164~166[33]) 8 
94 212~214(192~194[17]) 9 
95 199~201(194~196[33]) 10 
94 >300(200[10]) 11 
92 268~270(268~270[33]) 12c 
91 240~242(235~237[33]) a.The reactions were carried out with 0.5 mmol salicylaldehyde and 0.57 mmol Meldrum's acid in 1.0 mL V(H2O):V(EtOH)=3:1 at room temperature for 8 h; b.isolated yield; c.reaction was conducted in 2.0 mL V(H2O):V(EtOH)=3:1 solution at 50 ℃ for 24 h. 3 结论
在氯化胆碱与水和乙醇组成的反应体系中,多种取代的水杨醛可以顺利的与麦氏酸进行反应。该方法不需要大量使用有机溶剂,不使用金属催化剂,反应结束后不需要复杂的后处理过程就可以高产率地获得纯净的目标产物,是香豆素-3-羧酸类化合物的一种简便、绿色、高效的合成方法。与本实验室的前期工作相比,该方法实现了在室温条件下合成香豆素-3-羧酸、扩展了底物的适用范围、提高了目标产物的产率。
-
-
[1]
熊敏秋, 席海涛, 付永胜. 新型香豆素荧光探针的合成及其对三聚氰胺的识别性能研究[J]. 有机化学, 2010,30,(6): 908-911. XIONG Minqiu, XI Haitao, FU Yongsheng. Synthesis and Properties of Novel Coumarin-based Fluorescent Probes for Identifying Melamine[J]. Chinese J Org Chem, 2010, 30(6): 908-911.
-
[2]
王辉, 郑伟华, 谢凤妮. 香豆素席夫碱衍生物的合成及抗肿瘤活性研究[J]. 有机化学, 2011,31,(5): 708-714. WANG Hui, ZHENG Weihua, XIE Fengni. Synthesis and Biological Evaluation of Coumarin Schiff Base Derivatives as Novel Antitumor Inhibitors[J]. Chinese J Org Chem, 2011, 31(5): 708-714.
-
[3]
Wei J, Wang P, Jia Q. Amine-catalyzed Cascade Synthesis of 3, 4-Diunsubstituted Coumarins[J]. Eur J Org Chem, 2013, 2013(21): 4499-4502. doi: 10.1002/ejoc.201300538
-
[4]
Sandhu S, Bansal Y, Silakari O. Coumarin Hybrids as Novel Therapeutic Agents[J]. Bioorg Med Chem, 2014, 22(15): 3806-3814. doi: 10.1016/j.bmc.2014.05.032
-
[5]
Niharika P, Ramulu B V, Satyanarayana G. Lewis Acid Promoted Dual Bond Formation:Facile Synthesis of Dihydrocoumarins and Spiro-tetracyclic Dihydrocoumarins[J]. Org Biomol Chem, 2014, 12(25): 4347-4360. doi: 10.1039/C4OB00490F
-
[6]
申东升, 刘小帆, 杨广照. 香豆素类抗凝血药及其类似物的合成[J]. 应用化学, 2005,22,(10): 1158-1160. doi: 10.3969/j.issn.1000-0518.2005.10.027SHEN Dongsheng, LIU Xiaofan, YANG Guangzhao. Synthesis of Coumarin Anticoagulant and Its Analogues[J]. Chinese J Appl Chem, 2005, 22(10): 1158-1160. doi: 10.3969/j.issn.1000-0518.2005.10.027
-
[7]
Suresh D K, Sandhu J S. Synthesis of 5-Arylidene-2, 2-dimethyl-1, 3-dioxane-4, 6-diones and Coumarin-3-carboxylic Acids via Reaction of Nitrones and Meldrum's Acid[J]. Indian J Chem Sec B, 2013, 52B(8): 1157-1160.
-
[8]
Fiorito S, Genovese S, Taddeo V A. Microwave Assisted Synthesis of Coumarin-3-carboxylic Acids under Ytterbium Triflate Catalysis[J]. Tetrahedron Lett, 2015, 56(19): 2434-2436. doi: 10.1016/j.tetlet.2015.03.079
-
[9]
Vekariya R H, Patel H D. Recent Advances in the Synthesis of Coumarin Derivatives via Knoevenagel Condensation:A Review[J]. Synth Commun, 2014, 44(19): 2756-2788. doi: 10.1080/00397911.2014.926374
-
[10]
Undale K A, Gaikwad D S, Shaikh T S. Potassium Phosphate Catalyzed Efficient Synthesis of 3-Carboxycoumarins[J]. Indian J Chem Sec B, 2012, 51B(7): 1039-1042.
-
[11]
杨国玉, 王彩霞, 樊素芳. 微波辅助无溶剂合成3-三氟乙酰基香豆素类化合物[J]. 有机化学, 2015,35,(5): 1173-1178. YANG Guoyu, WANG Caixia, FAN Sufang. Microwave Assisted Solvent-Free Synthesis of 3-(Trifluoroacetyl)coumarins[J]. Chinese J Org Chem, 2015, 35(5): 1173-1178.
-
[12]
Maggi R, Bigi F, Carloni S. Uncatalysed Reactions in Water:Part 2.Preparation of 3-Carboxycoumarins[J]. Green Chem, 2001, 3(4): 173-174. doi: 10.1039/b101822c
-
[13]
Deshmukh M N, Burud R, Baldino C. A Practical and Environmentally Friendly Preparation of 3-Carboxycoumarins[J]. Synth Commun, 2003, 33(19): 3299-3303. doi: 10.1081/SCC-120023987
-
[14]
Kumar D, Kumar S, Makrandi J K. Aqueous-mediated Green Synthesis of 3-Carboxyxoumarins Using Grinding Technique[J]. Green Chem Lett Rev, 2015, 8(2): 21-25. doi: 10.1080/17518253.2015.1058975
-
[15]
Fiorito S, Taddeo V A, Genovese S. A Green Chemical Synthesis of Coumarin-3-carboxylic and Cinnamicacids Using Crop-derived Products and Waste Waters as Solvents[J]. Tetrahedron Lett, 2016, 57(43): 4795-4798. doi: 10.1016/j.tetlet.2016.09.023
-
[16]
Brahmachari G. Room Temperature One-Pot Green Synthesis of Coumarin-3-carboxylic Acids in Water:A Practical Method for the Large-scale Synthesis[J]. ACS Sustainable Chem Eng, 2015, 3(9): 2350-2358. doi: 10.1021/acssuschemeng.5b00826
-
[17]
Chavan H V, Bandgar B P. Aqueous Extract of Acacia Concinna Pods:An Efficient Surfactant Type Catalyst for Synthesis of 3-Carboxycoumarins and Cinnamic Acids via Knoevenagel Condensation[J]. ACS Sustainable Chem Eng, 2013, 1(8): 929-936. doi: 10.1021/sc4000237
-
[18]
Gu Y. Multicomponent Reactions in Unconventional Solvents:State of the Art[J]. Green Chem, 2012, 14(8): 2091-2128. doi: 10.1039/c2gc35635j
-
[19]
Bodaghifard M A, Solimannejad M, Asadbegi S. Mild and Green Synthesis of Tetrahydrobenzopyran, Pyranopyrimidinone and Polyhydroquinoline Derivatives and DFT Study on Product Structures[J]. Res Chem Intermed, 2016, 42(2): 1165-1179. doi: 10.1007/s11164-015-2079-1
-
[20]
王喜存, 张彰, 权正军. 水介质中N-芳基-N'-(2-苯并呋喃甲酰基)硫脲及1-芳甲酰基-4-(2'-苯并呋喃甲酰基)氨基硫脲的合成[J]. 有机化学, 2006,26,(7): 967-970. WANG Xicun, ZHANG Zhang, QUAN Zhengjun. Synthesis of N-Aryl-N'-(2-benzofuroyl)-thioureas and 1-Aroyl-4-(2'-benzofuroyl)-thiosemicarbazides in Aqueous Media[J]. Chinese J Org Chem, 2006, 26(7): 967-970.
-
[21]
Gawande M B, Bonifácio V D B, Luque R. Benign by Design:Catalyst-free In-water, On-water Green Chemical Methodologies in Organic Synthesis[J]. Chem Soc Rev, 2013, 42(12): 5522-5551. doi: 10.1039/c3cs60025d
-
[22]
Xiao J, Wen H, Wang L. Catalyst-free Dehydrative SN1-type Reaction of Indolyl Alcohols with Diverse Nucleophiles "On Water"[J]. Green Chem, 2016, 18(4): 1032-1037. doi: 10.1039/C5GC01838B
-
[23]
Venkatesan K, Pujari S S, Srinivasan K V. Proline-catalyzed Simple and Efficient Synthesis of 1, 8-Dioxo-decahydroacridines in Aqueous Ethanol Medium[J]. Synth Commun, 2009, 39(2): 228-241.
-
[24]
李正凯, 吴之清, 邓杭. 铜催化水相Ullmann类型偶联反应研究进展[J]. 有机化学, 2013,33,(4): 760-770. LI Zhengkai, WU Zhiqing, DENG Hang. Progress in Copper-catalyzed Ullmann-type Coupling Reactions in Water[J]. Chinese J Org Chem, 2013, 33(4): 760-770.
-
[25]
Sadeh F N, Maghsoodlou M T, Hazeri N. A Facile and Efficient Synthesis of Tetrahydrobenzo[J]. Res Chem Intermed, 2015, 41(8): 5907-5914. doi: 10.1007/s11164-014-1710-x
-
[26]
Shabalala N, Maddila S, Jonnalagadda S B. Catalyst-Free, One-pot, Four-component Green Synthesis of Functionalized 1-(2-Fluorophenyl)-1, 4-dihydropyridines under Ultrasound Irradiation[J]. New J Chem, 2016, 40(6): 5107-5112. doi: 10.1039/C5NJ03574K
-
[27]
吕成伟, 刘妍杭, 王佳晶. 磷酸二氢钾催化Yonemitsu缩合反应合成5-[(3-吲哚基)-芳甲基]-2, 2-二甲基-1, 3-二噁烷-4, 6-二酮衍生物[J]. 应用化学, 2015,32,(12): 1371-1378. doi: 10.11944/j.issn.1000-0518.2015.12.150165LYU Chengwei, LIU Yanhang, WANG Jiajing. KH2PO4 Catalyzed Yonemitsu Condensation Synthesis of 5-[(Indol-3-yl)-arylmethyl]-2, 2-dimethyl-1, 3-dioxane-4, 6-dione Derivatives[J]. Chinese J Appl Chem, 2015, 32(12): 1371-1378. doi: 10.11944/j.issn.1000-0518.2015.12.150165
-
[28]
Yü S, Wu S, Zhao M. Green and Efficient Synthesis of Acridine-1, 8-diones and Hexahydroquinolines via a KH2PO4 Catalyzed Hantzsch-type Reaction in Aqueous Ethanol[J]. Res Chem Intermed, 2017, 43(5): 3121-3130. doi: 10.1007/s11164-016-2814-2
-
[29]
Liu P, Hao J W, Mo L P. Recent Advances in the Application of Deep Eutectic Solvents as Sustainable Media as well as Catalysts in Organic Reactions[J]. RSC Adv, 2015, 5(60): 48675-48704. doi: 10.1039/C5RA05746A
-
[30]
熊兴泉, 韩骞, 石霖. 低共熔溶剂在绿色有机合成中的应用[J]. 有机化学, 2016,36,(3): 480-489. XIONG Xingquan, HAN Qian, SHI Lin. Application of Deep-eutectic Solvents in Green Organic Synthesis[J]. Chinese J Org Chem, 2016, 36(3): 480-489.
-
[31]
Alonso D A, Baeza A, Chinchilla R. Deep Eutectic Solvents:The Organic Reaction Medium of the Century[J]. Eur J Org Chem, 2016, 2016(4): 612-632. doi: 10.1002/ejoc.201501197
-
[32]
Pan W Y, Xiao Y M, Xiong H Q. Et3N Catalyzed Cascade Reaction of Meldrum's Acid with Ortho-hydroxyaryl Aldehydes for Synthesis of Coumarin-3-carboxylic Acids under Solvent-free Condition[J]. Res Chem Intermed, 2016, 42(9): 7057-7063. doi: 10.1007/s11164-016-2517-8
-
[33]
Gao S, Xiao D, Yang Y. KH2PO4 Promoted Practical and Environmentally Friendly Preparation of Coumarin-3-carboxylic Acids under Solvent-free Condition[J]. Heterocycles, 2016, 92(9): 1698-1705. doi: 10.3987/COM-16-13510
-
[1]
-
表 1 水杨醛与麦氏酸缩合反应条件的优化
Table 1. Screening the reaction conditions for the condensation of salicylaldehyde and Meldrum's acid
Entry Molar fraction of catalyst/% Solvent Volume/mL Temperature/℃ Time/h Yield/%c 1a Choline chloride/30 H2O 1.0 25 8 81 2 Choline chloride/30 V(H2O):V(EtOH)=3:1 1.0 25 8 88 3 Choline chloride/30 V(H2O):V(MeOH)=3:1 1.0 25 8 86 4 Choline chloride/30 V(H2O):V(EtOH)=2:1 1.0 25 8 84 5 TEBAC/30 V(H2O):V(EtOH)=3:1 1.0 25 8 85 6 TBAB/30 V(H2O):V(EtOH)=3:1 1.0 25 8 82 7b Choline chloride/30 V(H2O):V(EtOH)=3:1 1.0 25 8 93 8 Choline chloride/30 V(H2O):V(EtOH)=3:1 1.0 30 8 93 9 Choline chloride/30 V(H2O):V(EtOH)=3:1 1.0 40 8 92 10 Choline chloride/30 V(H2O):V(EtOH)=3:1 0.5 25 8 91 11 Choline chloride/30 V(H2O):V(EtOH)=3:1 1.5 25 8 93 12 Choline chloride/20 V(H2O):V(EtOH)=3:1 1.0 25 8 95 13 Choline chloride/15 V(H2O):V(EtOH)=3:1 1.0 25 8 90 14 Choline chloride/20 V(H2O):V(EtOH)=3:1 1.0 25 7 93 15 Choline chloride/20 V(H2O):V(EtOH)=3:1 1.0 25 9 95 a.Entries 1~6, the reactions were carried out with salicylaldehyde/Meldrum′s acid(0.5 mmol/0.5 mmol) at room temperature; b.entries 7~15, the reactions were carried out with salicylaldehyde/Meldrum's acid(0.5 mmol/0.57 mmol); c.isolated yield. 表 2 催化体系的底物适用性扩展
Table 2. Substrate scope for the synthesis of product 3
Entrya Product Yield/%b mp/℃ 1 
95 190~192(188~190[33]) 2 
90 228~230(231~233[33]) 3 
92 187~189(158~160[33]) 4 
92 198~201(201~203[33]) 5 
88 215~216(201~203[33]) 6 
96 213~215(217~219[33]) 7 
94 169~170(164~166[33]) 8 
94 212~214(192~194[17]) 9 
95 199~201(194~196[33]) 10 
94 >300(200[10]) 11 
92 268~270(268~270[33]) 12c 
91 240~242(235~237[33]) a.The reactions were carried out with 0.5 mmol salicylaldehyde and 0.57 mmol Meldrum's acid in 1.0 mL V(H2O):V(EtOH)=3:1 at room temperature for 8 h; b.isolated yield; c.reaction was conducted in 2.0 mL V(H2O):V(EtOH)=3:1 solution at 50 ℃ for 24 h. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 1
- 文章访问数: 1341
- HTML全文浏览量: 87


 下载:
下载:
 下载:
下载:

