
Citation: ZHANG Hualiang, YANG Shi, XU Chao, HONG Chao, YUAN Hua. Synthesis of Ethylenediamine by Catalytic Ammoniation of Ethylene Glycol[J]. Chinese Journal of Applied Chemistry, 2017, 34(5): 557-562. doi: 10.11944/j.issn.1000-0518.2017.05.160339

乙二醇催化氨化合成乙二胺
English
Synthesis of Ethylenediamine by Catalytic Ammoniation of Ethylene Glycol
-
Key words:
- ethylene glycol
- / ethylene diamine
- / catalytic amination
-
乙二胺及其衍生物是重要的化工原料和精细化工中间体,在农药、食品、医药、汽车、造船、土木建筑、水处理、造纸、橡胶、纺织和电子等行业应用广泛,例如可作为环氧树脂固化剂、染料中间体、电镀液、表面活性剂、润滑油添加剂、纸张湿强剂、土壤改良剂等的基础原料[1-4]。乙二胺的合成方法主要有二氯乙烷法、乙醇胺化法、环氧乙烷法、乙烯氨化法和二甘醇氨化法等,其中主要工业合成方法为二氯乙烷 (EDC) 法,但是EDC法存在产品质量差、设备腐蚀严重和三废排放量大等缺点[5-7],需要探索新的乙二胺制备新工艺。从反应原理而言,乙二醇的氨烷基化反应是制备乙二胺的最理想路线,文献报道,一些金属催化剂对双官能团醇类化合物催化胺化反应表现出了一定的催化活性。Winderl等[8]采用钴系催化剂对乙二醇的氨烷基化进行了研究,乙二醇的转化率90%,乙二胺的选择性可达78%,但反应条件非常苛刻 (180 ℃、30 MPa);Legoff等[9]发现镍铝体系对乙醇胺催化氨化制备乙二胺有较好的催化活性,但易于形成较多的副产物哌嗪。Deeba等[10]报道了Cu-Ni催化剂在乙二醇胺氨化中的作用,结果发现,适量Cu的加入既有利于提高镍的催化活性,又可能抑制乙二胺的过度氨基化。基于镍、铜和钴等金属催化剂在氨的催化烷基化反应中不同的催化作用,本工作选择NiO/CuO/Al2O3为非均相催化剂,对乙二醇进行催化氨化制备乙二胺进行初步研究,该工艺过程路线简捷,环境友好,具有潜在的工业应用前景。
1 实验部分
1.1 仪器和试剂
D8 ADVANCE型X射线衍射仪 (XRD,德国BRUKER公司),CuKα射线源,电压40 kV,电流40 mA;VG multilab 2000型X射线光电子能谱 (XPS,美国VG公司),MgKα射线源,1253.6 eV,150 W;GC-8000型气相色谱仪 (合肥科普分析仪器有限公司),氢火焰检测器FID,SE-54毛细管色谱柱,柱长30 m,柱温为180 ℃,检测器和辅助炉温均为250 ℃。
乙二醇 (99.0%)、乙二胺 (99.9%) 乙醇胺 (99.0%)、氧化铝 (99.0%)、三水硝酸铜 (99.0%)、六水硝酸钴 (98.5%) 均为分析纯试剂,购自国药集团化学试剂有限公司,六水硝酸镍 (98%),分析纯,购自西陇化工股份有限公司。
1.2 催化剂的制备
取适量的水合硝酸铜和硝酸镍溶解于蒸馏水中配置成一定浓度的溶液,以1.2 mL溶液/g载体Al2O3的比例,将载体氧化铝浸渍在配置好的溶液中,浸渍36 h,过滤,滤液保留,将滤出的固体产物于60 ℃,干燥2 h,放入马弗炉中,在80、150、280 ℃各焙烧3 h,自然降温。焙烧产物再放入原来的滤液中,二次浸渍24 h,过滤,固体产物于80 ℃,干燥2 h,在马弗炉中150 ℃,焙烧2 h,450 ℃,焙烧4 h,即得目标催化剂NiO/CuO/Al2O3。制备了5种不同负载量的催化剂NiO/CuO/Al2O3,n(NiO):n(CuO):n(Al2O3) 分别为1:1:10、2:1:10、3:1:10、4:1:10和5:1:10。
1.3 实验过程
采用间歇式反应釜进行实验。分别取1、0.5、0.25、0.2和0.1 g的原料乙二醇投入到反应釜内,按比例加入催化剂,密封。通过液氨钢瓶向反应釜内通入氨气至压力为0.6 MPa。升温、搅拌反应一定时间。结束反应,冷却至室温。
2 结果与讨论
2.1 催化剂的初选
制备了5种不同的催化剂,如表 1所示。可见,用负载单组份NiO的催化剂NiO/Al2O3进行合成实验,发现主要产物为乙二胺,但是含量不高,选择性为42.7%,同时,有深度烷基化等其他副产物出现,说明单组份催化剂NiO/Al2O3的催化性能有待改善;而用只负载CuO的催化剂CuO/Al2O3进行合成实验,发现产物中目标产物乙二胺选择性很低,仅为20.4%,说明CuO组份对该催化活性很差。使用负载型双组分复合金属氧化物NiO/CuO/Al2O3进行合成实验,发现乙二醇转化率和乙二胺选择性均有较明显的提高,分别达到68.6%和56.7%;而使用负载型双组分CoO/CuO/Al2O3催化剂,乙二醇转化率和乙二胺选择性分别为61.3%和51.2%。上述实验结果表明,NiO/CuO/Al2O3催化剂具有良好的催化性能。原因可能有以下两点:一是由于Al2O3表面的四面体空位能被CuO优先占据,从而阻碍了催化剂制备过程中活性组分镍的迁移和聚集,使镍在催化剂表面有较高的分散度,因此,CuO的加入能够提高活性组份NiO的催化活性[11];第二,CuO的加入可能抑制产物乙二胺的深度烷基化,从而减少副产物的形成,提高催化剂NiO/CuO/Al2O3对该反应的催化性能。
Catalyst Conversion/% Selectivity/% NiO/Al2O3 52.2 42.7 CuO/Al2O3 38.3 20.4 CoO/Al2O3 50.3 40.4 CoO/CuO/Al2O3 61.3 51.2 NiO/CuO/Al2O3 68.6 56.7 Temperature:180 ℃; pressure:0.6 MPa; time:4 h; catalyst quantity:3%; ammonia-alcohol molar ratio:4:1; n(CoO):n(CuO):n(Al2O3)=3:1:10, n(NiO):n(CuO):n(Al2O3)=3:1:10. 表 1 不同催化剂的转化率与选择性
Table 1. The conversion and selectivity of different catalyst2.2 TGA的测试
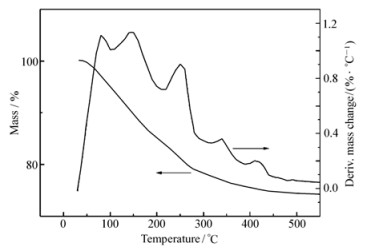
图 1为Ni (NO3)2·6H2O/Cu (NO3)2·3H2O/Al2O3(n(Ni):n(Cu)=1:1) 的热重分析曲线图。可见,在刚开始升温时,样品有一定量的失重,是由于随着温度的升高,本样品中的结晶水失去造成的。继续升温,样品质量继续降低,是由于硝酸镍和硝酸铜分解为氧化镍和氧化铜以及氮氧化物造成的。在500 ℃后,质量基本保持不变,说明其中硝酸铜和硝酸镍充分分解为CuO和NiO。因此,选择焙烧温度为500 ℃,使硝酸铜和硝酸镍分解完全,得到所需的催化剂。
2.3 催化剂的结构和性能表征
2.4 催化剂活性组分n(Ni):n(Cu) 的影响
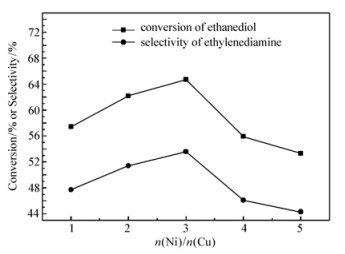
保持温度180 ℃、压力0.6 MPa、反应时间4 h、氨醇质量比4:1、催化剂质量分数3%不变,考察不同n(Ni):n(Cu) 对乙二胺选择性的影响,结果如图 4。乙二胺的选择性随着催化剂n(Ni):n(Cu) 的增加先升高后降低,在n(Ni):n(Cu)=3:1时,乙二胺选择性最大,达到了53.6%。随着活性组分比例的增加,催化剂中起主要作用的Ni组分含量的提高,催化剂活性逐渐升高。而随着催化剂中镍含量的升高,铜的相对含量降低,对活性组分镍的迁移和聚集的阻碍作用相对降低,从而导致催化剂的活性降低。所以在n(Ni):n(Cu)=3:1以后乙二胺的选择性逐渐降低。故选择催化剂活性组分n(Ni):n(Cu) 最佳摩尔比为3:1。
2.5 催化剂加入量的影响
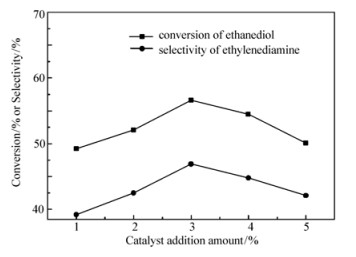
保持温度180 ℃、压力0.6 MPa、反应时间4 h、氨醇质量比为4:1、n(Ni):n(Cu)=3:1不变。不同催化剂加入量对产物乙二胺选择性的影响如图 5所示。乙二胺的选择性随催化剂用量的增加而增加,在催化剂质量分数为3%达到最大,为46.9%。继续增加催化剂用量,选择性反而降低。这是因为随着催化剂质量分数的增大,体系中催化活性中心增多,深度烷基化等副反应随之发生,导致乙二胺的选择性下降。所以选择3%为反应的最佳催化剂加入量。
2.6 反应温度的影响
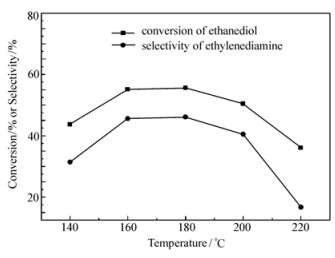
保持压力0.6 MPa、反应时间4 h、氨醇质量比4:1、n(Ni):n(Cu)=3:1、催化剂质量分数3%不变。不同反应温度对产物乙二胺选择性的影响如图 6所示。从图 6可以看出,随着反应温度的升高,乙二胺的选择性先增加后减小,在180 ℃时,选择性最高,达到了46.1%。在140 ℃时,由于温度较低,反应进行的不完全,导致选择性较低,仅仅为31.4%。在220 ℃时,选择性最低,为16.7%。原因是乙二醇氨化反应是一个放热反应,过高的温度不利于目标产物乙二胺的生成;同时,过高的反应温度可能导致如深度烷基化等副反应发生。故实验选择180 ℃为最佳反应温度。
2.7 反应时间的影响
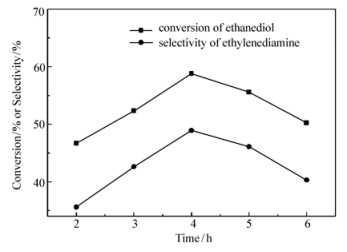
保持温度180 ℃、压力0.6 MPa、氨醇质量比4:1、n(Ni):n(Cu)=3:1、催化剂质量分数3%不变。不同反应时间对产物乙二胺选择性的影响,如图 7所示。可见,随着反应时间的延长,乙二胺的选择性先增大后减小,在4 h时达到最高,为48.9%。可能是反应起始阶段反应物相对浓度较高,反应速率较快,随着反应物原料的逐步消耗,反应速率呈下降趋势。继续延长反应时间,副反应开始增多,乙二胺选择性继续下降。故选择4 h为最佳反应时间。
2.8 氨醇比的影响
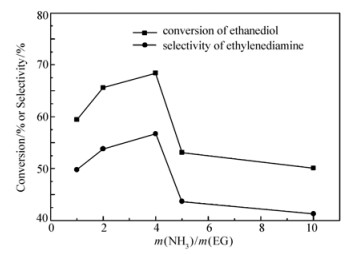
保持温度180 ℃、压力0.6 MPa、反应时间4 h、n(Ni):n(Cu)=3:1、催化剂质量分数3%不变。不同氨醇比对产物乙二胺选择性的影响如图 8所示。可见,随着氨醇比的提高,乙二胺的选择性先增加后减小。在氨醇质量比为4的时候,达到最大值56.7%。随着反应物浓度的增加,乙二醇与氨有效碰撞几率增加,乙二胺的选择性随之增加。随着氨的量继续增加,过量的氨又将进一步和目的产物乙二胺反应,生成更多副产物,导致乙二胺的选择性变小[14]。故选择氨醇比4:1为最佳反应比例。
2.3.1 XRD
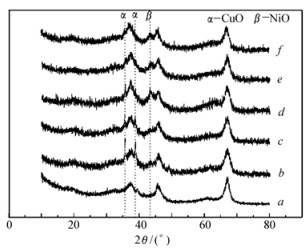
不同活性组份催化剂的XRD谱图如图 2所示。可见,各样品均出现立方晶系[PDFICDD 50-0741]晶相衍射峰。在2θ为37.5°、45.6°和66.6°等处,存在强的Al2O3特征峰。样品 (图 2谱线b) 在2θ=35.1°和38.4°处,出现了晶相CuO[PDFICDD 44-0706]的衍射峰,但晶相NiO[PDFICDD 44-1159]的衍射峰很弱,表明在催化剂 (图 2谱线b) 中,NiO可能主要以高分散的小颗粒形式存在于载体表面。由催化剂 (图 2谱线c~f) 的XRD特征峰可以看出,随着NiO含量的增加,CuO的特征峰强度逐渐减弱,NiO的特征峰强度逐渐增强。催化剂 (图 2谱线c) 在2θ=43.1°,存在NiO的特征峰,而没有CuO的特征峰。同纯相Al2O3(图 2谱线a) 相比,催化剂 (图 2谱线b~f) 的XRD曲线上出现了NiO或CuO的特征峰。
2.3.2 XPS
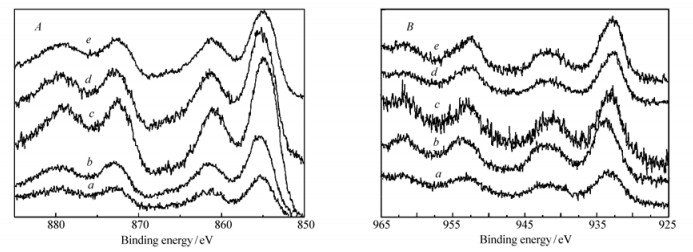
不同活性组份催化剂NiO/CuO/Al2O3的Ni2p和Cu2p的XPS谱图分别如图 3A、图 3B所示。从图 3A可知,5种NiO/CuO/Al2O3催化剂中Ni2p3/2的结合能为856.0 eV,其Shake-up伴峰的结合能值为862.6 eV,表明镍是以Ni2+存在的[12],因此催化剂NiO/CuO/Al2O3中镍的表面存在形态均为NiO;从图 3B可以看出,5种NiO/CuO/Al2O3催化剂中Cu2p3/2的结合能为934.0 eV,其Shake-up伴峰的结合能值均为942.8 eV,表明铜是以Cu2+存在的[13]。因此,5种催化剂NiO/CuO/Al2O3中铜的表面存在形态均为CuO。
3 结论
本文合成的负载型双组份复合金属氧化物催化剂NiO/CuO/Al2O3对乙二醇的氨烷基化具有较好的催化活性和选择性。适当的镍铜摩尔比既有利于提高催化剂的催化活性,同时又有利于提高反应的选择性。所以在原料氨醇质量比为4:1、催化剂质量分数为3%、活性组分n(Ni):n(Cu)=3:1、反应温度180 ℃、反应时间4 h时,乙二胺的选择性可达56.7%,乙二醇转化率达68.6%。
-
-
[1]
Zhang Y, Bai G, Yan X. Amination of Ethanolamine over Cobalt Modified H-ZSM-5 Catalysts[J]. Catal Commun, 2007, 8(7): 1102-1106. doi: 10.1016/j.catcom.2006.10.018
-
[2]
Segawa K, Shimura T. Effect of Dealumination of Mordenite by Acid leaching for Selective Synthesis of Ethylenediamine from Ethanolamine[J]. Appl Catal A Gen, 2000, s194/195(1): 309-317.
-
[3]
王彦明, 姚晓龙, 王建明. 乙二胺合成及分离工艺进展[J]. 广州化工, 2010,38,(10): 49-51. doi: 10.3969/j.issn.1001-9677.2010.10.018WANG Yanming, YAO Xiaolong, WANG Jianming. Research Advances in Synthesis and Separation of Ethanoldiamine[J]. Guangzhou Chem Ind, 2010, 38(10): 49-51. doi: 10.3969/j.issn.1001-9677.2010.10.018
-
[4]
Peeters A, Claes L, Geukens I. Alcohol Amination with Heterogeneous Ruthenium Hydroxyapatite Catalysts[J]. Appl Catal A Gen, 2014, 469(2): 191-197.
-
[5]
Zagidullin R N, Khismatullin S G, Dmitriev J U K, et al. Production of Diamines and Polyamines by Amination of Dichloroehane or Dichloropropane:Russ, 2226188[P]. 2004.
-
[6]
Zagidullin R N, Khismatullin S G, Dmitriev J U K, et al. Ethylenediamine Production Process:Russ, 2226190[P].2002.
-
[7]
Su W Y. Decolorization of Polyethylene Polyamines Using Ruthenium:US, US5364971 A[P]. 1994.
-
[8]
WinderI S, Haarer E, Corr H, et al. Production of Diaminoalkanes:US, US3270059 A[P]. 1966.
-
[9]
Le Goff Y, Senes M, Hamon C. Catalyst for Manufacturing Amines from Alcohols:US, US4209424[P]. 1980.
-
[10]
Deeba M, Ford M E, Johnson T A. Production of Ethylenediamine from Monoethanolamine and Ammonia:EP, US4918233[P]. 1990.
-
[11]
王达, 张因, 李海涛. Ni-Cu/Al2O3催化剂上顺酐液相选择加氢制丁二酸酐反应性能[J]. 催化学报, 2012,33,(7): 1229-1235. WANG Da, ZHANG Yin, LI Haitao. Selective Hydrogenation of Maleic Anhydride to Succinic Anhydride in Liquid Phase over Ni-Cu/Al2O3Catalyst[J]. Chinese J Catal, 2012, 33(7): 1229-1235.
-
[12]
张安杰, 丁天英, 刘云. 介质阻挡放电等离子体-Cu-Ni/γ-Al2O3催化剂体系在甲烷二氧化碳重整反应中的协同作用[J]. 分子催化, 2011(1): 11-16. ZHANG Anjie, DING Tianying, LIU Yun. Synergistic Effect of CO2 Reforming of Methane over a Combined System of Dielectric-Barrier Discharge Plasma and Cu-Ni/γ-Al2O3Catalyst[J]. J Mol Catal, 2011, (1): 11-16.
-
[13]
孙敬方, 张雷, 葛成艳. 固相浸渍法和湿浸渍法制备CuO/CeO2催化剂及其CO氧化性能的对比研究[J]. 催化学报, 2014(8): 1347-1358. SUN Jingfang, ZHANG Lei, GE Chengyan. Comparative Study on the Catalytic CO Oxidation Properties of CuO/CeO2Catalysts Prepared by Solid State and Wet Impregnation[J]. Chinese J Catal, 2014, (8): 1347-1358.
-
[14]
邓信忠, 裴世红, 程怡. 二氯乙烷连续催化氨化合成乙二胺[J]. 精细石油化工, 2013,30,(1): 8-12. DENG Xinzhong, PEI Shihong, CHENG Yi. Continuous Catalytic Synthesis of Ethylenedlamine from Dichloroethane and Ammonia[J]. Spec Petrochem, 2013, 30(1): 8-12.
-
[1]
-
表 1 不同催化剂的转化率与选择性
Table 1. The conversion and selectivity of different catalyst
Catalyst Conversion/% Selectivity/% NiO/Al2O3 52.2 42.7 CuO/Al2O3 38.3 20.4 CoO/Al2O3 50.3 40.4 CoO/CuO/Al2O3 61.3 51.2 NiO/CuO/Al2O3 68.6 56.7 Temperature:180 ℃; pressure:0.6 MPa; time:4 h; catalyst quantity:3%; ammonia-alcohol molar ratio:4:1; n(CoO):n(CuO):n(Al2O3)=3:1:10, n(NiO):n(CuO):n(Al2O3)=3:1:10. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 28
- 文章访问数: 2928
- HTML全文浏览量: 1228


 下载:
下载:







 下载:
下载:

