 图1
样品经不同温度退火2 h后的XRD图
Figure1.
XRD patterns of samples annealed at different temperature for 2 h
图1
样品经不同温度退火2 h后的XRD图
Figure1.
XRD patterns of samples annealed at different temperature for 2 h

Citation: CAO Jiao-Lan, WANG Xi-Gui. Preparation and Luminescent Properties of Eu3+ Doped B2O3-CaO Luminescent Materials[J]. Chinese Journal of Inorganic Chemistry, 2018, 34(2): 325-330. doi: 10.11862/CJIC.2018.066

Eu3+掺杂B2O3-CaO发光材料的制备及其发光性能
-
关键词:
- 溶胶凝胶
- / Eu3+掺杂B2O3-CaO
- / 发光性能
- / 发光机理
English
Preparation and Luminescent Properties of Eu3+ Doped B2O3-CaO Luminescent Materials
-
Key words:
- sol-gel
- / Eu3+ doped B2O3-CaO
- / luminescent properties
- / luminescent mechanism
-
0 引言
LED(发光二极管)灯是新一代绿色光源,具有节能、长寿命、无污染、性能稳定等显著优点。LED发光主要依赖于荧光粉,当采用不同的荧光粉封装时,可实现从暖白色到普通白色、冷白色直至日光色的不同色温和不同色坐标的调整并应用于不同场合,被认为是21世纪很有前景的新一代照明光源。因此,对于LED灯进一步商业化应用的成功,新的优良的荧光粉的发展至关重要[1-5]。
荧光粉的发光主要取决于稀土离子激活剂,而稀土离子的发光受其基质的影响较大。硼酸盐中因缺电子的B原子外层电子以sp2和sp3方式杂化,与3个或4个氧原子结合而形成BO3或BO4基本结构单元,这两单元通过共享氧原子方式相互连接形成结构复杂的硼氧骨架,从而形成结构多样的硼酸盐化合物,此多样性结构有益于寻找荧光粉所用的优良基质。另外,B、O原子间电负性相差较大,使B-O键在晶体中形成的价带与导带间能隙较大[6],这对掺杂稀土离子激活剂来说,无疑是一种优良基质。所以,稀土离子掺杂的硼酸盐作为一种重要的荧光材料,在过去的十多年里它被广泛的报道,如:Ca3B2O6:Dy3+ [7],CaB2O4:Eu3+ [8],SrB6O10·5H2O:Eu3+ [9],LiCaBO3:Sm3+ [10]等。目前,采用高温固相法、水热法、沉淀法等制备的以Ca3B2O6、Ca2B2O5、CaB2O4等为基质、结构优良, 并被Eu3+、Tb3+激活后具有潜在性应用的红、绿荧光粉依旧被不断报道。
在本论文中,用溶胶凝胶-高温固相合成法制得高纯的CaB2O4(即B2O3-CaO)结构,并且发现随退火温度的变化,能形成不同结构的硼酸盐基质,通过对不同退火温度下结构及发光性能的分析,探讨了材料的发光机理。
1 实验部分
1.1 主要试剂和仪器
硼酸三甲酯(分析纯,天津市光复精细化工研究所);Ca(NO3)2·4H2O(分析纯,天津市化学试剂三厂);氧化铕(分析纯,含量大于99.999%,配成0.10 mol·L-1的EuCl3溶液);无水乙醇(分析纯,含量不低于99.7%,天津市北联精细化学品开发有限公司)。
荧光光谱仪(日本日立公司F-4500型Fluores-cence Spectrophotometer,150 W的Xe灯作为激发源,光电倍增管电压400 V,扫描速度1 200 nm·min-1,室温下测试);X射线粉末衍射仪(日本理学Utima Ⅳ型;射线源Cu Kα,辐射波长0.154 06 nm,管电压40 kV,管电流40 mA,扫描范围10°~80°);FT-IR(美国Nicolet公司6700型,扫描次数32次,分辨率4 cm-1,KBr压片法)。
1.2 样品的制备
称取已知量的Ca(NO3)2·4H2O置于烧杯中,加入适量去离子水、已知量的硼酸三甲酯和EuCl3溶液,再加入适量无水乙醇(控制去离子水与无水乙醇的比例为1:1,并控制总体积,以保障硼酸三甲酯的水解和溶液的挥发性一致)。加完继续搅拌2 h,后置于表面皿上干燥得凝胶。将此凝胶研磨后,在600、700、900 ℃下退火处理2 h得相应的发光材料。硼酸三甲酯和Ca(NO3)2·4H2O的量按B2O3和CaO物质的量之比n1:n2=5:3计算,Eu3+含量控制在0.60%。
2 结果与讨论
2.1 材料的结构分析
2.1.1 XRD分析
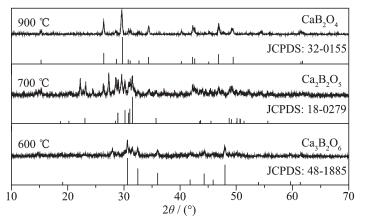
图 1为Eu3+掺杂量为0.60%的样品经不同温度退火2 h后的XRD图。发现样品经600、700、900 ℃退火后,主峰位置分别与JCPDS卡第48-1885号Ca3B2O6、第18-0279号Ca2B2O5及第32-0155号CaB2O4的主峰位置相吻合。由上述峰位置的吻合度可知,少量Eu3+的掺杂对晶体结构没有影响。另外,随着温度升高,晶体结构逐渐转变,依次为Ca3B2O6→Ca2B2O5→CaB2O4,即B2O3-3CaO→B2O3-2CaO→B2O3-CaO。可见随着温度的升高B2O3的比例逐渐增多,并且结构变化过渡阶段的Ca3B2O6、Ca2B2O5晶型差、杂峰多,而900 ℃时,CaB2O4结构结晶度好、晶粒大、无杂峰,即900 ℃退火后得到结晶度较好的纯CaB2O4(即B2O3-CaO)晶体。
2.1.2 IR分析
图 2显示了样品经600、700和900 ℃退火2 h后的红外光谱图。由图可见,不同温度退火所得样品皆在1 384和1 055 cm-1处出现吸收峰,这是BO3单元中B-O键的对称与反对称伸缩振动。经900 ℃退火所得样品,在775、738、708、632 cm-1处出现的吸收峰为BO3基团的B-O面外弯曲振动吸收峰;而538 cm-1处的吸收峰为BO3基团的B-O面内弯曲振动吸收峰。比正常孤立BO3基团峰向高频方向移动,可能因为在CaB2O4结构中,形成链间以及链内原子间相互作用构成相对紧凑结构而引起的[11]。经600、700 ℃退火所得样品,在800~500 cm-1处也有BO3基团的B-O弯曲振动吸收峰,但因Ca3B2O6、Ca2B2O5中BO3基团的形成的链及链内原子间相互作用与CaB2O4不同而吸收峰略有不同;除此之外,还有额外吸收峰,尤其经700 ℃退火后,这是因样品转化过程中的杂相引起。这与XRD图的分析结果一致。
2.2 发光性能的分析
2.2.1 Eu3+掺杂B2O3-xCaO的结构
在自然条件下合成的Ca3B2O6、Ca2B2O5和CaB2O4化合物中B原子都是以BO3的形式存在,且都是通过Ca、B原子共用O原子而形成三维网状结构,皆存在O2-与Ca2+的配位。这样的晶体结构不仅有益于其它离子进入晶格,而且能产生适当深度的陷阱存储激发能[12]。当掺杂稀土离子Eu3+时,因Eu3+的半径(0.095 nm)和Ca2+的半径(0.099 nm)相近,所以Eu3+取代了部分Ca2+。Eu3+取代Ca2+的同时,产生带正电荷的EuCa·空位缺陷,而在大气压条件和非还原气氛中得到的Ca3B2O6、Ca2B2O5和CaB2O4化合物,没有BO4四面体结构保护,此时,Ca2+周围的O2-就会以填隙式方式进攻Eu3+,试图为Eu3+提供电子,形成n型结构[13, 18];而Eu3+取代Ca2+时出现EuCa·空位形成的p型结构,由此在样品中形成p-n结。另外,晶体结构中产生p-n结的同时,也产生了带负电荷的Ca(VCa″)空位缺陷和带正电荷的O(VO··)空位缺陷。在基质中,VCa″空位充当空穴陷阱,VO··空位充当电子陷阱。产生p-n结和陷阱的原理可用下列方程式表示[19]:
此p-n结和陷阱的形成大有助于能量的有效传递,从而增强样品的发光性能。
2.2.2 CaB2O4:Eu3+的激发和发射光谱分析
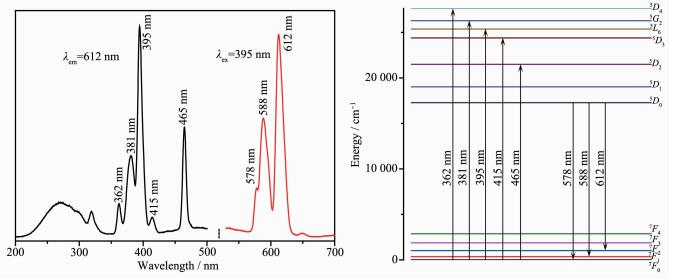
图 3a为经900 ℃退火2 h得到的CaB2O4:Eu3+荧光粉的激发和发射光谱图。激发图中,在210~310 nm处出现以268 nm为中心较弱的宽吸收峰,这是由O2-→Eu3+的电荷迁移(CT)带(即O2-的电子从已充满的2p轨道迁移到Eu3+的4f空轨产生)引起的;而300~500 nm范围内出现的峰宽较窄的吸收峰,是主晶格中,Eu3+内部4f电子间激发跃迁产生,即362、381、395、415、465 nm处,依次对应的7F0→5D4、7F0→5G2、7F0→5L6、7F0→5D3和7F0→5D2跃迁[14-15]。其中,465nm处的峰非最强峰,可在滤波器、蓝光激光器等方面有所应用。而位于紫外光区395 nm处峰型尖锐、峰强最强,可知此波长激发效率较高,所以在此选395 nm为最佳激发波长。
在395 nm激发波长下测得的样品的发射光谱图中可以看到,在578 nm(5D0→7F0)、588 nm(5D0→7F1)、612 nm(5D0→7F2)处出现Eu的特征发射峰,其中,612 nm(5D0→7F2)处发射峰最强,这是由Eu3+在晶体结构中所处的晶格位置决定。据选择定则,当Eu3+处于偏离反演对称中心格位时,将以5D0→7F2的电偶极跃迁为主[11-13]。在B2O3-CaO基质中Eu3+以612 nm处5D0→7F2电偶极跃迁为主,所以材料主要发红光。为更好了解上述发光情况,设计了Eu3+跃迁的能级图,如图 3b。
据文献知[19],在未掺杂稀土离子的CaB2O4晶体结构中,在350~400 nm处有宽的固有发射峰,该发射峰与Eu3+在395 nm处有很大重叠,这样使得基质吸收的能量更好的传递给Eu3+。此外,样品CaB2O4:Eu3+中存在p-n结,当样品CaB2O4:Eu3+吸收能量后,n型区中处于价带的电子受激进入导带,成非平衡态少数载流子,向p型区扩散(即p-n结正向注入),然后,少数载流子可能与Eu3+在395 nm处多数载流子复合而发光[17]。所以,CaB2O4基质中p-n结很有助于样品的发光。陷阱也可能对电子再捕获,在紫外光照射下再受激发射而重复利用,这样进一步提高样品的发光性能。另外,在晶体结构中产生的空位所造成的晶格缺陷,会使Eu3+在晶格中的对称性进一步降低,这更有利于5D0→7F2跃迁发射,从而得到较好的红光发射。
2.2.3 不同退火温度下样品的激发发射谱图分析
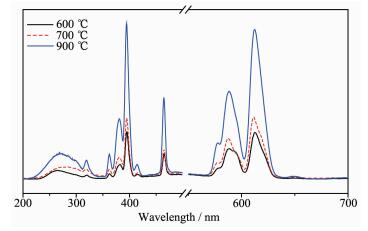
图 4为样品经不同温度退火2 h后的激发、发射谱图。从图中可以看出,样品经600、700、900 ℃退火后,激发发射峰位置基本一致,激发图中都在紫外光区395 nm处峰强最强,发射图中都在612 nm处有较强的红光发射峰。而且,随着温度的不断升高,峰的强度不断增强,直到900 ℃达到最大。对照XRD图,可知完善的CaB2O4晶体结构更有利于其发光,而这可能与晶格缺陷有关。
据文献知[6, 21-23],Ca3B2O6结构中有1种Ca环境、1种O环境;Ca2B2O5中有2种Ca环境,多种O环境;而CaB2O4中有1种Ca环境和多种O环境。相比之下Ca3B2O6结构的对称性大于后两者,其稳定性可能就相对强。因此,在掺杂稀土离子Eu3+后,在Ca3B2O6基质中Eu3+替换Ca2+很可能比在后两者基质中难,导致陷阱形成不易,加之对称性差的Ca2B2O5、CaB2O4容易出现晶格扭曲,晶格扭曲更易形成陷阱,这使前者形成陷阱数远少于后两者,从而导致其发光性也较差。另外,据XRD分析知,经不同温度退火形成的Ca3B2O6、Ca2B2O5的结晶度差、纯度低,尤其Ca2B2O5,属Ca3B2O6→Ca2B2O5→CaB2O4相转变的过渡阶段,含有不少的杂相,这很可能影响到电子和空穴陷阱的形成,从而造成发光强度的降低。综上知,900 ℃退火所得纯的CaB2O4晶体结构更有利于发光。
2.2.4 不同退火温度下样品的荧光衰减
图 5为经不同温度退火2 h后所得样品在395 nm的紫外光激发下,612 nm波长处的荧光衰减寿命。从图中可以看到,各样品均为单一指数衰减。经600、700和900 ℃退火所得的样品,衰减基本完成所需要的时间依次为:81、95、136 ms,可见,900 ℃的CaB2O4:Eu3+衰减时间最长,700 ℃的Ca2B2O5:Eu3+次之,而600 ℃的Ca3B2O6:Eu3+最短。衰减时间的延长很可能与载荷子运输到发光中心时,与缺陷相关的陷阱再捕获有关[20]。
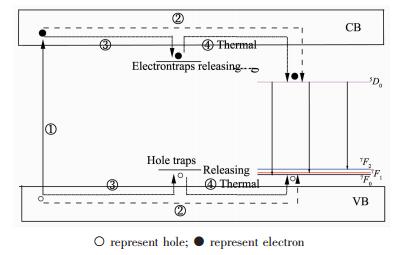
在紫外光的激发下(①),价带电子(VB)被激发到导带(CB),然后通过基质转移到发光中心Eu3+,随后是Eu3+的特征发射(②)。同时,许多光子引诱的电子或空穴可以被电子或空穴陷阱捕获(③)。一部分可能在紫外光照射下,再受激发射消耗掉,剩余部分在发射源关掉后,在室温下通过热扰动,捕获的电子或空穴再以某种速率从陷阱中释放出来(④)。自由电子将转移到Eu3+的5D0能级层,空穴将转移到Eu3+的基态。然后,自由电子和空穴的复合,将导致Eu3+的特征发射产生。在一定范围内,产生的陷阱越多,陷阱再捕获的几率就越高,再捕获所储存电子和空穴数目就越多,则室温下通过热扰而释放、复合概率就越高,衰减延续时间就相对较长。这也间接说明Eu3+取代Ca2+会产生缺陷的合理性。
3 结论
用溶胶凝胶法制备B2O3-xCaO:Eu3+荧光粉。经600、700、900 ℃退火后,依次形成Ca3B2O6、Ca2B2O5和CaB2O4相,并且在612 nm波长监测下,激发谱图符合Eu3+的激发规律,且在紫外光区395 nm处峰型最尖锐,峰强最强;将395 nm作为激发波长,测得612 nm(5D0→7F2)处发射峰最强,证明在不同退火温度所得基质中,Eu3+都处于无反演对称中心格位,以(5D0→7F2)电偶极跃迁的红光发射为主。另外,温度变化对峰强有很大影响,900 ℃退火所得高纯相的CaB2O4基质最有利于发光,这是因在此荧光粉中,Eu3+取代Ca2+后更易产生p-n结和陷阱,从而增强了其发光性能。另外,随着退火温度的升高,在612 nm处的荧光衰减时间延长,这是因陷阱再捕获所得的电子和空穴,在室温下,经热微扰而释放、复合而导致Eu3+的特征发射所致,也间接说明Eu3+取代Ca2+会产生缺陷的合理性。
-
-
[1]
夏李斌, 肖青辉, 李子成, 等.无机化学学报, 2017, 33(5):753-760 doi: 10.11862/CJIC.2017.103XIA Li-Bin, XIAO Qing-Hui, LI Zi-Cheng, et al. Chinese J. Inorg. Chem., 2017, 33(5):753-760 doi: 10.11862/CJIC.2017.103
-
[2]
冯永安, 雷小华, 任林娇, 等.发光学报, 2013, 34(3):303-307FENG Yong-An, LEI Xiao-Hua, REN Lin-Jiao, et al. Chinese Journal of Luminescence, 2013, 34(3):303-307
-
[3]
顾路顺, 施楠, 张乐, 等.发光学报, 2014, 35(8):897-904GU Lu-Shun, SHI Nan, ZHANG Le, et al. Chinese Journal of Luminescence, 2014, 35(8):897-904
-
[4]
Yang H C, Lakshminarayana G, Zhou S F, et al. Opt. Exp., 2008, 16(9):6731-6735 doi: 10.1364/OE.16.006731
-
[5]
Zhu Z F, Zhang Y B, Qiao Y P, et al. J. Non-Cryst. Solids, 2012, 358:1550-1553 doi: 10.1016/j.jnoncrysol.2012.04.015
-
[6]
祁淑云. 苏州大学硕士论文. 2016.QI Shu-Yun. Thesis for the Master of Soochow University. 2016.
-
[7]
Sun X Y, Zhang J C, Liu X G, et al. Physica B, 2011, 406:4089-4093 doi: 10.1016/j.physb.2011.07.057
-
[8]
Huang J L, Zhou L Y, Pang Q, et al. Luminescence, 2009, 24:363-366 doi: 10.1002/bio.v24:6
-
[9]
黄宏升, 金华峰, 袁光辉, 等.发光学报, 2014, 35(10):1176-1181HUANG Hong-Sheng, JIN Hua-Feng, YUAN Guang-Hui, et al. Chinese Journal of Luminescence, 2014, 35(10):1176-1181
-
[10]
Kindrat I I, Padlyak B V, Lisiecki R. Opt. Mater., 2015, 49:241-248 doi: 10.1016/j.optmat.2015.09.024
-
[11]
王海英, 王如骥, 张玥, 等.无机材料学报, 2009, 19(6):1367-1372WANG Hai-Ying, WANG Ru-Ji, ZHANG Yue, et al. J. Inorg. Mater., 2009, 19(6):1367-1372
-
[12]
王肖芳, 张弛, 邓朝勇.发光学报, 2016, 37(9):1037-1042WANG Xiao-Fang, ZHANG Chi, DENG Chao -Yong. Chinese Journal of Luminescence, 2016, 37(9):1037-1042
-
[13]
王喜贵, 薄素玲, 齐霞, 等.无机化学学报, 2009, 25(2):350-353 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?file_no=20090228&flag=1WANG Xi-Gui, BO Su-Ling, QI Xia, et al. Chinese J. Inorg. Chem., 2009, 25(2):350-353 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?file_no=20090228&flag=1
-
[14]
Qiao X, Seo H J. Mater. Res. Bull., 2014, 49(1):76-82
-
[15]
王喜贵, 于振友, 娜米拉, 等.无机化学学报, 2008, 24(4):571-575 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?file_no=20080413&flag=1WANG Xi-Gui, YU Zhen-You, NA Mi-La, et al. Chinese J. Inorg. Chem., 2008, 24(4):571-575 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?file_no=20080413&flag=1
-
[16]
王灵利, 王育华.中国稀土学报, 2004, 22(6):863-866WANG Ling-Li, WANG Yu-Hua. Journal of the Chinese Rare Earth Society, 2004, 22(6):863-866
-
[17]
王喜贵, 薄素玲, 娜米拉, 等.光谱学与光谱分析, 2010, 30(1):22-25WANG Xi-Gui, BO Su-Ling, NA Mi-La, et al. Spectroscopy and Spectral Analysis, 2010, 30(1):22-25
-
[18]
Zeng Q H, Pei Z W, Wang S B, et al. Spectrosc. Lett., 1999, 32(6):895-912 doi: 10.1080/00387019909350036
-
[19]
Shi M M, Zhang D Y, Chang C K, et al. J. Alloys Compd., 2015, 639:168-172 doi: 10.1016/j.jallcom.2015.02.068
-
[20]
Fujimoto Y, Yanagida T, Kawaguchi N, et al. Cryst. Growth Des., 2012, 12:142-146 doi: 10.1021/cg200885h
-
[21]
Yang L, Wan Y P, Li Y Z, et al. J. Nanopart. Res., 2016, 18:94 doi: 10.1007/s11051-016-3372-7
-
[22]
Manhas M, Kumar V, Agarwal G. Indian J. Phys., 2015, 89(9):899-906 doi: 10.1007/s12648-015-0657-0
-
[23]
杨扬, 丛妍, 朱子茂, 等.无机化学学报, 2017, 33(10):1757-1762 doi: 10.11862/CJIC.2017.235YANG Yang, CONG Yan, ZHU Zi-Mao, et al. Chinese J. Inorg. Chem., 2017, 33(10):1757-1762 doi: 10.11862/CJIC.2017.235
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 1921
- HTML全文浏览量: 380




 下载:
下载:





 下载:
下载:

