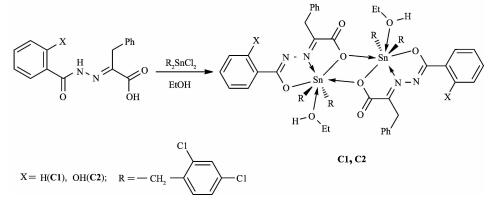
 图 1
配合物的合成线路图
Figure 1.
Syntheses of complexes
图 1
配合物的合成线路图
Figure 1.
Syntheses of complexes

Citation: JIANG Wu-Jiu, TAN Yu-Xing, YU Jiang-Xi, ZHU Xiao-Ming, ZHANG Fu-Xing, KUANG Dai-Zhi. Syntheses, Crystal Structures and Biological Activity of 2-Oxo-3-phenylpropionic Acid Aroyl Hydrazone Di-2, 4-dichlorobenzyltin Complexes[J]. Chinese Journal of Inorganic Chemistry, 2016, 32(8): 1383-1390. doi: 10.11862/CJIC.2016.179

2-羰基-3-苯基丙酸芳甲酰腙二(2, 4-二氯苄基)锡配合物的合成、晶体结构及生物活性
English
Syntheses, Crystal Structures and Biological Activity of 2-Oxo-3-phenylpropionic Acid Aroyl Hydrazone Di-2, 4-dichlorobenzyltin Complexes
-
Key words:
- organotin complex
- / hydrazone
- / synthesis
- / crystal structure
- / biological activity
-
0 前言
自1980年Crowe[1]首次报道二烃基锡化合物具有抑制癌细胞增殖作用以来,有机锡化合物在抗癌药物领域得到了人们的广泛关注[2-4],与其他结构类型的有机锡化合物相比,二烃基锡化合物通常具有更好的抗癌活性[5-6]。研究表明,甲基、乙基等小基团的有机锡化合物的毒性较大,严重损害动物体的免疫系统;随着基团增大有机锡化合物的毒性降低。因此, Sherman等[7]建议采用大基团的有机锡代替小分子量烃基锡,如丁基、苯基、苄基和环己基等,由它们构成的二烃基锡化合物可能具有较低的毒性和更好的抗癌活性。我们也曾报道过一些二(取代苄基)锡化合物,具有较好的体外抗癌活性[8]。苯丙酮酸为人体必需氨基酸苯丙氨酸代谢过程中间产物,生物兼容性好,与芳甲酰肼的缩合产物2-羰基-3-苯基丙酸芳甲酰腙具有肽键结构,且同时含有O, N等多配位点,对配位金属具有较强的调控作用。本文采用二(2, 4-二氯苄基)二氯化锡与2-羰基-3-苯基丙酸芳甲酰腙反应,合成了2个取代苄基锡配合物,初步研究了配合物对癌细胞及正常人体细胞的体外抑制活性,以及与小牛胸腺DNA的相互作用。
1 实验部分
1.1 仪器和试剂
IR用日本岛津Prestige-21红外光谱仪(4 000~400 cm-1, KBr压片)测定;1H和13C NMR用Bruker AVANCE-500核磁共振仪测定;元素分析用PE-2400(Ⅱ)元素分析仪测定;晶体结构用Bruker SMART APEX Ⅱ CCD单晶衍射仪测定;荧光光谱用日本日立F-7000荧光光谱仪测定;热重用德国NETZSCH TG 209 F3热重分析仪,熔点用北京泰克X-4双目体视显微熔点测定仪测定(温度计未经校正)。
2-羰基-3-苯基丙酸芳甲酰腙和二(2, 4-二氯苄基)二氯化锡参考文献[9-10]方法合成。溴化乙锭(EB)、小牛胸腺DNA、三羟甲基氨基甲烷(Tris)为Sigma-Aldrich公司产品,其它试剂均为分析纯,溶剂参考文献[11]方法纯化,水为超纯水。Tris-HCl(0.01 mol·L-1)缓冲溶液通过称取一定量Tris用0.1 mol·L-1的盐酸溶液调至pH值为7.40,使用前配制;小牛胸腺DNA的纯度通过比较260和280 nm处的吸光度来确定(A260/A280=1.8~1.9),用所需pH值条件下缓冲溶液配制,浓度通过测定260 nm处的吸光度计算而得(ε260=6 600 L·mol-1·cm-1),其储备液置于4 ℃保存;溴化乙锭溶液通过称取适量溴化乙锭固体,用pH=7.40的Tris-HCl (0.01 mol·L-1)缓冲溶液配制。
1.2 配合物的合成
于50 mL圆底烧瓶中,加入1 mmol 2-羰基-3-苯基丙酸苯甲酰腙或2-羰基-3-苯基丙酸水杨酰腙,1 mmol二(2, 4-二氯苄基)二氯化锡,25 mL无水乙醇,搅拌回流12 h。冷却,过滤,减压蒸除溶剂,用乙醇重结晶,得淡黄绿色晶体C1或C2。
配合物C1:晶体0.627 g,产率82%。m.p. 116~119 ℃ (dec)。元素分析(C64H56Cl8N4O8Sn2):实测值(计算值, %): C, 50.21 (50.23); H, 3.63 (3.69); N, 3.62 (3.66)。IR (KBr, cm-1): 3 084, 3 059, 3 030 ν(Ar-H), 2967 (C-H), 1 632 (C=N), 1 612, 1 385 ν(COO), 1 585 (C=N-N=C), 1 219 ν(C-O), 588 ν(Sn-O), 554 ν(Sn-O-Sn), 511 ν(Sn-N), 447 ν(Sn-C)。1H NMR (500 MHz, CDCl3) : δ 7.92 (dd, J=8.2, 1.2 Hz, 4H), 7.56 (t, J=7.4 Hz, 2H), 7.50~7.43 (m, 8H), 7.35~7.27 (m, 6H), 7.10 (d, J=2.1 Hz, 4H), 6.93 (d, J=8.3 Hz, 4H), 6.88 (dd, J=8.3, 2.1 Hz, 4H), 4.29 (s, 4H), 3.73 (q, J=7.0 Hz, 4H), 3.17 (d, J=12.1 Hz, 4H), 3.07 (d, J=12.1 Hz, 4H), 1.29 (s, 2H), 1.25 (t, J=7.0 Hz, 6H)。13C NMR (125 MHz, CDCl3): δ 174.74, 163.43, 155.00, 134.34, 133.28, 132.74, 132.71, 132.14, 131.92, 130.77, 130.14, 128.82, 128.73, 128.52, 128.34, 127.29, 127.20, 58.50, 32.82, 28.17, 18.44。119Sn NMR (Me4Sn, 187 MHz, CDCl3): δ -253.49。
配合物C2:晶体0.555 g,产率71%。m.p. 135~137 ℃ (dec)。元素分析(C64H56Cl8N4O10Sn2):实测值(计算值, %): C, 49.19 (49.21); H, 3.63 (3.61); N, 3.51 (3.59)。IR (KBr, cm-1): 3 451 ν(-OH), 3 059 ν(Ar-H), 2 968, 2 918 ν(C-H), 1 635 ν(C=N), 1 625, 1 381 (COO), 1 587 ν(C=N-N=C), 1 215 ν(C-O), 592 ν(Sn-O), 561 ν(Sn-O-Sn), 509 ν(Sn-N), 446 ν(Sn-C)。1H NMR (500 MHz, CDCl3) : δ 11.12 (s, 2H), 7.62 (dd, J=7.9, 1.5 Hz, 2H), 7.46~7.32 (m, 12H), 7.04 (d, J=2.1 Hz, 4H), 6.96 (d, J=8.3 Hz, 2H), 6.92~6.89 (m, 6H), 6.78 (dd, J=8.3, 2.1 Hz, 4H), 4.15 (s, 4H), 3.74 (q, J=7.0 Hz, 4H), 3.28 (d, J=12.0 Hz, 4H), 3.18 (d, J=12.0 Hz, 4H), 1.50 (s, 2H), 1.26 (t, J=7.0 Hz, 6H)。13C NMR (125 MHz, CDCl3) : δ 175.35, 164.51, 160.46, 153.36, 135.17, 133.37, 133.27, 132.62, 132.36, 130.99, 129.83, 129.65, 129.08, 128.82, 127.55, 127.21, 119.23, 117.54, 114.51, 58.53, 33.19, 30.89, 18.42。119Sn NMR (Me4Sn, 187 MHz, CDCl3): δ -314.76。
1.3 晶体结构测定
选取尺寸为0.21 mm×0.20 mm×0.20 mm(C1)和0.20 mm×0.19 mm×0.19 mm(C2)的配合物晶体,在Bruker SMART APEX Ⅱ CCD单晶衍射仪上,采用经石墨单色化的Mo Kα射线(λ=0.071 073 nm),以φ~ω扫描方式收集衍射数据。配合物C1在2.39°~25.10°范围内共收集16 761个衍射点,其中独立衍射点5 739个(Rint=0.018 3),用于结构精修的可观察衍射点5 262个[I > 2σ(I)];配合物C2在2.41°~25.09°范围内共收集15 939个衍射点,其中独立衍射点5 536个(Rint=0.022 5),用于结构精修的可观察衍射点5 121个[I > 2σ(I)]。全部数据经Lp因子和多重扫描吸收校正。晶体结构由直接法解出,全部非氢原子及C1中H4A、C2中H5A原子坐标在差值Fourier合成中陆续确定,其余氢原子由理论加氢法给出在晶胞中的位置坐标。对氢原子和非氢原子分别采用各向同性和各向异性热参数进行全矩阵最小二乘法修正,全部结构分析计算工作采用Shelxtl程序完成[12]。
Complex Cl C2 Empirical formula C64H56Cl8N4O8Sn2 C64H56Cl8N4O10Sn2 Formula weight 1 530.11 1 562.11 T/K 293(2) 293(2) Crystal system Triclinic Triclinic Space group P1 P1 a/nm 0.998 31(5) 1.004 80(14) b/nm 1.121 03(6) 1.124 81(16) c/nm 1.458 64(7) 1.4402(2) α/(°) 93.726(1) 92.734(2) β/(°) 93.394(1) 93.484(2) γ/(°) 96.579(1) 96.499(2) V/nm3 1.614 6(1) 1.611 8(4) Z 1 1 Dc/(Mg·m-3) 1.574 1.609 Absorption coefficient/mm-1 1.162 1.168 F(000) 768 784 Limiting indices -11≤h≤11, -13≤k≤13, -16≤l≤17 -11≤h≤11, -13≤k≤13, -17≤l≤17 Reflections collected, unique 16 761, 5 739 (Rint=0.018 3) 15 939, 5 536 (Rint=0.022 5) Completeness 0.997 0.966 Max. and min. transmission 0.800 9 and 0.792 5 0.808 6 and 0.800 0 Data, restraints, parameters 5 739, 3, 393 5 536, 21, 404 Goodness-of-fit on F2 1.059 1.055 Final R indices[I > 2σ(I)] R1=0.027 3, wR2=0.071 4 R1=0.056 9, wR2=0.173 7 R indices (all data) R1=0.031 0, wR2=0.073 7 R1=0.060 3, wR2=0.175 4 (Δρ)max, (Δρ)min/(e·nm-3) 1 019, -618 3 779, -964 CCDC: 1452066, C1; 1452067, C2。
1.4 体外抗癌活性测定
将待测药物溶于少量DMSO,用水稀释至所需浓度,保持最终DMSO浓度小于0.1%。MCF7(人乳腺癌细胞)、Colo205(人结肠癌细胞)、NCI-H460(人肺癌细胞)、Hela(人宫颈癌细胞)、HepG2(人肝癌细胞)以及HEK293(正常人体胚肾细胞)、HL7702(正常人体肝细胞)细胞株取自美国组织培养库(ATCC)。用含10%胎牛血清的RPMI 1640 (GIBICO公司)培养基,在5%(体积分数)CO2、37 ℃饱和湿度培养箱内进行体外培养。体外抗癌药敏试验是通过MTT法测定。数据处理使用Graph Pad Prism version 5.0程序,化合物IC50通过程序中具有S形剂量响应的非线性回归模型进行拟合得到。
1.5 与DNA相互作用实验
在5 mL容量瓶中分别加入小牛胸腺DNA、EB及不同浓度的配合物溶液,混匀,放置3.5 h,分别扫描荧光光谱,激发波长为258 nm,发射波长见图谱,激发和发射光谱扫描狭缝宽度均为5.0 nm。
2 结果与讨论
2.1 谱学研究
配体2-羰基-3-苯基丙酸苯甲酰腙的(C=N)出现在1 663 cm-1附近,而它与锡配位形成配合物C1后其ν(C=N)红移到1 632 cm-1附近,表明配体中亚胺基参与了配位[9, 13]。羧基的反对称伸缩振动峰在1 612 cm-1,而对称伸缩振动峰在1 385 cm-1处,反对称伸缩振动频率和对称伸缩振动频率之差为227 cm-1,表明配合物中的羧酸根是以单齿形式与Sn配位。二(2, 4-二氯苄基)二氯化锡的Sn-C振动峰在440 cm-1,配合物C1中此峰向高频区移动至447 cm-1,并分别于588 cm-1 (ν(Sn-O))、554 cm-1 (ν(Sn-O-Sn))和511 cm-1(ν(Sn-N))处出现形成配键的特征峰[14-18]。
配合物C2有着与C1类似的红外光谱征,羧基νs(C=O) 1 625 cm-1, νas(C=O) 1 381 cm-1,频率之差为244 cm-1,也是以单齿形式与Sn配位。其配键的特征峰ν(Sn-O)、ν(Sn-O-Sn)、ν(Sn-N)和ν(Sn-C)分别位于592、561、509和446 cm-1处,表明C2和C1有着相似的结构。
在1H NMR谱中,其各组峰的积分面积之比与预期结构的各组质子数相对吻合[19-21];在二(2, 4-二氯苄基)二氯化锡中,与锡原子相连的2, 4-二氯苄基的亚甲基质子峰是由1个正常的单峰和一对小卫星峰组成,这是由于119Sn-H耦合的结果[22];而在形成配合物C1、C2后,由于分子中心形成Sn2O2四元环,且与Sn原子连接的2, 4-二氯苄基空间位阻较大,致使2, 4-二氯苄基不能自由取向,亚甲基的2个质子发生同碳耦合,呈现2个双峰,说明配合物C1、C2分子在溶液状态下Sn2O2四元环未发生开环,与晶体状态下的单晶衍射结果一致。在13C NMR谱中,其各组峰与理论推测结构碳原子数相吻合[19],与X射线单晶衍射结果一致。
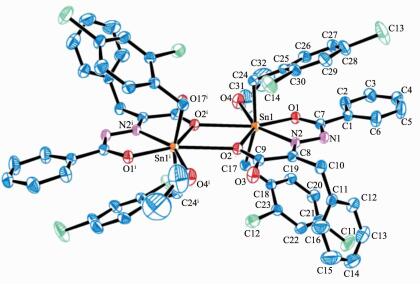
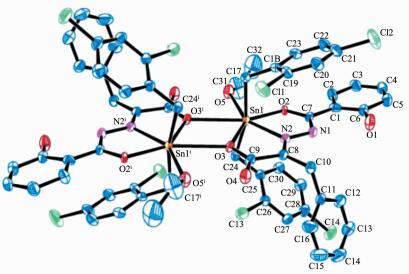
2.2 晶体结构
配合物的主要键长和键角数据列于表 2,分子结构见图 2、3。均为双锡核分子,存在1个Sn2O2平面中心四元环,环的中心就是分子的对称中心,四元环由羧基氧原子以μ3-桥联配位Sn原子,且与2个锡原子的键长不等,其中C1中Sn1-O2: 0.231 1(2) nm,C2中Sn1-O3: 0.231 2(5) nm,均属于正常Sn-O共价键长;而C1中Sn1-O2ⅰ: 0.271 7(2) nm,C2中Sn1-O3ⅰ: 0.271 8(5) nm,大于Sn-O共价键长,但是小于锡原子与氧原子范氏半径之和,比文献报道[17, 23-24]相似配合物的Sn-O略长。
Cl Sn1-C17 0.214 8(3) Sn1-O1 0.2l6 9(2) Sn1-O2 0.231 1(2) Sn1-C24 0.215 5(3) Sn1-O2 0.22l 9(2) Sn1-O4 0.249 9(2) Sn1-O2ⅰ 0.271 7(2) Cl7-Sn1-C24 161.89(11) O1-Sn1-N2 70.85(7) C17-Sn1-O4 83.75(l0) Cl7-Sn1-O1 93.60(9) C17-Sn1-O2 9l.80(9) C24-Sn1-O4 81.13(10) C24-Sn1-O1 92.39(9) C24-Sn1-O2 94.12(9) O1-Sn1-O4 76.09(7) C17-Sn1-N2 100.10(9) O1-Sn1-O2 l4l.47(7) N2-Sn1-O4 l46.88(8) C24-Sn1-N2 98.01(10) N2-Snl-O2 70.64(7) O2-Sn1-O4 l42.44(7) O2-Sn1-O2ⅰ 64.71(6) Cl7-Snl-O2ⅰ 83.13(9) C24-Sn1-O2ⅰ 83.98(9) Sn1-O2-Sn1ⅰ 115.29(7) O4-Snl-O2ⅰ 77.73(7) C2 O3-Sn1 0.231 2(5) O2-Sn1 0.2l3 9(4) Cl7-Sn1 0.213 8(7) N2-Sn1 0.223 0(5) O5-Sn1 0.248 3(6) C24-Sn1 0.215 3(7) O3ⅰ-Sn1 0.271 8(5) C17-Sn1-O2 91.9(2) C24-Sn1-O2 l00.4(2) Cl7-Sn1-O5 81.6(3) C17-Sn1-C24 162.7(3) C17-Sn1-O3 94.5(2) O2-Sn1-O5 77.46(l8) O2-Sn1-C24 94.0(2) O2-Sn1-O3 l39.50(15) C24-Sn1-O5 83.9(2) C17-Sn1-O2 96.9(2) C24-Sn1-O3 91.6(2) N2-Sn1-O5 l46.8l(l9) O2-Sn1-N2 69.42(17) N2-Sn1-O3 70.ll(l7) O3-Sn1-O5 l43.02(l7) O3-Sn1-O3ⅰ 65.23(15) O3ⅰ-Sn1-O5 77.09(17) C24-Sn1-O3ⅰ 83.50(l9) Sn1-O3ⅰ-Sn1ⅰ 114.77(18) C17-Sn1-O3ⅰ 84.38(22) Symmetry codes: ⅰ1-x, 1-y, 1-z for complex C1; ⅰ1-x, 1-y, 1-z for complex C2 在配合物C1结构中,Sn1与来自配体中的2个氧原子O1和O2,1个亚氨基氮原子N2,1个配位乙醇氧原子O4,来自2个2, 4-二氯苄基中的亚甲基碳原子C17和C24以及来自另1个配体分子中的O2ⅰ等配位,形成七配位五角双锥构型。O1、O2、O4、N2、O2ⅰ占据了赤道平面的5个位置,2个亚甲基碳原子C17和C24则占据了该平面两侧的轴向位置,轴向C17-Sn1-C24键角为161.88(11)°,与180°偏离了18.12°,且赤道平面的5个原子与中心锡原子的键长及键角也不等,因此该配合物中心锡原子为畸变七配位五角双锥构型。配合物C2与C1分子相类似,键参数差异不大,中心锡原子也为畸变七配位五角双锥构型。在2个配合物结构中,Sn-N键长为:C1: 0.221 9(2) nm,C2: 0.223 0(5) nm,与文献报道相似[15, 25-27]。
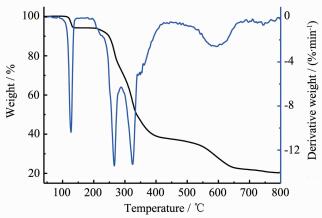
2.3 热稳定性研究
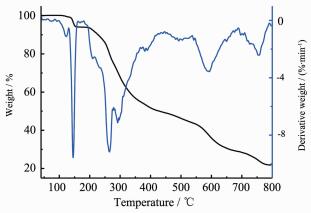
为了研究配合物的热稳定性,采用NETZSCH TG 209 F3热重分析仪,在空气氛下,加热速度为20 ℃·min-1,气体流速为20 mL·min-1,在40~800 ℃范围内对配合物进行热重测试。如图 4、5所示,随温度的升高,配合物发生相似的失重过程,观察到3个失重阶段。在初始阶段40~170 ℃,配合物C1失重为5.77%(理论值:6.02%),C2为6.03%(理论值:5.90%),分别对应配合物失去2个配位乙醇分子;配合物C1、C2的第二阶段与第三阶段界限均相对模糊,在170~800 ℃范围内失重,对应配合物分子失去2个2-羰基-3-苯基丙酸芳甲酰腙配体及4个2, 4-二氯苄基,最终稳定在约20.37% (C1)和21.76 % (C2),残余物与SnO2的计算含量19.70% (C1)及19.30% (C2)吻合;上述热分析结果表明配合物C1结构在119 ℃之前,配合物C2结构在137 ℃之前可稳定存在。
2.4 体外抗癌活性研究
表 3列出了配合物C1、C2对体外培养癌细胞MCF7、Colo205、NCI-H460、Hela、HepG2以及HEK293、HL7702的抑制活性。从表中数据可知,配合物C1、C2对5种癌细胞都有明显的抑制作用,对MCF7、NCI-H460、Hela的抑制作用均优于卡铂,对HepG2的抑制作用与卡铂相当,对Colo205的抑制作用弱于卡铂;在对正常人体细胞毒性试验中,配合物C1、C2对HEK293及HL7702细胞毒性均大于卡铂,但配合物C2对HEK293、HL7702的细胞毒性远小于C1,故配合物C2有望进一步化学优化作为抗癌药物的候选化合物;分析配合物C1、C2在正常人体细胞毒性试验中差异原因可能与配体分子中苯环取代基羟基有关[28-29]。
MCF7 Colo205 NCI-H460 Hela HepG2 HL7702 HEK293 C1 1.447 2.676 2.452 8.947 1.199 3.660 3.215 C2 3.150 4.891 13.92 8.167 2.683 31.06 26.54 Carboplatin 54.71 0.6247 63.34 42.94 1.349 67.87 57.31 2.5 配合物与DNA-EB作用的荧光光谱研究
EB是一种荧光染料,但其本身的荧光很弱。在DNA溶液中,EB能平行地嵌入到双螺旋DNA内部的碱基对之间,从而使荧光显著增强。当配合物与EB的DNA溶液共存时,便会发生竞争反应,配合物可能把EB从DNA双螺旋中挤出,导致荧光强度发生猝灭,因而EB可用作DNA结构的荧光探针[30]。
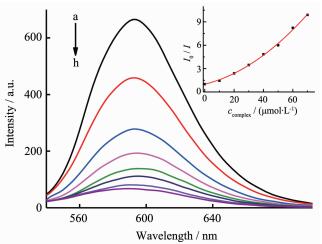
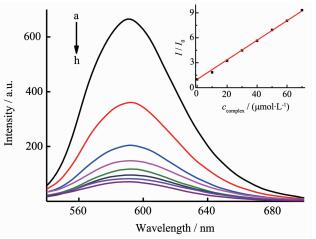
图 6、7分别为不同浓度的配合物C1及C2对EB-DNA复合体系的荧光淬灭曲线。加入配合物C1或C2后,DNA-EB体系的荧光均明显降低,说明配合物C1或C2的存在使DNA-EB体系的荧光产生了猝灭;配合物C1与EB-DNA复合体系的作用根据Stern-Volmer校正方程[31-32]:
$ {\mathit{I}_{\rm{0}}}{\rm{/}}\mathit{I}{\rm{ = 1 + (}}{\mathit{K}_{{\rm{SV}}}}{\rm{ + }}\mathit{K}{\rm{)}}{\mathit{c}_{{\rm{complex}}}}{\rm{ + }}{\mathit{K}_{{\rm{SV}}}}\mathit{K}{{\rm{(}}{\mathit{c}_{{\rm{complex}}}}{\rm{)}}^{\rm{2}}}$ ,由曲线拟合推断其作用属于动态和静态联合猝灭,表明配合物C1既可以与DNA分子中的磷酸基团静电结合,使DNA分子轴向收缩,把EB从DNA分子的碱基对中挤出; 又可以与DNA分子中的碱基基团配位结合,取代DNA分子碱基对中的EB,这两种作用都导致DNA-EB体系荧光的猝灭,与文献报道[33]相似;配合物C2与EB-DNA复合体系的作用根据经典Stern-Volmer方程[34]:$ {\mathit{I}_{\rm{0}}}{\rm{/}}\mathit{I}{\rm{ = 1 + }}{\mathit{K}_{{\rm{SV}}}}{\mathit{c}_{{\rm{complex}}}}$ ,由曲线拟合推断其作用属于静态猝灭,计算出配合物与DNA作用的猝灭常数KSV为1.2×105 L·mol-1,比文献[34]报道的结合常数大,表明配合物与DNA存在较强的插入作用,推测可能是配合物的中心锡原子与DNA分子中的碱基基团配位结合,配合物中的端基配体芳环插入到DNA的碱基对中,竞争了EB与DNA的结合,把EB从DNA分子的碱基对中挤出;结合配合物对癌细胞的体外抑制活性分析,配合物C1、C2的抗肿瘤活性与DNA的结合能力相关,杀死肿瘤细胞很可能是通过配体和有机锡的协同效应[35]与DNA相互键合所致[34]。3 结论
二(2, 4-二氯苄基)二氯化锡分别与2-羰基-3-苯基丙酸(苯甲酰基)腙及2-羰基-3-苯基丙酸(水杨酰基)腙反应,合成了2个取代苄基锡配合物(C1、C2)。结构分析表明,2个配合物分子均为双锡核分子,以Sn2O2四元环为中心对称,且锡原子与配位原子形成七配位畸变五角双锥构型。配合物C1、C2对癌细胞Hela、MCF7、HepG2、Colo205、NCI-H460都有明显的抑制作用,对MCF7、NCI-H460、Hela的抑制作用均优于卡铂,但配合物C2对HEK293、HL7702的细胞毒性远小于C1,故配合物C2有望作为抗癌药物的候选化合物。此外,还以EB为荧光探针初步研究了配合物与小牛胸腺DNA的相互作用,结果表明配合物C1与小牛胸腺DNA是插入结合与静电结合共同作用,配合物C2与小牛胸腺DNA是插入结合作用,对研究其抗癌机理具有一定的参考价值。
Supporting information is available at http://www.wjhxxb.cn
-
-
[1]
Crowe A J, Smith P J, Atassi Ghanem. Chem-Biol. Interact., 1980, 32(1/2):171-178 http://europepmc.org/abstract/MED/7428110
-
[2]
Gielen Marcel. Appl. Organomet. Chem., 2002, 16(9):481-494 doi: 10.1002/(ISSN)1099-0739
-
[3]
Shang X M, Ding N, Xiang G Y. Eur. J. Med. Chem., 2012, 48:305-312 doi: 10.1016/j.ejmech.2011.12.032
-
[4]
Martins M, Baptista P V, Mendo A S, et al. Mol. Biosyst., 2016, 12(3):1015-1023 doi: 10.1039/C5MB00791G
-
[5]
廖启华, 林森, 邓瑞红, 等.有机化学, 2015, 35 (09):1923-1928 http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201509011&dbname=CJFD&dbcode=CJFQLIAO Qi-Hua, LIN Sen, DENG Rui-Hong, et al. Chinese J. Org. Chem., 2015, 35 (09):1923-1928 http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201509011&dbname=CJFD&dbcode=CJFQ
-
[6]
Hong M, Yang Y G, Li C, et al. RSC Adv., 2015, 5(124): 102885-102894 doi: 10.1039/C5RA18445B
-
[7]
Sherman L R, Huber F. Appl. Organomet. Chem., 1988, 2(1): 65-72 doi: 10.1002/(ISSN)1099-0739
-
[8]
张复兴, 邝代治, 冯泳兰, 等.无机化学学报, 2014, 30(10):2367-2374 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20141018&journal_id=wjhxxbcnZHANG Fu-Xing, KUANG Dai-Zhi, FENG Yong-Lan, et al. Chinese J. Inorg. Chem., 2014, 30(10):2367-2374 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20141018&journal_id=wjhxxbcn
-
[9]
何水样, 曹文凯, 陈军利, 等.高等学校化学学报, 2002, 23(6):991-995 http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gdxh200206001&dbname=CJFD&dbcode=CJFQHE Shui-Yang, CAO Wen-Kai, CHEN Jun-Li, et al. Chem. J. Chinese Universities, 2002, 23(6):991-995 http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gdxh200206001&dbname=CJFD&dbcode=CJFQ
-
[10]
Sisido K, Takeda Y, Kinugawa Z, et al. J. Am. Chem. Soc., 1961, 83(3):538-541 doi: 10.1021/ja01464a008
-
[11]
Armarego W L F, Chai C L L. Purification of Laboratory Chemicals. 6th Ed. Oxford: Butterworth-Heinemann, 2009.
-
[12]
Sheldrick G M. SHELXTL, Version 5. 03. Madison, Wisconsin, USA: Siemens Analytical X-ray Division, 1994.
-
[13]
García-López M C, Muoz-Flores B M, Chan-Navarro R, et al. J. Organomet. Chem., 2016, 806:68-76 doi: 10.1016/j.jorganchem.2016.01.030
-
[14]
Barba V, Zaragoza J, Höpfl H, et al. J. Organomet. Chem., 2011, 696(10):1949-1956 doi: 10.1016/j.jorganchem.2010.10.040
-
[15]
蒋伍玖, 阳年发, 邝代治, 等.结构化学, 2011, 30(9):1327-1331 http://manu30.magtech.com.cn/jghx/EN/abstract/abstract435.shtmlJIANG Wu-Jiu, YANG Nian-Fa, KUANG Dai-Zhi, et al. Chinese J. Struct. Chem., 2011, 30(9):1327-1331 http://manu30.magtech.com.cn/jghx/EN/abstract/abstract435.shtml
-
[16]
Yang Y, Hong M, Xu L, et al. J. Organomet. Chem., 2016, 804:48-58 doi: 10.1016/j.jorganchem.2015.12.041
-
[17]
蒋伍玖, 邝代治, 庾江喜, 等.无机化学学报, 2012, 28(11):2363-2368 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20121114&journal_id=wjhxxbcnJIANG Wu-Jiu, KUANG Dai-Zhi, YU Jiang-Xi, et al. Chinese J. Inorg. Chem., 2012, 28(11):2363-2368 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20121114&journal_id=wjhxxbcn
-
[18]
Vatsa C, Jain V K, Das T K. J. Organomet. Chem., 1990, 396(1):9-18 doi: 10.1016/0022-328X(90)85187-4
-
[19]
Pretsch E, Buhlmann P, Martin B. Structure Determination of Organic Compounds: Tables of Spectral Data. 4th Ed. Berlin: Springer-Verlag Berlin and Heidelberg GmbH & Co KGaA, 2009.
-
[20]
Fulmer G R, Miller A J M, Sherden N H, et al. Organometallics, 2010, 29(9):2176-2179 doi: 10.1021/om100106e
-
[21]
Clark H C, Jain V K. J. Organomet. Chem., 1985, 279(3): 385-394 doi: 10.1016/0022-328X(85)87036-4
-
[22]
Davies A G. Organotin Chemistry. 2nd Ed. Berlin: Wiley-VCH Verlag GmbH & Co. KGaA, 2004.
-
[23]
Baba H S, Dietz C, Lutter M, et al. Organometallics, 2015, 34(23):5555-5565 doi: 10.1021/acs.organomet.5b00768
-
[24]
Wagner M, Zobel B, Dietz C, et al. Organometallics, 2015, 34(23):5602-5608 doi: 10.1021/acs.organomet.5b00829
-
[25]
Labib L, Khalil T E, Iskander M F. Polyhedron, 1996, 15 (21):3697-3707 doi: 10.1016/0277-5387(96)00125-8
-
[26]
Jmenez-Pérez V M, Camacho-Camacho C, Güizado-Rodrguez M, et al. J. Organomet. Chem., 2000, 614-615:283-293 doi: 10.1016/S0022-328X(00)00689-6
-
[27]
Hong M, Yin H, Chen S, et al. J. Organomet. Chem., 2010, 695(5):653-662 doi: 10.1016/j.jorganchem.2009.11.035
-
[28]
Effenberger K, Breyer S, Schobert R. Eur. J. Med. Chem., 2010, 45(5):1947-1954 doi: 10.1016/j.ejmech.2010.01.037
-
[29]
Dandawate P, Khan E, Padhye S, et al. Bioorg. Med. Chem. Lett., 2012, 22(9):3104-3108 doi: 10.1016/j.bmcl.2012.03.060
-
[30]
赵国良, 施霞, 张均平, 等.中国科学:化学, 2010, 40(10):1525-1535 http://kns.cnki.net/KCMS/detail/detail.aspx?filename=jbxk201010008&dbname=CJFD&dbcode=CJFQZHAO Guo-Liang, SHI Xia, ZHANG Jun-Ping, et al. Sci. China: Chem., 2010, 40(10):1525-1535 http://kns.cnki.net/KCMS/detail/detail.aspx?filename=jbxk201010008&dbname=CJFD&dbcode=CJFQ
-
[31]
XU Jin-Gou(许金钩), WANG Zun-Ben(王尊本). Fluorescence Analysis. 3rd Ed. (荧光分析法. 3版). Beijing: Science Press, 2006: 64-70
-
[32]
张冰卫, 李博, 夏文水, 等.药学进展, 2011, 35(7): 296-303 http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yxjz201107003&dbname=CJFD&dbcode=CJFQZHANG Bing-Wei, LI Bo, XIA Wen-Shui, et al. Proc. Pharm. Sci., 2011, 35(7): 296-303 http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yxjz201107003&dbname=CJFD&dbcode=CJFQ
-
[33]
冯泳兰, 郑建华, 蒋伍玖, 无机化学学报, 2014, 30(12):2767-2774 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20141212&journal_id=wjhxxbcnFENG Yong-Lan, ZHENG Jian-Hua, JIANG Wu-Jiu, Chinese J. Inorg. Chem., 2014, 30(12):2767-2774 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20141212&journal_id=wjhxxbcn
-
[34]
Yan C Q, Zhang J L, Liang T G, et al. Biomed. Pharmacother., 2015, 71:119-127 doi: 10.1016/j.biopha.2015.02.027
-
[35]
Yin H, Liu H, Hong M, et al. J. Organomet. Chem., 2012, 713(15):11-19 http://www.sciencedirect.com/science/article/pii/S0022328X12001817
-
[1]
-
表 1 晶体学数据
Table 1. Crystallographic Data
Complex Cl C2 Empirical formula C64H56Cl8N4O8Sn2 C64H56Cl8N4O10Sn2 Formula weight 1 530.11 1 562.11 T/K 293(2) 293(2) Crystal system Triclinic Triclinic Space group P1 P1 a/nm 0.998 31(5) 1.004 80(14) b/nm 1.121 03(6) 1.124 81(16) c/nm 1.458 64(7) 1.4402(2) α/(°) 93.726(1) 92.734(2) β/(°) 93.394(1) 93.484(2) γ/(°) 96.579(1) 96.499(2) V/nm3 1.614 6(1) 1.611 8(4) Z 1 1 Dc/(Mg·m-3) 1.574 1.609 Absorption coefficient/mm-1 1.162 1.168 F(000) 768 784 Limiting indices -11≤h≤11, -13≤k≤13, -16≤l≤17 -11≤h≤11, -13≤k≤13, -17≤l≤17 Reflections collected, unique 16 761, 5 739 (Rint=0.018 3) 15 939, 5 536 (Rint=0.022 5) Completeness 0.997 0.966 Max. and min. transmission 0.800 9 and 0.792 5 0.808 6 and 0.800 0 Data, restraints, parameters 5 739, 3, 393 5 536, 21, 404 Goodness-of-fit on F2 1.059 1.055 Final R indices[I > 2σ(I)] R1=0.027 3, wR2=0.071 4 R1=0.056 9, wR2=0.173 7 R indices (all data) R1=0.031 0, wR2=0.073 7 R1=0.060 3, wR2=0.175 4 (Δρ)max, (Δρ)min/(e·nm-3) 1 019, -618 3 779, -964 表 2 配合物的部分键长和键角
Table 2. Selected bond lengths(nm) and bond angles(°) for complexes C1 and C2
Cl Sn1-C17 0.214 8(3) Sn1-O1 0.2l6 9(2) Sn1-O2 0.231 1(2) Sn1-C24 0.215 5(3) Sn1-O2 0.22l 9(2) Sn1-O4 0.249 9(2) Sn1-O2ⅰ 0.271 7(2) Cl7-Sn1-C24 161.89(11) O1-Sn1-N2 70.85(7) C17-Sn1-O4 83.75(l0) Cl7-Sn1-O1 93.60(9) C17-Sn1-O2 9l.80(9) C24-Sn1-O4 81.13(10) C24-Sn1-O1 92.39(9) C24-Sn1-O2 94.12(9) O1-Sn1-O4 76.09(7) C17-Sn1-N2 100.10(9) O1-Sn1-O2 l4l.47(7) N2-Sn1-O4 l46.88(8) C24-Sn1-N2 98.01(10) N2-Snl-O2 70.64(7) O2-Sn1-O4 l42.44(7) O2-Sn1-O2ⅰ 64.71(6) Cl7-Snl-O2ⅰ 83.13(9) C24-Sn1-O2ⅰ 83.98(9) Sn1-O2-Sn1ⅰ 115.29(7) O4-Snl-O2ⅰ 77.73(7) C2 O3-Sn1 0.231 2(5) O2-Sn1 0.2l3 9(4) Cl7-Sn1 0.213 8(7) N2-Sn1 0.223 0(5) O5-Sn1 0.248 3(6) C24-Sn1 0.215 3(7) O3ⅰ-Sn1 0.271 8(5) C17-Sn1-O2 91.9(2) C24-Sn1-O2 l00.4(2) Cl7-Sn1-O5 81.6(3) C17-Sn1-C24 162.7(3) C17-Sn1-O3 94.5(2) O2-Sn1-O5 77.46(l8) O2-Sn1-C24 94.0(2) O2-Sn1-O3 l39.50(15) C24-Sn1-O5 83.9(2) C17-Sn1-O2 96.9(2) C24-Sn1-O3 91.6(2) N2-Sn1-O5 l46.8l(l9) O2-Sn1-N2 69.42(17) N2-Sn1-O3 70.ll(l7) O3-Sn1-O5 l43.02(l7) O3-Sn1-O3ⅰ 65.23(15) O3ⅰ-Sn1-O5 77.09(17) C24-Sn1-O3ⅰ 83.50(l9) Sn1-O3ⅰ-Sn1ⅰ 114.77(18) C17-Sn1-O3ⅰ 84.38(22) Symmetry codes: ⅰ1-x, 1-y, 1-z for complex C1; ⅰ1-x, 1-y, 1-z for complex C2 表 3 配合物对癌细胞的体外抑制活性
Table 3. Inhibition activity of complexes to cancer cell in vitro(IC50) μmol·L-1
MCF7 Colo205 NCI-H460 Hela HepG2 HL7702 HEK293 C1 1.447 2.676 2.452 8.947 1.199 3.660 3.215 C2 3.150 4.891 13.92 8.167 2.683 31.06 26.54 Carboplatin 54.71 0.6247 63.34 42.94 1.349 67.87 57.31 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 1
- 文章访问数: 854
- HTML全文浏览量: 152


 下载:
下载:






 下载:
下载:

