 图 1
以葡萄糖为分散剂制得的TiO2(A), 以柠檬酸为模板制得的TiO2@C (B) 的透射电镜图, C和D分别对应B的放大图和高分辨率投射电镜图
Figure 1.
TEM image of (A) TiO2 prepared using glucose as a dispersant, (B) TiO2@C using citric as a template; (C) and (D) Corresponding magnification and high resolution TEM image of (B)
图 1
以葡萄糖为分散剂制得的TiO2(A), 以柠檬酸为模板制得的TiO2@C (B) 的透射电镜图, C和D分别对应B的放大图和高分辨率投射电镜图
Figure 1.
TEM image of (A) TiO2 prepared using glucose as a dispersant, (B) TiO2@C using citric as a template; (C) and (D) Corresponding magnification and high resolution TEM image of (B)

Citation: CHANG Guan-Ru, LU Xin-Yong, PEI Chun, CHEN Long, LI Zhao. Application of Mesoporous Titanium Composite Nanoclusters in Photothermal/Photodynamics Therapy[J]. Chinese Journal of Inorganic Chemistry, 2016, 32(7): 1141-1148. doi: 10.11862/CJIC.2016.161

介孔钛纳米复合团簇应用于光热-光动力疗法
English
Application of Mesoporous Titanium Composite Nanoclusters in Photothermal/Photodynamics Therapy
-
0 引言
癌症至今仍然是严重威胁人类健康的主要疾病之一。随着科技进步,一些癌症治疗的新方法,新思路相继出现,目前癌症的联合治疗业已成为人们研究的热点。光动力疗法 (PDT) 是一种有效治疗恶性肿瘤的新方法,其治疗原理利用肿瘤组织选择性地摄入一些染料或光敏剂,在适当波长的激光照射光敏剂产生大量的活性很强的单态氧 (1O2),进而和相邻的生物大分子发生氧化反应,产生细胞毒性而导致细胞受损乃至死亡,从而达到治疗目的。自1976年Kelly和Snell应用血卟啉衍生物成功治疗膀胱癌以来,光动力学疗法已逐步成为肿瘤的基本治疗手段之一[1-2]。光动力疗法以其创伤小,治疗时间短,不易产生细胞耐药性,在杀死癌细胞的同时不会使正常细胞受损,也不抑制免疫系统等优点。
由于纳米颗粒的尺寸比癌细胞小100~1 000倍,加之肿瘤组织的血管和淋巴系统的不完整,使得纳米颗粒进入人体后借助EPR效应富集在肿瘤组织部位[3]。因此,将纳米颗粒作为载体和光敏剂结合用于光动力疗法引起了人们极大的兴趣,若纳米载体具有光热效应,还可以用于光热与光动力协同抗肿瘤的治疗中。所谓光热疗法 (PTT) 就是是利用一些具有靶向性的识别技术将光热转换效率高的材料聚集在肿瘤组织附近,并在激光 (一般是近红外光) 的照射下产生热能,通过肿瘤组织局部高温来杀死癌细胞的一种治疗方法。
介孔二氧化钛 (TiO2) 就是这类纳米载体的代表,其本身可作为光敏剂,且具有价廉易得、催化活性高、化学稳定性好和安全无毒等特点,因而被广泛应用于光催化[4-6]、太阳能电池[7-8]、光动力疗法[9-10]等领域。纳米TiO2颗粒能够被正常组织内的巨噬细胞所吞噬,对动物体无毒性,不会引起白细胞减少等副作用[11-12]。然而,作为一种常用的光敏剂,受其禁带宽度所限,TiO2只能在紫外光激发下产生1O2,发挥其生物学效应。而长期接受紫外光的照射可能导致DNA损伤甚至造成皮肤癌,不利于人体的健康。将TiO2与其他窄带隙的染料复合被认为是拓宽其光响应区域最有效的途径之一。
亚甲基蓝 (MB) 作为第二代光敏剂,具有很高的量子产率、较宽的光响应区域、低毒性等优点。然而亚甲基蓝在体内不够稳定,容易与酶等活性物质生成亚甲基蓝二聚物,从而失去光敏性[14-15]导致治疗效果远低于实验预期。将MB与TiO2复合既能将TiO2光响应区域拓宽到红外光区,也能借助TiO2的保护作用避免MB被酶解。由于碳材料具有着超强的电子传输能力,能显著地抑制电子和空穴对复合,对纳米TiO2包碳能够有效提高其光催化性能,且操作简单,无污染[16-17]。
本文通过一步水热法[17]以柠檬酸为表面控制剂合成介孔纳米TiO2;利用TiO2的介孔结构吸附MB分子。在柠檬酸的作用下,TiO2的晶核围绕着柠檬酸的羧基官能团生长,同时柠檬酸也被水热还原为碳材料,逐渐形成大约100 nm的碳层包覆的介孔TiO2团簇。由于团簇尺寸所具有的EPR效应,能很好地进入并滞留在肿瘤部位,提高癌变部位光敏剂浓度,增强PDT的治疗效果;外层包裹的碳层能有效地抑制TiO2光激发的电子/空穴对的复合,提高光敏剂的量子产率;此外碳材料也具有一定的光热效果,能与光动力疗法联合 (PTT-PDT),进一步增强治疗效果。
1 实验方法
1.1 仪器与试剂
试剂:硫酸钛Ti(SO4)2、柠檬酸 (C6H8O7)、亚甲基蓝 (MB)、1, 3-二苯基异苯并呋喃 (DPBF)、多聚甲醛 (PFA)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐 (MTT,生物试剂)、DMEM高糖培养基 (GIBCO)、胎牛血清 (GIBCO)、双抗 (生物试剂)、胰酶 (质量浓度为0.25 g·L-1含EDTA,GIBCO)、Hoechst 33342(生物试剂)、碘化吡啶 (PI,生物试剂) 和荧光素 (FITC) 购于上海生工生物工程有限公司。实验中所用到化学试剂均为分析纯,且购买后直接使用。
仪器:同时利用S-4800型扫描电子显微镜和JEM 100SX型透射电子显微镜 (加速电压200 kV),观察产物形貌与结构特征;傅里叶变换红外光谱 (NEXUS-870, 频率范围:4 000~500 cm-1) 测定样品红外光谱。在法国Horiba jobin yvon公司产HR-800型拉曼光谱仪上进行拉曼光谱测试;采用DX-2700型X射线衍射仪 (Cu Kα射线作为发射源,λ=0.154 nm,测试电压40 kV,测试电流100 mA) 对样品的物相分析,扫描速度为6°·min-1;借助德国Leica公司的DMI3000B型倒置荧光显微镜观察细胞荧光成像;光热成像图由美国Fluke公司Ti32型热红外摄像机完成。
1.2 介孔TiO2@C纳米团簇的制备
0.24 g Ti(SO4)2溶解在20 mL去离子水中,添加0.01 g柠檬酸后磁力搅拌10 min,将水溶液转移到Teflon-sealed高压釜,维持在180 ℃ 12 h。反应液冷却至室温后,经多次离心、水洗干燥后,获得碳包裹的介孔二氧化钛纳米团簇。
1.3 TiO2@C-MB
将实验制得的介孔TiO2粉末 (50 mg) 浸没在20 mL的亚甲基蓝溶液 (1 mg·mL-1) 中2 h,离心、重新分散在甲苯中,除去表面粘附的亚甲基蓝分子,干燥后备用。
1.4 光热效果测试
采用 (Fluke Ti32) 热红外摄像机对光照后的去离子水、TiO2@C-MB进行了热红外图像采集,光照时间为15 min,研究其光致生热的效果。
1.5 细胞存活率测试
TiO2和TiO2@C-MB的生物相容性和细胞杀伤能力由MTT实验来检测。向培养基中分别加入一定量的TiO2或者TiO2@C-MB (浓度分别为50、20、10、0.1 μg·mL-1),保存备用。将Hela细胞以5×103个/孔的密度接种到96孔板,并放于含有5% CO2的二氧化碳培养箱 (37 ℃) 中培养24 h。然后移去培养基,加入100 μL上述复合材料培养基溶液 (包含空白对照组),在660 nm激光器下光照10 min。继续置于二氧化碳培养箱中孵化24 h,移去培养基,加入20 μL的MTT继续孵化4 h后,去除上层液,加入100 μL的DMSO,震荡溶解后使用酶联免疫检测仪进行检测490 nm处的OD值。细胞存活率可由下面公式[18]得出,其中ODb,ODc,和ODe分别对应空白组、对照组和实验组的OD值。
1.6 细胞的荧光成像实验
将接种在6孔板上的Hela细胞 (5×104个/孔) 放在含5% CO2的二氧化碳培养箱 (37 ℃) 中培养24 h。然后将3 mL含有TiO2(150 μg) 培养基加入到孔板中,孵化6 h后,用660 nm激光光照10 min。再用pH=7.2的磷酸盐 (PBS) 缓冲液将样品冲洗干净,用0.5 mL Hoechst 33342(1 μg·mL-1) 和0.5 mL PI (1 μg·mL-1) 对其进行双染色,最后利用倒置荧光显微镜进行观察。
TUNEL法检测HeLa细胞凋亡过程如下:加入预先稀释好的样品,培养6 h后,洗涤,用4%的多聚甲醛固定细胞。用PBS洗涤并在封闭液中继续孵化10 min。冲洗后用30%的Triton X-100溶液处理培养皿5 min,冲洗后加入TUNEL反应液,37 ℃避光培养60 min。试验结束后,荧光共聚焦显微镜下观察拍照确凋亡的细胞核。
2 结果与分析
2.1 样品的表征
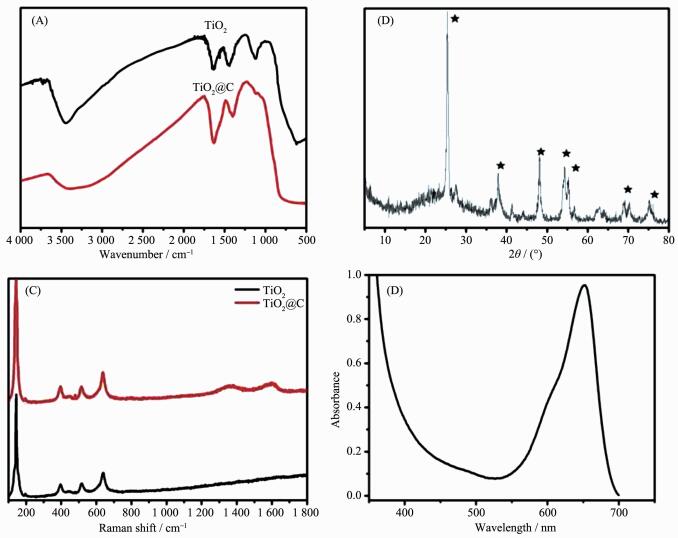
从图 1A与B可以看出, 以葡萄糖为分散剂制备的TiO2呈椭球状,粒子尺寸长15 nm,宽在10 nm,绝大部分处于单分散状态,颗粒中有明显的孔隙,少数颗粒出现堆积;而使用柠檬酸为模板制备的TiO2@C出现多个颗粒团聚现象,形成一个个相对独立的团簇结构,其粒径约100 nm。图C为图B进一步放大图,从C图中可以看出, 团簇颗粒边缘有明显的半透明裹覆层,其空隙分布也比较集中,呈现蜂窝状。图D是TiO2@C的高分辨率TEM图,从图中可以看出纳米粒子具有的介孔结构,孔径1~5 nm不等;晶格也十分清晰,其间距对应于锐钛矿TiO2结构。
 图 1
以葡萄糖为分散剂制得的TiO2(A), 以柠檬酸为模板制得的TiO2@C (B) 的透射电镜图, C和D分别对应B的放大图和高分辨率投射电镜图
Figure 1.
TEM image of (A) TiO2 prepared using glucose as a dispersant, (B) TiO2@C using citric as a template; (C) and (D) Corresponding magnification and high resolution TEM image of (B)
图 1
以葡萄糖为分散剂制得的TiO2(A), 以柠檬酸为模板制得的TiO2@C (B) 的透射电镜图, C和D分别对应B的放大图和高分辨率投射电镜图
Figure 1.
TEM image of (A) TiO2 prepared using glucose as a dispersant, (B) TiO2@C using citric as a template; (C) and (D) Corresponding magnification and high resolution TEM image of (B)
在图 2A中,在700~500 cm-1处的较宽吸收带是Ti-O-Ti键伸缩振动引起的,3 450 cm-1则对应着-OH的吸收峰;TiO2@C与TiO2相比,在1 120 cm-1处出现了一个新的吸收峰,其为C-O-C键的吸收峰。图 2B给出了TiO2@C的XRD图,从图中我们可以看出TiO2@C的衍射峰与标准锐钛矿晶型TiO2衍射峰对应的非常好,其中2θ=25.4°、37.9°、47.8°、54.3°、63.0°、69.0°和75.2°分别对应着 (101)、(004)、(200)、(105)、(211)、(116) 和 (215) 晶面。所有锐钛铁矿型特征峰都非常明显,没有其他杂峰,表明制备过程中其他反应物已去除干净。图 2C中的TiO2拉曼光谱147,396,512和635 cm-1处出现4个特征峰,吻合于锐钛矿型TiO2,而TiO2@C拉曼光谱在1 364.2、1 591.5 cm-1出现吸收峰,分别对应碳材料的D带和G带。上述分析结果表明有碳包覆在介孔TiO2上。图D为TiO2@C-MB的紫外吸收光谱,由图可知在657 cm-1处有最大紫外吸收峰,在可见光区和近红外区都有较好的吸收,表明复合后的TiO2其光响应区域向近红外区拓展。
2.2 单线态氧测定
利用1,3-二苯基异苯并呋喃 (DPBF) 作为1O2的捕获剂,检测其在410 nm处特征吸收峰的降低来展现1O2的产生情况。图 3A、B和C分别表示DPBF在TiO2、MB和TiO2@C-MB溶液中的随时间分解的紫外吸收光谱图,图 3D则对应着DPBF在410 nm的特征吸收峰值随光照时间的变化情况。相比TiO2、MB,TiO2@C-MB中DPBF的衰减速率更快,表明在光照条件下TiO2@C-MB能够在同样时间里产生最多的单1O2,从而可以很好地用于癌细胞的光动力学治疗。以上结果表明MB与TiO2复合,能显著提高TiO2的1O2产率,使其能更好的应用在光动力学疗法中。另外,MB被吸附在TiO2纳米晶的介孔中可以有效保护MB不被酶解,提高了光动力疗法的治疗效果。
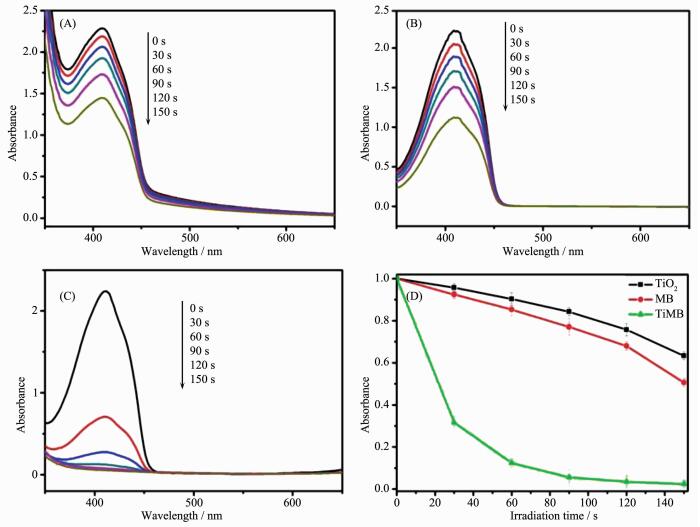 图 3
在TiO2 (A)、MB (B) 和TiO2@C-MB (C) 中,不同光照时间的DPBF吸收光谱; (D) 在TiO2、MB和TiO2@C-MB存在时, DPBF在410 nm处吸光度随光照时间变化
Figure 3.
Absorption spectra of DPBF in presence of TiO2 (A), MB (B) and TiO2@C-MB (C) under irradiation over different periods of time; (D) Time-dependent decrease in the absorbance of DPBF at 410 nm in presence of TiO2, MB and TiO2@C-MB under irradiation
图 3
在TiO2 (A)、MB (B) 和TiO2@C-MB (C) 中,不同光照时间的DPBF吸收光谱; (D) 在TiO2、MB和TiO2@C-MB存在时, DPBF在410 nm处吸光度随光照时间变化
Figure 3.
Absorption spectra of DPBF in presence of TiO2 (A), MB (B) and TiO2@C-MB (C) under irradiation over different periods of time; (D) Time-dependent decrease in the absorbance of DPBF at 410 nm in presence of TiO2, MB and TiO2@C-MB under irradiation
2.3 光热效果测试
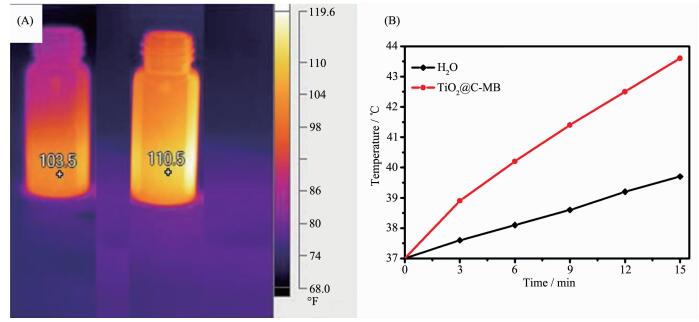
借助Fluke Ti32热红外摄像机对光照前后的纯水和TiO2@C-MB进行了热红外图像采集,光照时间为15 min。
结果如图 4B所示。光照之前,两者的温度相差不大,均接近于37 ℃(即98.6 ℉)。在808 nm近红外光照15 min之后,去离子水、TiO2@C-MB的温度分别39.7和43.5 ℃。光照后,装有TiO2@C-MB的瓶子温度有了明显地提高,可能归因于亚甲基蓝与介孔TiO2复合能够提高TiO2在近红外光的吸收和光热转化及碳裹覆层的光热效果,这也说明TiO2@C-MB具有很好的光热转化效果,可用于肿瘤细胞的光热疗法。
2.4 细胞存活率测试
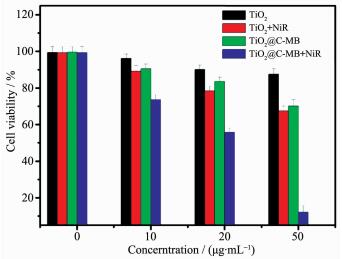
如图 5所示,光照前,随着TiO2质量浓度的变大,Hela细胞的活性没有明显下降,当TiO2的质量浓度为50 μg·mL-1时Hela细胞的活性为87.5%, 仍保持较高的活性,这与TiO2具有良好生物相容性的事实相符。然而,随着TiO2@C-MB用量增加,Hela细胞的活性由初始的99.5%下降至70.1%,表现出一定的细胞毒性,可能是因为复合材料中含有的少量MB分子进入到细胞培养液中,MB的低毒性造成了Hela细胞活性的下降。光照后,经TiO2、TiO2@C-MB培养后的细胞活性分别为67.5%和12.1%。这与1O2测定实验的结果一致,表明亚甲基蓝敏化TiO2纳米晶能够提高TiO2的光化学活性和光量子产率,介孔结构中也能够保障MB分子不被降解失活,利于细胞毒性的1O2生成。另外,外面的碳裹覆层具有一定的光热效果,这些均有利于杀伤HeLa细胞。对比同样浓度下光照前后的细胞活性,可知复合后的TiO2具有光热和光动力协同作用,治疗效果远远高于TiO2单纯的光动力疗法。
2.5 细胞荧光显微图像
利用Hoechst 33342和PI双染色法观察TiO2和TiO2@C-MB对细胞杀伤情况[19-20]。其中hoechst 33342能够通过细胞膜进入到细胞中,使活细胞呈蓝色荧光,而染料PI只能进入坏死细胞,染红细胞核。
通过荧光的变化和分布我们可以观察到Hela细胞的死亡与存活情况,进而表征TiO2和TiO2@C-MB杀伤癌细胞的能力。从图 6(不光照) 中的A2、B2、C2和图 7(光照) 中的A2、B2、C2可以看出hoechst 33342的蓝色荧光标记的Hela细胞分布情况。从图 6 A3 中可以看出,光照后,不加任何材料的Hela细胞没有红色荧光,说明Hela细胞处于存活状态,几乎没有死亡。在图 6 B3 、C3 中可以看出,加入TiO2、TiO2@C-MB在无光照条件下,没有出现明显红色荧光,说明Hela细胞的存活率没有因为TiO2、TiO2@C-MB的加入受到很大影响 (与MB复合后没有影响TiO2良好的生物相容性)。通过图 6 B3、C3与图 7 B3、C3对比可以看出,光照的条件下加入TiO2的细胞图中,只出现微弱的红色荧光,而加入TiO2@C-MB细胞图中,出现了显著的红色荧光,表明大部分的Hela细胞已经被杀死,证明复合后的TiO2对此波长的光具有较强的敏感性。结合前面光热效果实验及1O产生曲线,细胞染色实验结果表明TiO2@C-MB具有较好的光热效应,协同光动力学治疗能够有效杀伤肿瘤细胞也与MTT实验结果相符。
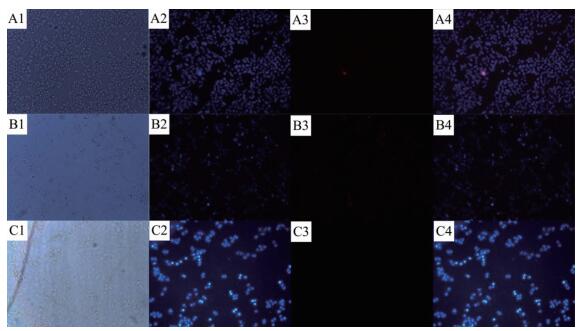 图 6
A、B与C分别为不光照情况下的对照组、培养基中含TiO2和TiO2@C-MB的Hela细胞荧光显微镜图, (1) Hela细胞 (光学图), (2) Hoechst 33342染色, (3) PI染色, (4) 为 (2) 和 (3) 的拟合图
Figure 6.
Fluorescence microscopy images of Hela cells without irradiation (A) control, incubated with TiO2 (B) and TiO2@C-MB (C),(1) Hela cell, dyed by (2) Hoechst 33342, (3) PI and (4) the merged images of (2) and (3)
图 6
A、B与C分别为不光照情况下的对照组、培养基中含TiO2和TiO2@C-MB的Hela细胞荧光显微镜图, (1) Hela细胞 (光学图), (2) Hoechst 33342染色, (3) PI染色, (4) 为 (2) 和 (3) 的拟合图
Figure 6.
Fluorescence microscopy images of Hela cells without irradiation (A) control, incubated with TiO2 (B) and TiO2@C-MB (C),(1) Hela cell, dyed by (2) Hoechst 33342, (3) PI and (4) the merged images of (2) and (3)
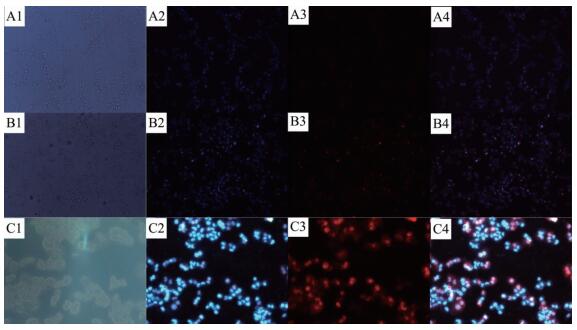 图 7
A、B与C分别为光照情况下的对照组,培养基中含TiO2,TiO2@C-MB的Hela细胞荧光显微镜图, (1) Hela细胞 (光学图), (2) Hoechst 33342染色, (3) PI染色, (4) 为 (2) 和 (3) 的拟合图
Figure 7.
Fluorescence microscopy images of Hela cells with irradiation (A) control, incubated with TiO2 (B) and TiO2@C-MB (C), (1) Hela cell, dyed by (2) Hoechst 33342, (3) PI and (4) the merged images of (2) and (3)
图 7
A、B与C分别为光照情况下的对照组,培养基中含TiO2,TiO2@C-MB的Hela细胞荧光显微镜图, (1) Hela细胞 (光学图), (2) Hoechst 33342染色, (3) PI染色, (4) 为 (2) 和 (3) 的拟合图
Figure 7.
Fluorescence microscopy images of Hela cells with irradiation (A) control, incubated with TiO2 (B) and TiO2@C-MB (C), (1) Hela cell, dyed by (2) Hoechst 33342, (3) PI and (4) the merged images of (2) and (3)
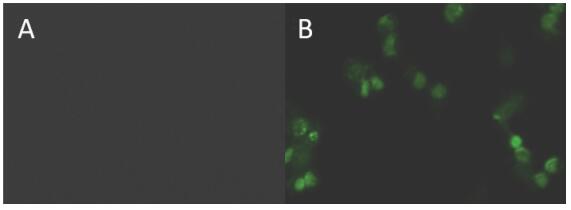
TUNEL实验的原理是在脱氧核糖核苷酸酶 (TdT) 的作用下,将荧光素标记到凋亡细胞的DNA的3'-OH,使细胞核显绿色,从而检测到细胞凋亡[21]。如图 8A所示,在近红外光辐射TiO2@C-MB前,几乎没有检测到任何凋亡细胞;光照10 min后,细胞核有明显的绿色荧光,细胞凋亡明显 (图 8B)。结果表明, 近红外激光谱辐射TiO2@C-MB可促进HeLa细胞凋亡。
3 结论
我们通过水热合成法合成得到的介孔二氧化钛纳米团簇,表现出有规律的团聚,尺寸在100~200 nm;紫外吸收光谱表明其最大吸收波长由387 nm红移到658 nm,证明MB与TiO2的复合拓宽了TiO2的光响应区域,;拉曼光谱则表明制得的介孔TiO2表面包覆了一层纳米碳材料。光动力学测试表明该复合材料具有较高的量子产率。MTT实验、细胞荧光实验和细胞凋亡实验结果均表明TiO2@C-MB所具有的光热-光动力联合治疗的治疗效果远比TiO2单纯的光动力疗法更为理想。
-
-
[1]
Liang X, Li X, Yue X, et al. Angew. Chew. Int. Ed, 2011, 50 (49):11622-11627 doi: 10.1002/anie.201103557
-
[2]
Sun Y Q, Liu J, Lü X, et al. Angew. Chew. Int. Ed, 2012, 51 (31):7634-7636 doi: 10.1002/anie.201202264
-
[3]
Jiang M Y, Dolphin D. J. Am. Chem. Soc., 2008, 130(13): 4236-4237 doi: 10.1021/ja800140g
-
[4]
魏圆, 康诗钊, 李向清, 等.无机化学学报, 2015, 31(8)1581-1589 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20150817&journal_id=wjhxxbcnWEI Yuan, KANG Shi-Zhao, LI Xiang-Qing, et al. Chinese J. Inorg. Chem., 2015, 31(8)1581-1589 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20150817&journal_id=wjhxxbcn
-
[5]
Lawless D, Serpone N, Meisel D. Phys. Chem., 1991, 95(13): 5166-5170 doi: 10.1021/j100166a047
-
[6]
Vinodgopal K, Kamat P V. Environ. Sci. Technol., 1995, 29 (3):841-845 doi: 10.1021/es00003a037
-
[7]
Miljevic M, Geiseler B, Bergfeldt T, et al. Adv. Funct. Mater., 2014, 24(7):907-915 doi: 10.1002/adfm.v24.7
-
[8]
卢永娟, 贾均红.无机化学学报, 2015, 31(6):1091-1098 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20150604&journal_id=wjhxxbcnLU Yong-Juan, JIA Jun-Hong. Chinese J. Inorg. Chem., 2015, 31(6):1091-1098 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20150604&journal_id=wjhxxbcn
-
[9]
Gratzel M. Nature, 2001, 414(6861):338-344 doi: 10.1038/35104607
-
[10]
Sun C H, Yang X H, Chen J S, et al. Chem. Commun., 2010, 46(46):6129-6131 http://www.ncbi.nlm.nih.gov/pubmed/20661506
-
[11]
Qin Y, Sun L, Li X, et al. J. Mater. Chem., 2011, 21(44): 18003-18010 doi: 10.1039/c1jm13615a
-
[12]
Rozhkova E A, Ulasov I, Lai B, et al. Nano Lett., 2009, 9 (9):3337-3342 doi: 10.1021/nl901610f
-
[13]
Liu L, Miao P, Xu Y, et al. J. Photochem. Photobiol. B, 2010, 98(3):207-210 doi: 10.1016/j.jphotobiol.2010.01.005
-
[14]
He X, Wu X, Wang K, et al. Biomaterials, 2009, 30(29): 5601-5609 doi: 10.1016/j.biomaterials.2009.06.030
-
[15]
Hah H J, Kim G, Lee Y-EK, et al. Macromol. Biosci., 2011, 11(1):90-99 doi: 10.1002/mabi.v11.1
-
[16]
Yan W, He F, Gai S L, et al. J. Mater. Chem. A, 2014, 2 (10):3605-3612 doi: 10.1039/c3ta14718e
-
[17]
Shu W, Liu Y L, Peng Z Y, et al. J. Alloys Compd., 2013, 563(3):229-233 http://www.sciencedirect.com/science/article/pii/S0925838813003940
-
[18]
Qiu C, Xing M Y, Zhang J L. J. Am. Chem. Soc., 2014, 136 (16):5852-5855 doi: 10.1021/ja500873u
-
[19]
Kundu B, Kundu S C. Biomaterials, 2012, 33(30):7456-7467 doi: 10.1016/j.biomaterials.2012.06.091
-
[20]
Zhao J, Huang Y, Song Y, et al. Toxicol. Lett., 2009, 185(2): 124-131 doi: 10.1016/j.toxlet.2008.12.009
-
[21]
Ji Q X, Deng J, Xing X M, et al. Carbohydr. Polym., 2010, 82(4):1153-1160 doi: 10.1016/j.carbpol.2010.06.045
-
[22]
Darzynkiewicz Z, Galkowski D, Zhao H. Methods, 2008, 44 (3):250-254 doi: 10.1016/j.ymeth.2007.11.008
-
[1]
-
图 3 在TiO2 (A)、MB (B) 和TiO2@C-MB (C) 中,不同光照时间的DPBF吸收光谱; (D) 在TiO2、MB和TiO2@C-MB存在时, DPBF在410 nm处吸光度随光照时间变化
Figure 3 Absorption spectra of DPBF in presence of TiO2 (A), MB (B) and TiO2@C-MB (C) under irradiation over different periods of time; (D) Time-dependent decrease in the absorbance of DPBF at 410 nm in presence of TiO2, MB and TiO2@C-MB under irradiation
图 6 A、B与C分别为不光照情况下的对照组、培养基中含TiO2和TiO2@C-MB的Hela细胞荧光显微镜图, (1) Hela细胞 (光学图), (2) Hoechst 33342染色, (3) PI染色, (4) 为 (2) 和 (3) 的拟合图
Figure 6 Fluorescence microscopy images of Hela cells without irradiation (A) control, incubated with TiO2 (B) and TiO2@C-MB (C),(1) Hela cell, dyed by (2) Hoechst 33342, (3) PI and (4) the merged images of (2) and (3)
图 7 A、B与C分别为光照情况下的对照组,培养基中含TiO2,TiO2@C-MB的Hela细胞荧光显微镜图, (1) Hela细胞 (光学图), (2) Hoechst 33342染色, (3) PI染色, (4) 为 (2) 和 (3) 的拟合图
Figure 7 Fluorescence microscopy images of Hela cells with irradiation (A) control, incubated with TiO2 (B) and TiO2@C-MB (C), (1) Hela cell, dyed by (2) Hoechst 33342, (3) PI and (4) the merged images of (2) and (3)
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 2
- 文章访问数: 1028
- HTML全文浏览量: 293


 下载:
下载:







 下载:
下载:

