 图 1
石墨、GO、graphene和NZFG的XRD图
Figure 1.
XRD patterns of Graphite, GO, grapheme and NZFG
图 1
石墨、GO、graphene和NZFG的XRD图
Figure 1.
XRD patterns of Graphite, GO, grapheme and NZFG

Citation: WU Shui-Sheng, MA Bo-Kai, JIA Qing-Ming, WANG Ya-Ming, DAI Wei-Li, ZHANG Shi-Ying. Synthesis and Photocatalytic Properties of Magnetically Separated Ni-Zn Ferrite-Graphene Nanocomposite[J]. Chinese Journal of Inorganic Chemistry, 2016, 32(4): 561-566. doi: 10.11862/CJIC.2016.094

可磁分离的镍锌铁氧体-石墨烯复合材料的制备及其光催化性能
English
Synthesis and Photocatalytic Properties of Magnetically Separated Ni-Zn Ferrite-Graphene Nanocomposite
-
Key words:
- Ni-Zn ferrite
- / graphene
- / microwave hydrothermal
- / photocatalysis
- / characterization
-
0 引言
具有尖晶石结构的镍锌铁氧体是重要的磁性材料[1], 其中ZnFe2O4由于带隙较窄 (1.92 eV),已被证明具有一定的光催化性能,但通常其磁性较弱不能满足磁分离要求[2]。NiFe2O4带隙为2.19 eV有较好的可见光吸收性能且表现为铁磁性[3],若是在ZnFe2O4中引入Ni元素形成镍锌铁氧体,则会改变其磁性能和光催化性能。然而镍锌铁氧体价带电势和光电转化效率较低,使其不适合直接用于光催化降解有机染料,但有磁性可通过外加磁场回收循环利用[4]。目前主要通过贵金属沉积、掺杂和复合等方法来提高铁酸盐的光催化性能[5-6]。
石墨烯 (graphene) 是新型二维碳纳米材料[7],具有比表面积大 (2 630 m2·g-1)[8]、化学稳定性高以及优异的电子传导性能 (2×105 cm2·V-1·s-1)[9]。研究表明将石墨烯与半导体光催化剂复合,利用石墨烯规整的二维平面结构作为光催化剂的载体,一方面可以提高催化剂的分散程度,另一方面石墨烯可以作为电子传递介质提高半导体中光生电子的迁移速率,降低载流子的复合几率,提高复合材料的光催化活性[10-11]。
微波水热法是一种特殊的液相合成方法,它把传统的水热合成法与微波场结合起来,有加热速度快、反应灵敏、受热均匀、对很多反应体系具有加速化学反应的优点,在制备均匀、粒度分布狭窄的纳米级粉体方面具有独特的优势,故其在制备纳米粉体方面得到了广泛的研究[12-13]。本文采用简易的微波水热法快速制备Ni0.5Zn0.5Fe2O4-graphene纳米复合物 (简称NZFG)。采用XRD、Raman、TEM/HRTEM、XPS和VSM对合成的样品进行了表征,研究了NZFG纳米复合物的光催化性能并且初步探讨其光催化剂机理,最后了考察光催化剂的稳定性。
1 实验部分
1.1 微波水热法制备NZFG复合材料
氧化石墨采用改性的Hummer法合成[14]。NZFG合成过程如下:将20 mg氧化石墨烯GO溶于20 mL水中,超声分散处理2 h;0.375 mmol硝酸锌、0.375 mmol硝酸镍和1.5mmol硝酸铁的溶解于10 mL水和5 mL PEG-400的混合溶液中搅拌30 min,缓慢加入超声好的GO分散液,搅拌2 h。滴加NH3·H2O调节pH值到10,定容至40 mL,加入50 mg硼氢化钠。然后快速转移该混合溶液到50 mL微波消解釜,固定在MDS-6微波反应器内,设定温度程序3 min内达到反应温度180 ℃,并且在180 ℃维持10 min。反应结束自然冷却到室温,将反应产物过滤,用去离子水和乙醇淋洗,60 ℃过夜烘干即得产物。用类似的方法也合成Ni0.5Zn0.5Fe2O4和石墨烯。
1.2 产物的表征
采用X射线粉末衍射仪 (XRD,Bruker D8 Advance X-Ray Diffractometer) 分析物相,透射电镜 (JEOL 2010F) 分析形貌和粒径,Raman光谱在Renishaw RM-1000上测量、XPS光谱在飞利浦X射线光电子能谱上测量,样品磁性能在综合物性测量系统 (PPMS,Quantum Design Inc.) 室温下测定,使用Hitachi F-4500型荧光光谱仪测试荧光光谱。
1.3 可见光催化实验
光催化实验的光源为带有400 nm滤波片的氙灯 (300 W)。将40 mg催化剂分散于40 mL亚甲基蓝溶液 (20 mg·L-1) 的烧杯中,避光搅拌50 min以达到吸附-脱附平衡,光照开始后每隔5~10 min取反应液,经离心后通过紫外可见分光光度计在MB最大吸收波长664 nm处测量其吸光度值并计算降解率。
2 结果与讨论
2.1 NZFG复合材料的表征
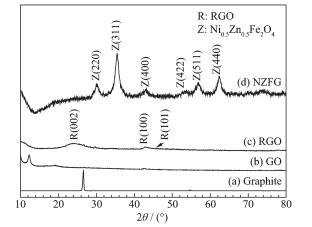
合成产物的XRD图如图 1所示。图 1a在2θ=26°对应于石墨的002衍射峰,图 1b氧化石墨在2θ=26°峰消失,同时在2θ=11.7°左右出现新的特征衍射峰,对应于氧化石墨的 (002) 衍射峰,说明采用改性的Hummer法得到了氧化石墨。图 1d为NZFG复合材料的XRD,所有衍射峰均与立方相尖晶石Ni0.5Zn0.5Fe2O4(JCPDS card No.74-22081) 吻合[15],其中位于30.1°、35.3°、43.0°、53.1°、56.7°和67.5°的衍射峰分别对应于 (220)、(311)、(400)、(422)、(511) 和 (440) 晶面,并且XRD衍射峰宽化,说明合成的晶粒尺寸很小,通过使用谢乐公式可以计算出镍锌铁氧体 (311) 晶面的平均晶粒尺寸为12 nm。NZFG复合材料在2θ=11.7°的衍射峰强度已经消失,也表明氧化石墨还原得到石墨烯结构。
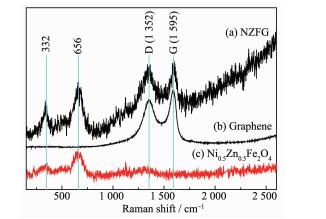
图 2是NZFG复合材料、氧化石墨以及纯Ni0.5Zn0.5Fe2O4的Raman光谱。1 595 cm-1对应于sp2杂化的碳原子G band和1 352 cm-1来源于无序碳原子D band均能在NZFG复合材料 (图 2a) 和石墨烯 (图 2b) 中观测到[16-18]。NZFG复合材料的D band与G band的峰强度比值 (ID/IG) 为0.98,相比于氧化石墨ID/IG=0.94高,可能纳米粒子锚固在石墨烯表面,与石墨烯相互作用后导致表面无序碳原子增多[19]。对比图 2a和2c,NZFG复合材料和纯镍锌铁氧体中均能观测到2个明显的Raman峰,332 cm-1的拉曼峰于尖晶石八面体AO6的Fe3+和O2-的晶格振动 (T2g3模式);656 cm-1的拉曼峰归因于尖晶石四面体AO4的Fe3+和O2-的晶格伸缩振动 (A1g模式)[20-21]。进一步说明所制备的样品中含有铁酸盐和石墨烯。
图 3为NZFG复合材料的透射电镜 (TEM/HRTEM)。图 3a和3b所示石墨烯为大约为直径500 nm的不规则片状结构,Ni0.5Zn0.5Fe2O4纳米颗粒以单分散状态锚固在在石墨烯片上,基本不团聚,说明合成的NZFG复合材料在合成过程中Ni0.5Zn0.5Fe2O4和RGO有相互作用,而不是的简单机械混合。从图 3c可清楚看到纳米颗粒尺寸均匀,在13 nm左右,与XRD数据经谢乐公式计算得到的颗粒尺寸基本吻合。图 3d为NZFG复合材料的高分辨透射电子显微镜图像,纳米颗粒显示很好的二维晶格条纹,晶格间距0.195 nm,这与尖晶石结构Ni0.5Zn0.5Fe2O4的 (400) 晶面间距匹配。
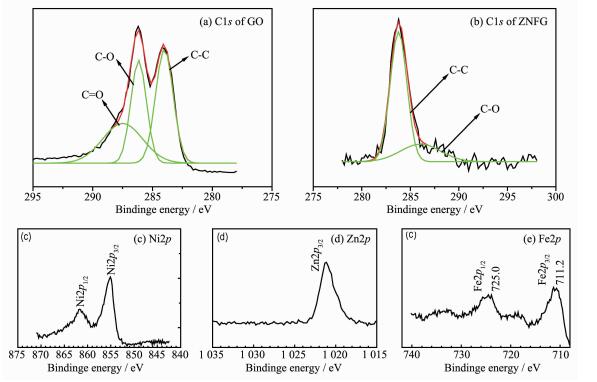
图 4为GO和NZFG复合材料的X射线光电子能谱分析谱 (XPS)。碳材料的C1s通常可拟合3种峰:sp2杂化的C-C峰 (284.8 eV)、羟基C-OH (286.4 eV)、羧基-COOH (288.4 eV)[22-24]。图 4a为GO的C1s XPS,显示采用改进的Hummers方法获得了具有相当程度的氧化石墨烯,180 ℃微波水热反应10 min制备的NZFG复合材料可明显观察到C1s的羟基C-OH和羧基-COOH峰强度大大降低 (图 4b),这表明水热过程中氧化石墨烯高效脱氧生成了石墨烯。Ni2p3/2的XPS峰位于855.0 eV和Ni2p1/2的XPS峰位于861.7 eV,以及Zn2p3/2的XPS峰位于1 021.3 eV (图 4c和4d),揭示NZFG复合材料的镍和锌以Ni2+和Zn2+形式存在[25-27]。XPS谱电子结合能为711.2和725.0 eV分别对应Fe2p3/2和Fe2p1/2(图 4e),并且717.3 eV有一个小卫星峰,这与文献报道的铁酸盐中的Fe3+的XPS谱相一致[25-27],XPS分析可知合成的NZFG复合材料含有镍锌铁氧体和石墨烯。
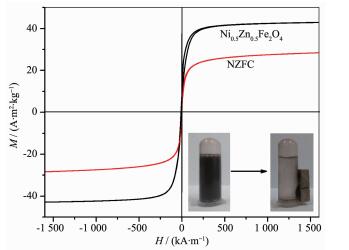
图 5为所制备的Ni0.5Zn0.5Fe2O4和NZFG复合材料的磁性能曲线。可以看出Ni0.5Zn0.5Fe2O4和NZFG复合材料的饱和磁化强度分别为42.9和28.2 A·m2·kg-1,剩磁和矫顽力基本为零,说明制备的物质具有超顺磁性。因此,当光催化体系外加磁场时,能够方便地回收磁性NZFG复合材料,当撤去外磁场时,又能重新分散在光催化体系中[28-29]。另外NZFG复合材料比Ni0.5Zn0.5Fe2O4的磁性弱,这是由于没有磁性的石墨烯包覆在磁性Ni0.5Zn0.5Fe2O4的表面所致。
2.2 NZFG复合材料的光催化性能与机理研究
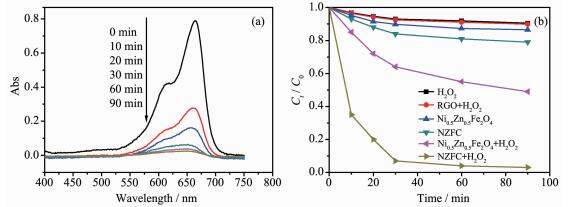
通过光催化降解MB染料废水来考察催化剂的活性结果见图 6。图 6a为H2O2存在条件下,NZFG复合材料可见光降解MB溶液的紫外可见吸收光谱的变化曲线,在光照10 min时,MB的664 nm处特征吸收峰吸光度迅速下降,说明MB的浓度在减小,表明了H2O2存在条件下,NZFG对于MB的降解具有很高的催化活性。
图 6b为不同催化系统可见光催化降解MB的催化活性的比较。从图中可以看出,催化剂的催化活性顺序为:NZFG+H2O2>Ni0.5Zn0.5Fe2O4+H2O2>NZFG>Ni0.5Zn0.5Fe2O4>RGO+H2O2>H2O2。对于只有H2O2、RGO+H2O2和纯Ni0.5Zn0.5Fe2O4存在条件下,在光照90 min时,MB的降解率分别为9.5%、10.2%和13.5%,说明对于MB的降解可以忽略不计。而对于NZFG光催化活性与纯Ni0.5Zn0.5Fe2O4相比有了一定的提高,光照90 min MB的降解率达到21%。
从图 6b中可以看出,在H2O2存在下Ni0.5Zn0.5Fe2O4的光催化活性有了一定的提高,光照90 min后MB的降解率达到了51%,光催化活性的提高主要归因于光Fenton反应。而对于NZFG在H2O2存在下,光催化活性显著提高,光照10 min MB的降解率就达到了65%,光照90 min后降解率达到97.5%,这主要归因于石墨烯的引入,优异的导电性能使Ni0.5Zn0.5Fe2O4激发光生电子一经产生,就会立刻转移到石墨烯上,导致光生电子与空穴有效分离,然后,转移到石墨烯上的电子能够与吸附在其表面的H2O2迅速反应形成羟基自由基降解MB分子,此反应机理占主导地位。
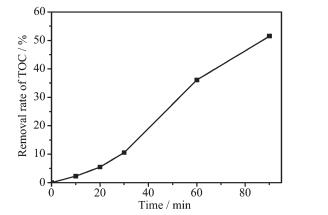
H2O2存在时NZFG复合材料可见光降解MB溶液的TOC浓度随时间的变化情况如图 7所示。由图可知, 光催化降解30 min后水样的TOC去除率仅为10.6%, 说明在光催化反应的初始阶段,染料分子的发色基团首先被破坏, 只有少部分被直接矿化。当降解90 min时,TOC的去除率达到51.5%,说明随着光催化反应时间的延长, MB能够在NZFG复合材料光催化作用下被逐渐矿化。
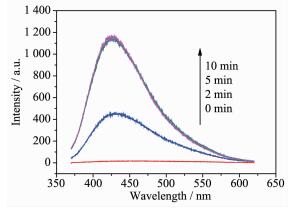
为了验证NZFG能够光降解H2O2产生羟基自由基,利用对苯二甲酸 (TA) 与羟基自由基 (·OH) 反应,生成具有荧光特性的2-羟基对苯二甲酸 (TAOH),采用荧光光谱检测2-羟基对苯二甲酸的荧光强度的变化,可以间接的得到·OH的量[26]。根据上面的方法, 如果NZFG能够光降解H2O2生成·OH, 那么·OH就能够与TA反应生成TAOH。将3 mmol ·L-1的TA和0.5 mL的H2O2溶于40 mL的去离子水中,之后加入10 mg的NZFG,开灯光照之后,定时取出约3 mL的溶液离心分离,取上层清液,用荧光分光光度计测试其在426 nm处的荧光强度,如图 8所示。t=0时即光照之前荧光强度为0,说明没有TAOH生成;当光照2 min时荧光强度荧光强度迅速增加,说明有TAOH生成,也就是说光照下NZFG能够光降解H2O2生成·OH;光照5 min之后荧光强度荧光强度基本保持不变,说明H2O2全部被降解生成了·OH,同时也说明了NZFG能够在很短的时间内光降解H2O2生成·OH,这也从另一侧面证明了为什么在H2O2存在条件下,NZFG的光催化降解MB,仅仅在可见光照射10 min时,MB的降解率就达到了65%。
根据实验结果和相关文献,推测了NZFC的光催化氧化降解机理。当可见光照射NZFC纳米材料时,会将Ni0.5Zn0.5Fe2O4价带上的电子激发跃迁到导带,产生光生电子和空穴。由于石墨烯的引入,其非常优异的导电性能使光生电子一产生,就会马上转移到石墨烯片层上,从而导致光生电子和空穴的有效分离。转移到石墨烯上的电子能够与吸附在其表面的H2O2反应形成强氧化剂羟基自由基 (·OH),羟基自由基和表面的光空穴等活性物质能够将吸附在催化剂表面的MB分子降解矿化,降解可能的反应过程如下:
除了具有高的催化活性外,NZFG复合型光催化剂克服了一般粉末难以回收的缺点,通过简单的磁分离即可回收。为了探讨NZFG的光催化稳定性,回收催化剂后再加入新鲜MB溶液和H2O2重新进行光催化降解实验,反复4次循环。实验结果如图 9所示,由图可见,经历4次循环利用后样品的光催化降解效率降低不足3%,显示了NZFG复合型光催化剂良好的稳定性。
3 结论
(1) 微波水热快速制备了Ni0.5Zn0.5Fe2O4-graphene纳米复合材料。XRD、Raman、TEM、XPS和VSM结果表明13 nm左右的Ni0.5Zn0.5Fe2O4纳米颗粒分散锚固在石墨烯片上,饱和磁化强度为28.2 A·m2·kg-1,剩磁和矫顽力基本为零,具有超顺磁性可满足磁分离要求。
(2) 在H2O2存在条件下,可见光照射90 min时,复合材料对MB降解率达到97.5%,较好的光催化活性主要归因于优异的导电性质的石墨烯使光生电子与空穴有效分离,并且转移到石墨烯上的电子能够与吸附在其表面的H2O2迅速反应形成羟基自由基从而加速降解MB分子。回收的样品经历4次重复试验表明降解率没有明显降低,说明Ni0.5Zn0.5Fe2O4-graphene纳米复合材料是一种稳定可重复使用的光催化剂。
-
-
[1]
Deraza N M, Abd-Elkader O H. J. Anal. Appl. Pyrolysis, 2014, 106:171-176 doi: 10.1016/j.jaap.2014.01.017
-
[2]
Boumaza S, Boudjemaa A, Bouguelia A, et al. Appl. Energ, 2010, 87(7):2230-2236 doi: 10.1016/j.apenergy.2009.12.016
-
[3]
Jadhav S D, Hankare P P, Patil R P, et al. Mater. Lett., 2011, 65(2):371-373 doi: 10.1016/j.matlet.2010.10.004
-
[4]
Valenzuela M A, Bosch P, Jimenez-Becerrill J, et al. J. Photochem. Photobiol. A, 2002, 148(1/2/3):177-182 http://www.jim.org.cn/EN/abstract/abstract9553.shtml
-
[5]
Cao X B, Gu L, Lan X M, et al. Mater. Chem. Phys., 2007, 106(2/3):175-180 http://muchong.com/html/201104/3050064.html
-
[6]
Bai J H. Mater. Lett., 2009, 63(17):1485-1488 doi: 10.1016/j.matlet.2009.03.052
-
[7]
Novosclov K S, Geim A K, Morozov S V, et al. Science, 2004, 306:666-669 doi: 10.1126/science.1102896
-
[8]
Stoller M D, Park S, Zhu Y, et al. Nano Lett., 2008, 8(10): 3498-3502 doi: 10.1021/nl802558y
-
[9]
Bolotin K I, Sikes K J, Jiang Z, et al. Solid State Commun., 2008, 146:35l-355 doi: 10.1016/j.ssc.2008.02.024
-
[10]
Lin Y, Zhang K, Chen M F, et al. ACS Nano, 2010, 4(6): 3033-3038 doi: 10.1021/nn100134j
-
[11]
Xu T G, Zhang L W, Cheng H Y, et al. Appl. Catal. B, 201I, 101:382-387 doi: 10.1088/0957-4484/25/26/265701/meta
-
[12]
种法国, 赵景联.高校化学工程学报, 2006, 20 (1):138-141 http://www.cjcu.jlu.edu.cn/EN/column/column104.shtmlCHONG Fa-Guo, ZHAO Jing-Lian. J. Chem. Eng. Chinese Univ., 2006, 20 (1):138-141 http://www.cjcu.jlu.edu.cn/EN/column/column104.shtml
-
[13]
王永在, 陈志伟, 郭红.人工晶体学报, 2008, 67(5): 1220-1223 https://www.researchgate.net/publication/264723741_ChemInform_Abstract_An_Efficient_Access_to_Fluorescent_234-Tricyanofurans_from_a-Cyano_Ketones_Using_DDQ_as_Maleonitrile_Building_BlockWANG Yong-Zai, CHEN Zhi-Wei, GUO Hong. J. Synth. Cryst., 2008, 67(5): 1220-1223 https://www.researchgate.net/publication/264723741_ChemInform_Abstract_An_Efficient_Access_to_Fluorescent_234-Tricyanofurans_from_a-Cyano_Ketones_Using_DDQ_as_Maleonitrile_Building_Block
-
[14]
Li B J, Cao H Q. J. Mater. Chem., 2011, 21(10):3346-3349 doi: 10.1039/C0JM03253K
-
[15]
张永刚, 徐波, 王树林,等.功能材料, 2013, 44(14): 2010-2013 doi: 10.3969/j.issn.1001-9731.2013.14.008ZHANG Yong-Gang, XU Bo, WANG Shu-Lin, et al. J. Funct. Mater., 2013, 44(14): 2010-2013 doi: 10.3969/j.issn.1001-9731.2013.14.008
-
[16]
Dresselhaus M S, Jorio A, Hofmann M, et al. Nano Lett., 2010, 10(3):751-758 doi: 10.1021/nl904286r
-
[17]
Tuinstra F, Koenig J L. J. Chem. Phys., 1970, 53(3):1126-1130 doi: 10.1063/1.1674108
-
[18]
Ferrari A C, Robertson J. Phys. Rev. B: Condens. Matter, 2000, 61(20):14095-14107 doi: 10.1103/PhysRevB.61.14095
-
[19]
Chen S Q, Wang Y. J. Mater. Chem., 2010, 20(43):9735-9739 doi: 10.1039/c0jm01573c
-
[20]
Wang Z W, Lazor P, Saxena S K, et al. J. Solid State Chem., 2002, 165(1):165-170 doi: 10.1006/jssc.2002.9527
-
[21]
Ayyappan S, Philip J, Raj B. J. Phys. Chem. C, 2009, 113 (2):590-596 doi: 10.1021/jp8083875
-
[22]
陈小刚, 贺蕴秋, 张琼,等.无机化学学报, 2009, 25(11):1953-1959 doi: 10.3321/j.issn:1001-4861.2009.11.012CHEN Xiao-Gang, HE Yun-Qiu, ZHANG Qiong, et al. Chinese J. Inorg. Chem., 2009, 25(11):1953-1959 doi: 10.3321/j.issn:1001-4861.2009.11.012
-
[23]
Li B J, Cao H Q, Shao J, et al. Chem. Commun., 2011, 47 (11):3159-3161 doi: 10.1039/c0cc04507a
-
[24]
Wu Z S, Ren W C, Wen L, et al. ACS Nano, 2010, 4(6): 3187-3194 doi: 10.1021/nn100740x
-
[25]
Xing Z, Ju Z C, Yang J, et al. Nano Res., 2012, 5(7):477-485 doi: 10.1007/s12274-012-0233-2
-
[26]
Chen L Y, Dai H, Shen Y M, et al. J. Alloys Compd., 2010, 491(1/2):L33-L38 http://www.nature.com/nmat/journal/v13/n7/abs/nmat3990.html
-
[27]
许士洪, 上官文峰, 袁坚,等.中国化学工程学报, 2007, 15(2):190-195 http://en.cnki.com.cn/Article_en/CJFDTotal-JZSX200624097.htmXU Shi-Hong, SHANGGUAN Wen-Feng, YUAN Jian, et al. Chin. J. Chem. Eng., 2007, 15(2):190-195 http://en.cnki.com.cn/Article_en/CJFDTotal-JZSX200624097.htm
-
[28]
Hirakawa T, Nosaka Y. Langmuir, 2002, 18:3247-3254 doi: 10.1021/la015685a
-
[29]
杨静, 崔世海, 练鸿振.无机化学学报, 2013, 29 (10):2043-2048 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?file_no=20131004&flag=1YANG Jing, CUI Shi-Hai, LIAN Hong-Zhen. Chinese J. Inorg. Chem., 2013, 29 (10):2043-2048 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?file_no=20131004&flag=1
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 634
- HTML全文浏览量: 91




 下载:
下载:








 下载:
下载:

