
Citation: LIU Dan-Dan, GE Kun, SUN Jing, ZHANG Shao-Han, ZHANG Jin-Chao. Effects of TbCl3 on the Proliferation, Osteogenic Differentiation and Mineralization Function of MC3T3-E1 Cells in Vitro[J]. Chinese Journal of Inorganic Chemistry, 2016, 32(4): 583-588. doi: 10.11862/CJIC.2016.072

稀土化合物TbCl3对成骨细胞系MC3T3-E1增殖、分化和矿化功能的影响
English
Effects of TbCl3 on the Proliferation, Osteogenic Differentiation and Mineralization Function of MC3T3-E1 Cells in Vitro
-
Key words:
- TbCl3
- / proliferation
- / osteogenic differentiation
- / mineralization
-
0 引言
稀土元素铽 (Tb) 已广泛应用于工业,例如,掺Tb的法拉第磁光玻璃、光纤通信、传感器等。除此之外,Tb化合物在生物医药领域的应用也甚为广泛。Ye等[1]报道,Tb掺杂的二氧化硅纳米颗粒作为荧光探针广泛应用于高灵敏临床分析、时间分辩荧光成像技术及其它生物技术上。Hussein等[2]发现三价Tb化合物具有较强的抗肿瘤活性,可以抑制人肝癌细胞HepG2和人乳腺癌细胞MCF7的生长。另外,Kubíček等[3]发现,三价Tb化合物作为骨靶向造影剂对羟基磷灰石有一定的吸收能力,从而影响骨矿化能力。随着稀土Tb的广泛应用,其在人体内的蓄积和分布已经引起广泛关注。据文献报道[4-5],稀土一般在动物、人的肝、脾、骨等网状内皮系统组织积聚较多,轻稀土主要蓄积在肝脏;重稀土则主要沉积于骨骼,如静脉注射Tb,有80%存在于兔子的骨骼中。考虑到稀土Tb3+和Ca2+具有相似的生化行为,然而到目前为止,Tb是否以及如何干预骨代谢却不是很清楚。
小鼠胚胎成骨细胞MC3T3-E1具有较好的分化及矿化能力,可以作为体外研究成骨细胞增殖、分化、矿化及调控机理的良好模型[6]。为了确证稀土化合物TbCl3是否以及如何影响成骨细胞的增殖和分化,本文从细胞和分子水平上研究了不同浓度的TbCl3对体外培养的成骨细胞的增殖、分化、矿化功能等的影响。结果显示,低浓度的TbCl3在细胞水平上均促进MC3T3-E1细胞的增殖、分化及其矿化功能,而高浓度则呈现出了抑制性。分子水平上,浓度为0.000 1和0.1 μmol·L-1的TbCl3上调了成骨分化相关基因Runx2、BMP-2、ALP和OCN和蛋白的表达。
1 实验部分
1.1 材料和试剂
成骨细胞系MC3T3-E1购于ATCC (Manassas, VA,USA)。α-MEM培养基和胎牛血清购自Gibco。氯化铽 (TbCl3)、青链霉素、MTT、β-甘油磷酸钠、胰蛋白酶、地塞米松、抗坏血酸、胰岛素、西吡氯铵和茜素红购自Sigma。细胞碱性磷酸酶测定试剂盒和蛋白含量测定试剂盒分别从南京建成生物工程研究所和碧云天生物技术公司购买。细胞裂解液Trizol和RNA纯化试剂盒购自Life Technologies。逆转录试剂盒和实时定量PCR试剂盒购自TaKaRa。成骨分化相关基因引物序列及抗体分别购自生工生物工程 (上海) 股份有限公司和Santa Cruz Biotechnology。
1.2 成骨细胞系MC3T3-E1的培养
小鼠成骨细胞系MC3T3-E1用含10%胎牛血清、100 U·mL-1青霉素和链霉素的α-MEM培养基,置于37 ℃,5% CO2的孵育箱 (Sanyo,Model MCO-18AIC) 内培养,每隔3 d更换培养基。待细胞80%汇合后,用0.25%胰蛋白酶加0.02%的乙二胺四乙酸 (EDTA) 消化传代。
1.3 细胞增殖的测定
根据MTT法[7],MC3T3-E1细胞以每孔2 000个接种于96孔板,于37 ℃,5% CO2的孵育箱内培养过夜。待细胞贴壁后,加入不同浓度的TbCl3,使其终浓度达到0.000 1、0.001、0.01、0.1、1、10、100和1 000 μmol·L-1。细胞加入10-6 μmol·L-1的NaF作为阳性对照,不含细胞孔设为空白,继续培养1、2、3 d,加入20 μL浓度为5 mg·mL-1的MTT,继续培养4 h,加入二甲基亚砜 (DMSO) 溶解。利用酶标仪 (Bio-rad Model 680,USA) 测定570 nm处的光密度OD值, 根据下面公式计算增殖率:(ODsample-ODcontrast)/ODcontrast×100%。
1.4 碱性磷酸酶 (ALP) 活性的测定
MC3T3-E1细胞以每孔2×104个的密度接种于48孔板中培养。待细胞贴壁后更换含有成骨诱导剂 (OS)(10 mmol·L-1 β-甘油磷酸钠 (β-GP),0.15 mmol·L-1抗坏血酸和10-8 mol·L-1地塞米松) 的培养基[8],同时,加入终浓度为3.0 mmol·L-1的NaH2PO4和不同浓度的TbCl3(0.000 1、0.001、0.01、0.1、1、10、100和1 000 μmol·L-1)。培养7、10、14 d后,培养板用冷的D-Hank′s洗2次,2次冻融裂解。用细胞碱性磷酸酶测定试剂盒和蛋白含量测定试剂盒分别测定上层清液的碱性磷酸酶活性和蛋白量,所有的结果通过蛋白的含量归一化。
1.5 矿化结节染色及定量测定
MC3T3-E1细胞 (每孔2×104个) 接种于24孔板中,在37 ℃,5% CO2培养箱中孵育过夜。细胞贴壁后加入矿化诱导剂 (10 mmol·L-1 β-甘油磷酸钠和50 mg·L-1抗坏血酸) 和终浓度为0.000 1、0.001、0.01、0.1、1、10、100和1 000 μmol·L-1的TbCl3,继续培养21 d,采用茜素红 (ARS) 对矿化结节染色。首先用D-Hank′s洗2次,然后用70%乙醇室温固定1 h,加入10% ARS (pH 4.2),于37 ℃孵育30 min,随后吸去染液,用D-Hank′s洗2次。加入10%西吡氯铵溶液,室温放置10 min,于570 nm测定光密度OD值。实验结果以矿化促进率 (100%) 表示。
1.6 逆转录聚合酶链反应 (RT-PCR)
浓度为0.000 1、0.1和1 000 μmol·L-1的TbCl3作用于细胞4 d后,用Trizol裂解细胞,提取总RNA。根据TaKaRa反转录试剂盒操作方法转第一链cDNA。实时定量PCR扩增为40个循环,条件为:于95 ℃变性10 min,60 ℃退火1 min,72 ℃延伸30 s。3-磷酸甘油醛脱氢酶 (GAPDH) 作为内参。表 1为引物序列。
Gene symbol Forward primer (5'-3') Reverse primer (5'-3') Runx2 TTCTCCAACCCACGAATGCAC CAGGTACGTGTGGTAGTGAGT BMP2 TGGCCCATTTAGAGGAGAACC AGGCATGATAGCCCGGAGG ALP GTTGCCAAGCTGGGAAGAACAC CCCACCCCGCTATTCAAAC BSP GAATCCACATGCCTATTGC AGAACCCACTGACCCATT Col Ⅰ AACATGACCAAAAACCAAAAGTG CATTGTTTCCTGTGTCTTCTGG OCN GAACAGACTCCGGCGCTA AGGGAGGATCAAGTCCCG GAPDH GACTTCAACAGCAACTCCCAC TCCACCACCCTGTTGCTGTA 表 1 成骨分化相关基因引物序列
Table 1. Osteogenesis-related genes primers1.7 蛋白印记分析
浓度为0.000 1、0.1和1 μmol·L-1的TbCl3作用于细胞4 d后,收集细胞并在细胞裂解液 (50 mmol·L-1 Tris-HCl、10 mmol·L-1 EDTA、4.3 M尿素和1% Triton X-100) 中进行裂解。通过10%的聚丙烯酰胺凝胶电泳进行蛋白分离,转膜、封闭后于4 ℃一抗杂交过夜,之后二抗杂交2 h。特异性杂交反应利用化学发光通过蛋白成像仪LAS-1000(Fuji-Film) 进行成像。细胞内β-actin的表达作为内参。
1.8 统计分析
实验数据来自至少3次独立的实验,数据表示为:平均值±标准偏差。数据分析采用SPSS t-test,P < 0.05认为有显著性差异。
2 结果与讨论
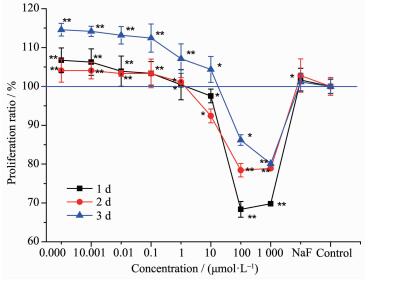
2.1 TbCl3对MC3T3-E1细胞增殖的影响
如图 1所示,浓度为0.000 1、0.001、0.01、0.1和1 μmol·L-1的TbCl3作用于MC3T3-E1细胞1、2、3 d后促进其增殖。然而浓度为100和1 000 μmol·L-1的TbCl3则抑制MC3T3-E1细胞的增殖。浓度为10 μmol·L-1的TbCl3作用MC3T3-E1细胞1、2 d后抑制细胞增殖,而作用3 d后则表现为促进作用。总之,TbCl3对细胞增殖的影响呈现出低剂量促进、高剂量抑制的关系。
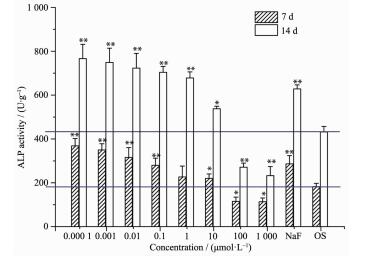
2.2 TbCl3对MC3T3-E1细胞成骨分化的影响
如图 2所示,TbCl3作用于MC3T3-E1细胞7、14 d后,浓度为0.000 1、0.001、0.01、0.1、1和10 μmol·L-1的TbCl3促进了细胞的成骨分化,且呈现出时间依赖的关系。而高浓度的TbCl3(100和1 000 μmol·L-1) 则抑制细胞的成骨分化。
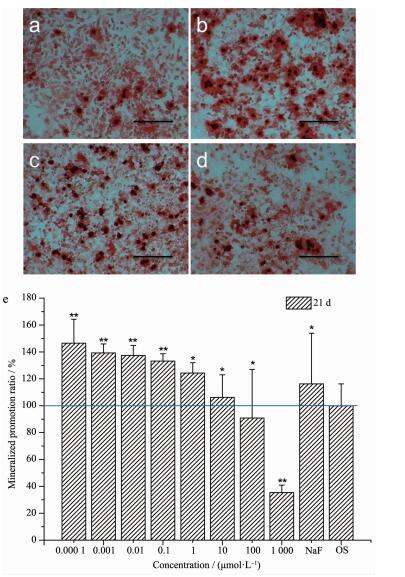
2.3 TbCl3对矿化结节形成的影响
与对照组比较,低浓度 (0.000 1、0.001、0.01、0.1、1、10 μmol·L-1) 的TbCl3促进矿化结节的形成,然而浓度为100、1 000 μmol·L-1的TbCl3抑制了矿化结节的形成,呈现出了剂量依赖关系。定量结果与形态学观察 (图 3a~d) 也是一致的。
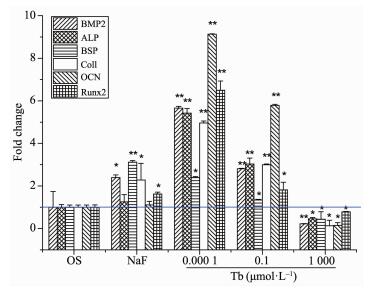
2.4 TbCl3对MC3T3-E1细胞成骨分化基因表达的影响
如图 4所示,浓度为0.000 1和0.1 μmol·L-1的TbCl3作用MC3T3-E1细胞4 d后,与对照组比较,明显上调了成骨分化相关基因BMP-2、ALP、BSP、Col Ⅰ、OCN和Runx2的表达。特别是BMP-2、ALP、Col Ⅰ、OCN和Runx2基因表达量高于阳性对照组NaF。但是当浓度为1 000 μmol·L-1的TbCl3作用于细胞4 d后,则抑制了成骨分化相关基因的表达。
2.5 TbCl3对MC3T3-E1细胞成骨分化蛋白表达的影响
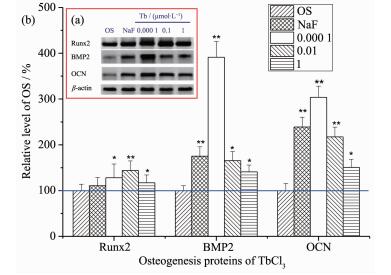
蛋白印记结果 (图 5) 显示,与对照组比较,MC3T3-E1细胞经过TbCl3(浓度为0.000 1、0.1和1 μmol·L-1) 作用4 d后,成骨分化相关蛋白Runx2,BMP-2和OCN的表达明显上调。特别是浓度为0.000 1 μmol·L-1的TbCl3促进蛋白表达量远高于NaF阳性对照。
2.6 TbCl3促进MC3T3-E1细胞增殖、分化及矿化功能
成骨细胞是负责骨形成,对骨组织的生长发育、损伤修复、维持骨代谢平衡和骨量的一类细胞。成骨分化分为3个步骤:细胞增殖、细胞外基质合成及矿化结节的形成。小鼠成骨细胞系MC3T3-E1具有极好的成骨分化潜能,血清和抗坏血酸即可刺激其向骨细胞分化[6]。因此,MC3T3-E1细胞系提供了一个体外研究骨细胞增殖和矿化的细胞模型。细胞通过一系列复杂的信号通路维持其代谢平衡。然而,一旦这些信号通路被扰乱,细胞将会面临功能的缺失和行为异常[9]。ALP活性是成骨分化的一个早期标志,由此开始骨的形成。矿化结节的形成是成骨分化的晚期标志,成骨细胞诱导2~3周后,分化成的骨细胞结节形成并且达到最大量。本文研究发现,TbCl3对成骨细胞MC3T3-E1增殖、分化及矿化功能具有双重作用,表现为低浓度 (0.000 1、0.001、0.01、0.1、1和10 μmol·L-1) 促进、高浓度 (100和1 000 μmol·L-1) 抑制。低浓度的稀土离子促进细胞从G0/G1期向S期转化,加速细胞DNA合成,从而促进细胞增殖;但是当稀土浓度增加到一定程度时对细胞表现出损伤作用,从而转为抑制成骨细胞的增殖。作者曾报道稀土La和Ce对MC3T3-E1和骨髓间充质细胞介导的上述过程的许多环节都造成影响,且呈现出低浓度促进、高浓度抑制的作用关系[10-13]。由此看来,稀土的浓度在抑制或促进成骨细胞增殖和分化过程中起到关键作用。Quarles等[14]发现,低剂量Gd3+离子能够促使成骨细胞MC3T3-E1从G1进入S期和促进DNA合成,同时激活成骨细胞膜上的G蛋白,从而促进了细胞的增殖。结合La和Ce的结果,作者推测,稀土离子Ln3+对体外成骨细胞的增殖、分化和功能表达与稀土物种有关。另外,刘会雪等[15]报道,不同稀土离子对细胞作用强弱不同,再次证明稀土物种对细胞功能影响的重要性。除此之外,由于稀土理化特性的差异 (如离子半径或电荷),其对成骨细胞增殖、分化及矿化影响也不同。
细胞通过复杂的信号通路维持其内在平衡,任何扰乱信号通路的行为将影响细胞功能及行为正常发挥[9]。复杂的信号通路必然涉及到大量的基因和蛋白的表达,如成骨细胞分化涉及到BMP-2、Runx2、ALP、OCN、Col Ⅰ、BSP等表达[16]。Runx2是调控成骨分化的关键因子,它的表达是成骨分化的一个重要标志。文献报道Runx2基因敲除的小鼠不能建立骨组织或不能分化出骨细胞,且过多表达了与Runx2作用相反的一些基因,因此导致成骨分化失败[17]。正常表达Runx-2基因的细胞具有与原代骨细胞同样的特性,如在抗坏血酸诱导下能够合成细胞外基质 (ECM) 和在不同阶段表达与成骨分化相关的基因[18]。ALP负责去除细胞内的磷酸根,如核酸、蛋白和生物碱等,在骨组织 (如骨及软骨) 矿化形成过程中起到了关键的作用[19]。OCN是骨细胞外基质中最为丰富的非胶原成分,其表达始于增殖后期,在矿化形成期达到最高。它的表达量决定了ECM矿化的程度[20],而矿化又是骨细胞分化的一个标志。另外,骨涎蛋白 (BSP) 和Col Ⅰ是ECM的重要组成物质。BMP-2作为TGF-β超家族一元,是骨细胞分化和骨形成过程中所必须的一种蛋白,即使对于不能进行矿化的骨细胞,它也能够诱导低表达的骨标志基因 (如OCN和ALP) 表达上调[21]。本文结果表明,浓度为0.000 1和0.1 μmol·L-1的TbCl3上调了BMP-2、ALP、BSP、Col Ⅰ、OCN和Runx2的表达。然而,当浓度为1 000 μmol·L-1的TbCl3作用于细胞4 d后,抑制了成骨分化相关基因的表达。表达上调的Runx2基因诱导成骨分化早期标志基因Col Ⅰ和BMP-2和晚期标志基因ALP和OCN的表达,从而促进MC3T3-E1细胞成骨分化及矿化形成。结合茜素红染色的结果,高度表达的OCN刺激了MC3T3-E1细胞矿化结节的形成。稀土低浓度促进细胞增殖、分化和矿化的机理尚未完全清楚,根据文献报道和我们的结果推断,可能与低浓度稀土促进细胞有丝分裂有关,从而刺激一系列分化通路的激活,诱导其成骨分化;然而,稀土离子浓度达到一定高的浓度后,反而抑制细胞正常功能,造成成骨细胞分化及矿化功能受阻。综上所述,一定浓度的稀土TbCl3对体外培养的成骨细胞的增殖、分化都具有明显的促进作用,从而在低浓度下可以促进成骨细胞诱导的钙化,促进骨形成。此研究将为进一步探讨稀土化合物TbCl3调控骨代谢平衡机理提供了重要的基础研究数据。
-
-
[1]
Ye Z Q, Tan M D, Wang G L, et al. Talanta, 2005, 65:206-210 https://www.journals.elsevier.com/talanta/
-
[2]
Hussein B H, Azab H A, el-Azab M F, et al. Eur. J. Med. Chem., 2012, 51:99-109 doi: 10.1016/j.ejmech.2012.02.025
-
[3]
Kubíček V, Rudovský J, Kotek J, et al. J. Am. Chem. Soc., 2005, 127(47):16477-16485 doi: 10.1021/ja054905u
-
[4]
Zaichick S, Zaichick V, Karandashev V, et al. Metallomics, 2011, 3(2):186-194 doi: 10.1039/C0MT00069H
-
[5]
Zaichick V. Biol. Trace Elem. Res., 2013, 153(1/2/3):84-99 https://en.wikipedia.org/wiki/Biological_Trace_Element_Research
-
[6]
Wang D, Christensen K, Chawla K, et al. J. Bone Miner. Res., 1999, 14(6):893-903 doi: 10.1359/jbmr.1999.14.6.893
-
[7]
Liu D D, Yi C Q, Zhang D W, et al. ACS Nano, 2010, 4: 2185-2195 doi: 10.1021/nn901479w
-
[8]
Yi C Q, Liu D D, Fong C C, et al. ACS Nano, 2010, 4:6439-6448 doi: 10.1021/nn101373r
-
[9]
Mu Q X, Du G Q, Chen T S, et al. ACS Nano, 2009, 3:1139-1144 doi: 10.1021/nn900252j
-
[10]
Liu D D, Zhang J C, Wang G F, et al. Biol. Trace Elem. Res., 2012, 150:433-440 doi: 10.1007/s12011-012-9486-6
-
[11]
Liu D D, Zhang J C, Li Y P, et al. Biol. Trace Elem. Res., 2012, 149:291-297 doi: 10.1007/s12011-012-9423-8
-
[12]
Liu D D, Zhang J C, Zhang Q, et al. J. Cell Biochem., 2013, 114:1105-1114 doi: 10.1002/jcb.v114.5
-
[13]
Liu D D, Ge K, Jin Y, et al. J. Biol. Inorg. Chem., 2014, 19: 879-891 doi: 10.1007/s00775-014-1119-4
-
[14]
Quarles L D, Hartle J E, Middleton J P, et al. J. Cell Biochem., 1994, 56(1):106-117 doi: 10.1002/(ISSN)1097-4644
-
[15]
刘会雪, 杨晓达, 王夔.中国稀土学报, 2006, 24 (4):484-488 http://www.re-journal.com/WKD/WebPublication/paperDigest.aspx?paperID=9164c8d1-848a-4906-93b4-b04af39540d9LIU Xue-Hui, YANG Xiao-Da, WANG Kui. J. Chin. Soc. Rare Earth, 2006, 24 (4):484-488 http://www.re-journal.com/WKD/WebPublication/paperDigest.aspx?paperID=9164c8d1-848a-4906-93b4-b04af39540d9
-
[16]
Ducy P, Zhang R, Geoffroy V, et al. Cell, 1997, 89(5):747-754 doi: 10.1016/S0092-8674(00)80257-3
-
[17]
Nakashima K, Zhou X, Kunkel G, et al. Cell, 2002, 108(1): 17-29 doi: 10.1016/S0092-8674(01)00622-5
-
[18]
Yang S Y, Wei D Y, Wang D, et al. J. Bone Miner. Res., 2003, 18:705-715 doi: 10.1359/jbmr.2003.18.4.705
-
[19]
Beertsen W, Van Den Bos T. J. Dent. Res., 1991, 70(3):176-181 doi: 10.1177/00220345910700030401
-
[20]
Chou Y F, Dunn J C Y, Wu B M. J. Biomed. Mater. Res., 2005, 75B (1):81-90 doi: 10.1002/(ISSN)1552-4981
-
[21]
Komori T, Yagi H, Nomura S. Cell, 1997, 89(5):755-764 doi: 10.1016/S0092-8674(00)80258-5
-
[1]
-
图 3 TbCl3对MC3T3-E1细胞矿化结节形成的影响
Figure 3 Effect of TbCl3 on the mineration of MC3T3-E1
(a~d) ARS staining. (a) cell treated with OS; (b) cell treated with 0.000 1 μmol·L-1 TbCl3+OS; (c) cell treated with 0.01 μmol·L-1 TbCl3+OS; (d) cell treated with 1 μmol·L-1 TbCl3+OS; Scale bar=50 μm; (e) Quantification of ARS staining, vs Control, *P < 0.05, **P < 0.01, n=6
表 1 成骨分化相关基因引物序列
Table 1. Osteogenesis-related genes primers
Gene symbol Forward primer (5'-3') Reverse primer (5'-3') Runx2 TTCTCCAACCCACGAATGCAC CAGGTACGTGTGGTAGTGAGT BMP2 TGGCCCATTTAGAGGAGAACC AGGCATGATAGCCCGGAGG ALP GTTGCCAAGCTGGGAAGAACAC CCCACCCCGCTATTCAAAC BSP GAATCCACATGCCTATTGC AGAACCCACTGACCCATT Col Ⅰ AACATGACCAAAAACCAAAAGTG CATTGTTTCCTGTGTCTTCTGG OCN GAACAGACTCCGGCGCTA AGGGAGGATCAAGTCCCG GAPDH GACTTCAACAGCAACTCCCAC TCCACCACCCTGTTGCTGTA -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 10
- 文章访问数: 1532
- HTML全文浏览量: 423


 下载:
下载:




 下载:
下载:

