
Citation: Qian Yu, Hong Chen. Smart Antibacterial Surfaces with Switchable Function to Kill and Release Bacteria[J]. Acta Polymerica Sinica, 2020, 51(4): 319-325. doi: 10.11777/j.issn1000-3304.2020.20031

具有“杀菌-释菌”功能转换的智能抗菌表面
English
Smart Antibacterial Surfaces with Switchable Function to Kill and Release Bacteria
-
细菌(特别是致病菌)在植入材料及医疗器械等生物材料表面的黏附和后续生物被膜的形成会造成一系列严重后果:一方面会引起患者创口感染、导致炎症和并发症甚至死亡,另一方面会对材料和器械的功能造成不良影响以至于缩短其使用寿命. 特别是近年来耐药性细菌(即所谓“超级细菌”)的出现,使得医源性感染成为全球范围内的健康隐患之一,并对社会公共卫生构成越来越严重的威胁[1,2]. 赋予生物材料表面抗菌性能是解决这类问题的有效途径,因此也成为了近年来国内外研究者们的研究热点[3,4].
根据抗菌机理的不同,传统抗菌表面的构建策略可以分为以阻抗细菌黏附为目的的“防御型”抑菌策略和以杀死表面黏附细菌为目的的“进攻型”杀菌策略[5]. 尽管这2种策略都取得了一定的应用效果,但都存在着各自的局限. 例如,虽然“防御型”抗菌表面能够大体上抑制细菌的初期黏附,但由于其自身不具有杀菌能力,因此在长期使用过程中,这类表面一旦被少量细菌黏附最终必将导致生物被膜的形成. 而“进攻型”抗菌表面尽管可以在初期杀灭细菌,但是死细菌及其碎片却仍残留在表面,这不仅会降低后续的杀菌效率,同时也会引起感染和炎症反应. 将“进攻型”和“防御型”抗菌策略相结合,同时在材料表面引入杀菌组分和抑菌组分可以有效地提高表面综合抗菌效果. 但值得注意的是,杀菌组分通常需要细菌与表面接触才能发挥作用,而抑菌组分则通常使表面排斥细菌或降低细菌与表面之间的黏附,导致这类双功能表面的杀菌性能可能不如单一“进攻型”抗菌表面,抑菌功能则可能不如单一“防御型”抗菌表面. 因此,对于理想的抗菌表面,其杀菌功能和抑菌功能应该能够发生“响应性”的转换,即表面在一种状态下只发挥一种功能,避免相互干扰.
针对上述问题,研究者们提出了一种“杀菌-释菌”功能转换的智能抗菌策略并以此发展了一系列智能抗菌表面[6,7]. 这类表面通常是在材料表面同时引入杀菌组分(如杀菌剂)与响应性组分(如刺激响应性高分子),使得表面不仅能够高效地杀死黏附的细菌,同时可以在一个适当的刺激下释放死细菌及其碎片使表面恢复清洁,从而实现长效的抗菌效果. 本文将根据杀菌剂与材料表面结合方式的不同,结合我们课题组的研究成果,对近年来智能抗菌表面的研究进展进行评述.
1. 永久固定杀菌剂的智能抗菌表面
智能抗菌策略的核心在于调控细菌与材料表面之间的相互作用(如疏水作用、静电作用等). 由于刺激响应性高分子能够对环境刺激的微小变化产生物理化学性质的响应性改变,因此将其与合适的杀菌剂共同修饰到材料表面,便可以实现材料表面功能从杀灭细菌到释放细菌的响应性转换.
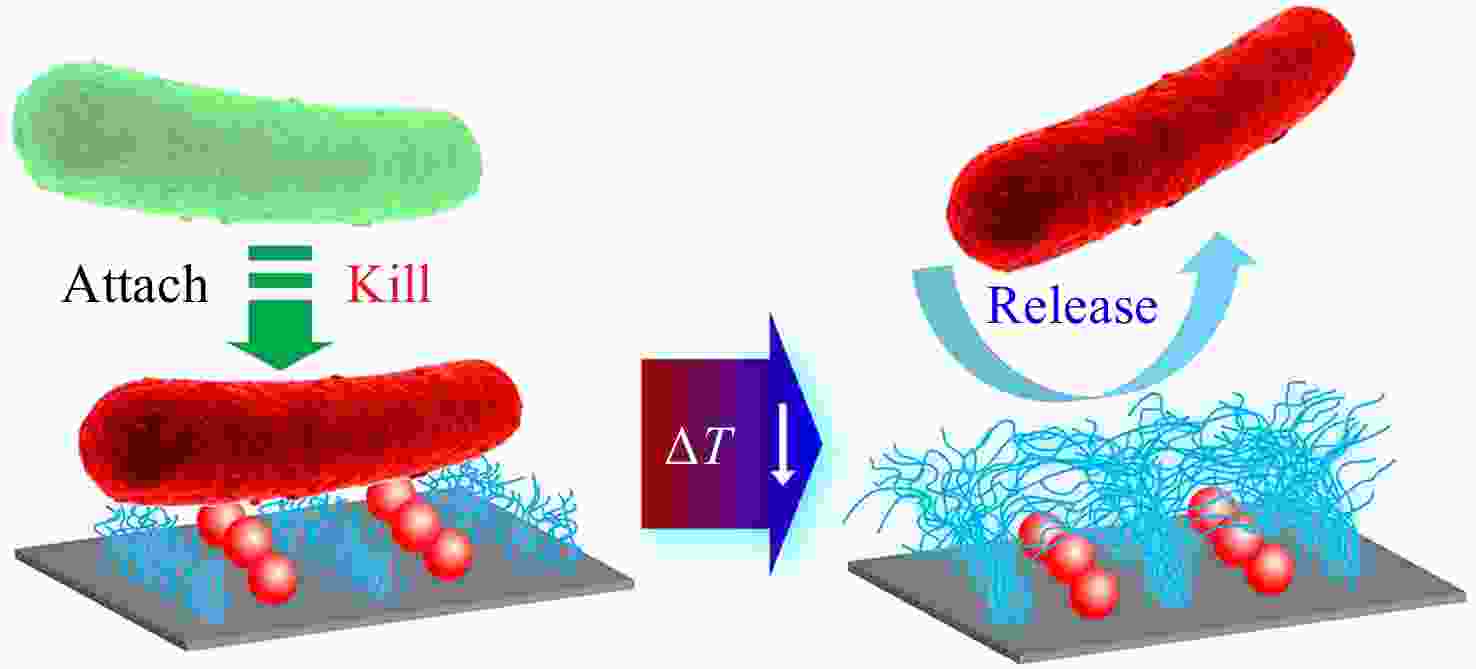
温度是一种常见的用以调控细菌在表面黏附行为的刺激因素. 例如,修饰了温度响应性高分子聚(N-异丙基丙烯酰胺) (PNIPAAm)的材料表面,当环境温度在其低临界溶解温度(LCST,约32 °C)附近变化时,其浸润性会发生响应性的变化,进而导致表面与细菌之间疏水作用的改变. 此外,可以通过温度控制分子尺度上PNIPAAm分子链的构象变化,达到调控微纳米尺度上特定区域内功能分子的暴露与包埋,最终实现表面宏观生物活性的“开关”转换[8, 9]. 利用PNIPAAm的独特性质,Lopez课题组自2013年报道一系列具有温度响应性“杀菌-释菌”功能转换的抗菌表面[10~14]. 首先,他们通过物理方法将杀菌剂固定在纳米图案化PNIPAAm分子链接枝微区之间的空白区域[10~12]. 在生理温度下(> LCST),PNIPAAm分子链的收缩导致杀菌剂的暴露,使得表面能够有效杀灭黏附的细菌;随着环境温度降低到LCST以下,PNIPAAm分子链发生伸展且亲水性增强,从而将死细菌从表面释放使表面恢复清洁状态(见图1). 而后,针对上述表面制备过程复杂、基材受限等问题,他们应用基质辅助共振红外脉冲激光蒸镀技术,将PNIPAAm与杀菌剂共同沉积在多种基材表面得到了具有类似功能的抗菌涂层[13]. 通过改变杀菌剂和PNIPAAm的初始比例,还可以对表面整体的杀菌功能和释放细菌功能进行调控和优化[14]. 以上开创性的“概念验证”工作为后续温度响应性抗菌表面的开发提供了基础. 最近几年,通过表面接枝共聚合、表面超分子共组装、原位光聚合等方法,多个课题组也分别报道了几类温度响应性抗菌表面并取得了较好的抗菌效果[15~19].
图 1
 Figure 1. Schematic illustration of a temperature-responsive “kill-and-release” antibacterial surface based on nanopatterned PNIPAAm/biocide (Reproduced with permission from Ref.[20]; Copyright (2016) The Royal Society of Chemistry)
Figure 1. Schematic illustration of a temperature-responsive “kill-and-release” antibacterial surface based on nanopatterned PNIPAAm/biocide (Reproduced with permission from Ref.[20]; Copyright (2016) The Royal Society of Chemistry)除了温度,盐浓度也可以作为一种刺激因素用于调控细菌在材料表面的黏附/脱附行为. 例如,通过盐浓度的增加可以削弱表面修饰的两性离子高分子聚(3-二甲基(4-乙烯基苄基)铵基丙烷1-磺酸盐) (PDVBAPS) 分子链之间的静电引力,引起分子链伸展以及与水分子结合的增强,进而导致黏附在表面的细菌发生脱附[21]. 利用这一性质,杨晋涛和郑洁课题组将一种常见的杀菌剂三氯生(TCS)固定到PDVBAPS高分子刷改性的材料表面,得到了一种具有高效杀菌活性并且能够在高NaCl浓度(1 mol/L)下释放死细菌的抗菌表面[22]. 进一步地,为了克服高盐浓度对其应用领域的限制,他们采用外加电场作为辅助,应用较低浓度(0.12 mol/L)的NaCl溶液便实现了95%的细菌释放(见图2)[23]. 此外,他们又分别通过嵌段共聚[24]和混合组装[25]的方法将PDVBAPS与具有杀菌功能的聚阳离子高分子相结合,赋予了改性表面杀菌功能和盐响应性的释放细菌功能.
图 2
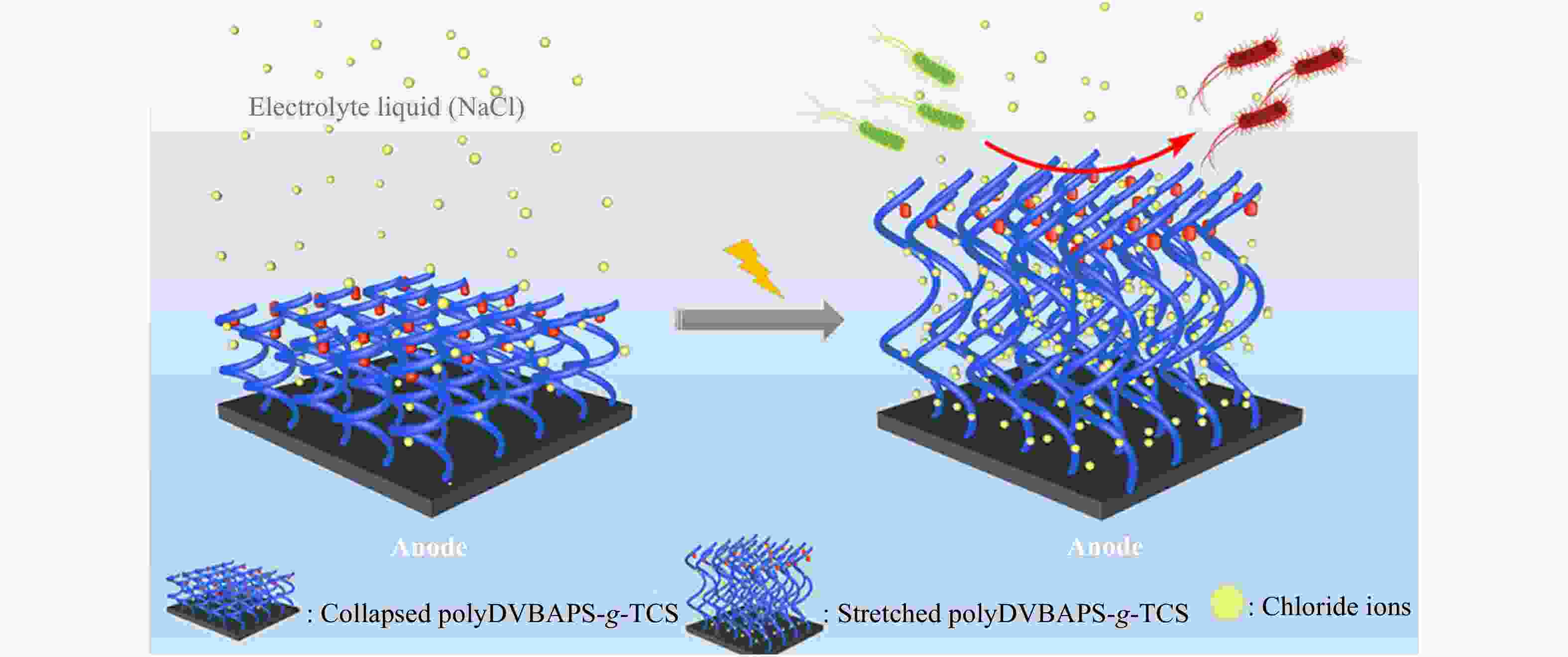 Figure 2. Schematic illustration of an electric assisted salt-responsive “kill-and-release” antibacterial surface based on PDVBAPS-g-TCS brushes (Reproduced with permission from Ref.[23]; Copyright (2019) American Chemical Society)
Figure 2. Schematic illustration of an electric assisted salt-responsive “kill-and-release” antibacterial surface based on PDVBAPS-g-TCS brushes (Reproduced with permission from Ref.[23]; Copyright (2019) American Chemical Society)2. 可重复负载杀菌剂的智能抗菌表面
对于永久性固定杀菌剂的智能抗菌表面,其杀菌效率往往会随着使用时间的延长或“杀菌-释菌”循环次数的增加而降低. 因此,需要表面能够及时“更新”杀菌剂以实现表面长期的杀菌活性. 通过改变环境刺激调控杀菌剂与表面之间的相互作用,使其在杀菌过程后从表面释放是一种行之有效的方法. 我们发现纳米结构的引入能够显著增强表面对蛋白质吸附的响应性调控. 例如,接枝了pH响应性高分子聚甲基丙烯酸(PMAA)的硅纳米线阵列(SiNWAs)能够通过改变pH实现表面对蛋白质的大量结合与高效释放[26]. 利用这一独特性质,我们将PMAA修饰的SiNWAs作为载体用于负载具有杀菌功能的蛋白质溶菌酶,通过改变pH调控PMAA的分子链构象以及其与水分子之间的结合,进而改变了表面与溶菌酶和细菌之间的相互作用,最终实现了对表面功能的逐步精确调控(酸性时负载溶菌酶,中性时释放溶菌酶杀菌,碱性时释放死细菌,见图3)[27]. 经历了3个“负载—杀菌—释菌”循环后,该表面的负载溶菌酶数量、杀菌效率和释菌效率均没有发生明显下降,表现出很好的可重复性.
图 3
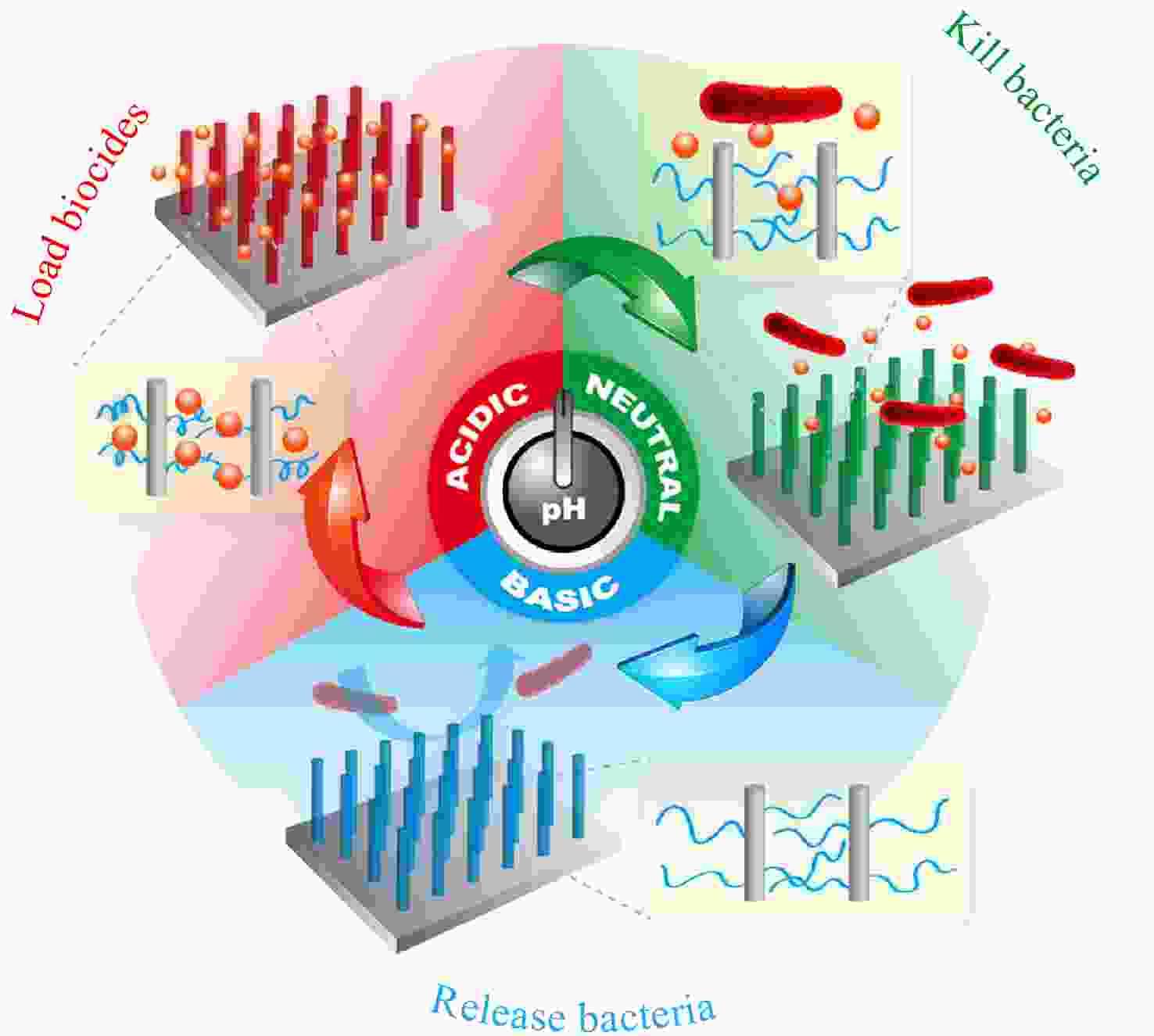 Figure 3. Schematic illustration of a pH-responsive “kill-and-release” antibacterial surface based on SiNWAs modified with PMAA (Reproduced with permission from Ref.[27]; Copyright (2016) Wiley-VCH)
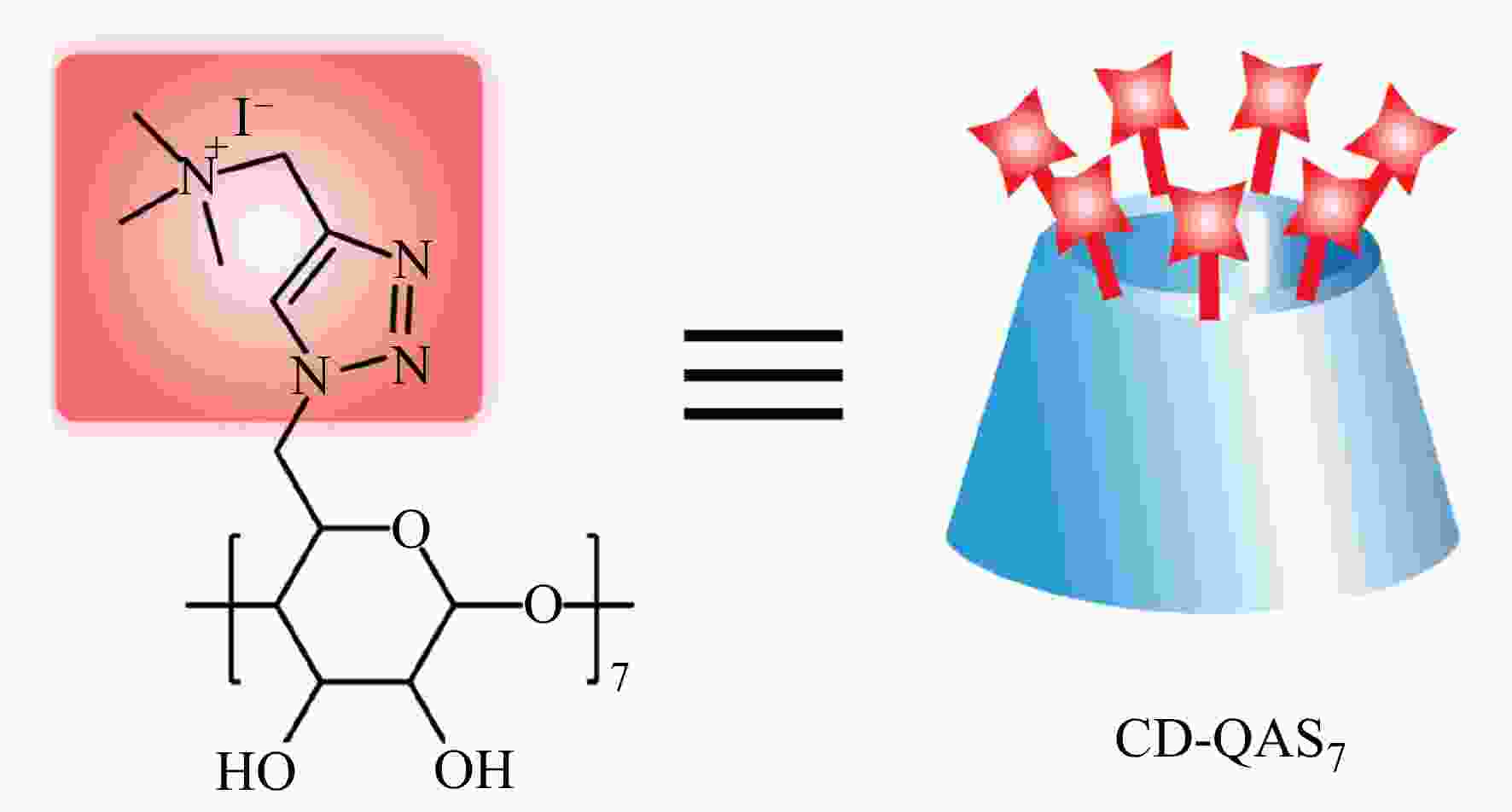
Figure 3. Schematic illustration of a pH-responsive “kill-and-release” antibacterial surface based on SiNWAs modified with PMAA (Reproduced with permission from Ref.[27]; Copyright (2016) Wiley-VCH)除了疏水作用和静电作用,基于超分子化学的主客体相互作用和以动态共价键为代表的可逆共价作用为杀菌剂的负载与释放提供了新的方法[28,29]. β-环糊精(β-CD)是一种典型的主体分子,其疏水性的空腔使其能够与多种客体分子(如金刚烷(Ada)、偶氮苯(Azo)等)形成包结络合物;同时β-CD的大口端的羟基具有邻二醇结构,能够与苯硼酸(PBA)基团形成苯硼酸酯动态共价键. 特别地,β-CD的小口端有7个羟基,可以通过后修饰的方法同时引入多个功能分子,较高的局部密度可以显著增强功能分子的活性[30~35]. 利用β-CD这些结构上的特点,我们合成了一种含有7个QAS基团的β-CD衍生物(CD-QAS7,见图4)作为杀菌剂分子,并分别通过主客体相互作用和动态共价键将其固定在表面,得到了几种具有不同响应性的智能抗菌表面.
图 4
在众多的刺激源中,光刺激具有清洁性和非入侵性,可以远程快速传递等优点. β-CD/Azo是一组典型的具有光响应性的主客体分子对:反式构型的Azo可以与β-CD之间形成稳定的包结络合物,而经过紫外光照后,Azo基团从反式构型转变为顺式构型,使得β-CD/Azo包结络合物发生解离. 利用这一性质,我们结合含Azo的表面和CD-QAS7构建了一种具有光响应性的抗菌表面[36]. 采用紫外光照可以将CD-QAS7以及死细菌共同从表面释放使表面恢复清洁,而通过可见光照处理可以使表面的Azo基团重新恢复为反式构型以结合新的CD-QAS7用于后续的杀菌(见图5).
图 5
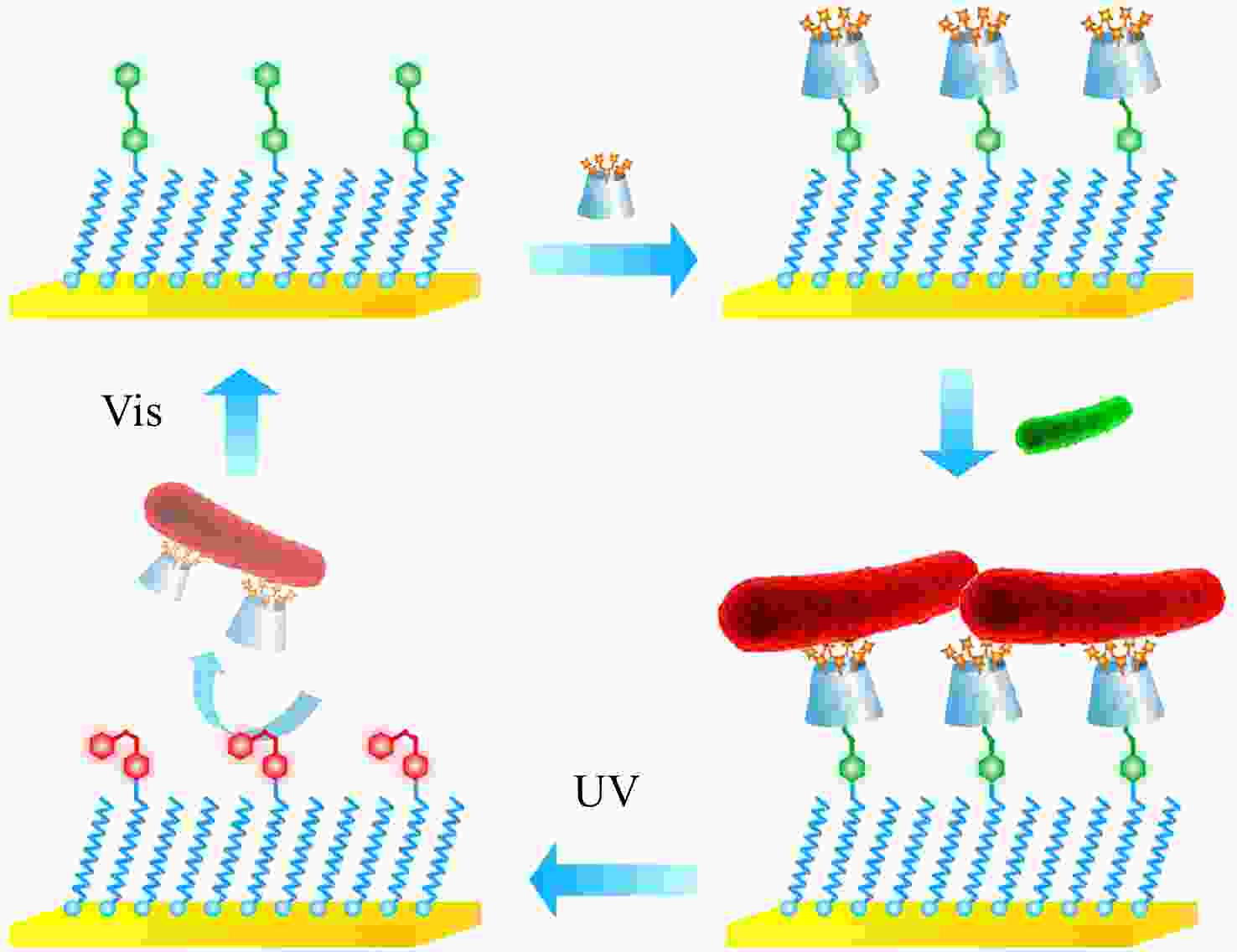 Figure 5. Schematic illustration of a light-responsive “kill-and-release”antibacterial surface based on Azo modified surface and CD-QAS7 (Reproduced with permission from Ref.[36]; Copyright (2017) American Chemical Society)
Figure 5. Schematic illustration of a light-responsive “kill-and-release”antibacterial surface based on Azo modified surface and CD-QAS7 (Reproduced with permission from Ref.[36]; Copyright (2017) American Chemical Society)许多生物材料都需要表面具有抗菌性能,但不同材料表面的物理化学性质之间的差异使得单一改性方法难以适用于所有基材. 针对这一难题,我们提出了一种以非共价相互作用为驱动力的普适性抗菌表面功能化方法[37]. 首先利用层层组装技术在多种基材表面沉积含有Ada基团的聚电解质多层膜,而后通过主客体作用引入CD-QAS7. 得到的表面不仅具有优异的杀菌活性,同时可以通过加入表面活性剂(如十二烷基苯磺酸钠(SDS))破坏主客体作用实现CD-QAS7和死细菌的释放(见图6). 这种抗菌表面的构建过程操作简单,条件温和,适用于大部分不同尺寸、形状和化学组成的基材. 特别地,通过混合组装另一种生物分子修饰的β-CD,可以实现在保证杀菌功能的同时引入其他生物功能(如促进细胞黏附、溶解初生血栓等),这在需要材料具有多种生物功能的应用领域具有重要意义.
图 6
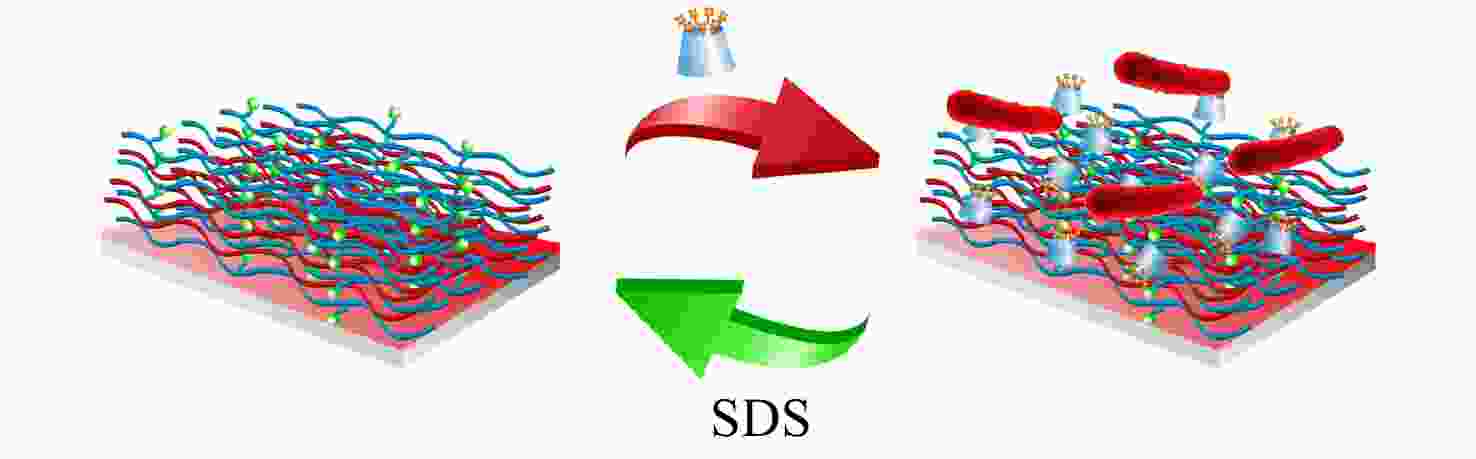 Figure 6. Schematic illustration of a surfactant-responsive “kill-and-release” antibacterial surface based on an Ada-containing multilayered film and CD-QAS (Reproduced with permission from Ref.[37]; Copyright (2016) American Chemical Society)
Figure 6. Schematic illustration of a surfactant-responsive “kill-and-release” antibacterial surface based on an Ada-containing multilayered film and CD-QAS (Reproduced with permission from Ref.[37]; Copyright (2016) American Chemical Society)除了应用主客体相互作用,我们也应用苯硼酸酯动态共价键将CD-QAS7引入到含有PBA基团的高分子刷改性表面,得到了具有糖响应性的抗菌表面[38]. 与其他外源性刺激不同,糖分子本身存在于生物体系中,属于内在生物学刺激,通过糖分子浓度的改变实现细菌的释放几乎不会对正常细胞的活性造成损害. 进一步地,基于不同的细菌释放机理,我们在硅片表面接枝了含有NIPAAm基团和PBA基团的共聚物刷,得到了具有温度、pH、糖三响应性的抗菌表面[39]. 如图7所示,该表面在37 °C、pH = 7.4、无果糖的条件下,共聚物刷中NIPAAm基团彼此之间形成分子内氢键使分子链收缩,暴露出PBA基团以结合CD-QAS7使表面得到杀菌活性. 而温度的降低可以削弱细菌与表面之间的疏水作用,pH的降低或果糖分子的引入可以破坏CD-QAS7和PBA之间的苯硼酸酯键,这3种刺激都可以促进死细菌从表面的释放. 特别地,同时改变3种刺激因素可以产生协同效应,获得最高的细菌释放效率.
图 7
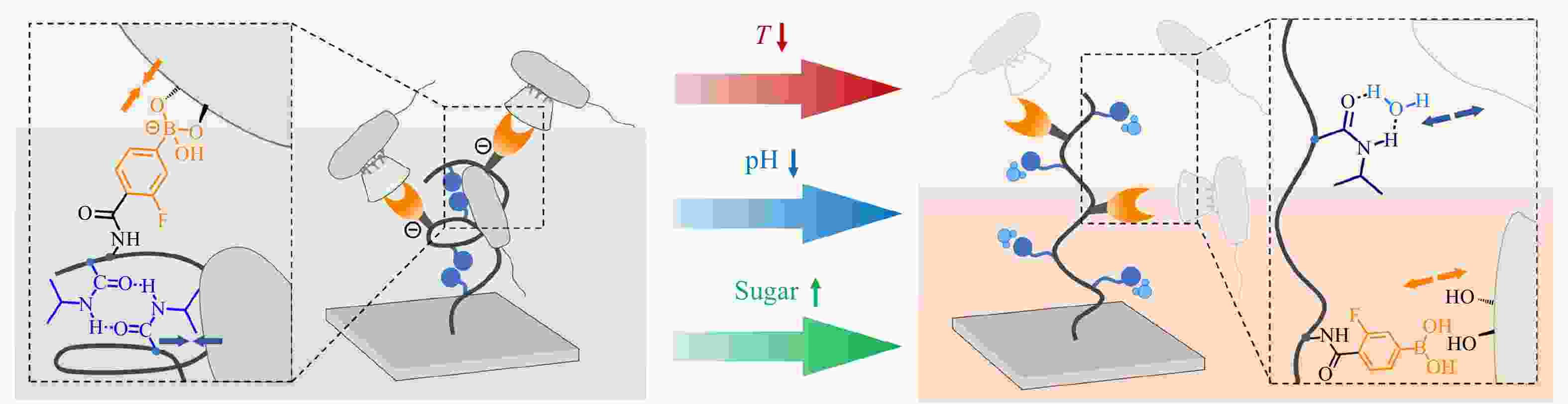 Figure 7. Schematic illustration of a multistimuli-responsive “kill-and-release” antibacterial surface based on CD-QAS (Reproduced with permission from Ref.[39]; Copyright (2020) American Chemical Society)
Figure 7. Schematic illustration of a multistimuli-responsive “kill-and-release” antibacterial surface based on CD-QAS (Reproduced with permission from Ref.[39]; Copyright (2020) American Chemical Society)3. 不需要杀菌剂的智能抗菌表面
近年来由于抗生素等杀菌剂的滥用,细菌耐药性逐渐增强,因此利用不需要杀菌剂的物理杀菌方法构建抗菌表面受到了越来越多的关注. 光热杀菌是一种利用光热转换材料将吸收的光能转换为热能,产生局部高温进行杀菌的方法,具有无耐药性、无细菌选择性并且环境友好等优点. 将光热转换材料与刺激响应性高分子结合是构建新型智能抗菌表面的有效方法.
单宁酸(TA)是一种天然的植物多酚,能够与多种金属离子形成络合物并在多种基材表面形成稳定的涂层,同时利用涂层表面自由的酚羟基还可以通过化学反应结合含氨基或巯基的小分子/高分子实现进一步的功能化[40]. 特别的,TA和Fe3+形成的络合物涂层具有良好的光热效应. 利用这些特点,我们在TA/Fe3+络合物涂层固定了温度响应性高分子PNIPAAm得到了一个“光热杀菌-温度响应释放细菌”的智能抗菌表面(见图8) [41]. 经过5 min的近红外光照射,该表面能杀灭将近100%表面黏附的细菌(包括耐甲氧西林金黄色葡萄球菌),同时杀死的细菌可以通过简单的冷水清洗从表面得以释放. 在另一个工作中,结合金纳米粒子的光热效应和相转变溶菌酶膜(PTLF)的可降解性,我们通过逐步沉积的方法在多种基材表面构建了含有金纳米粒子沉积膜(GNPL)和PTLF的复合智能抗菌涂层[42]. 改性后的表面在近红外光照射下能够快速高效地杀灭表面的细菌;同时经过简单的抗坏血酸处理使表层的PTLF发生降解,便可以有效地清除表面残留的死细菌及碎片. 由于PTLF的降解过程是自上而下的,因此可以通过控制抗坏血酸的浓度和处理时间实现PTLF的逐层降解,使得同一个涂层可以多次重复使用.
图 8
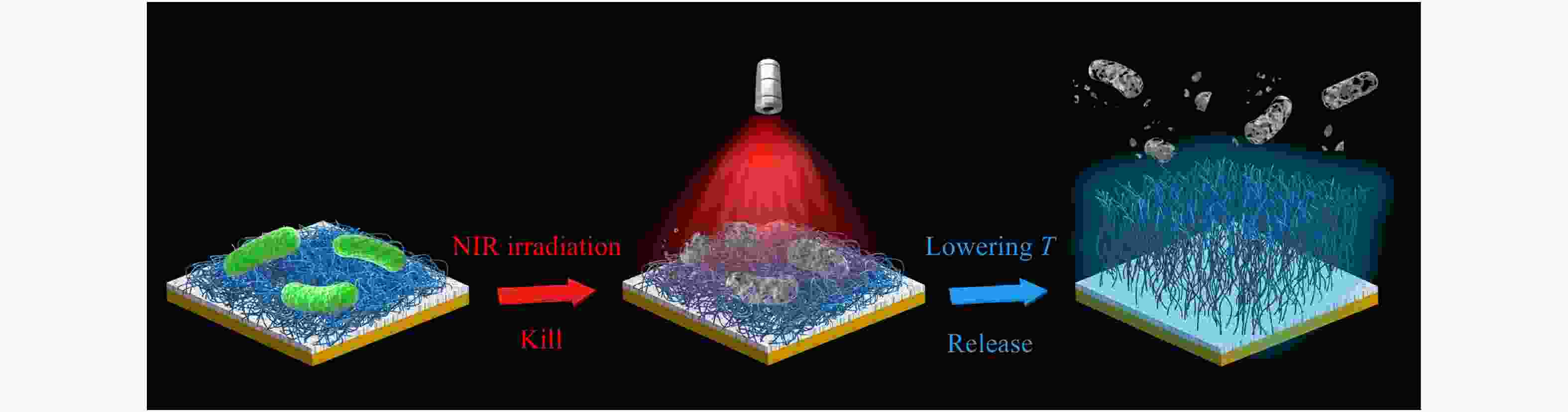 Figure 8. Schematic illustration of a temperature-responsive “kill-and-release” antibacterial surface with photothermal activated biocidal activity (Reproduced with permission from Ref.[41]; Copyright (2020) American Chemical Society)
Figure 8. Schematic illustration of a temperature-responsive “kill-and-release” antibacterial surface with photothermal activated biocidal activity (Reproduced with permission from Ref.[41]; Copyright (2020) American Chemical Society)4. 展望
本文对近年来具有“杀菌-释菌”功能转换的智能抗菌表面的研究进展进行了小结. 与传统的抗菌表面相比,这些表面能够在杀灭细菌后及时清除表面残留的死细菌,不仅可以保持长期有效的抗菌活性,同时也避免了堆积的死细菌造成的不良后果. 然而这些智能抗菌表面仍存在着一些不足和局限,在未来的工作中可以从以下几个方面进行更加深入的研究. 首先,目前大多抗菌表面是应用非特异性的外源性刺激(如温度、光、盐离子等)来实现细菌的释放,为了使表面功能进一步“智能化”,今后可以尝试应用一些具有生物特异性的内源性刺激去构建具有自触发性的抗菌表面;其次,相比单个细菌,成熟的生物被膜无论是对其杀灭还是从表面清除的难度都更大,因此在设计材料表面时需要针对生物被膜的特点,特别是需要赋予表面在清除成熟的生物被膜后能继续抑制生物被膜形成的功能;最后,已报道的体系大多还处于概念和模型阶段,需要进一步开发简单、高效、通用的表面制备方法,将这些体系推广应用到医用材料和器械上.
-
-
[1]
Gupta A, Mumtaz S, Li C H, Hussain I, Rotello V M. Chem Soc Rev, 2019, 48: 415 − 427 doi: 10.1039/C7CS00748E
-
[2]
Qian Yuxin(钱宇芯), Zhang Danfeng(张丹丰), Wu Yueming(武月铭), Chen Qi(陈琦), Liu Runhui(刘润辉). Acta Polymerica Sinica(高分子学报), 2016, (10): 1300 − 1311
-
[3]
Ding X, Duan S, Ding X, Liu R, Xu F. Adv Funct Mater, 2018, 28: 1802140 doi: 10.1002/adfm.201802140
-
[4]
Wang Rong(王蓉), Shen Xinkun(沈新坤), Hu Yan(胡燕), Cai Kaiyong(蔡开勇). Acta Polymerica Sinica(高分子学报), 2019, 50(9): 863 − 872
-
[5]
Yu Q, Wu Z, Chen H. Acta Biomater, 2015, 16: 1 − 13 doi: 10.1016/j.actbio.2015.01.018
-
[6]
Wei T, Tang Z, Yu Q, Chen H. ACS Appl Mater Interfaces, 2017, 9: 37511 − 37523 doi: 10.1021/acsami.7b13565
-
[7]
Wei T, Yu Q, Chen H. Adv Healthc Mater, 2019, 8: 1801381 doi: 10.1002/adhm.201801381
-
[8]
Yu Q, Shivapooja P, Johnson L M, Tizazu G, Leggett G J, Lopez G P. Nanoscale, 2013, 5: 3632 − 3637 doi: 10.1039/c3nr00312d
-
[9]
Yu Q, Johnson L M, Lopez G P. Adv Funct Mater, 2014, 24: 3751 − 3759 doi: 10.1002/adfm.201304274
-
[10]
Yu Q, Cho J, Shivapooja P, Ista L K, Lopez G P. ACS Appl Mater Interfaces, 2013, 5: 9295 − 9304 doi: 10.1021/am4022279
-
[11]
Yu Q, Ista L K, Lopez G P. Nanoscale, 2014, 6: 4750 − 4757 doi: 10.1039/C3NR06497B
-
[12]
Ista L K, Yu Q, Parthasarathy A, Schanze K S, Lopez G P. Biointerphases, 2016, 11: 019003 doi: 10.1116/1.4939239
-
[13]
Yu Q, Ge W, Atewologun A, Stiff-Roberts A D, Lopez G P. J Mater Chem B, 2014, 2: 4371 − 4378 doi: 10.1039/C4TB00566J
-
[14]
Yu Q, Ge W, Atewologun A, Stiff-Roberts A D, Lopez G P. Colloids Surf, B, 2015, 126: 328 − 334 doi: 10.1016/j.colsurfb.2014.12.043
-
[15]
He M, Wang Q, Zhang J, Zhao W, Zhao C. ACS Appl Mater Interfaces, 2017, 9: 44782 − 44791 doi: 10.1021/acsami.7b13238
-
[16]
Shi Z Q, Cai Y, Deng J, Zhao W, Zhao C. ACS Appl Mater Interfaces, 2016, 8: 23523 − 23532 doi: 10.1021/acsami.6b07397
-
[17]
Wang B, Xu Q, Ye Z, Liu H, Lin Q, Nan K, Li Y, Wang Y, Qi L, Chen H. ACS Appl Mater Interfaces, 2016, 8: 27207 − 27217 doi: 10.1021/acsami.6b08893
-
[18]
Wang X, Yan S, Song L, Shi H, Yang H, Luan S, Huang Y, Yin J, Khan A F, Zhao J. ACS Appl Mater Interfaces, 2017, 9: 40930 − 40939 doi: 10.1021/acsami.7b09968
-
[19]
Yang H, Li G, Stansbury J W, Zhu X, Wang X, Nie J. ACS Appl Mater Interfaces, 2016, 8: 28047 − 28054 doi: 10.1021/acsami.6b09343
-
[20]
Yu Q, Ista L K, Gu R, Zauscher S, Lopez G P. Nanoscale, 2016, 8: 680 − 700 doi: 10.1039/C5NR07107K
-
[21]
Xiao S, Ren B, Huang L, Shen M, Zhang Y, Zhong M, Yang J, Zheng J. Curr Opin Chem Eng, 2018, 19: 86 − 93 doi: 10.1016/j.coche.2017.12.008
-
[22]
Wu B, Zhang L, Huang L, Xiao S, Yang Y, Zhong M, Yang J. Langmuir, 2017, 33: 7160 − 7168 doi: 10.1021/acs.langmuir.7b01333
-
[23]
Wu J, Zhang D, Wang Y, Mao S, Xiao S, Chen F, Fan P, Zhong M, Tan J, Yang J. Langmuir, 2019, 35: 8285 − 8293
-
[24]
Huang L, Zhang L, Xiao S, Yang Y, Chen F, Fan P, Zhao Z, Zhong M, Yang J. Chem Eng J, 2018, 333: 1 − 10 doi: 10.1016/j.cej.2017.09.142
-
[25]
Fu Y, Wang Y, Huang L, Xiao S, Chen F, Fan P, Zhong M, Tan J, Yang J. Ind Eng Chem Res, 2018, 57: 8938 − 8945 doi: 10.1021/acs.iecr.8b01730
-
[26]
Yu Q, Chen H, Zhang Y, Yuan L, Zhao T, Li X, Wang H. Langmuir, 2010, 26: 17812 − 17815 doi: 10.1021/la103647s
-
[27]
Wei T, Yu Q, Zhan W, Chen H. Adv Healthc Mater, 2016, 5: 449 − 456 doi: 10.1002/adhm.201500700
-
[28]
Zhan W, Wei T, Yu Q, Chen H. ACS Appl Mater Interfaces, 2018, 10: 36585 − 36601 doi: 10.1021/acsami.8b12130
-
[29]
Ma Y, Tian X, Liu L, Pan J, Pan G. Acc Chem Res, 2019, 52: 1611 − 1622 doi: 10.1021/acs.accounts.8b00604
-
[30]
Zhan W, Shi X, Yu Q, Lyu Z, Cao L, Du H, Liu Q, Wang X, Chen G, Li D, Brash J L, Chen H. Adv Funct Mater, 2015, 25: 5206 − 5213 doi: 10.1002/adfm.201501642
-
[31]
Cao L, Qu Y, Hu C, Wei T, Zhan W, Yu Q, Chen H. Adv Mater Interfaces, 2016, 3: 1600600 doi: 10.1002/admi.201600600
-
[32]
Hu C, Qu Y, Zhan W, Wei T, Cao L, Yu Q, Chen H. Colloid Surface B, 2017, 152: 192 − 198 doi: 10.1016/j.colsurfb.2017.01.025
-
[33]
Lyu Z, Shi X, Lei J, Yuan Y, Yuan L, Yu Q, Chen H. J Mater Chem B, 2017, 5: 1896 − 1900 doi: 10.1039/C6TB02572B
-
[34]
Qu Y, Wei T, Zhan W, Hu C, Cao L, Yu Q, Chen H. J Mater Chem B, 2017, 5: 444 − 453 doi: 10.1039/C6TB02821G
-
[35]
Hu C, Wu J, Wei T, Zhan W, Qu Y, Pan Y, Yu Q, Chen H. J Mater Chem B, 2018, 6: 2198 − 2203 doi: 10.1039/C8TB00490K
-
[36]
Wei T, Zhan W, Yu Q, Chen H. ACS Appl Mater Interfaces, 2017, 9: 25767 − 25774 doi: 10.1021/acsami.7b06483
-
[37]
Wei T, Zhan W, Cao L, Hu C, Qu Y, Yu Q, Chen H. ACS Appl Mater Interfaces, 2016, 8: 30048 − 30057 doi: 10.1021/acsami.6b11187
-
[38]
Zhan W, Qu Y, Wei T, Hu C, Pan Y, Yu Q, Chen H. ACS Appl Mater Interfaces, 2018, 10: 10647 − 10655 doi: 10.1021/acsami.7b18166
-
[39]
Zhou Y, Zheng Y, Wei T, Qu Y, Wang Y, Zhan W, Zhang Y, Pan G, Li D, Yu Q, Chen H. ACS Appl Mater Interfaces, 2020, 12: 5447 − 5455 doi: 10.1021/acsami.9b18505
-
[40]
Xu L, Neoh K G, Kang E T. Prog Polym Sci, 2018, 87: 165 − 196 doi: 10.1016/j.progpolymsci.2018.08.005
-
[41]
Wang Y, Wei T, Qu Y, Zhou Y, Zheng Y, Huang C, Zhang Y, Yu Q, Chen H. ACS Appl Mater Interfaces, DOI: 10.1021/acsami.9b17581
-
[42]
Qu Y, Wei T, Zhao J, Jiang S, Yang P, Yu Q, Chen H. J Mater Chem B, 2018, 6: 3946 − 3955 doi: 10.1039/C8TB01122B
-
[1]
-
Figure 1 Schematic illustration of a temperature-responsive “kill-and-release” antibacterial surface based on nanopatterned PNIPAAm/biocide (Reproduced with permission from Ref.[20]; Copyright (2016) The Royal Society of Chemistry)
Figure 2 Schematic illustration of an electric assisted salt-responsive “kill-and-release” antibacterial surface based on PDVBAPS-g-TCS brushes (Reproduced with permission from Ref.[23]; Copyright (2019) American Chemical Society)
Figure 3 Schematic illustration of a pH-responsive “kill-and-release” antibacterial surface based on SiNWAs modified with PMAA (Reproduced with permission from Ref.[27]; Copyright (2016) Wiley-VCH)
Figure 5 Schematic illustration of a light-responsive “kill-and-release”antibacterial surface based on Azo modified surface and CD-QAS7 (Reproduced with permission from Ref.[36]; Copyright (2017) American Chemical Society)
Figure 6 Schematic illustration of a surfactant-responsive “kill-and-release” antibacterial surface based on an Ada-containing multilayered film and CD-QAS (Reproduced with permission from Ref.[37]; Copyright (2016) American Chemical Society)
Figure 7 Schematic illustration of a multistimuli-responsive “kill-and-release” antibacterial surface based on CD-QAS (Reproduced with permission from Ref.[39]; Copyright (2020) American Chemical Society)
Figure 8 Schematic illustration of a temperature-responsive “kill-and-release” antibacterial surface with photothermal activated biocidal activity (Reproduced with permission from Ref.[41]; Copyright (2020) American Chemical Society)
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 268
- 文章访问数: 9498
- HTML全文浏览量: 1913

 下载:
下载:
 下载:
下载:
 下载:
下载:

