
Citation: Ya-li Wang, Bing-xue Liu, Guo-feng Tian, Sheng-li Qi, De-zhen Wu. Research Progress of Cathode Binder for High Performance Lithium-ion Battery[J]. Acta Polymerica Sinica, 2020, 51(4): 326-337. doi: 10.11777/j.issn1000-3304.2019.19215

高性能锂离子电池正极黏合剂研究进展
English
Research Progress of Cathode Binder for High Performance Lithium-ion Battery
-
20世纪80年代,Armand[1]提出了“摇椅式”锂离子电池的新概念,从此奠定了锂离子电池发展的基础. 自1991年开始,日本索尼公司成功将全球第一支商业化的锂离子电池推向市场,随着产品的成熟和时间的推移,锂离子电池已经被广泛应用在PC、手机、AV设备等小型电子器件中[2]. 21世纪以来,锂离子电池开始朝着大容量和高比能方向发展,应用范围涉及电动汽车、无人机、智能电网及航天航空等领域. 2008年,特斯拉公司首先采用锂离子电池技术,开发出第一款纯电动敞篷跑车Roadster,其后又推出第二款纯电动跑车Model S,促进了纯电动汽车产业的发展. 沃尔沃公司推出了首款电动车型XC40 Recharge,并计划在2025年实现纯电动汽车的销量占销售总量的一半. 而我国最近出台了《新能源汽车产业发展规划(2021 ~ 2035年)》,规划指出到2030年,新能源汽车将形成市场竞争优势,销量占当年汽车销量的40%,有条件自动驾驶智能网联汽车销量占比70%,在2050年以前实现传统燃油车的全面退出. 除此之外,2019年10月28日,我国自主研制的首架四座电动飞机RX4E首飞成功,该飞机装配了总容量为7 × 104瓦时的动力电池系统,电芯采用的是国内首个商业化应用的能量密度超过300 Wh/kg的电芯产品. 与电动汽车相比,电动飞机对动力电池的安全性、能量密度及轻量化、倍率性能等方面的要求更高. 由此可见,动力锂离子电池将成为未来储能领域的支柱,因此对于高性能锂离子电池技术的开发成为重中之重.
近10年来,大量的研究主要集中在对锂离子电池电极材料、隔膜、电解液等主要材料的优化改进方面,而对于一些其他关键辅助材料,如正极黏合剂等的研究相对较少. 正极黏合剂的选择对于提高电池的电化学性能等方面有着重要影响,随着锂离子电池能量密度的不断提升以及人们对电池安全性要求的不断提高,作为关键辅助材料之一的正极黏合剂已引起人们越来越多的关注. 开发新型的高性能正极黏合剂材料,以实现高能量密度、高安全性锂离子电池的制备,成为当前的重要研究方向之一. 本文概述了黏合剂的种类、特性及其对电池的电化学性能的影响,介绍了黏合剂的作用机理,并综述了近几年正极黏合剂材料的研究现状,最后探讨了高性能锂离子电池先进正极黏合剂材料的未来发展方向.
1. 黏合剂的特性
黏合剂是将电极活性材料、导电剂和电极集流体连接起来的主要载体,使电极内部各组分具有整体性,形成稳定的电极结构,利于缓解锂离子电池的电极在充放电过程中发生的体积变形,防止活性材料的脱离,从而保持电极的机械完整性,改善电池的电化学性能[3]. 此外,黏合剂胶液在一定程度上有助于活性材料和导电剂的分散,避免沉降,使电极极片的加工简单易行[4]. 随着对电池性能要求的提高,电池内部各组分的性能需要进一步改进,这也使得黏合剂必须具备优良的特性来适应电池的不同需求[5]. 第一,强大的黏结力和高抗拉强度是形成坚固电极结构的必备条件;第二,较好的柔韧性是保证活性物质在体积变化过程中不脱落的重要条件;第三,良好的化学稳定性和电化学稳定性可防止黏合剂在充放电循环过程中与其他组分发生反应,导致电池性能的降低;第四,易分散、对电解液不溶胀、绝缘性好、成本低、环境友好. 因此,设计高性能黏合剂对于高性能锂离子电池的发展具有重要的意义. 常见的黏合剂主要分为2类,一类是以有机溶剂为分散剂的油溶性黏合剂,另一类是以水为分散剂的水溶性黏合剂.
2. 油溶性黏合剂
油溶性黏合剂是目前最为常见的黏合剂. 制备油溶性黏合剂的强极性有机溶剂包括N-甲基吡咯烷酮(NMP)、N,N-二甲基甲酰胺(DMF)、N,N-二甲基乙酰胺(DMAc)和二甲基亚砜(DMSO)等. 应用油溶性黏合剂制备的浆料中各个组分具有较好的分散性,不易沉降,电极的黏合力较高. 以PVDF的均聚物和共聚物为代表的油溶性黏合剂已经成为当今商业锂电池所使用的主要产品. 同时,PI凭借其良好的机械性能、优异的热稳定性及化学稳定性得到广泛的研究,有望成为高性能锂离子电池的新型先进正极黏合剂材料. 此外,功能性聚合物黏合剂可有效抑制Li-S锂电池中多硫化物的穿梭效应,缓解电池容量的衰减,从而促进Li-S锂电池高能量密度的发挥和循环寿命的延长.
2.1 PVDF型黏合剂
2.1.1 PVDF型聚合物的特性
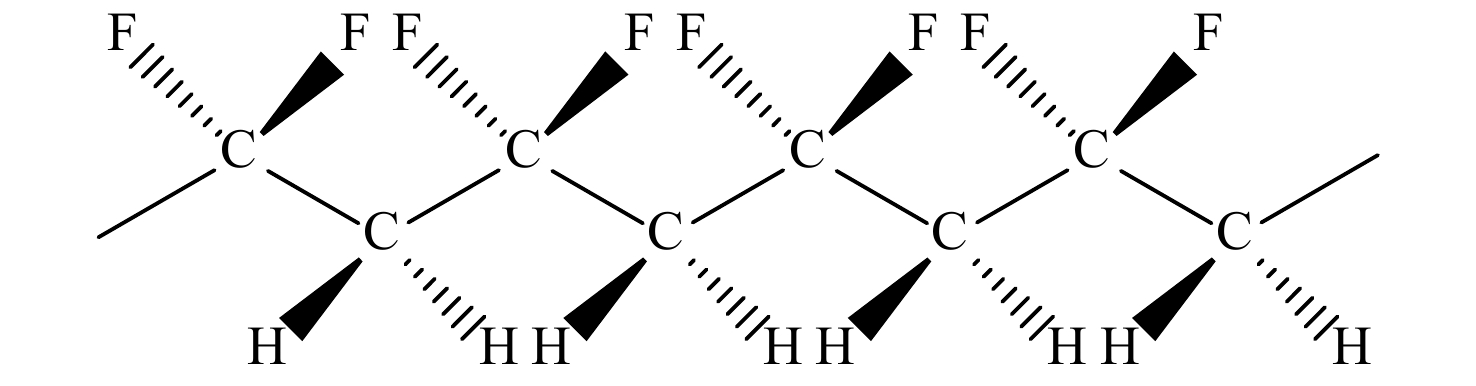
PVDF是一种偏氟乙烯(VDF)均聚物或VDF与其他少量含氟乙烯基单体的共聚物. 分子结构如图1所示(其重复单元是―CF2―CH2―),由CF2―和CH2―基元的重复交替连接组成,C―F键和C―H键具有一定的排列规整性,是半结晶性的线性高分子[6]. PVDF的主链骨架呈锯齿状,高电负性氟原子取代氢原子后与附近氟原子发生排斥力,使其不在同一平面内,性质稳定的氟原子包围在碳链的周围,形成紧密的空间屏障从而保障聚合物内部结构的稳定性,因此具有良好的化学稳定性[7].
图 1
基于PVDF的强抗氧化还原能力,其在电池循环过程中表现出极好的电化学稳定性[8]. PVDF易于分散,溶液具有较强的黏合能力,商业生产和科学研究的大多数电极材料也都采用PVDF作为黏合剂. 常规的PVDF主要是依靠分子间的范德华力将活性材料、导电剂和集流体等正极组分结合起来.
PVDF黏合剂对锂离子电池的性能有较大的影响,高黏结性可以提高电池的循环寿命. 影响黏结性的主要因素包括分子量和结晶度[9]. 分子量过小,黏合剂的用量变多,黏结性能变差;分子量越大,黏结性越强,对于极片的剥离强度越大;但是分子量过高不利于电极组分在分散剂中的分散,致使浆料粘度过高易形成凝胶,所以控制分子量对于黏合剂的黏结性能十分重要. 结晶度是影响PVDF黏合剂机械性能的直接因素,结晶度高,分子链间堆砌紧密,分子间作用力强,黏结效果好,但是对正常温度范围内工作的电池而言,PVDF的结晶性不利于电解液分子的流动,使电池充放电过程极化增加,内阻升高.
2.1.2 PVDF型黏合剂在正极材料中的研究进展
液体型锂离子二次电池从20世纪90年代初即开始工业化生产,其市场规模不断扩大,PVDF被用作电极(正极和负极)活性物质黏合剂;而聚合物型锂离子二次电池则于1990年由美国贝尔通讯研究公司公布其技术要点,1996 ~ 1997年在日本公开专利,PVDF系树脂是电极(正极和负极)活性物质黏合剂[10].
随着PVDF黏合剂的市场化,国内外开始致力于研究PVDF黏合剂结构与性能及含量对于电池性能的影响. 张翠芬等[11]研究了PVDF黏合剂的结构及晶型对锂离子电池性能的影响. PVDF分子量小有利于离子迁移,但黏合强度不够;PVDF分子量大致使高聚物内部自由体积小,不利于离子迁移. Choi等[12]研究了PVDF的质量分数对正极的循环寿命、放电容量的影响. 随聚偏氟乙烯的质量百分含量的增加,电池的首次充放电效率升高,充放电容量降低,当PVDF量过多时,黏合剂阻隔了正极材料氧化镍钴锂和导电剂炭黑的直接接触,其接触面积减小导致活性物质利用率降低,容量减小;当PVDF含量过少时,与活性物质黏结不够牢固,氧化镍钴锂和导电剂碳黑之间的接触也不紧密,导致循环过程中容量衰减过快.
由于PVDF黏合剂本身的高结晶度及高绝缘性极易导致锂离子电池的内阻上升、影响锂离子电池的电化学性能,研究者们开始设计改性PVDF黏合剂. 常见的改性方法主要包括共聚法和共混法. 共聚法是选取VDF与单体摩尔占比较少的第二、三单体共聚后形成性能较好的黏合剂. 共混法是将2种不同的聚合物通过充分的机械搅拌混合作为黏合剂,选取的聚合物性能互补以使黏合剂兼具柔软性与黏弹性. Choi等[12]研究了不同PVDF含量对锂二次聚合物电池电化学性能的影响,P(VDF-co-HFP)/PMMA共混物和P(VDF-co-HFP)共聚物黏合剂对电池电化学性能的影响,在正极中的无定形区域中引入无定形聚甲基丙烯酸甲酯(PMMA)使得电池电化学性能明显提高. 无定形相的引入利于增加电极对液态电解质的吸收,提高锂离子的迁移率. P(VDF-co-HFP)/PMMA黏合剂电池的放电容量和充放电效率要高于P(VDF-co-HFP)黏合剂电池,主要是因为正极大量吸收液体电解液,增大了锂离子的迁移率,从而提高了电池的放电容量和充放电效率.
目前为止,通过对PVDF型黏合剂的结构设计及改性,其黏结性、耐热性、对电解液的溶胀性等均有所改善,也使得PVDF型黏合剂逐渐成为锂离子电池电极材料所使用的主要产品类型. 但是,在高温条件下,PVDF型黏合剂容易软化,机械强度降低,无法将活性物质、导电剂和集流体的电极组份有效结合在一起[13]. 因此,现有的PVDF型黏合剂无法满足纯电动汽车、航空航天及大型储能电源应用领域锂离子电池对耐高温性能的进一步要求,市场急需开发一种同时具备高低温条件下高黏附力和优异热稳定性以及利于保持正极高容量的功能性黏合剂.
2.2 PI黏合剂
2.2.1 PI的特性
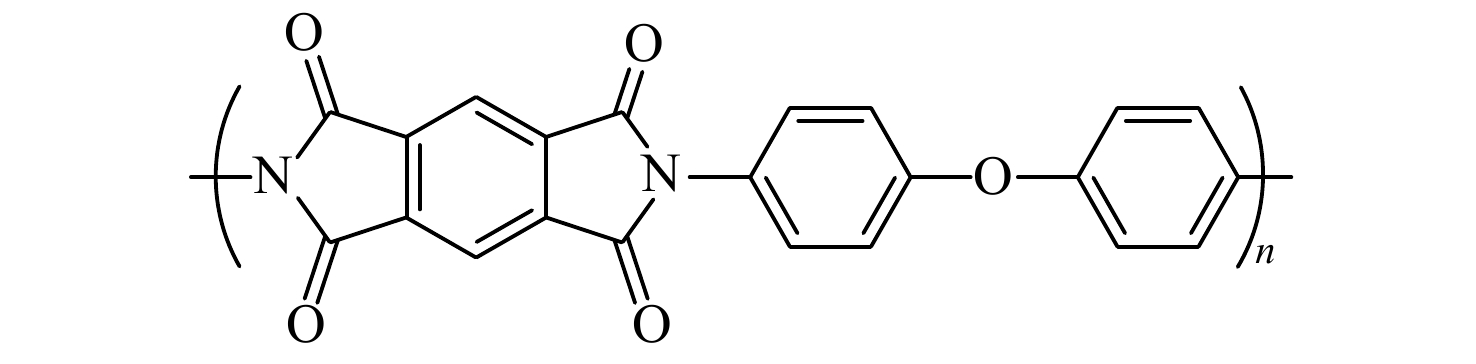
PI是分子骨架上具备酰亚胺环结构的一类大分子,结构多样,可以通过改变二胺和二酐单体的种类[14],设计得到具有理想结构及性能的聚酰亚胺. 典型的PI大分子的结构式如图2所示.
图 2
PI的制备通常采用一步法或者两步法[15,16]. 一步法是指在200 °C以上的高温下,二酐和二胺在高沸点酚类溶剂中直接合成PI;两步法合成PI,即二酐和二胺首先反应形成前驱体聚酰胺酸,经过热/化学酰亚胺化作用转化为PI. PI大分子骨架中的杂环酰亚胺环和芳族苯环赋予PI较高的玻璃化转变温度、高的强度和模量、优异的尺寸稳定性、化学稳定性以及阻燃自熄的特性[17].
PI优异的综合性能,使其成为新型黏合剂重要发展方向. PI黏合剂继承了PI优异的耐高低温性能及化学稳定性[17,18]. 优异的耐热性能可以保持正极材料在高温高压下的结构稳定性,从而提高正极在高压循环下的容量. 良好的化学稳定性使得PI黏合剂不被氧化或还原,不与活性物质、电解液及其他物质发生副反应,保障正极的电化学稳定性. PI黏合剂还具有较好的介电性能[19,20],利于提高正极材料的高压循环性能. PI的结晶度低,属于无定形高分子,利于正极材料之间的黏附均匀性. 除此之外,PI分子结构中的酰亚胺基团使PI黏合剂具有更高的抗拉强度和弹性复原能力,可有效适应电极的收缩和膨胀,保证了电极在循环过程中的结构完整性和稳定性. 而且基于PI分子结构的可设计性,将羧基(―COOH)、三氟甲基(―CF3)等功能性基团引入PI骨架中,增加PI黏合剂的黏结强度,确保活性材料不脱落,从而提高正极材料、极片的稳定性和电池的循环寿命.
2.2.2 PI黏合剂在正极材料中的研究进展
作为高性能材料的PI,已经大量应用在航空航天、微电子等高水平领域,在纤维、涂料、薄膜及复合材料等方面也得到了广泛的应用[20~22]. 近年来,作为新型正极黏合剂,PI材料得到越来越多的研究. PI黏合剂凭借出色的机械性能、耐热性能和低膨胀系数,可以有效阻止正极在高压高温下发生结构降解、活性颗粒破碎、金属析出等,从而避免电池容量的急速衰减,同时提高电池的充放电循环性能[23,24].
Qian等[25]通过2,2-双[4-(4-氨基苯氧基)苯基]丙烷,4,4-氧代二苯胺和4,4-氧代二邻苯二甲酸酐合成了可溶性PI (结构如图3所示),并尝试将其用作锂离子电池正极材料黏合剂,对比分析了PVDF黏合剂和PI黏合剂的性能. 如图4所示,经过电化学性能测试,发现以PI为黏合剂的电池在500次循环后显示出91.4%的容量保持率,与以PVDF为黏合剂的电池几乎相同;但是在进行过充安全性能的测试时,PI黏合剂电池通过测试,而PVDF黏合剂电池却出现燃烧现象,证明PI黏合剂对于提高锂离子电池的安全性有重要作用.
图 3
图 4
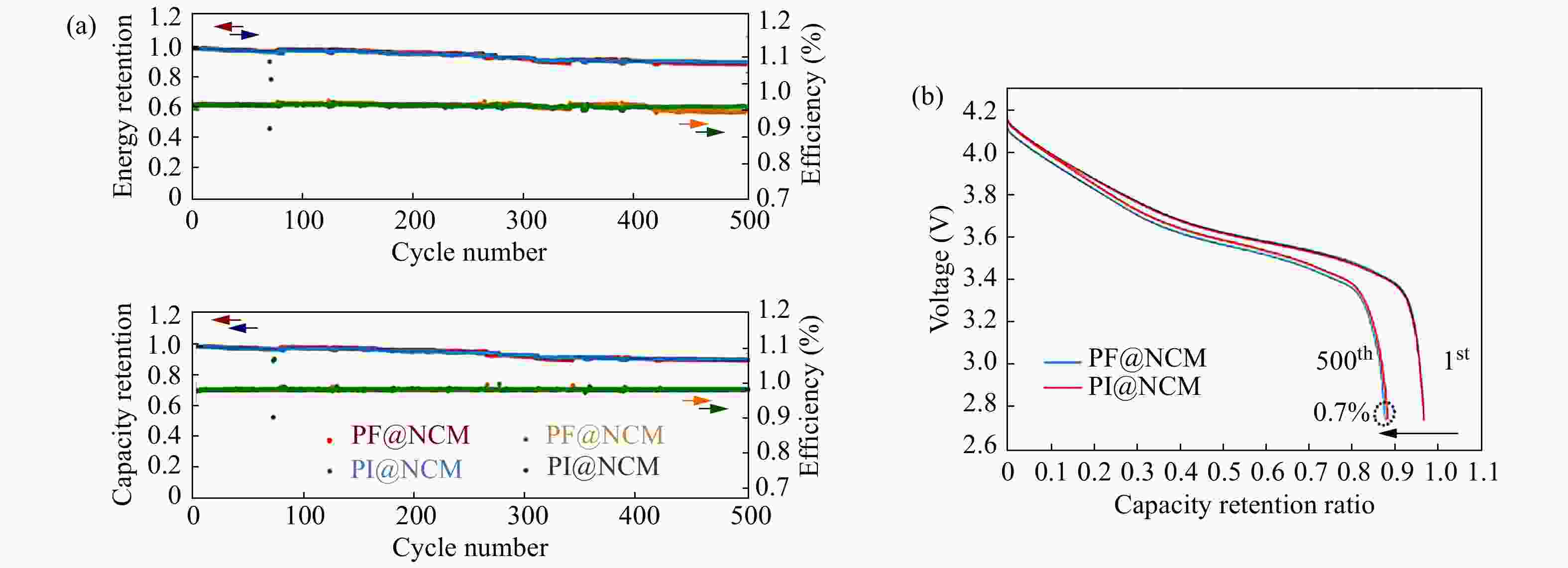 Figure 4. (a) Cyclic performance of PF@NCM and PI@NCM batteries; (b) The 1st and 500th charge and discharge cycles of PF@NCM and PI@NCM batteries (Reprinted with permission from Ref.[25]; Copyright (2016) Elsevier) (The online version is colorful.)
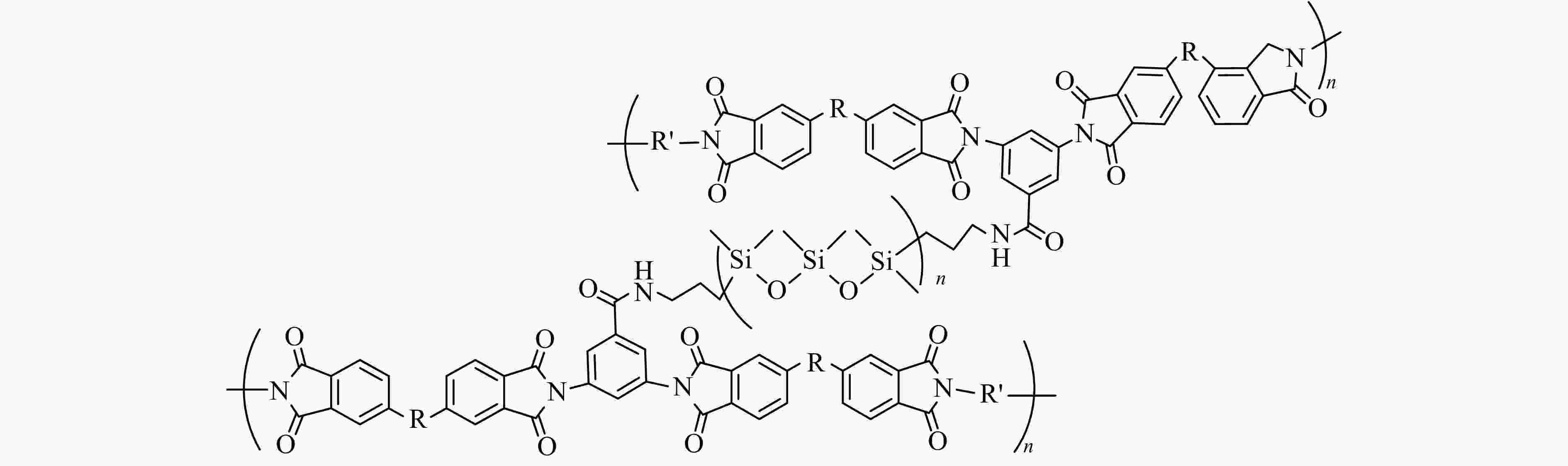
Figure 4. (a) Cyclic performance of PF@NCM and PI@NCM batteries; (b) The 1st and 500th charge and discharge cycles of PF@NCM and PI@NCM batteries (Reprinted with permission from Ref.[25]; Copyright (2016) Elsevier) (The online version is colorful.)Oh Ilwhan等[24]通过采用聚酰亚胺与聚硅氧烷交联制备了聚(酰亚胺-共硅氧烷)黏合剂(PIS),图5为PIS的化学结构式. 该黏合剂在正极形成了薄薄的表面层,该层可在450 °C的高温下工作. 经过扫描电镜观察FeS2/PIS复合材料的表面形貌,如图6所示,发现FeS2颗粒被PIS交联凝胶包覆,包覆表面层厚度是常规颗粒型正极厚度的10% ~ 20%,且该表面层具有较好的机械强度. FeS2/PIS复合材料在高达400 °C的温度下形态保持不变,可见其热稳定十分优异. 与传统的粒状正极材料相比,带有PIS聚合物黏合剂电池的放电容量增加了20%.
图 5
图 6
 Figure 6. Scanning electron microscope (SEM) and transmission electron microscope (TEM) images of the cathode layer composites of FeS2/PIS: (a, c) After formation of the cathode composites at 250 °C; (b, d) After 1 h treatment at 450 °C; SEM images of pellet-type FeS2: (e) After formation of the cathode; (f) After 1 h treatment at 450 °C (Reprinted with permission from Ref.[24]; Copyright (2018) MDPI)
Figure 6. Scanning electron microscope (SEM) and transmission electron microscope (TEM) images of the cathode layer composites of FeS2/PIS: (a, c) After formation of the cathode composites at 250 °C; (b, d) After 1 h treatment at 450 °C; SEM images of pellet-type FeS2: (e) After formation of the cathode; (f) After 1 h treatment at 450 °C (Reprinted with permission from Ref.[24]; Copyright (2018) MDPI)Zhao等[23]将PI黏合剂和N-甲基吡咯烷酮混合,添加导电性炭黑和活性材料,经过搅拌,在集流体上涂覆并干燥制备了锂离子电池正极材料,电池测试显示,倍率性能及充放电循环性能有所提升. Pham等[26]研究报告了一种氟化聚酰亚胺(FPI)新型高压黏合剂,该研究通过与常规PVDF黏合剂作对比,发现FPI黏合剂具有优异的黏合能力,并且在正极结构形成了坚固的表面层,如图7所示,经多次充放电循环后,FPI-LMNC正极极片颗粒形态依旧保持完整,减轻了正极材料的降解. 如图8所示,由FPI黏合剂辅助的富锂层状氧化物正极和不含任何电解质添加剂的常规电解质组成的全电池在55 °C和4.7 V的高充电电压的苛刻条件下,经过第100个循环后仍显示出有效的容量保持率,放电容量为198 ~ 223 mAh g−1.
图 7
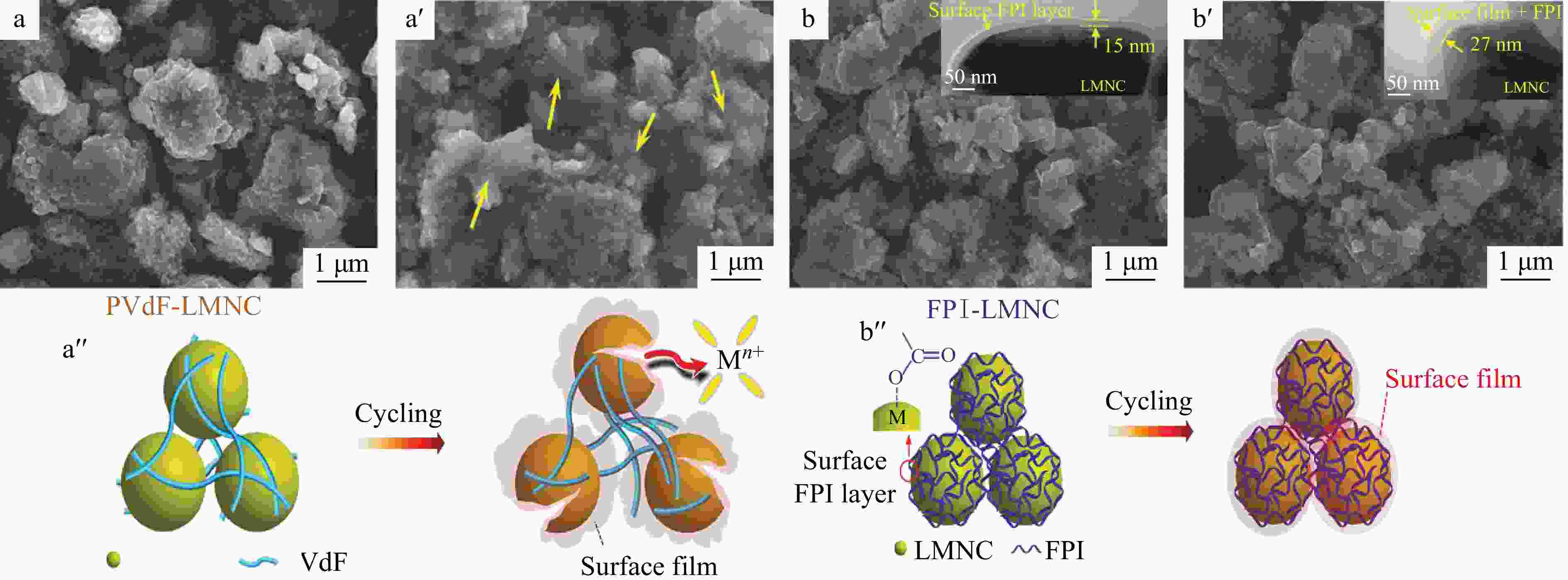 Figure 7. (a, a') Particle morphology changes of PVDF-LMNC cathode before and after 100 cycles; (b, b') FPI-LMNC cathode before and after 100 cycles; (a", b") Schematic illustration of the changes in their particle morphology and surface state, respectively (Reprinted with permission from Ref.[26]; Copyright (2017) John Wiley and Sons)
Figure 7. (a, a') Particle morphology changes of PVDF-LMNC cathode before and after 100 cycles; (b, b') FPI-LMNC cathode before and after 100 cycles; (a", b") Schematic illustration of the changes in their particle morphology and surface state, respectively (Reprinted with permission from Ref.[26]; Copyright (2017) John Wiley and Sons)图 8
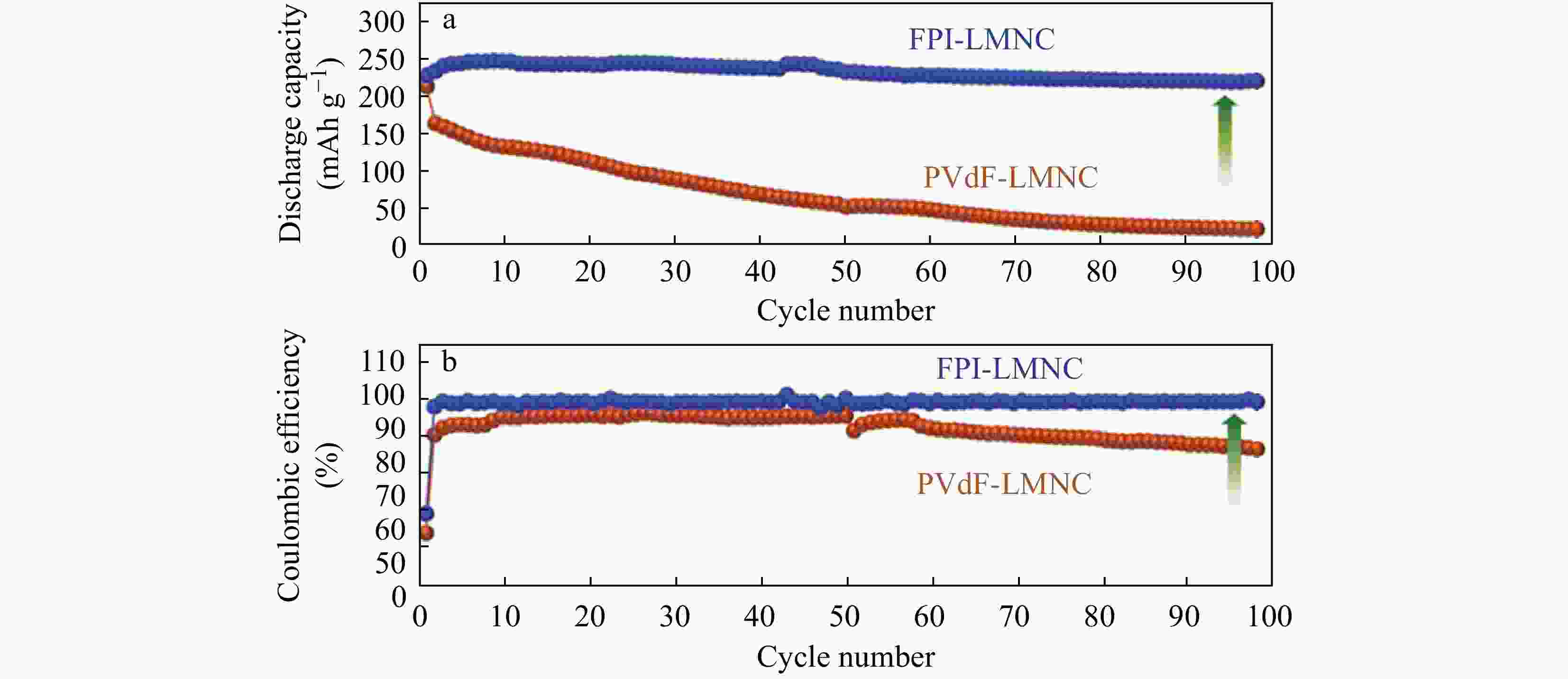 Figure 8. (a) Cycling performance and (b) Coulombic efficiency of PVdF-LMNC//graphite and FPI-LMNC//graphite full-cells (Reprinted with permission from Ref.[26]; Copyright (2017) John Wiley and Sons)
Figure 8. (a) Cycling performance and (b) Coulombic efficiency of PVdF-LMNC//graphite and FPI-LMNC//graphite full-cells (Reprinted with permission from Ref.[26]; Copyright (2017) John Wiley and Sons)2.3 Li-S锂电池油溶性黏合剂
2.3.1 Li-S锂电池的特性
基于16Li + S8→8Li2S的多电子电化学反应,Li-S锂电池凭借较高的理论能量密度(2567 Wh kg−1)成为最有希望的高性能储能体系之一. 硫元素在自然界中储量丰富、成本低以及环境友好性使得Li-S锂电池更具商业竞争力[27]. 然而,在充放电反应过程中,元素硫和Li2S的体积发生剧烈膨胀,造成正极结构的不稳定;同时,正极经历了复杂的氧化还原反应并伴随着相变,比如可溶性多硫化物中间体(Li2Sx,4 ≤ x ≤ 8)的形成以及它们在硫正极和金属锂负极之间的迁移和扩散,即“穿梭”效应. Li-S锂电池中多硫化物的穿梭效应会导致活性硫的损失、锂金属负极的腐蚀、容量的快速衰减和低库仑效率[28~30]. 此外,硫的绝缘性和短链放电产物(Li2S2和Li2S)也会导致电化学动力学反应缓慢. 所以设计与硫正极相匹配的功能性聚合物黏合剂在一定程度上可有效缓解容量的衰减等问题.
功能性聚合物黏合剂在硫正极中起着重要的作用[30]:(1)确保活性硫颗粒和导电剂之间的紧密接触;(2)提供强大的黏合力,将S/C活性材料结合到集流体上;(3)缓冲大体积变化并保持电极结构的完整性,特别是硫正极处于高负载状态;(4)促进Li离子在硫正极中的传输和电子转移;(5)捕获可溶性硫物质;(6)促进多硫化物氧化还原反应的动力学;(7)调节可溶性多硫化物中间体的溶解和扩散.
2.3.2 功能性聚合物黏合剂在硫正极中的研究进展
常见黏结剂的电绝缘特性会导致电极内阻的增加和氧化还原反应动力学的降低. 因此,研究者认为导电黏合剂可以保持锂硫电池的机械完整性并提高电子转移. Milroy等[31]提出了由聚吡咯和聚氨酯组成的集导电、弹性和电活性一体的混合黏合剂. 导电聚吡咯纳米颗粒的引入有效地构建了高速电子转移网络,降低了硫正极的电阻抗,并促进了绝缘硫正极的氧化还原反应进程. 使用聚(3,4-乙烯二氧噻吩) (PEDOT)黏合剂可降低电极的内阻并促进电子转移,该分子中的极性杂原子对可溶性多硫化物具有较好的吸附作用[32]. Liu[30,33]设计了一种导电的聚(9,9-二辛基芴-共芴酮-甲基苯甲酸酯) (PFM)聚合物作为高性能Li-S电池的黏合剂. 具有辛基侧链的聚芴骨架使PFM具有出色的电子导电性;引入芴酮官能团以调节和优化聚合物的电子结构,从而进一步提高电导率;而结合的苯甲酸酯基团能够降低聚合物链的刚性,因此增强了聚合物链的机械性能;由于黏合剂中极性羰基与硫之间的结合能高,PFM基硫电极避免了活性硫的溶解和损失. 如图9所示,PFM黏合剂的Li-S锂电池在经过150次充放电循环后,显示出较高的可逆容量.
图 9
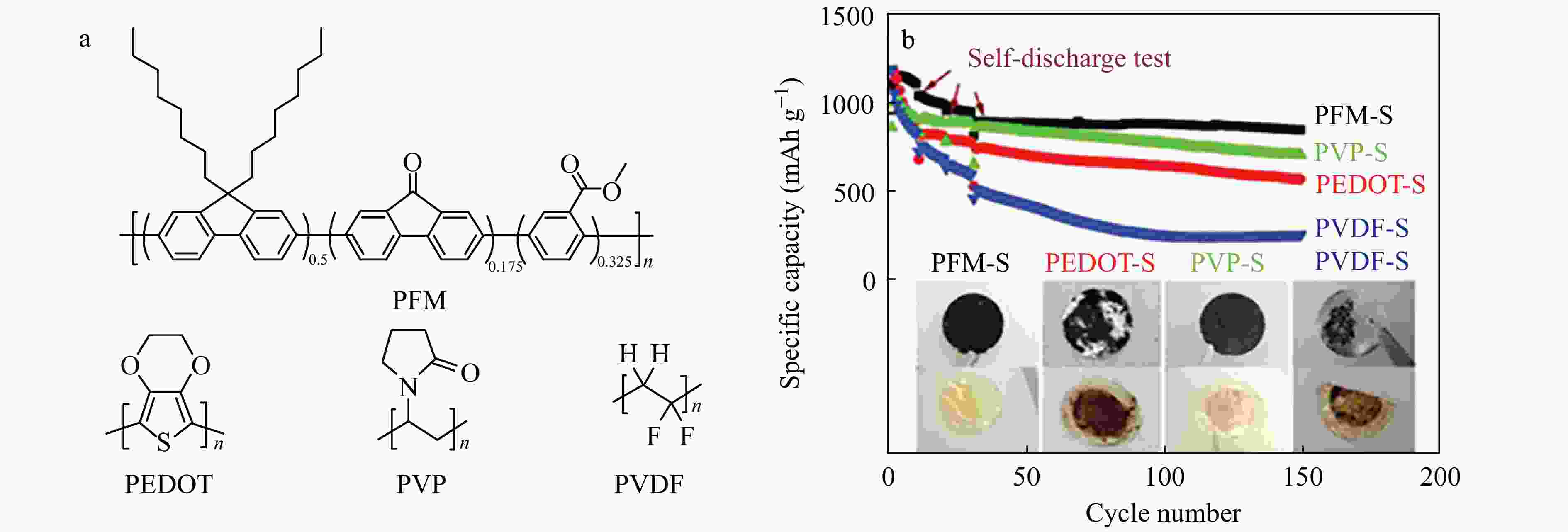 Figure 9. (a) Chemical structures of PFM, PEDOT, PVP, and PVDF binders; (b) Cycling performance and self-discharge performance of sulfur cathodes fabricated with different binders at C/10 (Reprinted with permission from Ref.[30]; Copyright (2018) John Wiley and Sons)
Figure 9. (a) Chemical structures of PFM, PEDOT, PVP, and PVDF binders; (b) Cycling performance and self-discharge performance of sulfur cathodes fabricated with different binders at C/10 (Reprinted with permission from Ref.[30]; Copyright (2018) John Wiley and Sons)2.4 其他油溶性黏合剂及研究进展
锂离子电池的高压化以及高能量化需要电位更高的正极活性物质,但是由于现有的黏合剂黏结性差且抗氧化性差,随着充放电的反复进行,黏合剂易逐渐分解,从而导致正极活性物质脱落,造成电池容量衰减. 针对这一问题,成富拓也等[34]设计制备了接枝共聚物(丙烯腈为主成分的单体与聚乙烯醇进行接枝)协同不饱和羧酸酯的组合黏合剂,用其制备的电池满电态在60 °C条件下存放96 h后,测试发现从正极活性物质向负极溶出的Mn和Ni量均在100 mg L−1以下,在正极的充放电曲线中,电压平台稳定在4.5 V,证明活性物质并没有发生明显的结构变化,进一步说明该黏合剂具有较好的黏结力和抗氧化性.
油溶性黏合剂易于与不同的正极材料相匹配,适用范围广;且应用油溶性黏合剂制备的正极浆料中,正极各组分分散均匀,不易沉积,对电极的黏结性较好;使用油溶性黏合剂制备的极片含水量低,且除水工艺简单,在很大程度上可降低水对于锂离子电池电化学性能的影响. 但是,油溶性黏合剂也存在着相应的问题:油溶性黏合剂在非水性电解液中容易被润湿发生溶胀,进而降低正极材料与集流体之间的黏结性,导致内部电阻增大,电池的电化学性能降低. 同时,使用的有机溶剂易挥发且有一定的毒性,使得环保成本上升;极片涂布工艺要求严格,生产能耗高. 为了克服和改善油溶性黏合剂所存在的问题,需对其进行合理设计,可从以下方面考虑:(1)提高黏结剂的吸液能力;(2)降低黏合剂的成本,开发低成本的油溶性黏合剂;(3)开发新型绿色环保油溶性黏合剂.
3. 水溶性黏合剂
油溶性黏合剂的易溶胀、易污染、高成本等缺点,使得开发具备环境友好型、成本低、成膜性优异等特点的水溶性黏合剂成为电池电极黏合剂研究领域的另一热点方向.
早在2000年,以聚丙烯酸类(PAA)、丁苯橡胶类(SBR)为典型代表的水溶性黏合剂开始应用在负极材料中,目前为止其制备工艺成熟,在负极黏合剂市场中占比约70%. 但是,水溶性黏合剂在正极材料中的应用相对较少,主要原因有以下4点:(1)常见的水溶性黏合剂中含有不饱和双键,在4 V以上电压下易被氧化;(2)水相体系很难干燥,残余的水影响容量及循环;(3)水做分散剂,易使浆料沉积且分散不均匀;(4)水性黏合剂易使正极材料中的金属溶出,导致浆料pH发生变化及正极容量的下降.
3.1 PAA类水溶性黏合剂
PAA是无定形高分子且呈链状交联结构,所以PAA与复合材料电极之间具有更好的黏合均匀性和柔性. PAA分子中存在的羧基基团会与活性材料或导电剂表面的羟基基团形成酯键结构,将各种材料紧密地连接在一起,且羧基基团之间相互作用形成氢键,使得分子长链之间相互交联,产生更强的黏合力[4,35]. PAA类树脂的抗氧化能力、抗高电压能力较强,可通过调整羧基以及其它官能团的比例,得到适用于正极极片的水系黏合剂.
中国科学院成都有机化学研究所等单位研发成功的LA132水溶性黏结剂,其有效成分为聚丙烯酸类三元共聚物胶乳,是一种以水为介质的环保型锂离子电池正、负极黏结剂[36]. Cai等[35]分别将水溶性PAA和油溶性PVDF作为黏合剂应用在LiFePO4正极材料中,通过对比,发现PAA型电池的电化学性能诸如循环性能、极化程度,容量保持率等优于PVDF型电池. 从SEM图中可以观察到PVDF型极片出现大小不一的裂纹,PAA型极片形貌良好,说明PAA黏合剂的机械性能和黏合力较好,这也是造成PAA型电池循环性能较好的原因. Zhang等[37]将PAA应用到LiFePO4正极中,考察了极片剥离强度、溶胀性能、表面形貌等性质,并测试了电池的常温电化学性能. 如图10(a)所示,与PVDF黏合剂对比发现,PAA黏合剂的LiFePO4正极表现出更好的循环稳定性. PVDF黏合剂的LiFePO4正极的初始放电容量为135.4 mAh g−1,经过200次循环后降低至117.3 mAh g−1. 而PAA黏合剂的LiFePO4正极在初始循环中的放电容量为142.1 mAh g−1,在200次循环后容量保持在141.1 mAh g−1,容量保持率为99.3%,这表明PAA利于提高LiFePO4正极的循环能力. 图10(b)为2.5和4.2 V电压极限之间PAA和PVDF黏合剂的LiFePO4正极的充放电曲线. 与PVDF黏合剂的正极对比,发现PAA黏合剂的正极显示出较低的充电平台和较高的放电平台,说明PAA黏合剂利于降低电极的极化. 交流阻抗测试结果如图11所示,PAA黏合剂的电池具有较小的电池极化,且其电池阻抗随着循环的进行不升反降. 通过极片理化性质分析,PAA黏合剂的极片具有良好的黏结性能和合适的电解液吸收量,保证了其良好的电性能发挥.
图 10
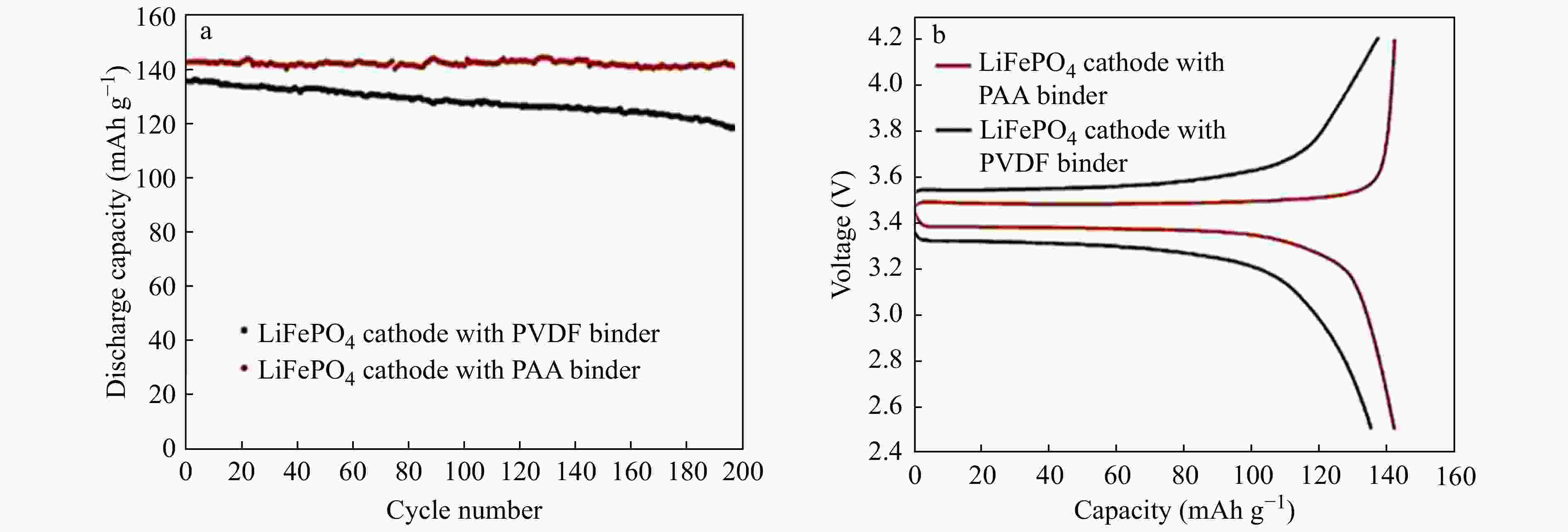 Figure 10. (a) Discharge cycle performances of LiFePO4 cathodes with PAA and PVDF binder at the current density of 175 mA g−1 between 2.5 and 4.2 V at 25 °C; (b) The 5th charge-discharge profiles of LiFePO4 cathodes with PAA and PVDF binder at the current density of 175 mA g−1 between 2.5 and 4.2 V at 25 °C (Reprinted with permission from Ref.[37]; Copyright (2012) Elsevier) (The online version is colorful.)
Figure 10. (a) Discharge cycle performances of LiFePO4 cathodes with PAA and PVDF binder at the current density of 175 mA g−1 between 2.5 and 4.2 V at 25 °C; (b) The 5th charge-discharge profiles of LiFePO4 cathodes with PAA and PVDF binder at the current density of 175 mA g−1 between 2.5 and 4.2 V at 25 °C (Reprinted with permission from Ref.[37]; Copyright (2012) Elsevier) (The online version is colorful.)图 11
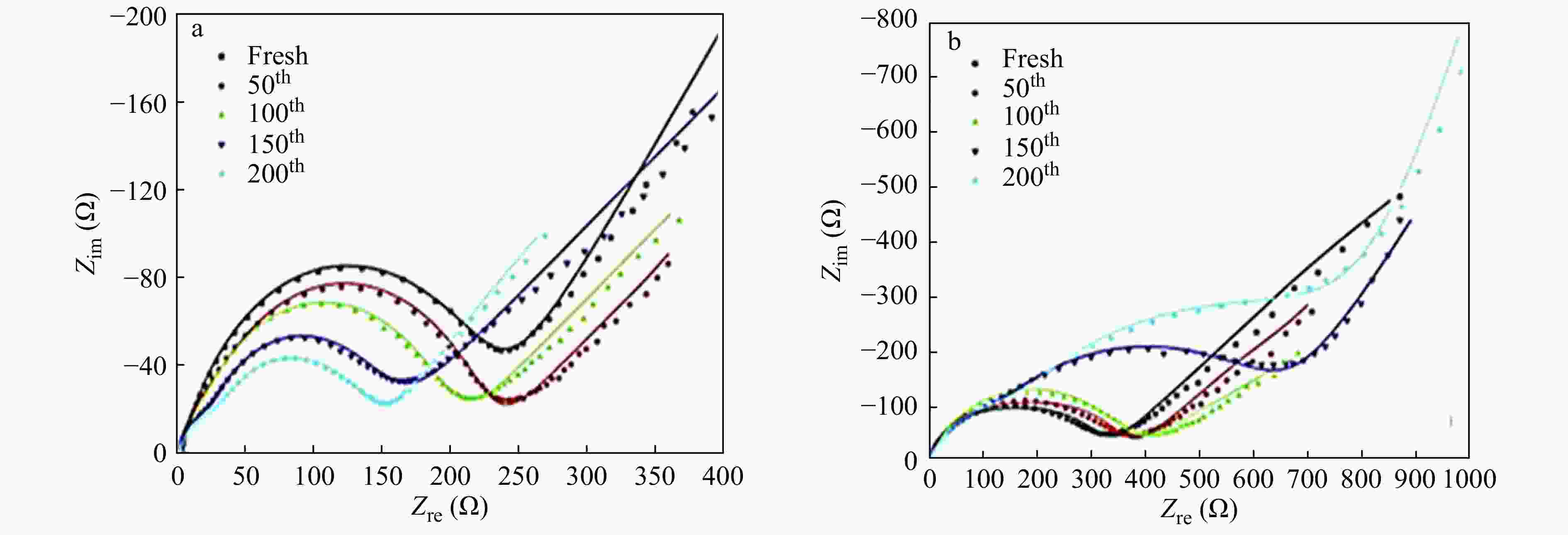 Figure 11. Nyquist plots of the LiFePO4/Li half cells (a) made with PAA and (b) made with PVDF after different cycle numbers (Reprinted with permission from Ref.[37]; Copyright (2012) Elsevier) (The online version is colorful.)
Figure 11. Nyquist plots of the LiFePO4/Li half cells (a) made with PAA and (b) made with PVDF after different cycle numbers (Reprinted with permission from Ref.[37]; Copyright (2012) Elsevier) (The online version is colorful.)Lee等[38]将PAA加入到CMC悬浮液中制备了电池正极,PAA的加入有效降低了悬浮液的黏稠度,同时还提高了电池的比容量. Guerfi等[39]选择PAA水性黏合剂代替传统的油性黏合剂PVDF制备了正极极片,比较2种不同类型的黏合剂所制备的电池性能,发现各项电化学指标相近,说明PAA水性黏合剂具有良好的电化学性能.
3.2 羧甲基纤维素(CMC)类水溶性黏合剂
CMC[4]是一种纤维素衍生的具有线性长链结构的天然聚阴离子多糖类化合物,由羧甲基基团 (―CH2COONa) 取代纤维素结构中羟基基团(―OH)上的氢原子转变而来. CMC分子具有良好的亲水性,其分子链上的羧甲基数量决定了CMC的取代度,也部分决定了CMC的分子量. 黏度、取代度和分子量影响着CMC溶液的黏合性、增稠性和保水性等. 但是,由于CMC的机械性能差(如脆性),故通常将CMC和SBR结合作为硫正极黏合剂.
高弹性的SBR保证了硫正极的连续性及导电网络的机械稳定性,水性CMC利于硫活性颗粒及导电剂的均匀分布,从而降低传质阻力和增强电子传输. 此外,CMC-SBR共混黏合剂还有助于抑制放电产物(Li2S)的聚集,并维持正极结构在充放电循环过程中的稳定性[30,40]. 通过与微小型次级碳颗粒结合,弹性体CMC-SBR黏合剂使硫正极的面负载达到3 ~ 7 mg cm−2[41]. 与CMC-SBR类似,由CMC和丁腈橡胶(CMC/NBR)组成的类似黏合剂体系在硫正极中也具有很强的附着力和较好的柔韧性,使用CMC/NBR黏合剂的硫正极在经过100次循环后仍具有出色的完整性和稳定性[42].
3.3 其他水溶性黏合剂及研究进展
近年来,随着锂离子电池研究的深入,研究者们探索出各种用于电池正极的新型水系黏合剂,主要有聚乙烯醇、明胶、从海洋植物褐藻中提取的藻朊酸盐以及从农作物中提取的多糖.
Dominko等[43]使用明胶作为LiMn2O4正极材料的黏合剂,探究了黏合剂对于电池性能的影响. 测试发现正极活性物质的比重高达96%,大幅提高了正极的能量密度,且电池的循环性能极佳. 通过对极片的柔韧性及黏合力测试,对比PVDF黏合剂,发现二者基本相当. 通过形貌表征发现极片内部导电剂分散均匀,并且与活性颗粒较好的连接,呈现出具有网络结构的导电体系,进一步促进了电池电化学性能的提升.
最新发现,5 V锂离子电池有望实现电池的高能量密度. 但是,当正极处于高压环境下,以碳酸盐为主要组分的电解质由于产生了连续的自由基而易于分解,致使5 V锂离子电池的循环性能较差. Ma等[44]提出了一种基于自由基清除作用的新型策略,以抑制由LiNi0.5Mn1.5O4正极和碳酸盐基电解质组成的5 V电池的电解质分解. 该策略是采用具有大量酚基团的可再生生物质木质素作为正极黏合剂,在充放电过程中,黏合剂可显著抑制自由基链反应,并在正极与电解质之间形成多维界面,从而有效缓解电解质的分解. 实验证明,以木质素为黏合剂的正极在1000次循环后显示出94.1%的容量保持率,明显高于以PVDF为黏合剂的正极容量保持率(46.2%).
制造黏合剂时使用的油溶性自由基引发剂残留在黏合剂组合物中,会导致该引发剂与电解液发生反应引起内部电阻上升,从而使电池的放电效率变低. 为此牛岛靖仁等[45]通过将油溶性引发剂控制在500 mg L−1以下,制备了组合式水溶性黏合剂树脂(烷基改性的羧基共聚物与聚乙烯醇交联化合物等),在截止电位为4.2 ~ 2.0 V,以0.5 C充电且在0.5、1、3、5、10、30 C的倍率下进行放电,测试结果显示出高的放电容量及高的放电电位,说明该组合式水溶性黏合剂可以有效抑制电池内部电阻上升并赋予锂离子电池高效率放电特性.
水溶性黏合剂的成本低、绿色无污染且来源广;在有机液态电解液中不溶胀,可有效抑制电池内部电阻的增加,从而促进离子及电子的运输;水溶性黏合剂利于调节溶液的粘稠度,改善正极组分之间的分散性. 但是,水溶性黏合剂也存在一些问题,如易在高压下被氧化,极片除水不彻底影响电池电化学性能,易使正极材料中的活性物质溶出,影响电池容量. 所以可以设计多元复合体系的黏合剂,将不同水溶性黏合剂的优点整合在一起,提高正极材料的理化性能及促进电池电化学性能的发挥.
4. 结语与展望
随着锂离子电池在电动汽车、电动飞机等领域的应用,锂离子电池在安全性、能量密度、以及轻量化、倍率性能等方面的要求都在不断提高,这对应用在锂离子电池电极中的黏合剂的用量及性能提出了越来越高的要求. 近年来对于高性能电池电极黏合剂的研究已经有所突破,应用在负极的黏合剂无论是性能还是种类也日趋多样化. 正极材料结构的复杂性、正极反应的多变性,致使与正极材料相匹配的黏合剂的研究存在着各种因素的限制,也使得正极黏合剂的研究进展十分有限.
因此,开发耐高温、高黏结性正极黏合剂,实现与正极的较佳匹配,以充分发挥正极材料容量并提高电池循环稳定性和安全性十分必要. 可以从以下5个方面入手:(1)增加界面接触. 通过制浆工艺调控黏合剂与活性颗粒的润湿性和渗透,从而增大二者的界面接触. (2)提高分子间作用力. 羟基(-OH)、羧基(-COOH)、邻苯二酚、酯基(-COOR)、羰基(RCOR)和氨基(-NH2)等极性基团可以与活性颗粒形成较强的氢键、离子-偶极子、化学键和共价键等;采用支化或超支化聚合物黏合剂能够与活性颗粒形成多维黏结接触点和氢键,通过上述2种方法可显著提高黏合力、同时减少正极副反应的发生、充分发挥材料比容量和提高库伦效率. (3)根据正极材料的性能,选择与之相匹配的黏合剂. 调整黏合剂的相态,使黏合剂与正极组分之间形成均匀的包覆结构. (4)多功能化黏合剂. 常见的黏合剂结构单一、功能单一,难以满足力学、电学、化学及电化学等多功能需求,所以通过分子设计、纳米化、多元复合等方式获得功能性黏合剂. 三维结构的纳米黏合剂可显著改善电子和离子的传输速率;导电聚合物可同时起到黏合剂和导电剂的作用,减少非活性物质的比例;纳米结构的黏合剂具有优异的柔韧性,可用于柔性和可穿戴电子设备. 但是,较低的体积比容量和较低的导电性限制了纳米黏合剂的商业化应用. (5)开发新型黏合剂. 通过主链或支链掺杂修饰形成到导电官能团制备导电黏合剂. 导电黏合剂除了具备较好的黏合力,还能够在电极内部建立良好的导电网络和离子传输网络,显著改善电池的倍率性能和循环性能. 虽然目前导电黏合剂由于导电性不稳定而难以规模化生产,但是导电黏合剂在未来储能系统领域仍具备较好的研究及应用价值.
设计优化黏合剂结构对于开发出具有高黏结力、高弹性的黏合剂具有重要作用,从而充分发挥正极的容量、库伦效率、并提高其循环寿命等性能,推动锂离子电池的发展. 综合来看,具有高耐温性能、高黏结性、低膨胀系数、低结晶度和功能性的PI黏合剂可基于分子结构设计实现与正极材料的更好匹配、更高的放电电压平台、更佳的高温热稳定性和循环稳定性,从而大幅提升锂离子电池的能量密度、安全性和使用寿命,在新型锂离子电池正极黏合剂领域具有广阔的发展前景.
-
-
[1]
Makimura Y, Ohzuku T. J Power Sources, 2003, 119-121: 156 − 160 doi: 10.1016/S0378-7753(03)00170-8
-
[2]
Nishi Y. J Power Sources, 2001, 100(1-2): 101 − 106 doi: 10.1016/S0378-7753(01)00887-4
-
[3]
Shi Y, Zhou X Y, Yu G H. Accounts Chem Res, 2017, 50(11): 2642 − 2652 doi: 10.1021/acs.accounts.7b00402
-
[4]
Zhu Ziyi(朱子翼), Li Yongtai(黎永泰), Dong Peng(董鹏), Zeng Xiaoyuan(曾晓苑), Xu Bin(许斌), Hao Tao(郝涛),Li Xue(李雪), Zhang Yingjie(张英杰). Chemical Industry and Engineering Progress(化工进展), 2019, 38(10): 4693 − 4704
-
[5]
Gao L, Xun S, Vukmirovic N, Song X, Olalde-Velasco P, Zheng H, Battaglia V S, Wang L, Yang W. Adv Mater, 2011, 23(40): 4679 − 4683 doi: 10.1002/adma.201102421
-
[6]
Mohajir B-E E, Nicole H. Polymer, 2001, 42(13): 5661 − 5667 doi: 10.1016/S0032-3861(01)00064-7
-
[7]
Zhao Shihuai(赵世怀), Zhang Cuicui(张翠翠), Yang Zibo(杨紫博), Zhang Xuping(张旭平), Guo Yunlu(郭云露). New Chemical Materials(化工新型材料), 2018, 548(5): 66 − 69
-
[8]
Maleki H, Deng G, Kerzhner-Haller I, Anani A, Howard J N. J Electrochem Soc, 2000, 147(12): 4470 − 4775 doi: 10.1149/1.1394088
-
[9]
Yoo M, Frank C W, Mori S, Yamaguchi S. Polymer, 2003, 44(15): 4197 − 4204 doi: 10.1016/S0032-3861(03)00364-1
-
[10]
Miyamoto Y, Ren Weicheng(任伟成). Organo-fluorine Industry(有机氟工业), 1998, (4): 40 − 45
-
[11]
Zhang Cuifen(张翠芬), Gao Peng(高鹏), Zeng Shihua(曾石华), Chen Ling(陈玲). Chinese Journal of Power Sources (电源技术), 2002, 26(1): 201 − 202; 254
-
[12]
Choi N S, Lee Y G, Park J K. J Power Sources, 2002, 112(1): 61 − 66 doi: 10.1016/S0378-7753(02)00337-3
-
[13]
Shim J, Kostecki R, Richardson T, Song X, Striebel K A. J Power Sources, 2002, 112(1): 222 − 230 doi: 10.1016/S0378-7753(02)00363-4
-
[14]
Fang X Z, Li Q X, Wang Z, Yang Z H, Gao L X, Ding M X. J Polym Sci Pol Chem, 2004, 42(9): 2130 − 2144 doi: 10.1002/pola.20069
-
[15]
Choi H, Chung I S, Hong K, Park C E, Kim S Y. Polymer, 2004, 49(11): 2644 − 2649
-
[16]
Ding Y, Hou H, Zhao Y, Zhu Z, Hao F. Prog Polym Sci, 2016, 61: 67 − 103 doi: 10.1016/j.progpolymsci.2016.06.006
-
[17]
Liaw D J, Huang C C, Chen W H. Polymer, 2006, 47(7): 2337 − 2348 doi: 10.1016/j.polymer.2006.01.028
-
[18]
Ma P C, Hou Y. Chem Res Chinese U, 2013, 29(2): 396 − 400 doi: 10.1007/s40242-013-2160-5
-
[19]
Fan Zhenguo(范振国), Chen Wenxin(陈文欣), Wei Shiyang(魏世洋), Liu Teng(刘腾), Liu Siwei(刘四委),Chi Zhenguo(池振国), Zhang Yi(张艺), Xu Jiarui(许家瑞). Acta Polymerica Sinica(高分子学报), 2019, 50(2): 179 − 188 doi: 10.11777/j.issn1000-3304.2018.18183
-
[20]
Ziyu L, Kaichang K, Chen H, Zhang Y, Yiqun W, Longhai Z. Eng Plast Appl, 2015, 42(5): 141 − 144
-
[21]
Kausar A. Polym-Plast Technol, 2017, 56(13): 1375 − 1390 doi: 10.1080/03602559.2016.1275688
-
[22]
Gouzman I, Grossman E, Verker R, Atar N, Bolker A, Eliaz N. Adv Mater, 2019, 31(18): 1807738 doi: 10.1002/adma.201807738
-
[23]
Zhao Q, Cheng M, Xu F, He H. CHN patent, H01m, CN109841795A. 2019-05-23
-
[24]
Oh I, Cho J, Kim K, Ko J, Cheong H, Yoon Y S, Jung H M. Energies, 2018, 11(11): 3154 − 316 doi: 10.3390/en11113154
-
[25]
Qian G, Wang L, Shang Y, He X, Tang S, Liu M, Li T, Zhang G, Wang J. Electrochim Acta, 2016, 187: 113 − 118 doi: 10.1016/j.electacta.2015.11.019
-
[26]
Pham H Q, Kim G, Jung H M, Song S W. Adv Funct Mater, 2018, 28(2): 1704690 doi: 10.1002/adfm.201704690
-
[27]
Fang R, Zhao S, Sun Z, Wang D W, Cheng H M, Li F. Adv Mater, 2017, 29: 1606823 doi: 10.1002/adma.201606823
-
[28]
Manthiram A, Fu Y, Chung S H, Zu C, Su Y S. Chem Rev, 2014, 114(23): 11751 − 11787 doi: 10.1021/cr500062v
-
[29]
Zhang G, Zhang Z W, Peng H J, Huang J Q, Zhang Q. Small Methods, 2017, 1: 1700134 doi: 10.1002/smtd.201700134
-
[30]
Yuan H, Huang J Q, Peng H J, Titiric M M, Xiang R, Chen R, Liu Q, Zhang Q. Adv Energy Mater, 2018, 8(31): 1802107 doi: 10.1002/aenm.201802107
-
[31]
Milroy C, Manthiram A. Adv Mater, 2016, 28(44): 9744 − 9751 doi: 10.1002/adma.201601665
-
[32]
Wang Z, Chen Y, Battaglia V, Liu G. J Mater Res, 2014, 29(9): 1027 − 1033 doi: 10.1557/jmr.2014.85
-
[33]
Ai G, Dai Y, Ye Y, Mao W, Wang Z, Zhao H, Chen Y, Zhu J, Fu Y, BattagliaV. Nano Energy, 2015, 16: 28 − 37 doi: 10.1016/j.nanoen.2015.05.036
-
[34]
Takyya N, Watari J, Suzuki S. China patent, H01m, CN108432005A. 2018-08-21
-
[35]
Cai Z P, Liang Y, Li W S, Xing L D, Liao Y H. J Power Sources, 2009, 189(1): 547 − 551 doi: 10.1016/j.jpowsour.2008.10.040
-
[36]
Zhou Xiaoqian(周晓谦). New Chemical Materials(化工新型材料), 2013, 41(3): 16 − 33
-
[37]
Zhang Z, Zeng T, Qu C, Lu H, Jia M, Lai Y, Li J. Electrochim Acta, 2012, 80: 440 − 444 doi: 10.1016/j.electacta.2012.07.054
-
[38]
Lee J H, Choi Y M, Paik U, Park J G. J Electroceram, 2006, 17(2-4): 657 − 660 doi: 10.1007/s10832-006-8975-4
-
[39]
Guerfi A, Kaneko M, Petitclerc M, Mori M, Zaghib K. J Power Sources, 2009, 163(2): 1047 − 1052
-
[40]
Guo J, Wang C. Chem Commun, 2010, 46(9): 1428 − 1430 doi: 10.1039/b918727h
-
[41]
He M, Yuan L X, Zhang W X, Hu X L, Huang Y H. J Phys Chem C, 2011, 115(31): 15703 − 15709 doi: 10.1021/jp2043416
-
[42]
Walu S, Barchasz C, Bouchet R, Martin J F, Lepretre J C, Alloin F. Electrochim Acta, 2016, 210: 492 doi: 10.1016/j.electacta.2016.05.130
-
[43]
Dominko R, Gaberscek M, Drofenik J, Bele M, Pejovnik S, Jamnik J. J Power Sources, 2003, 119-121: 770 − 773 doi: 10.1016/S0378-7753(03)00250-7
-
[44]
Ma Y, Chen K, Ma J, Xu G, Dong S, Chen B, Li J, Chen Z, Zhou X, Cui G. Energy Environ Sci, 2019, 12(1): 273 − 280 doi: 10.1039/C8EE02555J
-
[45]
Yasushi U, Shigeichi F, Moto H, Yuji K. China patent, H01m, CN107615533A. 2018-08-21
-
[1]
-
Figure 4 (a) Cyclic performance of PF@NCM and PI@NCM batteries; (b) The 1st and 500th charge and discharge cycles of PF@NCM and PI@NCM batteries (Reprinted with permission from Ref.[25]; Copyright (2016) Elsevier) (The online version is colorful.)
Figure 6 Scanning electron microscope (SEM) and transmission electron microscope (TEM) images of the cathode layer composites of FeS2/PIS: (a, c) After formation of the cathode composites at 250 °C; (b, d) After 1 h treatment at 450 °C; SEM images of pellet-type FeS2: (e) After formation of the cathode; (f) After 1 h treatment at 450 °C (Reprinted with permission from Ref.[24]; Copyright (2018) MDPI)
Figure 7 (a, a') Particle morphology changes of PVDF-LMNC cathode before and after 100 cycles; (b, b') FPI-LMNC cathode before and after 100 cycles; (a", b") Schematic illustration of the changes in their particle morphology and surface state, respectively (Reprinted with permission from Ref.[26]; Copyright (2017) John Wiley and Sons)
Figure 8 (a) Cycling performance and (b) Coulombic efficiency of PVdF-LMNC//graphite and FPI-LMNC//graphite full-cells (Reprinted with permission from Ref.[26]; Copyright (2017) John Wiley and Sons)
Figure 9 (a) Chemical structures of PFM, PEDOT, PVP, and PVDF binders; (b) Cycling performance and self-discharge performance of sulfur cathodes fabricated with different binders at C/10 (Reprinted with permission from Ref.[30]; Copyright (2018) John Wiley and Sons)
Figure 10 (a) Discharge cycle performances of LiFePO4 cathodes with PAA and PVDF binder at the current density of 175 mA g−1 between 2.5 and 4.2 V at 25 °C; (b) The 5th charge-discharge profiles of LiFePO4 cathodes with PAA and PVDF binder at the current density of 175 mA g−1 between 2.5 and 4.2 V at 25 °C (Reprinted with permission from Ref.[37]; Copyright (2012) Elsevier) (The online version is colorful.)
Figure 11 Nyquist plots of the LiFePO4/Li half cells (a) made with PAA and (b) made with PVDF after different cycle numbers (Reprinted with permission from Ref.[37]; Copyright (2012) Elsevier) (The online version is colorful.)
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 679
- 文章访问数: 14975
- HTML全文浏览量: 4399

 下载:
下载:

 下载:
下载:
 下载:
下载:

