 图式1
青蒿砜-氨基二硫代甲酸酯的合成
Scheme1.
Synthesis of artemisone-aminodithioformate
图式1
青蒿砜-氨基二硫代甲酸酯的合成
Scheme1.
Synthesis of artemisone-aminodithioformate

Citation: Tang Lei, Yang Maoxiang, Ma Fuli, Li Xueqiang, Wei Mengxue. Syntheses of Artemisone-aminodithioformate Hybrid Compounds[J]. Chemistry, 2017, 80(9): 884-887.

青蒿砜-氨基二硫代甲酸酯类化合物的合成
English
Syntheses of Artemisone-aminodithioformate Hybrid Compounds
-
Key words:
- Dihydroartemisinin
- / Synthesis
- / Artemisone
- / Aminodithioformate
-
青蒿素(Artemisinin)是我国科学家屠呦呦等[1]从特有中草药植物黄花蒿(Artemisia annual.)叶中提取出来的具有抗疟活性的倍半萜内酯类化合物。因其分子中具有独特的过氧桥结构,几乎对所有恶性疟原虫均有直接杀伤作用,因此成为世界上一种十分有效的抗疟药物[2]。后来我国科研工作者又相继研发了活性好、毒副作用低的双氢青蒿素(Dihydroartemisinin)、蒿甲醚(Artemether)、青蒿琥酯(Artesunate)、蒿乙醚(Arteether)等系列药物[3]。
目前对青蒿素类化合物的研究主要有以下两个方面:一是为了提高抗疟活性,在保留过氧桥键的基础上,引入一些亲水亲脂基团[4, 5]来增加其活性,已合成了几百种新型青蒿素类衍生物;二是针对已有青蒿素衍生物进行其他生理活性方面的研究[6~11],并已发现,青蒿素类衍生物还具有抗孕、抗肿瘤、抗吸血、提高免疫力和抗心律失常等多种药理活性[12]。青蒿素及其衍生物虽然在临床上应用多年,但仍存在油溶性和水溶性不佳、对热不稳定,易受湿、热和还原性物质的影响而分解以及临床复发率高等缺点,使其应用受到限制[13~16]。
在有机合成中,氨基硫代甲酸酯类衍生物是一类含硫且结构特殊的重要有机合成中间体,经常被用于合成各种杂环类化合物,在药物合成方面,氨基硫代甲酸酯类衍生物也被用于抗菌、抗氧化、抗病毒等药物的研发中。在农业方面,氨基硫代甲酸酯类衍生物是除草剂、杀虫剂等农药的有效成分之一[17],可以用于防治70余种农作物的相关病原体,病原体数目可达400多种。
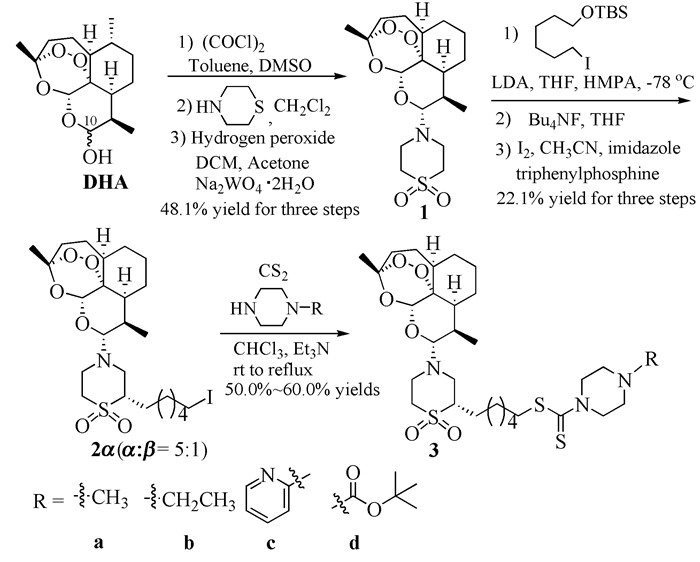
基于以上情况,我们希望以双氢青蒿素为原料,经一系列反应得到青蒿砜衍生物,然后与二硫化碳及哌嗪衍生物进行嫁接,从而合成含青蒿砜的氨基二硫代甲酸酯。其合成路线如图式1所示。
1 实验部分
1.1 仪器与试剂
Bruker Avance 400 MHz核磁共振谱仪(TMS为内标,CDCl3为溶剂);API QSTAR Pulsar飞行时间高分辨质谱仪(ESI源上测定);日本岛津FTIR-8400S型红外光谱仪。
双氢青蒿素(DHA,纯度99%,山西太远兴远生物科技有限公司);常规色谱柱硅胶(200~300目,青岛海洋化工厂);化合物1~2均按照文献方法[18]制备。其余所用试剂均为分析纯。
1.2 化合物的合成
1.2.1 青蒿砜1的合成
室温下,在充有氮气的100mL三口圆底烧瓶中,依次加入25.0mL绝对无水甲苯和1.0g(3.5mmo1) 双氢青蒿素,逐滴加入25μL(22.5mg) DMSO,搅拌至其全部溶解,注入0.33mL(3.5mmol)草酰氯,搅拌0.5h后,加入到溶有1.41g(14mmol)硫代吗啉的绝对无水二氯甲烷溶液中,室温搅拌反应,TLC监测至反应结束。加入饱和Na2CO3溶液,用乙酸乙酯萃取,饱和食盐水洗涤,有机相用无水MgSO4干燥,过滤,减压浓缩,得双氢青蒿素-10-硫代吗啉粗品670mg。
将670mg的双氢青蒿素-10-硫代吗啉溶于15.0mL的丙酮中,加入50mg(0.15mmol)的二水合钨酸钠,缓慢滴加0.83mL(8.14mmol)双氧水,55℃下回流5h,TLC跟踪至反应结束,先减压除去丙酮,再加入15mL饱和Na2S2O3溶液,用乙酸乙酯萃取,饱和食盐水洗涤,有机相用无水MgSO4干燥,过滤,减压浓缩,得粗品。粗品进行硅胶柱层析纯化(洗脱剂:石油醚/乙酸乙酯,体积比10:1),得白色固体化合物1(481mg,1.24mmol),以双氢青蒿素为起始物三步总产率为48.1%,熔点123.1~123.4℃(与文献数值一致[18]);1H NMR (400MHz,CDCl3)δ:5.27(s,1H),4.26(d,J=10.4Hz,H),3.43~3.47(m,2H),3.30~3.36(m,2H),3.10(s,4H),2.43~2.56(m,1H),2.23~2.31(m,1H),1.96~1.97(m,1H),1.74~1.82(m,1H),1.66~1.72(m,2H),1.64~1.67(m,1H),1.44(s,3H),1.29~1.38(m,1H),1.11~1.22(m,3H),0.96~0.99(m,1H),0.91(d,J=6Hz,3H),0.78(d,J=7.2Hz,3H)。
1.2.2 青蒿砜-碘代物2α的合成
氩气保护、-78℃条件下,向100mL圆底烧瓶中加入25mL THF、0.2mL (1.875mmol)二异丙胺和1.2mL(1.61mmol)正丁基锂,搅拌反应1h后,缓慢加入481mg(1.24mmol)化合物1,继续反应1h后,加入508mg(1.49mmol)TBS保护的6-碘-1-己醇、0.5mL的HMPA,反应体系在-78℃下继续反应3h后,缓慢升至室温,继续反应10h,TLC跟踪至反应结束,加入饱和NH4Cl溶液,用乙醚萃取,饱和食盐水洗涤,有机相用无水MgSO4干燥,过滤,减压浓缩,得青蒿砜烷基氧硅醚产物粗品228mg。
将228mg青蒿砜烷基化产物粗品溶于10mL的THF中,加入0.501g(1.93mmol)Bu4NF,室温下反应10h,TLC跟踪反应,反应结束后,加入蒸馏水,用乙酸乙酯萃取,饱和食盐水洗涤,有机相用无水MgSO4干燥,过滤,减压浓缩,得青蒿砜-羟基化合物粗品169mg。
将169mg青蒿砜-羟基化合物溶于10mL乙腈-乙醚体积比2:3) 溶液中,依次加入115.5mg(0.439mmol)三苯基磷和68.7mg(1.01mmol)咪唑,最后分批加入344mg(1.86mmol)碘单质,室温下反应3h,TLC跟踪至反应结束,加入30mL(1mol/L)NaHSO3溶液,用乙酸乙酯萃取,饱和食盐水洗涤,有机相用无水MgSO4干燥,过滤,减压浓缩,得粗品。粗品进行硅胶柱层析纯化,(洗脱剂:石油醚/乙酸乙酯,体积比6:1),得白色固体化合物2α(137mg,0.275mmol),以青蒿砜1为起始物三步反应总产率为22.1%;1H NMR(400MHz,CDCl3) δ:5.29(s,1H),4.22(d,J=10.4Hz,1H),3.64(t,J=6.5Hz,2H),3.32~3.48(m,5H),2.92(d,J=11.6Hz,1H),2.54~2.57(m,1H),2.30~2.37(m,1H),1.99~2.11(m,2H),1.87~1.91(m,1H),1.71~1.74(m,2H),1.49~1.58(m,6H),1.31~1.42(m,11H),0.99~1.13(m,1H),0.96(d,J=6.1Hz,3H),0.82(d,J=7.1Hz,3H)。
1.2.3 化合物3a~3d的合成通法
室温下,向圆底烧瓶中依次加入0.06mmol不同结构的哌嗪类化合物、1mL二硫化碳、1mL无水氯仿以及4μL(0.03mmol)三乙胺,搅拌3min后,加入0.02g(0.03mmol)青蒿砜-碘代物2α,加热升温至回流,反应3h,TLC跟踪至反应结束。用乙酸乙酯萃取,合并萃取液,用无水MgSO4干燥,旋除溶剂后经硅胶柱层析(洗脱剂:二氯甲烷/甲醇,体积比15:1) 纯化得3a~3d。
3a:黄色液体,收率60.0%,[α]D20:+140 (c 0.50,CH2Cl2);1H NMR (400MHz,CDCl3) δ:5.29(s,J=5.1Hz,1H),4.36(s,2H),4.18(d,J=10.2Hz,1H),3.97(s,2H),3.48(d,J=12.7Hz,1H),3.42~3.34(m,2H),3.34~3.26(t,4H),3.11~2.96(t,1H),2.87(d,J=13.4Hz,1H),2.60~2.46(m,5H),2.39~2.31(m,4H),2.07~1.97(m,2H),1.91~1.83(dd,1H),1.76~1.67(t,4H),1.62~1.55(t,1H),1.49~1.42(m,4H),1.37(m,J=9.2Hz,6H),1.25(t,J=5.5Hz,3H),0.95(d,J=6.2Hz,3H),0.80(d,J=8.2Hz,3H);13C NMR(101MHz,CDCl3) δ:197.3,104.4,91.8,90.9,80.2,60.7,54.2,53.3,51.3,45.6,45.4,37.2,36.9,36.1,34.1,29.5,29.2,28.9,28.8,28.3,28.3,25.8,24.6,23.2,22.5,21.4,20.1,13.9;IR(KBr) ν/cm-1:2940,2844,1686,1467,1375,1258,1100,1014,734;HRMS m/z:C31H53N3NaO6S,理论值682.2982,实测值682.2989[M+Na]+。
3b:黄色液体,收率55.0%,[α]D20:+100 (c 0.50,CH2Cl2);1H NMR (400MHz,CDCl3)δ:5.27(s,J=5.1Hz,1H),4.35(s,2H),4.16(d,J=10.2Hz,1H),3.95(s,2H),3.71~3.57(m,1H),3.46(d,J=7.0Hz,1H),3.38~3.24(m,5H),3.10~2.99(t,1H),2.85(d,J=13.4Hz,1H),2.67~2.39(m,7H),2.39~2.27(t,1H),2.03~1.95(m,2H),1.90~1.80(m,1H),1.73~1.65(m,4H),1.60~1.51(m,3H),1.45~1.39(m,4H),1.36(m,4H),1.23(t,J=8.6Hz,5H),1.13~1.08(m,3H),0.93(d,J=6.2Hz,3H),0.77(d,J=7.1Hz,3H),1.13~1.08(m,3H),0.93(d,3H),0.77 (d,3H);13C NMR(101MHz,CDCl3) δ:197.6,104.3,92.1,91.2,80.5,60.1,52.2,51.9,51.5,48.7,45.7,45.5,37.5,37.1,36.3,34.2,29.7,29.2,29.1,28.4,28.6,28.4,26.5,25.9,23.4,22.7,22.5,22.5,20.9,13.9;IR(KBr) ν/cm-1:2925,2848,1674,1478,1410,1379,1276,1121,1008,743;HRMS m/z:C32H55N3NaO6S3,理论值696.3140,实测值696.3145 [M+Na]+。
3c:黄色液体,收率56.5%,[а]D20:+233 (c 0.50,CH2Cl2);1H NMR(400MHz,CDCl3)δ:8.19(dd,J=4.8、1.3Hz,1H),7.51(m,J=8.8、6.5、1.9Hz,1H),6.72~6.57(m,2H),5.28(s,J=5.0Hz,1H),4.44(m,J=16.7、7.5Hz,2H),4.16(d,J=10.2Hz,1H),3.82~3.57(m,5H),3.42~3.20(m,4H),3.11~2.95(m,1H),2.86(d,J=13.4Hz,1H),2.63~2.50(m,1H),2.00(m,J=9.7,6.3Hz,1H),1.91~1.80(m,1H),1.71(m,J=13.7,7.0Hz,3H),1.58~1.49(m,3H),1.49~1.31(m,8H),1.24(m,J=11.3、5.2Hz,2H),0.96(dd,J=19.0、4.8Hz,2H),0.77(d,J=7.1Hz,2H);13C NMR(101MHz,CDCl3)δ:197.8,158.7,148.2,148.2,137.9,137.9,114.3,114.1,107.1,107.1,104.4,92.1,91.3,80.3,61.0,51.6,45.8,44.7,37.6,36.3,34.3,29.3,29.2,28.7,28.6,26.7,26.1,24.9,23.6,21.8,20.4,13.7;IR(KBr) ν/cm-1:2933,2846,1734,1675,1588,1559,1472,1419,1309,1262,1221,1105,1023,988,918,755;HRMS m/z:理论值C35H54N4NaO6S3,745.3098,实测值745.3085 [M+Na]+。
3d:黄色液体,收率60.0%,[α]D20:+250(c 0.50,CH2Cl2);1H NMR(400MHz,CDCl3)δ:5.28~5.20(s,1H),4.13(d,J=10.2Hz,1H),3.54~3.44(m,4H),3.35~3.19(m,4H),3.04~2.93(m,1H),2.83(d,J=13.4Hz,1H),2.58~2.45(m,1H),2.30(m,J=14.1,3.9Hz,1H),1.97(m,J=14.5、4.8Hz,2H),1.85~1.78(m,1H),1.66(m,J=14.9、7.6Hz,3H),1.57~1.47(m,2H),1.46~1.40(m,10H),1.32(d,J=10.8Hz,5H),1.21(m,J=15.8、5.4Hz,2H),0.92(t,J=10.0Hz,3H),0.75(t,J=8.1Hz,3H);13C NMR(101MHz,CDCl3)δ:198.2,145.7,119.3,104.5,92.2,91.5,80.8,80.4,61.1,51.7,49.3,45.8,37.6,37.3,36.4,34.4,29.3,28.7,28.7,28.6,26.7,26.2,25.1,23.6,21.8,20.5,13.7;IR(KBr) ν/cm-1:2933,2864,1698,1448,1402,1268,1215,1157,1111,1046,1005,936,738;HRMS m/z:C35H59N3NaO8S3,理论值768.3346,实测值768.3356 [M+Na]+。
2 结果与讨论
最近几年来,在碱催化下卤代烃、CS2和二级胺合成氨基二硫代甲酸酯的反应已被报道,但底物卤代烃的结构常为脂肪卤代烃,很少有其他复杂环状的卤代烃化合物参与反应的报道。为了进一步探索氨基二硫代甲酸酯衍生物的合成及相关活性,本文利用青蒿砜类衍生化的卤代烃代替普通脂肪卤代烃,成功合成出了含青蒿砜骨架的氨基二硫代甲酸酯类化合物3。实验证明含青蒿砜骨架的卤代烃2α在与胺、二硫化碳的三组分反应中,青蒿砜中的过氧桥在有还原性的二硫化碳存在下并没有断裂;该三组分体系的反应平顺,在氯仿为溶剂的体系中,回流3h就可反应完全。青蒿砜-氨基二硫代甲酸酯类化合物3的生物活性还在进一步研究之中。
-
-
[1]
屠呦呦. 青蒿及青蒿素类药物. 北京: 化学工业出版社, 2009: 1~4.
-
[2]
L H Miller, X Z Su. Cell, 2011, 146(6):855~858. doi: 10.1016/j.cell.2011.08.024
-
[3]
杨涵, 田攀, 余明莲等. 2009, 9(19): 3785~3787. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=swcx200919059&dbname=CJFD&dbcode=CJFQ
-
[4]
屠呦呦. 中国药学杂志, 1979, 14(2): 49~53.
-
[5]
J N Lisgarten, B S Potter, C Bantuzeko et al. J. Chem. Crystallogr., 1998, 28(7):539~543. doi: 10.1023/a:1015696306812
-
[6]
曹培国, 王肇炎. 肿瘤防治杂志, 2004, 11(6): 666~668. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_qlzlzz200406036
-
[7]
李世辉, 潘岐. 中成药, 2007, 28(4): 561~562. http://d.wanfangdata.com.cn/Periodical/zhongcy200704029
-
[8]
龚峻梅, 杜庆锋, 刘晓力. 国际肿瘤学杂志, 2007, 34(2): 101~104. http://www.yydbzz.com/qikan/Cpaper/zhaiyao.asp?bsid=16324
-
[9]
郭燕, 王俊, 陈正堂. 中国临床药理学与治疗学, 2006, 11(6): 615~620. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=ylzl200606004&dbname=CJFD&dbcode=CJFQ
-
[10]
李颖, 李英. 临床血液学, 2005, 18(5): 287~289. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=lcxz200505011&dbname=CJFD&dbcode=CJFQ
-
[11]
贺小青, 方鹏飞. 医药导报, 2006, 25(6): 528~530. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yydb200606017&dbname=CJFD&dbcode=CJFQ
-
[12]
a) H Chen, B Sun, S Pan et al. Anticancer-Drugs, 2009, 20(2):131~140; (b) T Chen, M Li, R Zhang et al. J. Cell. Mol. Med., 2009, 13(7):1358~1370; (c) J Hou, D Wang, R Zhang et al. Clin. Cancer Res., 2008, 14(17):5519~5530; (d) H J Zhou, J L Zhang, A Li et al. Cancer Chemoth. Pharm., 2010, 66(1):21~29; (e) S J Wang, Y Gao, H Chen et al. Cancer. Lett., 2010, 293(1):99~108; (f) T Efferth. Planta Med., 2007, 73(4):299~309.
-
[13]
C S Lai, N K Nair, S M Mansor et al. J. Chromatogr. B, 2007, 857(2):308~314. doi: 10.1016/j.jchromb.2007.07.037
-
[14]
张东, 杨岚, 杨立新等. 药学学报, 2006, 42(9): 978~981. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yxxb200709012&dbname=CJFD&dbcode=CJFQ
-
[15]
H Wu, K D Moeller. Org. Lett., 2007, 9(22):4599~4602. doi: 10.1021/ol702118n
-
[16]
T Efferth, M Volm. In Vivo, 2005, 19(1):225~232. http://www.ncbi.nlm.nih.gov/pubmed/15796179
-
[17]
王家颖, 王丹红, 卢声宇等. 中国食品卫生杂志, 2009, 21(6): 501~504. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zspz200906008&dbname=CJFD&dbcode=CJFQ
-
[18]
魏梦雪, 徐建, 张和等. 有机化学, 2015, 35(5): 1097~1103. doi: 10.6023/cjoc201409039
-
[1]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:
 下载:
下载:

