 图1
基于新型磁性适配体探针的抗生素荧光检测[10]
Figure1.
Fluorescence assay of antibiotics based on a novel magnetic aptamer probe[10]
图1
基于新型磁性适配体探针的抗生素荧光检测[10]
Figure1.
Fluorescence assay of antibiotics based on a novel magnetic aptamer probe[10]

Citation: Nian Yujiao, Kong Weijun, Zhao Xue, Yang Shihai, Yang Meihua. Application Progress of Aptamers in Targeted Specific Detection[J]. Chemistry, 2017, 80(9): 819-828.

适配体在靶向特异性检测中的最新应用进展
English
Application Progress of Aptamers in Targeted Specific Detection
-
Key words:
- Aptamers
- / Specific recognition
- / Sensitive and rapid detection
-
指数富集配基系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX)是一种从大容量寡核苷酸文库中经反复分离扩增步骤得到针对靶分子的高亲和力高特异性核酸配基——适配体(Aptamer,又称适配子、核酸适配体)的体外筛选技术[1, 2]。1990年,Tuerk等[3]和Ellington等[4]首次提出SELEX技术并筛选得到核酸适配体,此后,该技术得到广泛推广和应用。适配体的功能类似抗体,但具有抗体无法比拟的优势,如分子量较小、可化学合成、可体外筛选、易于标记和修饰、稳定性好、没有毒性、易制备且耐受性强、无批间差异等。它可通过折叠成一定的三维空间结构如发夹(hairpin)、假结(pseudoknot)、凸环(bulge)、G-四聚体(G-tetramer)等结合目标分子,实现高亲和力和高特异性结合,在许多方面体现了传统的免疫学(如抗体等)与化学分子识别无法比拟的优势。
由于筛选文库的容量巨大,理论上采用SELEX技术可筛选出与自然界几乎所有靶分子相结合的适配体。靶物质范围非常广泛,已由包括病毒、细菌和细胞等微生物及酶、蛋白质等大分子物质扩展到三磷酸腺苷(ATP)、金属离子、真菌毒素、农药等小分子物质,进而在分析检测、生物化学、食品安全、临床医疗等领域得到广泛应用。适配体在快速分析检测方面的应用研究几乎涉及所有的分析方法和技术[5, 6],如被用作探针开发基于核酸适配体构型变化的电化学传感器、生物传感器等。本文就适配体在金属离子、抗生素、农药残留、真菌毒素、蛋白质、微生物、细胞等目标物快速分析方面的应用进行综述,并对其发展前景进行展望,以期为后续研究提供参考和支持。
1 适配体在靶向检测中的应用
1.1 金属离子
金属离子能够维持生物体内的水和电解质平衡,是部分酶反应的重要组成部分。但重金属离子对环境存在潜在的危害,其在人体中累积达到一定程度,会造成慢性中毒。研究基于适配体靶向识别金属离子的检测技术,对环境保护、精准医疗等方面都具有极其重要的意义[7]。
Leung等[8]搭建了检测金属离子、蛋白质和其他小分子物质的无标记适配体荧光传感平台,在没有目标物质时,末端脱氧核苷酸转移酶(TdT)不能产生G四联体序列,平台发光较弱;TdT能够将完整的DNA适配体链延长为富含鸟嘌呤的随机序列,加入目标物质后,诱导DNA链折叠成G-四联体结构,使Ir(Ⅲ)配合物产生强烈的发光反应。有别于文献报道的检测技术,该平台不需要适配体的特定二级结构,从而大大简化了DNA的设计,已被成功用于K+等金属离子及凝血酶、蛋白质和小分子物质的快速检测。
Qian等[9]结合适配体及量子点、氧化石墨烯(GO)等纳米探针材料,建立了能够快速检测Pb2+的荧光纳米传感器。制备的适配体-石墨烯量子点探针具有良好的生物相容性且能抵抗荧光猝灭,能够实现对复杂基质中Pb2+的快速识别和检测,灵敏度高、重复性好、线性范围广、检测限低,对金属离子的痕量分析具有明显优势。
1.2 抗生素
抗生素(Antibiotics)是由微生物(包括细菌、真菌等)或高等动植物在生活过程中所产生的具有抗病原体或其他活性的一类次级代谢产物,能抑制微生物和其他细胞的增殖和发育,被广泛应用于医疗、食品工业等领域。但是,其在临床使用中常常显现诸多副作用,很可能导致人体内细菌对抗生素的耐药性,增加潜在的严重危害。抗生素检测方法主要包括微生物法、理化法、免疫法等,近年来,基于适配体的特异性识别技术已在抗生素的残留分析中得到广泛应用。
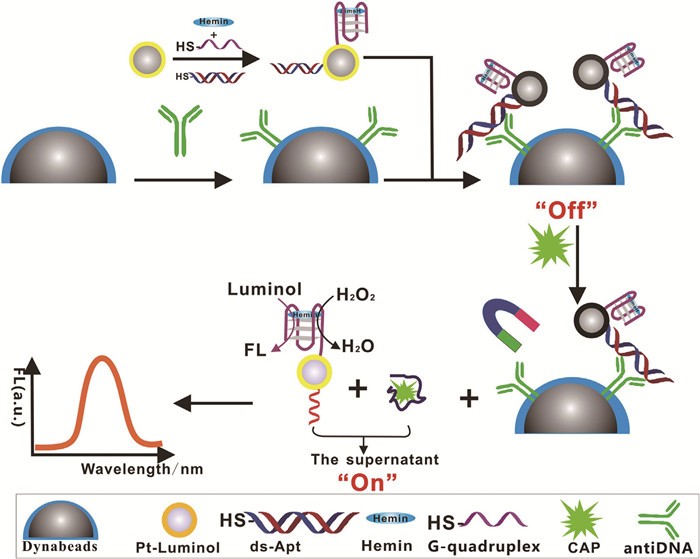
由于适配体可进行功能化修饰和标记[10],近年来多将适配体修饰荧光基团用于分析检测领域,但由于其易受荧光基团附近环境的影响[11],实际应用受到一定限制。Miao等[12]建立了一种基于新型磁性适配体探针(标记血红素/G-四联体适配体-铂-鲁米诺纳米复合材料)和“Switch-On”模式的荧光检测方法用于食品中氯霉素(CAP)残留的快速分析(图 1)。他们首先基于捕获磁珠和纳米示踪剂的免疫反应制备磁性适配体复合探针。当复合探针与CAP混合时,适配体优先与CAP反应以使适配体及其互补序列分解成单链DNA,磁分离后,纳米示踪剂被释放到上清液中。通过检测纳米示踪剂中的血红素/G-四联体和铂纳米颗粒催化鲁米诺-过氧化氢系统时释放的荧光强度,实现对CAP的定性定量分析。该方法对CAP的最低检测限为0.5ng/mL(S/N=3)。
 图1
基于新型磁性适配体探针的抗生素荧光检测[10]
Figure1.
Fluorescence assay of antibiotics based on a novel magnetic aptamer probe[10]
图1
基于新型磁性适配体探针的抗生素荧光检测[10]
Figure1.
Fluorescence assay of antibiotics based on a novel magnetic aptamer probe[10]
量子点作为极具应用前景的半导体材料[13],近年来同适配体结合被广泛应用于靶目标成分的快速检测中。Xue等[14]将适配体和量子点结合,建立了同时检测牛奶中链霉素(STR)、氯霉素(CHL)和四环素(TET)等多种抗生素残留的电化学检测方法。通过检测捕获探针上量子点酸溶解后产生的电化学信号强度,定性定量反映了目标抗生素的类型和含量,STR、CHL和TET的最低检出限分别可达到10、5和20 nmol/L。这项研究为以后同时检测更多种抗生素残留提供了方法和技术参考。
由于生物传感器分析速度快、专一性强、准确度高等优点[15, 16],近年来将适配体应用于传感器的研究也非常多。Wu等[17]建立了一种新型荧光生物传感器,以磁性纳米颗粒(MNPs)表面结合的适配体为识别元件,纳米上转换(UCNPs)进行信号标记检测食品中CAP的残留水平。在优化的测定条件下,线性范围为0.01~1 ng/mL,检测限低至0.01ng/mL。通过与酶联免疫吸附测定方法(ELISA)的对比试验,确证了所建立新方法对CAP检测的高灵敏度和选择性。该方法可推广用于其他食品中更多抗生素的生物传感器检测,拓展了适配体及基于适配体生物传感器的应用领域。
1.3 农药残留
长期以来,农药以其高效的防治病虫、除草和植物生长调节性能被用于农作物、药用植物的生长过程中。但是,大规模、高剂量的持续使用导致的农药残留已对环境和人类身体健康造成巨大的潜在威胁。为此,许多国家和组织已制定了多种农药的严格限量标准。为满足这些限量标准的要求,一系列农药残留的检测方法已被开发并得到推广应用,其中,基于适配体特异性识别和吸附的新型简便快捷、灵敏准确的检测体系的构建已成为人们关注的重点[18, 19]。本文列举了一些近年来常见的农药残留检测方法,如表 1所示。
检测物 方法 标记物 检测限 线性范围 文献 多农药残留 适配体标记量子点的turn-on型传感器 无标记 0.7nmol/L 0~150 nmol/L [26] 啶虫脒 基于三股螺旋分子开关的适配体荧光检测法 无标记 9.12nmol/L 100~1200 nmol/L [27] 啶虫脒 化学发光适配体传感器 纳米金 62pmol/L 8×10-10~6.3×10-7 mol/L [28] 氧化乐果 适配体包裹纳米金的比色检测法 纳米金 0.1μmol/L 0.1~10 μmol/L [29] 甲拌磷 适配体传感器比色法 纳米金 0.01nmol/L 0.01nmol/L~1.3 μmol/L [30] 3, 3′4, 4′-多氯联苯 电化学适配体生物传感器 二茂铁 0.01μg/L 0.2~200 μg/L [31] 马拉硫磷 适配体生物传感器 纳米金 0.06pmol/L 0.5~1000 pmol/L [32] 作为一种能够接受激发光产生荧光的半导体纳米晶粒,量子点生物荧光探针具有生物相容性好、荧光寿命长等传统荧光染料无法比拟的优势[20, 21],近年来常常被用来标记适配体应用于多种农药残留的快速检测中。Tang等[22]首次以量子点为信号指示,在DNA适配体的基础上建立了能够灵敏检测有机磷农药的毛细管电泳-激光诱导荧光法(CE-LIF)。该方法的灵敏度和准确性较好,对甲拌磷、丙溴磷、水胺硫磷和氧乐果的检出限分别为0.2、0.1、0.17和0.23 μmol/L。
Shi等[23]以金纳米颗粒聚集时产生的颜色变化为基础,研究了一种基于适配体的比色法用于土壤中啶虫脒的检测,并监测其自然降解过程。线性范围在75nmol/L至7.5μmol/L之间,检测限为5nmol/L。之后Tian等[24]研究缩短适配体序列对比色检测方法灵敏度的影响,发现去除结合区外侧翼区的核苷酸能够将啶虫脒比色检测法的灵敏度提高3.3倍。
Bai等[25]将有机磷农药的适配体吸附于纳米金粒子表面,以防止金纳米颗粒的聚集。当加入有机磷农药后,适配体与农药结合,纳米金粒子被脱离并聚集,颜色从红变到蓝紫色。该方法对河水中水胺硫磷的检测限为100ng/mL,对其他5种农药(毒死蜱、敌百虫、乙酰甲胺磷、甲胺磷、伏杀硫磷)的检测限为2000ng/mL,回收率为72%~135%,可满足大批量河水样品中有机磷农药的灵敏快速检测需求。
1.4 真菌毒素
真菌毒素是由产毒真菌产生的具有致癌、致畸、致突变及其他毒性作用的次级代谢产物,在食品、农作物、药用植物中痕量存在(10-9级或更低),所以对检测方法的灵敏度和准确性提出了较高要求。近年来,基于抗体和DNA/RNA适配体的新型检测技术,如生物传感器[33],以其较高的靶向特异性和灵敏度被用于真菌毒素的痕量检测中。相比于抗体,适配体对靶目标物质具有更高的亲和力和特异性,在真菌毒素检测中的应用和报道日趋增多。
试纸条具有制备简单、成本低、检测耗时短、可视化、不需昂贵仪器、便于携带和可用于现场大批量检测等优点,广泛应用于多种物质的分析检测。Zhou等[34]将基于竞争法原理建立的适配体试纸条应用于黄芪中赭曲霉毒素A(OTA)的检测,在优化的条件下,视觉检测限为1ng/mL,整个检测能够在15min内完成,9个批次黄芪样品中有1批被检测出OTA,与LC-MS/MS的检测结果一致。
适配体还被应用于真菌毒素检测时样品的前处理过程中。Yang等[35]将中药用涡旋固相辅助微提取后,经适配体亲和柱净化后用超高速液相色谱串联质谱法检测中药中OTA的含量,在优化条件下,方法的检测限为0.5~0.8 μg/kg,回收率83.54%~94.44%。此研究为快速、准确地靶向性监测复杂基质中OTA等真菌毒素提供了更好的方法选择和理论基础。
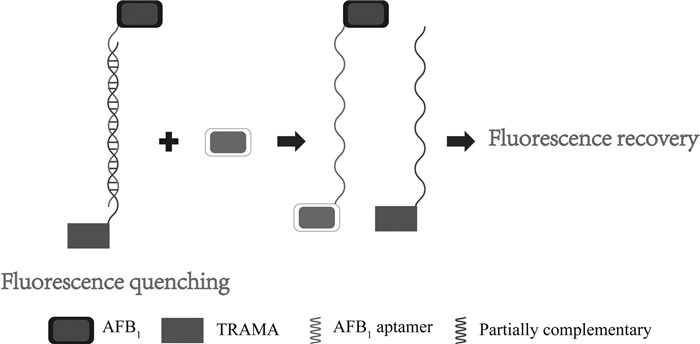
Lv等[36]建立了基于适配体的单壁碳纳米角(SWCNHs)传感器检测OTA含量的方法。当样品中不存在OTA时,羧基荧光素(FAM)修饰的适配体被吸附在SWCNH表面,在这种结构中,由于荧光共振能量转移(FRET),FAM的荧光发生猝灭。当样品中存在目标分子OTA时,OTA适配体形成反平行G-四联体结构靶向识别和包裹OTA,FAM的荧光复原。可利用复原的荧光强度不同对样品中的OTA进行定量测定。结果表明,该方法的检测限为17.2nmol/L,线性范围为20~500 nmol/L。在红酒基质中,荧光强度的复原程度与OTA含量的对数之间存在较好的相关性。Chu等[37]将适配体同量子点结合建立了一种快速有效检测OTA的方法。将三个硫代磷酸酯修饰的捕获适配体精确地附着到单个厚壳量子点上,制作成一种自组装适配体传感器。当OTA存在时,捕获适配体通过FRET系统适配体传感器的作用转化为可测量的信号,检测限低至0.5ng/mL,线性浓度范围为1~30 ng/mL。Chen等[38]建立了快速灵敏检测婴儿食品中黄曲霉毒素B1(AFB1)的适配体荧光传感器,原理见图 2。结果表明,在优化的条件下,方法灵敏度较好,检测限低至1.6ng/mL,线性范围5~100 ng/mL。该方法可扩展用于其他复杂基质中AFB1的痕量检测。
1.5 蛋白质
目前,蛋白质的检测主要包括常用的以抗体为识别物的免疫法及非标记方法。但是这些方法难以适应所有蛋白质的检测。近年来,基于适配体的传感器技术在蛋白质检测中已取得了较大进展。
Erdem等[39]基于磁性微球表面人活化蛋白C(Activated protein C,APC)与其DNA核酸适配体之间的相互作用构建了适配体传感器,结合石墨电极伏安法检测人体APC的含量。该方法简单、灵敏,特异性好,操作方便,检测结果准确可靠,对APC的检测限为2.35μg/mL,且与其他蛋白质和生物大分子,如补体蛋白(Potein C)、凝血酶(thrombin)、牛血清白蛋白等不存在交叉反应。
Scarano等[40]首次探索了基于适配体灵敏检测人类基质金属蛋白酶-9(MNP-9) 的压电生物传感器,在标准溶液中对MNP-9的检测限为100pg/mL,在未经处理的血清中检测限可达560pg/mL。
Chang等[41]使用未修饰的纳米金(AuNPs)将bDNA(分支链DNA信号放大技术)扩增应用到比色适配体传感器中,将两种双链底物DNA和两个单链辅助的DNA通过扩增反应形成一个编码的DNA树枝状纳米结构,被金纳米颗粒固定的DNA传感探针捕获,导致金纳米颗粒的释放和不稳定金纳米颗粒的产生,促进盐诱导的聚集。通过整合的bDNA级联反应和未修饰的金纳米颗粒的信号放大能力实现对多种蛋白质的高选择性和超灵敏(飞摩尔级)检测,对VEGF(血管内皮细胞生长因子)的检测限明显低于其他基于适配体的检测方法。
1.6 微生物
1.6.1 病毒
病毒主要由核酸和蛋白质外壳组成。传统的病毒学鉴定和分子诊断已为当今临床和科研提供了一些准确可靠的数据,得到了广泛的应用。但是,这些方法相对费时,劳动强度较大,而且灵敏度较低。随着现代科学技术的快速发展,特别是免疫学、生物化学、分子生物学的不断发展,新的诊断技术和分析方法已广泛用于各种病毒微生物的鉴别和检测中。其中基于适配体特异性识别的检测技术的发展,大大提高了鉴定灵敏度和检测的准确性,扩大了人类对疾病认识的广度和深度。
Tseng等[42]提出了在集成微流体系统自动使用夹心结构适配体测定甲型H1N1病毒的荧光检测新方法。相比于传统的病毒培养方法,这种以芯片为基础的微流体检测系统靶向性更强,分析速度更快(小于30min),检测限更低(提高到0.032血凝单元),灵敏度更高(比常规血清学诊断的灵敏度高约103倍)。
甲型流感病毒聚合酶PA亚基(PAN)是不同亚型流感病毒中高度保守性的一种,可通过阻止病毒感染细胞的任一阶段如吸附、复制等达到抑制病毒作用,显示了较强大的抗病毒应用潜能,已成为开发抗流感药物的理想目标。Yuan等[43]采用SELEX技术筛选完整PA蛋白或PAN域的DNA适配体,并对筛选出的适配体进行结合亲和力的测定和体外抑制核酸内切酶活性的评价,以及对甲型流感病毒的抗病毒效果。结果共筛选出3个PA和6个PAN适配体。3个PA适配体未表现出抑制核酸内切酶活性及抗病毒的效果,而6个PAN适配体中有4个具有抑制核酸内切酶活性的作用而表现出抗H5N1病毒的效果。而且,其中1个适配体在抗H1N1、H5N1、H7N7和H7N9流感病毒感染上表现出交叉保护作用,IC50为10nmol/L左右。该适配体在第5轮筛选中被确定,但超过10轮后消失,表明早期筛选对有效适配体的确定具有重要影响,这为筛选和开发有效的抗流感药物适配体提供了新思路。
流感病毒的表面血凝素蛋白(HA)结合宿主细胞膜上的唾液酸受体(glycan)能促进病毒感染的最初阶段。Li等[44]通过SELEX技术选择出两条特异结合甲型H1N1流感病毒HA蛋白的单链DNA(ssDNA)适配体。其中适配体1表现出干扰HA-glycan相互作用的能力,表明它显著抑制宿主细胞的病毒感染。这表明,分离出的单链DNA适配体可以通过适当方式制成抗病毒剂。
1.6.2 细菌
感染性疾病尤其是细菌感染的不及时诊断和治疗,已成为导致患者死亡的主要原因之一。常规病原菌的鉴定操作过程复杂,耗时长,不能满足临床上对感染性疾病早期诊断和及时治疗的需求。近年来,人们已将目光聚焦在基于适配体的病原菌检测新方法的开发上[45]。
常规的SELEX技术筛选适配体时需要纯化目标分子并固定到固体载体上。但是,从细胞中纯化的目标不总是可用,而且目标固定时可能会发生构象的改变。为了克服这些问题,Camille等[46]使用活细菌(嗜酸乳杆菌和化脓性链球菌)的细胞悬浮液作为靶标创新了SELEX技术,用于选择细胞表面分子特定的DNA适配体。结果发现,起始文库序列的多样性和反选能使SELEX技术更有效,且适配体的选择性和特异性更强,可筛选得到以较高亲和力结合化脓性链球菌细胞的适配体序列,表明基于细菌细胞的SELEX技术稳定性更好,结果更可靠,应用前景更广阔。
Yoo等[47]开发了基于适配体功能化的局域表面等离子体共振(LSPR)传感器,并用于不同种类细菌的灵敏检测。通过对探针浓度、适配体固定时间和细胞结合时间的优化和该生物传感器识别病原菌能力的分析,结果发现,所制备的适配体传感器对3种病原菌的检测限为均为30cfu。而且,该传感器可以高特异性地准确识别单个芯片上不同的靶细菌,灵敏度高,在感染性疾病的精准诊断方面具有较好的应用前景。
Wang等[48]构建了基于单链DNA(ssDNA)适配体和二氧化硅荧光纳米颗粒的生物探针,用于检测鼠伤寒沙门氏菌。他们将鼠伤寒沙门氏菌与特定的生物素标记的ssDNA适配体共同孵育,并通过链霉亲和素偶联二氧化硅荧光纳米颗粒制备荧光生物探针(SA-FSiNPs)。结果表明,所制备的SA-FSiNPs探针具有强的光稳定性,能应用于鼠伤寒沙门氏菌检测。通过大肠杆菌和枯草芽孢杆菌的对比试验,验证了该SA-FSiNPs探针对鼠伤寒沙门氏菌的特异性。在鸡肉样品中鼠伤寒沙门氏菌的应用结果表明,所建立的适配体纳米探针在病原体检测方面具有广泛的应用前景。
1.7 细胞
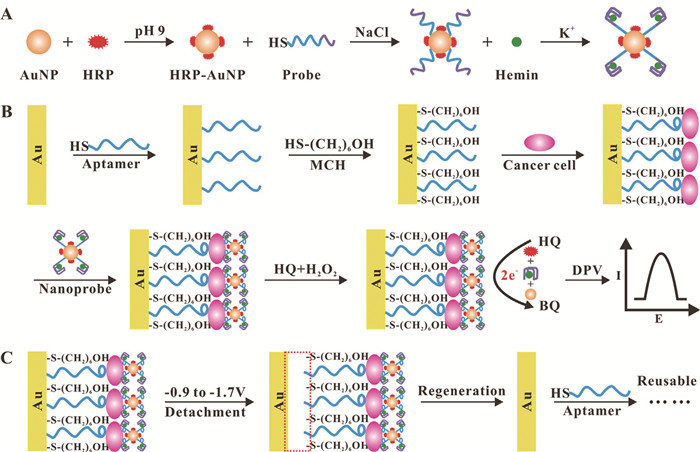
近年来,基于适配体的高灵敏分析技术已在细胞检测中取得了快速发展。Sun等[49]建立了双重识别和信号放大灵敏检测人肝癌细胞(HepG2) 的可重复组装和拆卸的电化学适配体细胞传感器(见图 3)。他们将高亲和力的硫醇化TLS11a适配体通过金-硫醇的相互作用共价偶联至金电极上,用来识别和捕获靶目标HepG2。同时,设计了G-四联体/氯化血红素/适配体和辣根过氧化物酶(HRP)修饰的纳米金(G-quadruplex/hemin/aptamer-AuNPs-HRP)探针,以实现HepG2的灵敏快速检测。结果表明,该适配体细胞传感器对HepG2细胞的检测限低至30cells/mL,线性范围为1×102~1×107 cells/mL,不仅灵敏度高,准确性好,而且金电极能重复使用,预示了适配体细胞传感器在癌症诊断中的应用潜力。
细胞间通讯连接是细胞-细胞串扰的一个重要途径。然而,超灵敏分子探针的缺乏使其形成机理和功能及干扰机制尚未被完全阐明。Zhang等[50]提出了一种由cell-SELEX技术筛选得到的抗耐阿霉素乳腺癌细胞系(MCF-7R)M17A2适配体特异识别的细胞间连接。这些连接具有不同的形态,但骨架组成均为肌动蛋白丝,不仅可以建立在MCF-7R细胞之间,也可以在共培养之后建立在MCF-7R和其他细胞之间。适配体M17A2作为新探针用于研究这种细胞间连接以及用于研究细胞间通信体现出巨大潜力。
MicroRNAs(miRNAs)是短链非编码RNA,能够有效调节多种基因的表达。越来越多的证据已表明miRNAs在肿瘤的发生和发展中的重要作用及在癌症治疗中的应用前景。然而,由于缺乏安全可靠的选择性靶向器官和组织限制了miRNAs的翻译及其应用。核酸适配体的靶向特异性和高亲和力可为miRNAs对目标肿瘤的选择性积累、细胞摄取、处理和功能目标基因沉默提供高效的传递工具,进一步拓展了适配体的应用范围[51]。
1.8 ATP
作为生物体化学能的主要载体,ATP在细胞代谢的调节中具有重要作用,为几乎每一个生物体的各种生化反应提供能量,已被用于评估由各种小分子药物和生物制剂诱导的细胞损伤、抑制和增殖。机体ATP水平的异常必然会导致各种疾病如心血管疾病的发生[52, 53]。因此,发展ATP的灵敏检测新方法(见表 2)对生物化学研究的发展和临床诊断具有重要意义。
Zhang等[54]开发了一种以抗ATP适配体-功能化的金纳米颗粒(AuNPs)作为感测元件的可视化检测小分子ATP的新型干试纸条生物传感器。该传感器不仅特异性和准确性高,而且检测成本低,操作简单方便。
Qiu等[55]以嵌入剂SYBR Green Ⅰ(SGI)为荧光探针,基于竞争原理检测ATP。其原理为,ATP适配体与其分段互补DNA连续杂交形成双链DNA多联体。当不存在ATP时,探针产生强烈的荧光信号;加入ATP后,适配体和ATP的结合导致多联体结构破坏,并释放SGI,荧光猝灭,从而实现ATP的定量检测。结果表明,基于适配体的检测方法对ATP的最低检测限为6.1μmol/L,检测浓度线性范围为0~5000 μmol/L,检测结果与金标法测定相吻合。该方法灵敏度高,操作简便,成本低,在细胞和其他系统中ATP的快速灵敏检测中具有广阔的应用前景。
Chen等[56]构建了能同时检测溶菌酶和ATP的适配体传感器。基于甲基紫(MV)和dsDNA电子相互作用,ATP适配体和溶菌酶适配体杂交获得双链DNA,通过共振光散射(RLS)技术检测溶菌酶和ATP的浓度。检测过程中,适配体传感器的工作方式类似“双向开关”,当待检目标(溶菌酶或ATP)“点击(click)”适配体时,双链DNA的相应侧链被打开,引起RLS信号的改变。这种改变同溶菌酶和ATP浓度呈正比。检测结果表明,该适配体传感器对ATP和溶菌酶的检出限可分别达到10-11mol/L和10-12mol/L,体现了基于适配体传感器的RLS检测技术在分析检测中的应用能力。
1.9 可卡因
可卡因是一种莨菪烷型生物碱,在临床治疗中多被用为局部麻醉剂,但其对身体各系统有不同程度的损害,尤其会导致肝细胞坏死。近年来,关于可卡因研究及其检测方法发展的报道(见表 3)也逐渐增多。
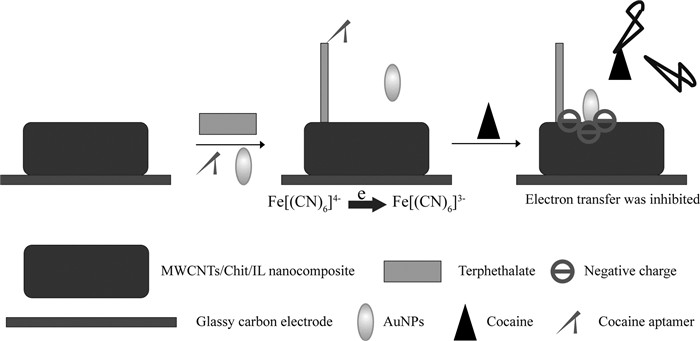
检测方法 标记物 检测限 线性范围 文献 基于化学发光检测技术结合介孔二氧化硅基控释系统的生物传感器 无标记 1.43μmol/L 5.0~60μmol/L [65] 电化学适配体生物传感器 无标记 2.5nmol/L 2.5~10nmol/L [66] 电化学传感 二茂铁 32pmol/L 0.1~20nmol/L [67] 荧光适配体传感器 无标记 5nmol/L 12~1300nmol/L [68] 适配体标记荧光法 FAM 0.1nmol/L 1~500nmol/L [69] 光电适配体传感器 无标记 10nmol/L 10-8~5×10-4mol/L [70] 荧光适配体传感器 无标记 56nmol/L 0.10~10μmol/L [71] 荧光适配体传感器 FAM 209pmol/L 0.5~20nmol/L [72] 发光“switch-on”适配体检测 无标记 30nmol/L 30~300nmol/L [73] 电化学适配体传感器 无标记 100pmol/L 1nmol/L~11μmol/L [74] 阻抗滴定传感器 无标记 50nmol/L 100nmol/L~1.0mmol/L [75] 基于适配体功能化的纳米金粒子(AuNPs)在多壁碳纳米管/离子液体/壳聚糖(MWCNTs/IL/Chit)纳米复合材料的构象改变为支撑平台,Roushani等[63]开发了灵敏检测可卡因的新型电化学适配体传感器,通过微分脉冲伏安法超灵敏检测人血清中可卡因的含量(图 4)。该传感器对可卡因的检测限可达100pmol/L,线性范围可达到11μmol/L,且其他镇痛药不干扰可卡因的特异检测。该研究为其他电化学适配体传感器的研制和应用及临床医学诊断提供了材料、技术和理论参考。
生物液体中可卡因的快速灵敏检测对预防非法药物的滥用具有重要指导意义。Tang等[64]开发了基于光纤倏逝波生物传感平台的两步结构转换适配体传感器检测人血液样本中可卡因的方法。荧光信号与可卡因浓度成正比,450s内即可完成检测,检测限为165.2nmol/L。该方法准确可靠,无需进行复杂的样品预处理即可用于复杂基质样本中可卡因等靶目标的灵敏快速检测。
2 适配体特异性的应用
采用SELEX技术可从特定的寡核苷酸库中通过多轮筛选,筛选出对靶物质亲和力最高、特异性最强的单链核苷酸[76]。将选择的随机寡核苷酸库同靶物质相结合,即形成ssDNA/ssRNA-靶物质复合物,然后将不能够同靶物质结合的ssDNA或ssRNA洗脱掉,分离出结合靶物质的ssDNA或ssRNA[77],以其为模板进行聚合酶链式反应(PCR)扩增,进行多轮筛选。通过多轮循环筛选,富集到靶物质的ssDNA或ssRNA不断增加,直到亲和力达到饱和。除去与靶物质不结合或低(中)亲和结合的核酸分子,分离出与靶分子高亲和性结合的适配体,且纯度随着筛选轮数的增加而提高。如果要筛选到RNA适配体,可在每轮筛选后增加反转录过程[78, 79]。将筛选出的高特异性适配体进行人工体外合成,用于靶物质的特异性识别、检测和其他应用[80]。
由于随机寡核苷酸库种类繁杂,筛选出的适配体结构多样,能够折叠成多种空间结构(如假节、发卡、凸环等),通过结构互补、氢键及静电作用等多种作用方式同靶物质高特异性结合。适配体的二级结构可区分结构相近的靶物质,识别其中的细小差别。因此表现出与靶物质结合的高度特异性[81]。
通过对适配体筛选过程的优化可提高其特异性。许蕊等[82]采用全菌消减SELEX技术筛选出大肠埃希菌O157:H7特异性适配体,通过荧光分光光度法和激光共聚焦显微镜法检测适配体与沙门菌、粪肠球菌大肠埃希菌O157:H7的结合能力判断该适配体的特异性。结果显示筛选到的适配体特异性很高,且该改良的SELEX技术能够筛选出未知靶分子的强特异性适配体。消减菌的加入减少了筛选的轮数,加快了筛选过程,并且提高了适配体的特异性,即使是与靶细菌种属关系相近、致病性质相似的细菌也不会与该适配体发生特异性结合[83]。
研究发现[84],氧化石墨烯(GO)的浓度可影响ATP适配体特异性,在一定程度上增加GO浓度能够提高适配体特异性,不仅为靶目标成分的特异性检测提供了新方法,也扩展了GO和适配体在生物传感器的应用范围,为适配体的筛选及提高适配体的特异性提供了思路。
但是,适配体一般与小分子物质的亲和力相对较低,发生非特异性结合的概率随之提高。例如,黄嘌呤的适配体也能同鸟嘌呤结合,识别辅酶A的适配体也可以结合AMP。然而,适配体与大分子物质则具有更高的亲和力,特异性更强,通常可避免非特异性结合[85, 86]。随着SELEX技术的不断发展和改良SELEX技术的应用,筛选出的适配体对靶物质的亲和力和特异性也会越来越高,展示其广阔的应用前景。
3 前景与展望
适配体凭借其高特异性和强亲和力等优势,自问世以来已经在多目标成分靶向检测、临床治疗以及细胞间通讯等领域取得了广泛的应用和发展。基于适配体发展起来的新型灵敏快速检测技术也逐渐增多,如在适配体上标记荧光物质,将修饰的适配体作为识别探针,基于适配体开发的光学、电化学、石英晶振传感器,适配体试纸条等。适配体生物传感器以其操作简单、特异性高、成本低并且可以实现野外快速检测等优点,已成为近年来多目标成分灵敏检测研究的重点,逐渐显示出其巨大的发展潜力和广阔的应用前景。但是,适配体在多目标成分快速分析和应用领域仍存在一些问题需要深入挖掘并解决。
(1) 研究和开发更简单快速准确的适配体筛选技术。传统的SELEX技术筛选过程比较繁琐,大多数适配体都要经过多轮筛选才能获得。而且,目前筛选得到的适配体序列并不一定适合所有基质中目标物质的靶向吸附和检测。随着研究的深入,近些年来一些新方法尤其组合技术逐渐被广泛应用,例如自动筛选技术、毛细管电泳-SELEX技术等。毛细管电泳筛选可以在30min内完成分离,减少了筛选轮数,分离成本低,但它在部分小分子物质适配体筛选中存在一些限制[87]。为了促进适配体在临床治疗和生物诊断等方面的应用,研究和开发更简单、快速、准确、可靠的适配体筛选技术势在必行。
(2) 在适配体上标记荧光物质时,还需考虑不同位点标记对适配体结合目标物的亲和力的影响。标记适配体的荧光基团主要有单荧光基团和双荧光基团,在适配体邻近碱基和靶分子作用位点上修饰荧光物质通常会导致适配体对目标物质亲和力的下降,将具有荧光特性的碱基类似物代替结合位点附近的碱基会显著降低其对亲和力的影响。但对位于适配体中间位置上标记荧光物质操作更困难一些。适配体对目标物结合亲和力的强度对实验的影响至关重要,因此在标记荧光物质时要特别注意其对亲和力的影响。
(3) 开发基于适配体探针对多种目标分析物的快速检测方法。由于适配体具有高度特异性,一次实验可检测的目标物质数量有限,不能较好满足实际检测的需求。开发基于适配体探针对多种目标分析物的快速检测方法必将成为适配体今后发展的一个重要方向。
(4) 开发适配体传感器所需的新型芯片和纳米复合材料。随着传感器的不断发展,新型适配体传感器也被逐渐开发并应用,由于许多纳米材料具有光学、电学、磁学等特性,常将其用于合成探针以用于适配体传感器中。常见的纳米材料有量子点、纳米金和单壁碳纳米管等。其中,量子点具有宽的激发波长范围和窄的发射波长范围的特点,被用于标记适配体组建传感器用于多种分析物的检测。但多数量子点含重金属铬,对人的健康存在潜在危害。因此,开发适合适配体传感器需求的灵敏度高、成本低、安全无毒的纳米复合材料具有重要意义。
(5) 推进无标记适配体生物传感器的研究及应用进程。一些修饰或标记的适配体会对适配体结合目标物的特异性及结合力产生影响,而且样品基质的复杂性也会对标记物质周围的化学环境产生干扰。因此,近年来无标记的适配体生物传感器已受到较多关注。
(6) 适配体传感器的发展尚需要考虑其再生问题。检测方法的再生也可提高检测效率、降低成本。适配体传感器以其快速、特异性好、低成本的特点已在多目标物快速检测中备受关注。然而,目前适配体传感器的可重复率较低,成本相对较高。对适配体进行再生处理,可能提高检测效率和传感器的利用率、降低成本,从而扩大其应用范围。
(7) 综合考虑适配体药物的安全性和有效性。随着SELEX筛选技术的逐渐成熟,具有高度特异性的适配体逐渐被筛选得到。在生物医疗领域,适配体能够甄别与肿瘤相关的潜在标志物,对癌症早期诊断有重要意义,也能够同治疗药物偶联特异性治疗癌症,提高治疗效率,同时,也作为诊断成像试剂在生物成像领域得到应用。近年来,部分适配体药物已被开发并得到应用。但是,核酸适配体易被肾脏过滤,降低其利用率。实际应用时,尚需综合考虑适配体药物的安全性和有效性,提高对疾病的预防和治疗效果。
总之,随着SELEX技术、纳米技术及其他分子生物学技术的快速发展和相互融合,基于适配体的靶向特异性检测技术将会在多目标成分的定性定量分析方面显示巨大的优越性,也将会在更为广阔的领域得到发展和应用。
-
-
[1]
吴崔晨, 胡佳, 邹远等. 化学进展, 2010, 22(8):1518~1530. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxjz201008002&dbname=CJFD&dbcode=CJFQ
-
[2]
J A Cruz-Aguado, G Penner. J. Agric. Food Chem., 2008, 56(22):10456~10461. doi: 10.1021/jf801957h
-
[3]
C Tuerk, L Gold. Science, 1990, 249(4968):505~510. doi: 10.1126/science.2200121
-
[4]
A D Ellington, J W Szostak. Nature, 1990, 346(6287):818~822. doi: 10.1038/346818a0
-
[5]
F Li, H Q Zhang, Z X Wang et al. Anal. Chem., 2014, 87(1):274~292.
-
[6]
H Q Zhang, F Li, B Dever et al. Chem. Rev., 2012, 113(4):2812~2841.
-
[7]
周晨. 吉林大学博士学位论文, 2015.
-
[8]
K H Leung, B Y He, C Yang et al. ACS Appl. Mater. Interf., 2015, 7(43):24046~24052. doi: 10.1021/acsami.5b08314
-
[9]
Z S Qian, X Y Shan, L J Chai et al. Biosens. Bioelectron., 2015, 68:225~231. doi: 10.1016/j.bios.2014.12.057
-
[10]
S N Hashim, A Tsuchiya, N Kamiya et al. Chem. Lett., 2015, 44(12):1670~1672. doi: 10.1246/cl.150794
-
[11]
A Yasmeen, F Du, Y Zhao et al. ACS Chem. Biol., 2016, 11(7):1945~1951. doi: 10.1021/acschembio.5b01081
-
[12]
Y B Miao, N Gan, H X Ren et al. Talanta, 2016, 147:296~301. doi: 10.1016/j.talanta.2015.10.005
-
[13]
Y Wang, N Gan, T H Li et al. Anal. Methods, 2016, 8(15):3006~3013. doi: 10.1039/C6AY00412A
-
[14]
J K Xue, J Liu, Wang C S et al. Anal. Methods, 2016, 8(9):1981~1988. doi: 10.1039/C5AY03136B
-
[15]
Y N Zheng, Y L Yuan, Y Q Chai et al. Biosens. Bioelectron., 2015, 66:585~589. doi: 10.1016/j.bios.2014.12.022
-
[16]
L Cui, J Wu, H X Ju. Biosens. Bioelectron., 2016, 79:861~865. doi: 10.1016/j.bios.2016.01.010
-
[17]
S J Wu, H Zhang, Z Shi et al. Food Control, 2015, 50:597~604. doi: 10.1016/j.foodcont.2014.10.003
-
[18]
郭佳佳. 吉林大学硕士学位论文, 2015.
-
[19]
朱赫, 纪明山. 中国农学通报, 2014, 30(4):242~250. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zntb201404044&dbname=CJFD&dbcode=CJFQ
-
[20]
H Kurt, M Yüce, B Hussain et al. Biosens. Bioelectron., 2016, 81:280~286. doi: 10.1016/j.bios.2016.03.005
-
[21]
Y B Miao, H X Ren, N Gan et al. Anal. Chim. Acta, 2016, 929:49~55. doi: 10.1016/j.aca.2016.04.060
-
[22]
T T Tang, J J Deng, M Zhang et al. Talanta, 2016, 146:55~61. doi: 10.1016/j.talanta.2015.08.023
-
[23]
H J Shi, G H Zhao, M C Liu et al. J. Hazard. Mater., 2013, 260:754~761. doi: 10.1016/j.jhazmat.2013.06.031
-
[24]
Y Tian, Y Wang, Z Sheng et al. Anal. Biochem., 2016, 513:87~92. doi: 10.1016/j.ab.2016.09.004
-
[25]
W H Bai, C Zhu, J C Liu et al. Environ. Toxicol. Chem., 2015, 34(10):2244~2249 doi: 10.1002/etc.3088
-
[26]
B X Lin, Y Yu, R Y Li et al. Sens. Actuat. B, 2016, 229:100~109. doi: 10.1016/j.snb.2016.01.114
-
[27]
X Liu, Y Li, J Liang et al. Talanta, 2016, 160:99~105. doi: 10.1016/j.talanta.2016.07.010
-
[28]
Y Y Qi, F R Xiu, M F Zheng et al. Biosens. Bioelectron., 2016, 83:243~249. doi: 10.1016/j.bios.2016.04.074
-
[29]
P J Wang, Y Wan, A Ali et al. Sci. China:Chem., 2016, 59(2):237~242. doi: 10.1007/s11426-015-5488-5
-
[30]
R Bala, R K Sharma, N Wangoo. Anal. Bioanal. Chem., 2016, 408(1):333~338. doi: 10.1007/s00216-015-9085-4
-
[31]
L D Wu, P P Qi, X C Fu et al. J. Electroanal. Chem., 2016, 771:45~49. doi: 10.1016/j.jelechem.2016.04.003
-
[32]
R Bala, M Kumar, K Bansal et al. Biosens. Bioelectron., 2016, 85:445~449. doi: 10.1016/j.bios.2016.05.042
-
[33]
R Chauhan, J Singh, T Sachdev et al. Biosens. Bioelectron., 2016, 81:532~545. doi: 10.1016/j.bios.2016.03.004
-
[34]
W L Zhou, W J Kong, X W Dou et al. J. Chromatogr. B, 2016, 1022:102~108. doi: 10.1016/j.jchromb.2016.04.016
-
[35]
X H Yang, Y C Hu, W J Kong et al. J. Sep. Sci., 2014, 37(21):3052~3059. doi: 10.1002/jssc.201400635
-
[36]
L Lv, C B Cui, C Y Liang et al. Food Control, 2016, 60:296~301. doi: 10.1016/j.foodcont.2015.08.002
-
[37]
X F Chu, X W Dou, R Z Liang et al. Nanoscale, 2016, 8(7):4127~4133. doi: 10.1039/C5NR08284F
-
[38]
L Chen, F Wen, M Li et al. Food Chem., 2017, 215:377~382. doi: 10.1016/j.foodchem.2016.07.148
-
[39]
A Erdem, G Congur. Talanta, 2014, 128:428~433. doi: 10.1016/j.talanta.2014.04.082
-
[40]
S Scarano, E Dausse, F Crispo et al. Anal. Chim. Acta, 2015, 897:1~9. doi: 10.1016/j.aca.2015.07.009
-
[41]
C C Chang, C Y Chen, T L Chuang et al. Biosens. Bioelectron., 2016, 78:200~205. doi: 10.1016/j.bios.2015.11.051
-
[42]
Y T Tseng, C H Wang, C P Chang et al. Biosens. Bioelectron., 2016, 82:105~111. doi: 10.1016/j.bios.2016.03.073
-
[43]
S F Yuan, N R Zhang, K L Singh et al. Antimicrob. Agents Chemother., 2015, 59(7):4082~4093. doi: 10.1128/AAC.00306-15
-
[44]
W K Li, X R Feng, X Yan et al. Nucleic Acid Ther., 2016,26(3):166~172. doi: 10.1089/nat.2015.0564
-
[45]
何佳芮. 大连医科大学硕士学位论文, 2014.
-
[46]
C L A Hamula, H Peng, Z Wang et al. J. Mol. Evol., 2015, 81(5~6):194~209. doi: 10.1007/s00239-015-9711-y
-
[47]
S M Yoo, D K Kim, S Y Lee. Talanta, 2015, 132:112~117. doi: 10.1016/j.talanta.2014.09.003
-
[48]
Q Y Wang, Y J Kang. Nanoscale Res. Lett., 2016, 11(1):1~9. doi: 10.1186/s11671-015-1209-4
-
[49]
D P Sun, J Lu, Z G Chen et al. Anal. Chim. Acta, 2015, 885:166~173. doi: 10.1016/j.aca.2015.05.027
-
[50]
N Zhang, T Bing, L Y Shen et al. Angew. Chem. Int. Ed., 2016, 55(12):3914~3918. doi: 10.1002/anie.201510786
-
[51]
C L Esposito, S Catuogno, V de Franciscis. SiRNA Delivery Methods:Methods and Protocols, 2016, 1364:197~208. doi: 10.1007/978-1-4939-3112-5_16
-
[52]
J F Callan, R C Mulrooney, S Kamila. J. Fluoresc., 2008, 18(6):1157~1161. doi: 10.1007/s10895-008-0367-5
-
[53]
Y L Wei, Y X Chen, H H Li et al. Biosens. Bioelectron., 2015, 63:311~316. doi: 10.1016/j.bios.2014.07.064
-
[54]
Q Zhang, H B Qiu, F Q Tang et al. Chem. Lett., 2016, 45(3):289~290. doi: 10.1246/cl.151077
-
[55]
H Z Qiu, Z E Huang, M Chen et al. Microchim. Acta, 2015, 182(15~16):2387~2393. doi: 10.1007/s00604-015-1578-5
-
[56]
F Chen, C Q Cai, X M Chen et al. Sci. Rep., 2016, 6:18814. doi: 10.1038/srep18814
-
[57]
X X He, Z X Li, X K Jia et al. Talanta, 2013, 111:105~110. doi: 10.1016/j.talanta.2013.02.050
-
[58]
Y Huo, L Qi, X J Lv et al. Biosens. Bioelectron., 2016, 78:315~320. doi: 10.1016/j.bios.2015.11.043
-
[59]
Y F He, L F Liao, C H Xu et al. Microchim. Acta, 2015, 182(1~2):419~426. doi: 10.1007/s00604-014-1350-2
-
[60]
陈伶利, 李杰, 贺气志等. 湖南中医药大学学报, 2011, 31(5):6~9.
-
[61]
Y L Wei, Y X Chen, H H Li et al. Biosens. Bioelectron., 2015, 63:311~316. doi: 10.1016/j.bios.2014.07.064
-
[62]
B Y Fang, M H Yao, C Y Wang et al. Colloid. Surf., B, 2016, 140:233~238. doi: 10.1016/j.colsurfb.2015.12.043
-
[63]
M Roushani, F Shahdost-Fard. Anal. Chim. Acta, 2015, 853:214~221. doi: 10.1016/j.aca.2014.09.031
-
[64]
Y F Tang, F Long, C M Gu et al. Anal. Chim. Acta, 2016, 933:182~188. doi: 10.1016/j.aca.2016.05.021
-
[65]
Z H Chen, Y Tan, K F Xu et al. Biosens. Bioelectron., 2016, 75:8~14. doi: 10.1016/j.bios.2015.08.006
-
[66]
G Bozokalfa, H Akbulut, B Demir et al. Anal. Chem., 2016, 88(7):4161~4167. doi: 10.1021/acs.analchem.6b00760
-
[67]
Z B Chen, M H Lu. Talanta, 2016, 160:444~448. doi: 10.1016/j.talanta.2016.07.052
-
[68]
S B Zhang, L P Wang, M L Liu et al. Anal. Methods, 2016, 8(18):3740~3746. doi: 10.1039/C6AY00231E
-
[69]
Y L Zhang, Z Y Sun, L N Tang et al. Microchim. Acta, 2016, 183(10):2791~2797. doi: 10.1007/s00604-016-1923-3
-
[70]
F Haddache, A Le Goff, N Spinelli et al. Electrochim. Acta, 2016, 219:82~87. doi: 10.1016/j.electacta.2016.09.127
-
[71]
J M Wang, J Song, X Y Wang et al. Talanta, 2016, 161:437~442. doi: 10.1016/j.talanta.2016.08.039
-
[72]
A S Emrani, N M Danesh, M Ramezani et al. Biosens. Bioelectron., 2016, 79:288~293. doi: 10.1016/j.bios.2015.12.025
-
[73]
D L Ma, M Wang, B He et al. ACS Appl. Mater. Interf., 2015, 7(34):19060~19067. doi: 10.1021/acsami.5b05861
-
[74]
M Roushani, F Shahdost-fard. Microchim. Acta, 2016, 183(1):185~193. doi: 10.1007/s00604-015-1604-7
-
[75]
F Beigloo, A Noori, M A Mehrgardi et al. J. Iran. Chem. Soc., 2016, 13(4):659~669. doi: 10.1007/s13738-015-0778-6
-
[76]
H Hasegawa, N Savory, K Abe et al. Molecules, 2016, 21(4):421. doi: 10.3390/molecules21040421
-
[77]
X L Tang, Y Hua, Q Guan et al. Eur. J. Clin. Microbiol. Infect. Dis., 2016, 35(4):587~595. doi: 10.1007/s10096-015-2574-8
-
[78]
G Mahlknecht, M Sela, Y Yarden. Gene Therapy of Solid Cancers:Methods Protoc., 2015:3~15.
-
[79]
I C Elle, K K Karlsen, M G Terp et al. Mol. BioSyst., 2015, 11(5):1260~1270. doi: 10.1039/C5MB00045A
-
[80]
E Ouellet, J H Foley, E M Conway et al. Biotechnol. Bioeng., 2015, 112(8):1506~1522. doi: 10.1002/bit.25581
-
[81]
刘腾飞, 杨代凤, 邓金花等. 生物技术通报, 2013, 4:39~48. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=swjt201304010&dbname=CJFD&dbcode=CJFQ
-
[82]
许蕊, 邱志刚, 杨栋等. 环境与健康杂志, 2016, 1(1):59~62. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hjyj201601018&dbname=CJFD&dbcode=CJFQ
-
[83]
H P Dwivedi, R D Smiley, L A Jaykus. Appl. Microbiol. Biotechnol., 2010, 87:2323~2334. doi: 10.1007/s00253-010-2728-7
-
[84]
X J Xing, X G Liu, Y Zhou et al. RSC Adv., 2016, 6(14):11815~11821. doi: 10.1039/C5RA25481G
-
[85]
D Q Fan, C T Wu, K Wang et al. Chem. Commun., 2016, 52(2):406~409. doi: 10.1039/C5CC06754E
-
[86]
E Mondragón, L J Maher Ⅲ. Nucl. Acid Ther., 2016, 26(1):29~43. doi: 10.1089/nat.2015.0566
-
[87]
王巍, 贾凌云. 分析化学, 2009, 37(3):454~460. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=fxhx200903038&dbname=CJFD&dbcode=CJFQ
-
[1]
-
表 1 基于适配体的农药残留检测方法
Table 1. Detection methods of pesticide residues based on aptamers
检测物 方法 标记物 检测限 线性范围 文献 多农药残留 适配体标记量子点的turn-on型传感器 无标记 0.7nmol/L 0~150 nmol/L [26] 啶虫脒 基于三股螺旋分子开关的适配体荧光检测法 无标记 9.12nmol/L 100~1200 nmol/L [27] 啶虫脒 化学发光适配体传感器 纳米金 62pmol/L 8×10-10~6.3×10-7 mol/L [28] 氧化乐果 适配体包裹纳米金的比色检测法 纳米金 0.1μmol/L 0.1~10 μmol/L [29] 甲拌磷 适配体传感器比色法 纳米金 0.01nmol/L 0.01nmol/L~1.3 μmol/L [30] 3, 3′4, 4′-多氯联苯 电化学适配体生物传感器 二茂铁 0.01μg/L 0.2~200 μg/L [31] 马拉硫磷 适配体生物传感器 纳米金 0.06pmol/L 0.5~1000 pmol/L [32] 表 2 适配体在ATP检测中的应用
Table 2. Application of aptamers in the detection of ATP
表 3 适配体在可卡因检测中的应用
Table 3. Application of aptamers in the detection of cocaine
检测方法 标记物 检测限 线性范围 文献 基于化学发光检测技术结合介孔二氧化硅基控释系统的生物传感器 无标记 1.43μmol/L 5.0~60μmol/L [65] 电化学适配体生物传感器 无标记 2.5nmol/L 2.5~10nmol/L [66] 电化学传感 二茂铁 32pmol/L 0.1~20nmol/L [67] 荧光适配体传感器 无标记 5nmol/L 12~1300nmol/L [68] 适配体标记荧光法 FAM 0.1nmol/L 1~500nmol/L [69] 光电适配体传感器 无标记 10nmol/L 10-8~5×10-4mol/L [70] 荧光适配体传感器 无标记 56nmol/L 0.10~10μmol/L [71] 荧光适配体传感器 FAM 209pmol/L 0.5~20nmol/L [72] 发光“switch-on”适配体检测 无标记 30nmol/L 30~300nmol/L [73] 电化学适配体传感器 无标记 100pmol/L 1nmol/L~11μmol/L [74] 阻抗滴定传感器 无标记 50nmol/L 100nmol/L~1.0mmol/L [75] -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:



 下载:
下载:

