 图式1
探针C3与Fe3+的可能络合模式
图式1.
Proposed binding mode of C3 with Fe3+
图式1
探针C3与Fe3+的可能络合模式
图式1.
Proposed binding mode of C3 with Fe3+

Citation: Chen Guofeng, Fan Dongdong, Liu Lin, Wu Jiuli. Research Progress in Coumarin-based Fluorescent Probes for Fe3+[J]. Chemistry, 2017, 80(8): 708-714.

基于香豆素骨架的Fe3+荧光探针的研究进展
English
Research Progress in Coumarin-based Fluorescent Probes for Fe3+
-
Key words:
- Coumarin
- / Fluorescent probes
- / Cations recognition
- / Fe3+
-
金属离子广泛存在于自然界中,在生命体系中起着重要作用,与人类的健康息息相关。它们能与生物分子产生各种键合作用,从而在生物体内承担如电子转移、载氧、酶的活性中心等各种各样的功能[1]。铁是人体内含量最丰富的过渡金属元素,是人体必需的微量元素之一。铁作为血红蛋白、肌红蛋白和细胞色素C中的辅基的组成部分[2],也是许多酶的组成成分和氧化还原反应酶的激活剂[3]。人体内铁元素不足会引起缺铁性贫血甚至一些癌症等疾病,但过量的铁也存在潜在的危害,研究表明,人体吸收的铁过量或铁平衡紊乱将使其沉积在肝脏、胰腺、心脏和皮肤,从而引起肝功能异常、心肌损伤及糖尿病、血色病(血色素沉积症)[4~6]。因此,开发简单、方便、实时的铁离子检测方法对于医学、生物科学及环境科学都有重要的意义。目前,原子吸收光谱(AAS)[7]、电感耦合等离子体-原子发射法(ICP-AES)[8]、电感耦合等离子体-质谱法(ICP-MS)[9]、电化学方法[10]等已用来检测铁离子。这些检测方法虽具有较高的灵敏度,但需要昂贵的仪器、复杂的前处理和专业人员操作等。荧光法检测铁离子由于具有简单快速、仪器价廉且易操作、选择性高、灵敏度好、可实时在线分析等优点而备受科技工作者的关注[11~15]。基于以上原因,各种结构新颖、高选择性的铁离子荧光探针不断涌现,基于香豆素骨架的Fe3+荧光探针是其中重要的一类。
1929年,Krais首次发现天然香豆素化合物Esculin能用来提高一些纺织品的白度,随后大量天然及合成的香豆素衍生物被用于荧光增白剂、染料等方面[16]。香豆素类荧光团具有苯并α-吡喃酮母核结构,其母体结构无色且在常温下没有荧光,但取代后的香豆素衍生物,特别是当7-位被给电子基团取代或3-位和4-位被吸电子基团取代后,将导致其吸收光谱和发射光谱发生变化。含香豆素骨架的化合物是荧光分子探针设计中的优秀候选荧光团,其性能可通过对母体上不同位置供吸电子基团的修饰来实现,具有发射波长适中、荧光量子产率高、光稳定性好及较强的可修饰性等优点,近年来该类探针受到广泛关注并成为离子识别研究的热点之一[17~20]。研究人员着眼于不同识别机制将香豆素与冠醚、醇类、席夫碱、若丹明、杯芳烃等结构相连用于Fe3+的荧光识别。
本文主要就近十年来以香豆素为荧光团的Fe3+荧光探针的设计、结构特性及应用进行评述,并展望了基于香豆素骨架的Fe3+探针的发展趋势。
1 冠醚类Fe3+荧光探针
冠醚类化合物由于自身的独特结构决定了其在离子识别中的地位,该类物质被广泛应用于设计荧光分子探针。2005年,Hua等[21]在香豆素的4-位和7-位引入两个氮杂-18-冠-6基团作为识别基团,合成了一种新型探针C1,预期这种结构在识别金属离子时形成半刚性Ⅴ型构象,进而可以提高识别的选择性。实验结果表明,在接近生理条件(pH=7.4,[NaCl]=0.135mol/L,[KCl]=0.01mol/L)下,Fe3+可以使探针C1荧光增强15倍;Cu2+、Hg2+的加入使荧光分别增强2.5和1.9倍。此外,C1和Fe3+形成1:1络合物后两个冠醚之间的距离减小,进而形成激基缔合物,导致吸收光谱红移了8nm。离子竞争实验表明其他离子对该探针识别Fe3+影响不大,从而实现了对Fe3+的专一识别。
2014年,Li等[22]以二氮杂-18-冠-6连接双香豆素荧光团合成了一个对Fe3+具有高选择性的荧光探针C2。当冠醚上连接N原子后,其对金属离子络合能力和选择性大大提高。探针与金属离子结合后,金属离子的正电荷使配位N原子上的电子云密度降低,从而使探针荧光强度发生改变。该探针在456nm处的荧光强度与Fe3+浓度在0~30 μmol/L范围内呈线性相关,检测限为0.31μmol/L,响应时间小于10s。过量乙二胺四乙酸二钠(EDTA)加入后,C2-Fe3+体系荧光完全恢复;Job’s滴定曲线证实探针C2与Fe3+形成1:1的络合物;环境和生物体中其他相关的金属阳离子对该探针识别Fe3+无影响。
2 醇类Fe3+荧光探针
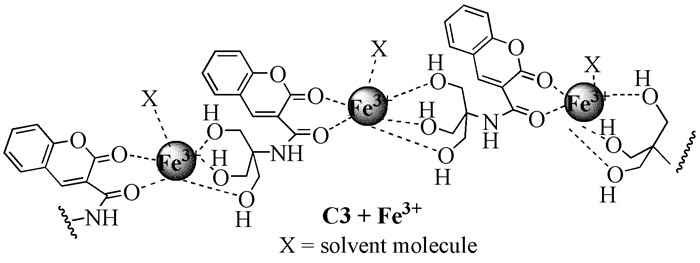
羟基对Fe3+有一定的配位能力,所以在荧光探针设计中引入含有不同数目羟基的单元可以改变对其对金属离子的选择性。2009年,Yao等[23]以水杨醛为原料合成了香豆素-3-甲酸乙酯,进而和三羟甲基氨基甲烷反应制得香豆素酰胺化合物C3。在HEPES缓冲水溶液(20μmol/L,pH=7.2) 中,Fe3+加入后主体分子荧光猝灭。荧光滴定实验证明C3和Fe3+络合比例为1:1。他们利用紫外吸收光谱、ESI-MS和红外光谱数据推测结合模式可能为Fe3+与C3的三个羟基和另一分子的两个羰基配位,最终形成了聚合物(图式 1)。竞争实验表明,碱金属、碱土金属和其他过渡金属对探针的识别作用影响不大。C3在HEPES缓冲溶液中高选择性识别Fe3+可以使之在与Fe3+有关的疾病治疗中发挥作用。
2013年,Chen等[24]合成了两种7-位不带取代基的N-(2-羟乙基)和N-(3-羟丙基)香豆素类酰胺化合物C4、C5,以及两种带有7-二乙氨基的N-(2-羟乙基)和N-(3-羟丙基)香豆素类酰胺化合物C6、C7。在乙腈中,Fe3+对探针的荧光具有很好的猝灭作用,其中对C7的荧光猝灭率高达99.9%。该探针在461nm处的荧光强度与Fe3+浓度在0~50 μmol/L范围内呈线性关系;Fe3+和探针的缔合常数为2.2× 104L/mol,表现出非常好的选择性。
2014年,En等[25]利用2, 4-二羟基苯甲醛为原料首先合成出7-羟基-3-香豆素甲酸乙酯,再和三羟甲基氨基甲烷反应合成出新型香豆素类荧光探针N-[2-羟基-1, 1-双(羟甲基)乙基]-7-羟基香豆素-3-甲酰胺(C8)。2-氨基-2-(羟甲基)-1, 3-丙二醇作为识别基团的同时还可以增加水溶性。在Na2HPO4-柠檬酸缓冲液(0.2 mol/L)中,C8对Fe3+的选择性和亲和性优于对其他阳离子,该探针适用于pH 3~8范围内水溶液中Fe3+的检测。此外,生物成像、膜渗透性和无毒实验证明探针C8可以作为在活体细胞中检测Fe3+的一种“开-关”型荧光探针,检测限为3×10-7mol/L。竞争实验表明环境和生物体中相关的金属离子对该探针识别Fe3+无影响。
3 席夫碱类Fe3+荧光探针
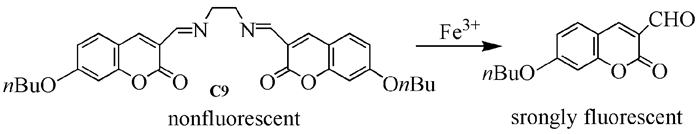
席夫碱型荧光探针具有合成简单、光稳定性好、Stocks位移大等优点,当探针与金属离子结合时,C=N键的异构化受到影响会导致荧光变化,因此成为探针设计中的优秀候选结构。2008年,Lin等[26]利用7-丁氧基香豆素-3-甲醛和乙二胺反应合成了双香豆素席夫碱探针C9,可用于Fe3+的识别。没有加入Fe3+前,化合物C9上的供电子基团CN和香豆素环相连接,光诱导电荷转移(从CN键到香豆素)作用导致香豆素基团荧光很弱;当加入Fe3+后,金属离子促进席夫碱水解生成荧光较强的7-丁氧基香豆素-3-甲醛(图式 2),荧光强度增加140倍。该探针对Fe3+有高度的选择性,离子竞争反应证实其他离子的加入对C9识别Fe3+几乎没有干扰。体系加入Fe3+后,再加入EDTA,荧光强度不会减弱,验证了Fe3+促进的水解反应的不可逆性。
2012年,Ma等[27]利用7-二乙氨基香豆素-3-甲醛和硫代卡巴肼反应合成了含席夫碱结构的香豆素类荧光探针C10,7-位的二乙氨基提高了探针C10的量子产率和其在水性介质中的溶解度。探针与金属离子结合后,CN键的异构化受到抑制,使荧光发生变化。在0.02mol/L Tris-HCl的甲醇/水(95:5,体积比)溶液中加入Fe3+后,体系荧光增强并发生蓝移,探针对Fe3+表现出很好的选择性和灵敏度。
2012年,Devaraj等[28]利用8-甲酰基-7-羟基-4-甲基香豆素和2-氨基吡啶反应合成新型香豆素荧光探针C11。在乙腈中,C11对Fe3+表现出高选择性和灵敏度,由于配体向Fe3+的电荷转移,溶液颜色从无色变为褐色。加入Fe3+后探针的紫外吸收光谱在538nm处产生了新的吸收峰,这是由于C11-Fe3+上的d-d电子跃迁产生的。该探针与Fe3+以1:1方式结合,其结合常数为1.42×104L/mol;探针对Fe3+的检出限在基态为1.79μmol/L,在激发态为0.09μmol/L。C11对Fe3+的选择性不受其他离子的干扰。
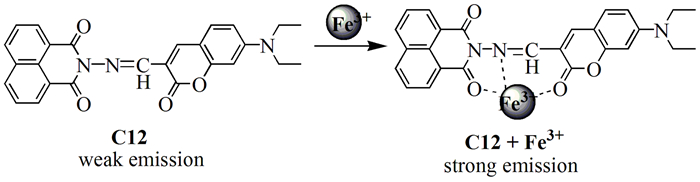
2014年,Li等[29]基于香豆素和萘酰亚胺设计合成了一个对Fe3+有选择性的“开-关”席夫碱型探针C12(图式 3)。香豆素中C=O基团上的氧原子和萘酰亚胺提供螯合位点,席夫碱上的C=N键被激发时容易产生异构化而表现出微弱的荧光。当探针与金属离子结合形成配合物时,C=N键的异构化受到抑制,荧光发生变化。在THF/H2O(1:1,体积比)溶液中,C12对Fe3+表现出良好的选择性,荧光增强。根据Job’s滴定曲线,C12和Fe3+形成1:1配合物。Fe3+和探针的缔合常数为(2.589±0.206)×103L/mol,方法的检测限为0.388μmol/L。
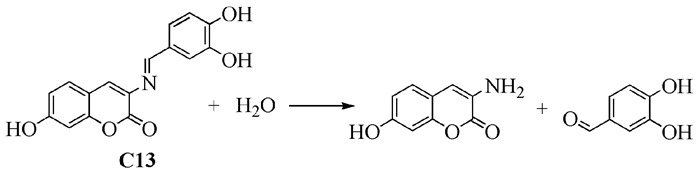
2014年,García-Beltrán等[30]合成了两个新的香豆素类“开-关”型荧光探针(E)-3-[(3, 4-双羟基苯亚甲基)氨基]-7-羟基-2H-吡喃-2-酮(C13)和(E)-3-[(2, 4-双羟基苯亚甲基)氨基]-7-羟基-2H-吡喃-2-酮(C14),并对它们在金属离子的检测方面进行了研究。结果表明,这两个化合物对Cu2+和Fe3+有高选择性。C14可以直接检测Cu2+和Fe3+,而C13是先水解成3-氨基-7-羟基香豆素和3, 4-二羟基苯甲醛(图式 4),然后3-氨基-7-羟基香豆素与Cu2+和Fe3+反应,这种相互作用使荧光减弱,检测限低至10-5mol/L。荧光成像研究发现该探针能够检测人类神经母细胞瘤SH-SY5Y中的Cu2+和Fe3+。
2015年,山少斌等[31]通过脱水反应将香豆素探针负载到介孔硅材料SBA-15上,合成了一种无机-有机杂化荧光材料SBA-K(C15),负载后介孔材料的有序孔道没有被破坏。在HEPES悬浮液(0.02mol/L,CH3OH/H2O=99.5:0.5,体积比,pH=7.2) 中,探针仅对Fe3+产生荧光猝灭(98%)响应,这可归因于Fe3+的顺磁性和重金属离子效应引起的电荷转移,同时体系颜色由无色变成棕黄色。竞争性实验结果表明,其他共存阳离子的存在并未对C15识别Fe3+产生干扰。此外,C15对Fe3+表现出较强的吸附能力,吸附率可达92.7%。
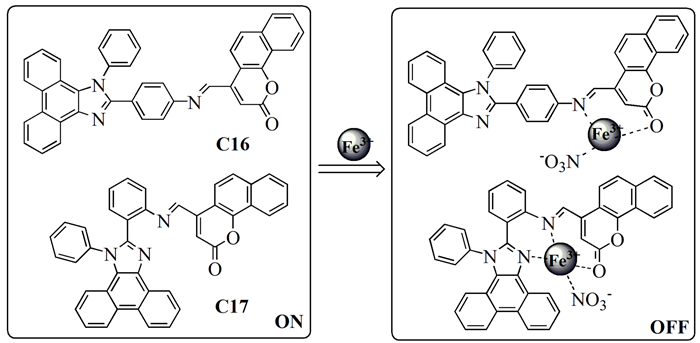
2016年,Zhao等[32]设计合成了两个基于菲并[9, 10-d]咪唑-香豆素衍生物的席夫碱型探针C16、C17。在DMF/HEPES(7:3,体积比,10mmol/L,pH=7.4) 溶液中,C16、C17对Fe3+表现出“开-关”作用,这是由于顺磁性的Fe3+对荧光有猝灭作用造成的。尽管单独的C16、C17受体系的pH影响较大,但他们仍然可以用来在大多数生物系统中检测Fe3+,通过荧光滴定可以计算出C16、C17的检测限分别为4.28和0.83 μmol/L。通过Job’s曲线、核磁滴定和质谱数据得出该类探针与Fe3+形成1:1的络合物(图式 5)。该类探针成功用于瓶装水和自来水样本中Fe3+的检测。
4 若丹明类Fe3+荧光探针
若丹明作为经典的荧光染料具有摩尔吸收系数大、荧光量子产率高和激发波长长等优点,被广泛用于荧光探针设计。同时,若丹明衍生物存在螺环与开环之间的平衡,当处在螺环形式时没有荧光,而在开环状态下却有强的荧光,可以利用金属离子调节这两种状态的平衡进而用于离子检测。
2011年,Tang等[33]等通过酰胺键将若丹明B与香豆素基团连接,合成了能检测Fe3+的荧光探针C18。在CH3CN/H2O(1:1,体积比,HEPES 50mmol/L,pH=7.0) 溶液中,C18可选择性识别Fe3+,其他共存离子对Fe3+的识别几乎没有干扰。识别机理主要是CO对过渡金属离子表现出较高的亲和性,同时在Fe3+诱导下,若丹明的螺环结构发生开环反应,引起荧光增强。根据荧光滴定和Job’s滴定曲线证实C18与Fe3+以1:1的比例络合。该探针能可逆检测Fe3+,络合常数为1.7×104L/mol。
2013年,Ge等[34]合成了一种基于若丹明B和7-二乙氨基香豆素的新型比率荧光探针C19,它对Fe3+检测有很高的灵敏度和选择性。该探针水溶液加入Fe3+后,在580和460 nm处有两个荧光发射峰,分别属于若丹明B和香豆素。Fe3+加入前,与香豆素上3-位羰基相连的N原子上的电子由于光诱导电子转移机理(PET)猝灭了香豆素单体和激基缔合物的荧光。当Fe3+加入后,体系荧光增强,原因在于N原子参与探针与Fe3+的配位,PET过程被抑制。对于若丹明部分,由于螺环打开和螯合增强荧光作用,5倍化学计量的Fe3+加入到该探针水溶液后,580nm处的荧光强度增加了大约120倍,检测限低至0.524μmol/L。探针与Fe3+以1:1的比例络合,络合常数为1.172×104L/mol。
2014年,An等[35]利用8-甲酰基-7-羟基-4-甲基香豆素和若丹明-6G酰肼合成新型荧光探针C20,在乙醇溶液中,该荧光分子探针作为“关-开”型探针对Fe3+表现出了很好的选择性,发出很强的黄绿色荧光。Fe3+加入后,C20的荧光强度增大125倍,相比其他金属离子,探针对Fe3+的检测具有选择性好、灵敏高等优点,这主要是由于螺环在Fe3+诱导下开环,提供了与Fe3+络合的位点,光诱导电子转移和分子内电荷转移使该探针发出强荧光辐射。同时,通过ESI-MS数据发现,伴随若丹明-6G-乙二胺结构生成,可能会有两种络合模式。紫外光谱、Job’s曲线和ESI-MS均表明该探针与Fe3+以1:1络合,络合常数为1.1×107L/mol,检出限低至5.6×10-9mol/L,并且该探针属于可逆型荧光分子探针。探针的激发波长为500nm,该波长属于可见光区域(400~700 nm),因此不会对细胞造成损害或者造成的损害可以忽略,有望在生物检测领域得到应用。
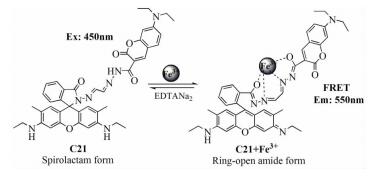
2015年,Qin等[36]设计合成了一个基于若丹明-香豆素结构的新型比率探针C21。该探针在EtOH/H2O(9:1,体积比,Tris-HCl,pH=7.4) 溶液中只发射香豆素的荧光发射峰(475nm),加入Fe3+后,探针在550nm处出现强荧光辐射,同时伴随着溶液由绿色到黄色的变化。这是由于在Fe3+的诱导下,若丹明的螺环部分打开参与Fe3+的络合,发生了香豆素到若丹明6G结构的分子内荧光共振能量转移(图式 6)。根据Job’s滴定实验和质谱数据可以推断探针C21与Fe3+形成1:1络合物,其他离子的加入不会干扰检测,检测限为4.05× 10-6 mol/L。
5 杯芳烃类Fe3+荧光探针
氧杂杯[3]芳烃由于其空腔尺寸精确、构型特殊,作为荧光分子结构平台后性能优异。2014年,李燕琴等[37]以氧杂杯[3]芳烃为母体,通过“点击化学”技术,以1, 2, 3-三氮唑为连接基,将香豆素引入氧杂杯[3]芳烃的下沿,得到两种香豆素-氧杂杯[3]芳烃衍生物C22、C23。在DMSO/H2O中性混合溶剂中,Fe3+的加入均导致探针溶液的荧光显著降低,紫外吸收增强,而其他金属离子加入后则无明显变化,表明C22、C23对Fe3+有荧光猝灭识别能力。通过Fe3+对探针的荧光滴定,利用摩尔比和Job法分别推测出Fe3+与探针C22、C23的络合比均为1:1,探针对Fe3+的识别几乎不受共存离子的影响。荧光探针在水溶性介质中检测Fe3+的浓度线性范围为9×10-6~1.4×10-4 mol/L,检测限低至10-8 mol/L。
6 其他类Fe3+荧光探针
除了以上介绍的5种类型外,Fe3+的其他类型荧光探针也有很多。2005年,Ma等[38]设计合成了一系列由香豆素荧光基团与3-羟基吡啶-4-酮以共价键相连的探针分子。其中C24是一种亲脂性适中、敏感性非常高的Fe3+荧光螯合剂。Fe3+加入后,探针C24的荧光猝灭,当1, 2-二乙基-3-羟基吡啶-4-酮加入到C24-Fe3+体系中后,体系荧光得以恢复,两者联合使用可以用来测定肝细胞内Fe3+含量。该类铁离子螯合剂的主要优点在于对Fe3+的高选择性,对Cu2+、Zn2+、Ni2+和Co2+这些与生命相关的金属离子响应较弱,其他优点在于该类探针保留了膜可渗透性,并且在渗透细胞膜之后不被水解。
2008年,李芳等[39]利用丁二酸酐和7-羟基香豆素合成了丁二酸(7-羟基香豆素)单酯(C25),详细考察了探针浓度、体系酸度、加入顺序和放置时间对Fe3+检测的影响。结果表明,在pH=3.3盐酸介质中,Fe3+的加入可使探针C25的荧光猝灭,且其猝灭程度与Fe3+的加入量呈线性关系。该方法检测限为51ng/L,对比母体7-羟基香豆素对Fe3+的检测,C25测定的灵敏度提高了104倍,从而建立了荧光猝灭法测定痕量Fe3+的新方法。检测灵敏度的提高是由于C25中含有羧酸基团,该基团与Fe3+的络合能力远大于7-羟基香豆素所含羟基的络合能力。
2009年,Ma等[40]合成了系列六齿结构荧光探针C26、C27和C28,该类探针以香豆素为荧光团、3-羟基吡啶-4-酮或3-羟基吡喃-4-酮为识别基团。当探针螯合部分与Fe3+结合后,荧光发生猝灭,且对Fe3+的选择性优于其他金属离子(Cu2+、Zn2+、Mn2+、Ni2+和Co2+)。Cu2+对探针荧光的影响可以在N, N, N′, N′-四(2-吡啶基甲基)乙二胺的存在下消除。竞争研究表明,以吡啶酮为基础的探针和脱铁转铁蛋白之间铁的交换很慢,从低聚柠檬酸铁(Ⅲ)络合物中去除铁的能力表明含有吡啶酮的探针清除铁的速度比去铁酮和去铁敏快。
2014年,Kaya等[41]通过Perkin反应合成7-羟基-3-(3, 4, 5-三甲氧基苯基)香豆素,然后与3-硝基邻苯二甲腈、4-硝基邻苯二甲腈或4, 5-二氯邻苯二甲腈反应制备邻苯二甲腈类衍生物C29~C32。在1, 4-二氧六环溶液中,C29~C32可以选择性识别Fe3+,表现为荧光猝灭,其他的金属离子表现为略微的荧光增强。Job’s滴定表明Fe3+与探针C29~C32的络合比均为1:1,结合常数均达到10-3L/mol水平。
7 结语
由于以香豆素为骨架的荧光探针在Fe3+识别、检测及荧光显影跟踪方面具有诸多优点,近年来,该项研究工作成为化学工作者关注的热点。今后此类探针将向更高灵敏度、更好选择性、更强抗干扰性能的研究方向发展,并开发对细胞无毒副作用、生物兼容性好且对细胞内的Fe3+能进行定性和定量检测的香豆素类荧光探针。此外,尽管化学工作者掌握了很多探针结构的设计方法,但是随着纳米生物技术的发展,如何借助新技术来进一步开发更有效的探针仍然是一个充满挑战的课题。
-
-
[1]
孙红哲, 陈嵘, 支志明. 化学进展, 2002, 14(4): 257~262. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxjz200204004&dbname=CJFD&dbcode=CJFQ
-
[2]
M C R Symons, J M C Gutteridge. Free Radicals and Iron:Chemistry, Biology, and Medicine. Oxford:Oxford Science Publications, 1998. doi: 10.1086/393521
-
[3]
J L Bricks, A Kovalchuk, C Trieflinger et al. J. Am. Chem. Soc., 2005, 127(39):13522~13529. http://www.researchgate.net/profile/Jorg_Daub/publication/7573274_On_the_Development_of_Sensor_Molecules_that_Display_Fe_III_-amplified_Fluorescence/links/585410c808aeff086bf6e951/On-the-Development-of-Sensor-Molecules-that-Display-Fe-III-amplified-Fluorescence.pdf
-
[4]
B P Esposito, S Epsztejn, W Breuer et al. Anal. Biochem., 2002, 304(1):1~18. http://europepmc.org/abstract/med/11969183
-
[5]
E H Hanson, G Imperatore, W Burke. Am. J. Epidemiol., 2001, 154(3):193~206.
-
[6]
J N Feder, A Gnirke, W Thomas et al. Nat. Genet., 1996, 13(4):399~408.
-
[7]
陈华, 李宇, 金耀军等. 广东化工, 2015, 42(14): 216~217. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gdhg201514109&dbname=CJFD&dbcode=CJFQ
-
[8]
周晨光, 赵磊, 刘明等. 天津化工, 2005, 29(1): 50~51. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=tjhg201501020&dbname=CJFD&dbcode=CJFQ
-
[9]
王征, 赵学玒, 孙传强等. 冶金分析, 2015, 35(6): 1~7. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjfx201506001&dbname=CJFD&dbcode=CJFQ
-
[10]
林明月, 潘大为, 张海云等. 环境化学, 2015, 34(3): 536~544. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hjhx201503019&dbname=CJFD&dbcode=CJFQ
-
[11]
黎俊波, 李楠楠, 余响林等. 武汉工程大学学报, 2010, 32(5): 11~14. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=whhg201005004&dbname=CJFD&dbcode=CJFQ
-
[12]
王作辉, 王淑敏. 化工技术与开发, 2014, 43(11): 32~35. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gxhg201411012&dbname=CJFD&dbcode=CJFQ
-
[13]
孟文斐, 杨美盼, 成昭等. 有机化学, 2014, 34(2): 398~402. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201402018&dbname=CJFD&dbcode=CJFQ
-
[14]
郝二宏, 张萍, 孟婷. 安徽师范大学学报, 2015, 38(1): 8~13. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=ahsz201501003&dbname=CJFD&dbcode=CJFQ
-
[15]
Z X Li, H X Li, C X Shi et al. Sens. Actuat. B, 2016, 226, 127~134.
-
[16]
马德强. 化工百科全书. 北京: 化学工业出版社, 1998, 1047.
-
[17]
Y X Song, Z Chen, H Q Li. Curr. Org. Chem., 2012, 16(22):2690~2707.
-
[18]
孔令义. 香豆素化学. 北京: 化学工业出版社, 2007: 19~20.
-
[19]
马文辉, 彭孝军, 徐群等. 化学进展, 2007, 19(9): 1258~1266. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxjz200709004&dbname=CJFD&dbcode=CJFQ
-
[20]
陈国锋, 李弘扬, 兰瑞家等. 化学通报, 2013, 76(11): 1002~1010. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxtb201311009&dbname=CJFD&dbcode=CJFQ
-
[21]
J Hua, Y G Wang. Chem. Lett., 2005, 34(1):98~99. doi: 10.1002/chin.200523174/full
-
[22]
H D Li, L L Li, B Z Yin. Inorg. Chem. Commun., 2014, 42:1~4.
-
[23]
J N Yao, W Dou, W W Qin et al. Inorg. Chem. Commun., 2009, 12(2):116~118. http://www.sciencedirect.com/science/article/pii/S1387700308004164
-
[24]
G F Chen, H M Jia, L Y Zhang et al. Res. Chem. Intermed., 2013, 39(9):4081~4090.
-
[25]
D En, Y Guo, B T Chen et al. RSC Adv., 2014, 4(1):248~253. http://pubs.rsc.org/en/content/articlehtml/2013/ra/c3ra44843f
-
[26]
W Y Lin, L Yuan, J B Feng et al. Eur. J. Org. Chem., 2008, 2008(16):2689~2692.
-
[27]
W H Ma, Q Xu, B Song et al. Adv. Mater. Res., 2012, 396~398:2137~2140. http://www.scientific.net/AMR.396-398.2137
-
[28]
S Devaraj, Y K Tsui, C Y Chiang et al. Spectrochim. Acta, A, 2012, 96:594~599. http://europepmc.org/abstract/MED/22868330
-
[29]
Z Q Li, Y Zhou, K Yin et al. Dyes Pigments, 2014, 105, 7~11.
-
[30]
O García-Beltrán, B K Cassels, C Pérez et al. Sensors, 2014, 14(1):1358~1371.
-
[31]
山少斌, 马文辉, 吕磊等. 齐齐哈尔大学学报, 2015, 31(2): 8~11. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=qqhe201502003&dbname=CJFD&dbcode=CJFQ
-
[32]
B Zhao, T Liu, Y Fang et al. Tetrahed. Lett., 2016, 57(39):4417~4423. http://www.sciencedirect.com/science/article/pii/S0040403916310917
-
[33]
L J Tang, F F Li, M H Liu et al. Bull. Korean Chem., 2011, 32(9):3400~3404.
-
[34]
F Ge, H Ye, H Zhang et al. Dyes Pigments, 2013, 99(3), 661~665.
-
[35]
J M An, T R Li, B D Wang et al. J. Coord. Chem., 2014, 67(5):921~928. doi: 10.1134/S1070328413010028
-
[36]
J C Qin, Z Y Yang, G Q Wang et al. Tetrahed. Lett., 2015, 56(35):5024~5029.
-
[37]
李燕琴, 牟兰, 曾晞等. 贵州大学学报. 2014, 31(3): 25~29. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gzdi201403008&dbname=CJFD&dbcode=CJFQ
-
[38]
Y M Ma, H de Groot, Z D Liu et al. Biochem. J., 2006, 395(1):49~55.
-
[39]
李芳, 孙向英. 光谱学与光谱分析. 2008, 28(9): 2165~2168. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=guan200809057&dbname=CJFD&dbcode=CJFQ
-
[40]
Y M Ma, R C Hider. Bioorg. Med. Chem., 2009, 17(23):8093~8101.
-
[41]
E N Kaya, F Yuksel, G A Ozpınar et al. Sens. Actuat. B, 2014, 194:377~388.
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:





 下载:
下载:

