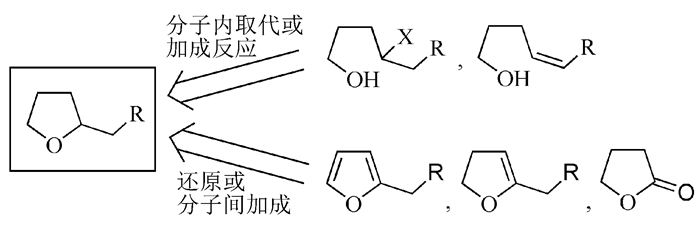
 图 图式1
构筑四氢呋喃环的直线型合成策略
Figure 图式1.
Linear strategies for tetrahydrofuran-ring construction
图 图式1
构筑四氢呋喃环的直线型合成策略
Figure 图式1.
Linear strategies for tetrahydrofuran-ring construction

Citation: Wang Linna, Miao Jianzhuang, Xu Shu, Jin Zhexiong. Applications of the Convergent [4+1]/[3+2] Tetrahydrofuran-Cyclization Strategies in the Total Synthesis of Natural Products[J]. Chemistry, 2017, 80(5): 441-447.

[4+1]及[3+2]会聚式四氢呋喃环合成策略在天然产物全合成中的应用进展
English
Applications of the Convergent [4+1]/[3+2] Tetrahydrofuran-Cyclization Strategies in the Total Synthesis of Natural Products
-
Key words:
- Natural product
- / Total synthesis
- / Tetrahydrofuran ring
- / Convergent strategy
-
四氢呋喃环广泛存在于药物(如吉西他滨、索非布韦、泊沙康唑等)和天然产物(如木质素、番荔素、大环内酯、生物碱、糖、核酸等)结构中。含有四氢呋喃环的天然产物在抗癌、抗感染、抗炎、免疫抑制、抗氧化等诸多方面展现了强有力的活性,作为新药的候选物其合成需求近年来不断增加[1~3]。如何高效合成取代的四氢呋喃环,往往成为此类天然产物全合成中的关键。四氢呋喃环作为有机化学中的常见环系,对其进行合成的方法极多,也多有综述性报道[1, 4~6];但由于天然产物的结构复杂性及官能团的多样性,多数条件苛刻或者缺乏选择性的方法(如丁二醇脱水法等)并不能适用于全合成的研究。
四氢呋喃环为含有一个氧原子和四个饱和碳原子的五元环系,环上包括两个C—O单键和3个C—C单键。由于在一般情况下C—O单键要比C—C单键容易连接,在已报道的文献中,对含四氢呋喃环的天然产物做逆合成分析时,多数情况下都会选择切断C—O单键的分子内成环策略(图式1):先在直线分子骨架上导入官能团,再通过分子内取代/加成反应进行关环。另外也有通过对呋喃、二氢呋喃、γ-丁内酯等五元杂环进行还原或分子间加成的合成策略。以上这些合成策略,都可以归类为直线型策略,其特点是四氢呋喃环的五个原子都已事先被导入到其合成前体(环化前体)中,只是通过改变原子间的成键状态来完成合成。
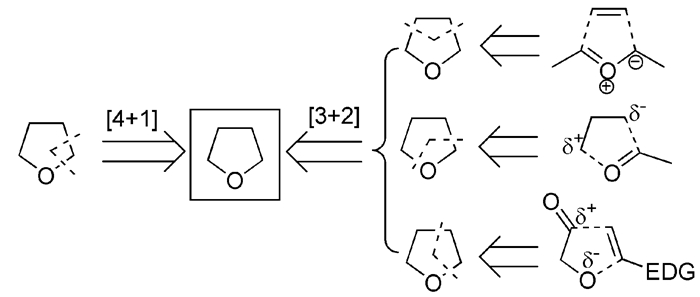
近年来,有些报道的全合成在逆合成分析时,利用一些新开发的反应,采用会聚式的合成策略将四氢呋喃环的5个原子分割到两个不同的合成前体中,反应时通过生成两根新键把两个前体连接到一起,同时形成四氢呋喃环。由于两个前体可以分别进行合成,成环时又采用了高效的反应,这样的合成路线往往都能取得比直线型路线更优的整体合成效率。对于含四氢呋喃环的天然产物,可以有[4+1]和[3+2]两种会聚式的合成策略(图式2)。
本文整理评述了使用会聚式合成策略成功构筑天然产物中四氢呋喃环的已有案例,并对其应用前景进行了展望。由于篇幅所限,对于四氢呋喃环只出现在合成路线中,但不包含在最终天然产物目标分子中的,本综述未予涉及。
1 [4+1]会聚式四氢呋喃环合成策略在天然产物中的应用
如图式2所示,目前已有应用报道的四氢呋喃环[4+1]合成策略都是在较易形成的碳氧键处进行切断,切去与氧原子相连的1个碳原子;通过将另外3个碳原子和1个氧原子先连接在一个底物中,再与含有剩余1个碳原子的底物进行[4+1]反应。
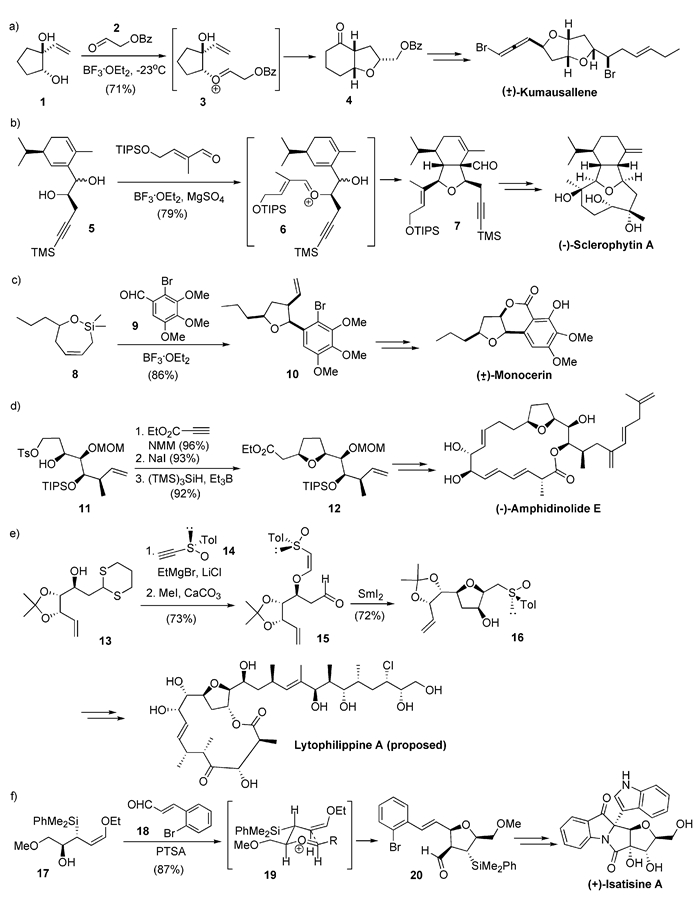
1991年,Overman等开发了基于[4+1]策略的四氢呋喃合成法[7, 8],并使用其成功地完成了含双四氢呋喃环的天然产物Kumausallene的消旋体全合成[9, 10]。在三氟化硼乙醚条件下,他们将二醇(1)与醛(2)缩合生成氧鎓离子中间体3,从而引发串联的Prins环化/频那醇重排,高立体选择性得到含有四氢呋喃骨架的中间体4,再经Baeyer-Villiger氧化等反应引入第二个四氢呋喃环,最终合成了Kumausallene(图式3(a))。他们还使用类似策略完成了以Sclerophytin A[11](图式3(b))为代表的一系列含四氢呋喃环复杂天然产物的全合成[8]。
2006年,Cassidy等[12]以简洁的会聚式路线完成了含有四氢呋喃环的抗真菌天然产物Monocerin的全合成。其关键反应使用了其课题组开发的环状烯丙基硅氧烷(8)与醛(9)的[4+1]四氢呋喃合成法,高非对映选择性生成了三取代四氢呋喃环而得到化合物10,进而完成天然产物Monoberin的消旋体全合成(图式3(c))。
Amphidinolide天然产物具有多种生物活性,其抗肿瘤活性尤为突出[13]。Amphidinolide家族包括40多个结构类似的大环内酯类化合物,其中近20个包含四氢呋喃结构。2006年,Lee课题组[14]报道了Amphidinolide E的不对称全合成。为得到分子中的四氢呋喃片段,他们使用了[4+1]的合成策略(图式3(d)):化合物11可与丙炔酸乙酯进行1, 4-加成,其产物经取代得到的碘化物可在自由基条件下加成环化,高非对映选择性地生成含四氢呋喃环的中间体12。再经后续步骤最终合成了天然产物Amphidinolide E。之后在2008年,他们[15]使用相似的策略还完成了Amphidinolide K的不对称全合成。另外,使用丙炔酸乙酯的手性亚砜类似物14,他们[16]还通过[4+1]策略合成了具有抗菌活性的天然产物Lytophilippine A在原始文献中的推定结构(图式3(e))。在该合成路线中,二噻烷13可以和手性亚砜14进行1, 4-加成,生成的双键顺式产物再脱除二噻烷单元得到醛15。15可以在SmI2存在下发生自由基环化,由于Sm可以同时与醛基和亚砜的氧原子进行配位,从而在环化四氢呋喃环的同时,高立体选择性地引入了两个新的手性中心。采用手性亚砜的[4+1]策略,他们[17]还完成了Amphidinolide X的不对称全合成。
2015年,Panek等[18, 19]报道了具有抗病毒活性的天然产物Isatisine A的不对称全合成。在对甲苯磺酸存在下,烯醇醚(17)和醛(18)发生Mukaiyama型反应,经氧鎓离子过渡态19(文献[18]和[19]都将此反应写作Mukaiyama型[3+2]反应,但由于其氧鎓离子的氧原子来自17的醇羟基,而不是醛18,笔者认为应将其归类为[4+1]反应),高非对映选择性地合成了四取代四氢呋喃关键中间体20,并最后完成天然产物Isatisine A的全合成(图式3(f))。
2 [3+2]会聚式四氢呋喃环合成策略在天然产物中的应用
在已报道的全合成实例中,四氢呋喃环的[3+2]合成策略主要有如前面图式2所示的三种逆合成切断方式:(1) 切去与氧原子不邻接的C2片段,此方式一般通过羰基叶立德的环加成协同反应实现;(2) 切去氧原子及其相邻的C1片段,此方式多使用易生成1, 3-偶极合成子的C3片段与羰基化合物进行串联反应连接环化;(3) 切去邻接氧原子的C2片段,此方式则一般使用α-羟基醛与富电子的烯烃进行串联反应连接环化。
2.1 羰基叶立德[3+2]反应的应用实例
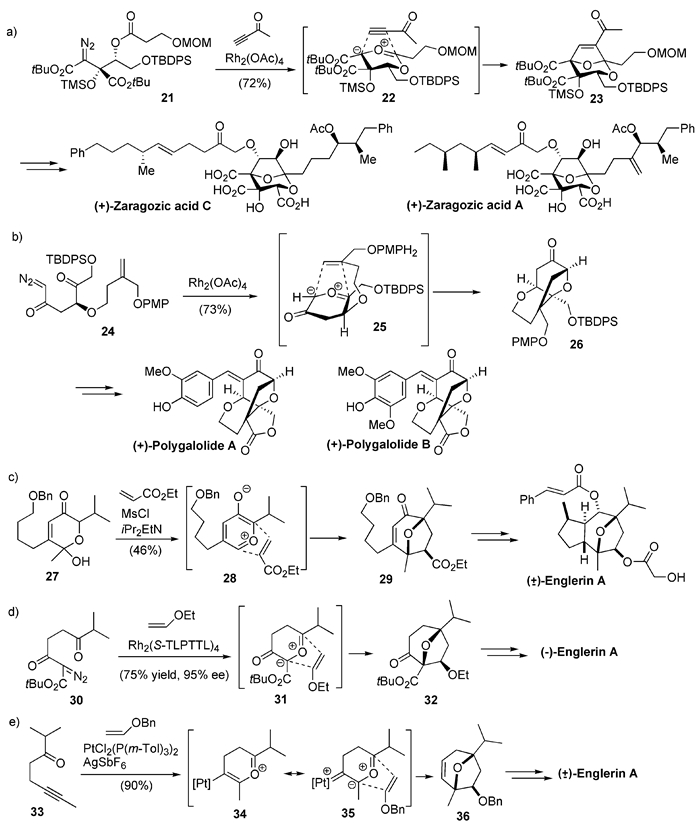
聚酮类天然产物Zaragozic acid具有抑制鲨烯合成酶和法尼基转移酶活性,由于独特的分子骨架和显著的生物学活性引起了合成界的研究兴趣,超过30个研究组报道了这类天然产物的全合成工作。其中,2003年Hashimoto等[20]完成了Zaragozic acid C的不对称全合成,2006年他们[21]使用相同策略还完成了Zaragozic acid A的不对称全合成。其关键反应都是由重氮化合物21在Rh催化下先生成羰基叶立德中间体22,再与炔基酮发生[3+2]的1, 3-偶极环加成,从而立体选择性地得到化合物23;进而完成目标天然产物的全合成(图式4(a))。使用类似的分子内[3+2]环加成反应,他们[22, 23]还报道了含四氢呋喃环天然产物Polygalolide A和B的全合成,并鉴定了其绝对立体构型(图式4(b))。
愈创木烷型倍半萜Englerin A对肾癌细胞系具有显著抑制作用,目前已有十余篇全合成和形式全合成的报道。其中,Nicolaou等[24]以吡喃叶立德28为活性中间体,与丙烯酸乙酯进行[3+2](也可称为[5+2])环加成反应,高非对映选择性地得到化合物29,进而完成了Englerin A消旋体的全合成(图式4(c))。2015年,Hanari等[25]使用手性的Rh催化剂,由前手性重氮化合物30和烯醇乙醚发生[3+2]环加成,对映选择性合成了手性化合物32,进而完成了Englerin A不对称的全合成(图式4(d))。2016年,Kusama等[26]通过他们开发的Pt催化环化反应,以炔酮33为原料,先生成含有Pt的羰基叶立德中间体35,再与烯醇苄醚的进行[3+2]环加成,可得到单一非对映异构体36,最后也完成了Englerin A消旋体的全合成(图式4(e))。
2.2 羰基作为C2片段的[3+2]反应应用实例
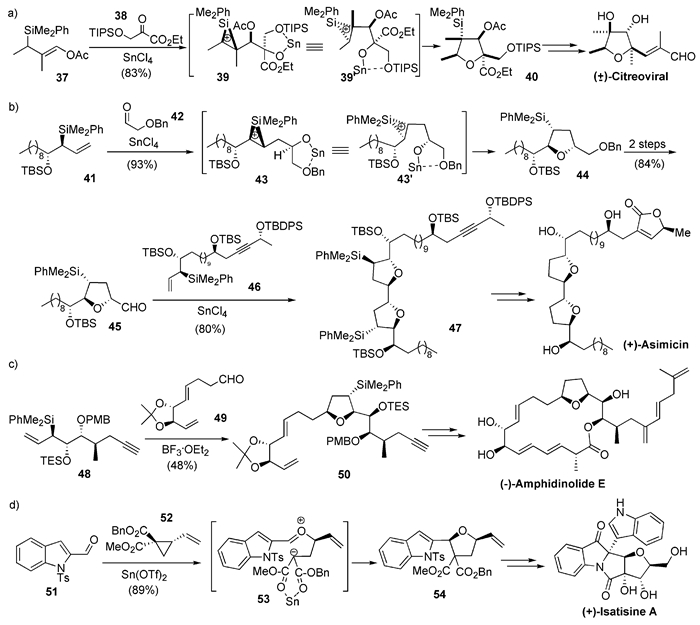
2002年,Peng等[27]使用使用烯丙基硅烷37与醛38在SnCl4作用下发生非对映选择性加成反应,生成具有一定稳定性的环丙硅烷正离子39,再进行串联的分子内关环,从而高选择性地生成了硅基迁移的四氢呋喃化合物40,进而完成了天然产物Citreoviral的消旋体全合成(图式5(a))。
番荔素是一大类一般含有四氢呋喃环的聚酮天然产物,可具有多种生物活性,特别是其抗肿瘤活性尤为引人关注[28]。2005年,Roush课题组[29]进一步发展了使用烯丙基硅烷作为1, 3-偶极合成子的[3+2]策略,在合成路线中两次使用此关键反应(由41与42合成44,及由45与46合成47),从而高度会聚地完成了含双四氢呋喃环的番荔枝内酯Asimicin的不对称全合成(图式5(b))。其后他们[30]使用相同策略还完成了Asimicin的差相异构体天然产物Bullatacin的不对称全合成。另外,他们[31]还用此策略将烯丙基硅烷48与醛49反应,高度会聚地完成了的Amphidinolide E的不对称全合成(图式5(c))。
图式3(f)中化合物Isatisine A的首次不对称全合成是由Karadeolian等于2010年完成的。他们[32, 33]应用了由Pohlhaus等[34]报道的[3+2]型反应,使化合物51的醛基氧与手性环丙烷化合物52发生离子对机理的亲核取代,生成的中间体53再发生分子内加成环化,可以立体选择性地得到化合物54,进而完成了Isatisine A的全合成(图式5(d))。
2.3 α-羟基醛为C3片段的[3+2]反应应用实例
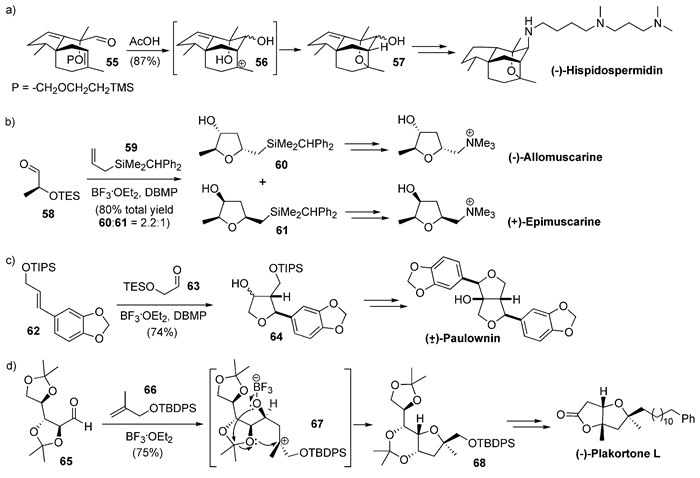
Tamiya等[35, 36]完成了细胞生长抑制剂生物碱(-)-Hispidospermidin的不对称全合成。其关键的四氢呋喃成环反应就是带保护基的α-羟基醛55在酸性条件下发生分子内的Prins反应,生成碳正离子中间体56,再串联与去保护的羟基关环(图式6(a))。
2002年,Angle等[37]使用同上机理的分子间反应,从三乙基硅(TES)保护的α-羟基醛58和烯丙基硅烷59合成了四氢呋喃化合物60及其异构体61,进而完成了天然产物(-)-Allomuscarine和(+)-Epimuscarine的不对称全合成(图式6(b))。使用带有推电子基的苯环替代烯丙位硅基以稳定碳正离子中间体,他们[38]还完成了具有抗氧化活性的天然产物Paulownin的消旋体全合成(图式6(c))。
2014年,Sugimura等[39]完成了天然产物Plakortone L的不对称全合成。其关键反应也是与上面相似的Prins型[3+2]反应,但他们使用的烯烃66为1, 1-二取代烯烃,对醛65加成后,可生成稳定的叔碳正离子67,再进一步关环及保护基迁移,从而高非对映选择性地得到四氢呋喃化合物68,并最终合成了Plakortone L(图6式(d))。
3 结语
四氢呋喃环广泛存在于具有生物活性的天然产物的结构之中。立体选择性地构筑四氢呋喃环往往成为这些天然产物全合成研究中的关键。本文归纳了已有全合成报道中的四氢呋喃环成环策略,特别是以实例展示了其中的会聚式合成策略在近年的发展。相比于直线型的分子内四氢呋喃关环策略,以[4+1]、[3+2]为代表的会聚式环化策略能够使全合成的整体路线更加简洁高效,更符合全合成研究领域的发展趋势[40]。
从本文所举的实例来看,目前在全合成中应用的会聚式四氢呋喃成环策略,还有如下问题有待进一步解决:(1) 相比于海量的直线型合成实例,会聚式策略的实例还很有限;(2) 多数例子中的成环反应在整体路线的中前期实施,在全合成后期成环的例子很少;(3) 会聚式合成的底物之一往往较为简单(特别是叶立德[3+2]策略的实例中),没能充分体现会聚式策略的优势;(4) 会聚式合成的原料之一般含有羰基,但除了羰基叶立德方法之外,一般都只使用醛羰基作为原料,使用酮羰基的几乎没有。
以上这些问题,其实主要因为相比于其他杂环,目前四氢呋喃环的会聚式合成法还较为有限,特别是高效、高选择性并且条件温和可用于复杂天然产物全合成的方法很少。但是可以预期,随着活性四氢呋喃分子合成需求的逐渐提高,以及当代有机合成方法学的高速发展,不断会有新的四氢呋喃环合成方法[41, 42]、合成策略(如[2+2+1][43]、其他的[4+1]切断法等)被开发出来,并成功应用到复杂天然产物的高度会聚式全合成当中。
-
-
[1]
A Lorente, J Lamariano-Merketegi, F Albericio et al. Chem. Rev., 2013, 113(7): 4567~4610. https://www.researchgate.net/publication/236058529_ChemInform_Abstract_Tetrahydrofuran-Containing_Macrolides_A_Fascinating_Gift_from_the_Deep_Sea?ev=prf_cit
-
[2]
A E Wróblewski, I E Głowacka, D G Piotrowska. Eur. J. Med. Chem., 2016, 118: 123~142. https://www.researchgate.net/publication/309670598_Acyclic_nucleoside_phosphonates_containing_the_amide_bond
-
[3]
孙彦君, 王俊敏, 王雪等. 中成药, 2014, 36(10): 2159~2162. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zcya201410034&dbname=CJFD&dbcode=CJFQ
-
[4]
A de la Torre, C Cuyamendous, V Bultel-Poncé et al. Tetrahedron, 2016, 72(33): 5003~5025. https://www.researchgate.net/publication/304746892_Recent_Advances_in_the_Synthesis_of_Tetrahydrofurans_and_Applications_in_Total_Synthesis
-
[5]
A Tikad, J A Delbrouck, S P Vincent. Chem. Eur. J., 2016, 22(28): 9456~9476. https://www.researchgate.net/publication/304005811_Debenzylative_Cycloetherification_An_Overlooked_Key_Strategy_for_Complex_Tetrahydrofuran_Synthesis
-
[6]
R D C Pullin, R M Lipiński, T J Donohoe. Pure Appl. Chem., 2013, 85(6): 1175~1184. https://www.iupac.org/publications/pac/85/6/1175/
-
[7]
M J Brown, T Harrison, P M Herrinton et al. J. Am. Chem. Soc., 1991, 113(14): 5365~5378. https://www.researchgate.net/publication/231431603_Acid-promoted_reaction_of_cyclic_allylic_diols_with_carbonyl_compounds_Stereoselective_ring-enlarging_tetrahydrofuran_annulations
-
[8]
L E Overman, L D Pennington. J. Org. Chem., 2003, 68(19): 7143~7157. https://www.researchgate.net/publication/10571948_Strategic_Use_of_Pinacol-Terminated_Prins_Cyclizations_in_Target-Oriented_Total_Synthesis
-
[9]
M J Brown, T Harrison, L E Overman. J. Am. Chem. Soc., 1991, 113(14): 5378~5384. https://www.researchgate.net/publication/231431603_Acid-promoted_reaction_of_cyclic_allylic_diols_with_carbonyl_compounds_Stereoselective_ring-enlarging_tetrahydrofuran_annulations
-
[10]
T A Grese, K D Hutchinson, L E Overman. J. Org. Chem., 1993, 58(9): 2468~2477. https://www.researchgate.net/publication/231569381_General_approach_to_halogenated_tetrahydrofuran_natural_products_from_red_algae_of_the_genus_Laurencia_Total_synthesis_of_--kumausallene_and_--1-epi-kumausallene
-
[11]
D W C MacMillan, L E Overman, L D Pennington. J. Am. Chem. Soc., 2001, 123(37): 9033~9044. https://www.researchgate.net/publication/11794514_A_General_Strategy_for_the_Synthesis_of_Cladiellin_Diterpenes_Enantioselective_Total_Syntheses_of_6-Acetoxycladiell-71611-dien-3-ol_Deacetoxyalcyonin_Acetate_Cladiell-11-ene-367-triol_Sclerophytin_A_a
-
[12]
J H Cassidy, C N Farthing, S P Marsden et al. Org. Biomol. Chem., 2006, 4(22): 4118~4126. http://www.researchgate.net/publication/6492764_a_concise_convergent_total_synthesis_of_monocerin
-
[13]
T K Chakraborty, S Das. Cur. Med. Chem.: Anti-Cancer Agents, 2001, 1(2): 131~149. https://www.researchgate.net/publication/7637082_Chemistry_of_Potent_Anti-Cancer_Compounds_Amphidinolides
-
[14]
C H Kim, H J An, W K Shin et al. Angew. Chem. Int. Ed., 2006, 45(47): 8019~8021. https://www.researchgate.net/publication/6703433_Total_Synthesis_of_--Amphidinolide_E
-
[15]
H M Ko, C W Lee, H K Kwon et al. Angew. Chem. Int. Ed., 2009, 48(13): 2364~2366.
-
[16]
K P Jang, S Y Choi, Y K Chung et al. Org. Lett., 2011, 13(9): 2476~2479.
-
[17]
J H Jung, E Lee. Angew. Chem. Int. Ed., 2009, 48(31): 5698~5700. https://www.researchgate.net/publication/24410922_Expedient_Synthesis_of_--Amphidinolide_X
-
[18]
J Lee, J S Panek. Org. Lett., 2011, 13(3): 502~505. https://www.researchgate.net/publication/49712378_Total_Synthesis_of_-Isatisine_A
-
[19]
J Lee, J S Panek. J. Org. Chem., 2015, 80(6): 2959~2971. https://www.researchgate.net/publication/273150181_Total_Synthesis_of_-Isatisine_A_Application_of_a_Silicon-Directed_Mukaiyama-Type_3_2-Annulation
-
[20]
S Nakamura, Y Hirata, T Kurosaki et al. Angew. Chem. Int. Ed., 2003, 42(43): 5351~5355. https://www.researchgate.net/publication/9013058_Total_Synthesis_of_the_Squalene_Synthase_Inhibitor_Zaragozic_Acid_C_by_a_Carbonyl_Ylide_Cycloaddition_Strategy
-
[21]
Y Hirata, S Nakamura, N Watanabe et al. Chem. Eur. J., 2006, 12(35): 8898~8925. https://www.researchgate.net/publication/6690698_Total_Syntheses_of_Zaragozic_Acids_A_and_C_by_a_Carbonyl_Ylide_Cycloaddition_Strategy
-
[22]
S Nakamura, Y Sugano, F Kikuchi et al. Angew. Chem. Int. Ed., 2006, 45(39): 6532~6535. https://www.researchgate.net/publication/6835697_Total_Synthesis_and_Absolute_Stereochemistry_of_Polygalolides_A_and_B
-
[23]
Y Sugano, F Kikuchi, A Toita et al. Chem. Eur. J., 2012, 18(31): 9682~9690. https://www.researchgate.net/publication/228115637_Total_Syntheses_of_-Polygalolide_A_and_-Polygalolide_B_Elucidation_of_the_Absolute_Stereochemistry_and_Biogenetic_Implications
-
[24]
K C Nicolaou, Q Kang, S Y Ng et al. J. Am. Chem. Soc., 2010, 132(23): 8219~8222. https://www.researchgate.net/publication/44624967_Total_Synthesis_of_Englerin_A
-
[25]
T Hanari, N Shimada, Y Kurosaki et al. Chem. Eur. J., 2015, 21(33): 11671~11676.
-
[26]
H Kusama, A Tazawa, K Ishida et al. Chem. Asian J., 2016, 11(1): 64~67. https://www.researchgate.net/publication/282042140_Total_Synthesis_of_-Englerin_A_Using_An_Intermolecular_32_Cycloaddition_Reaction_of_Platinum-Containing_Carbonyl_Ylide
-
[27]
Z Peng, K A Woerpel. Org. Lett., 2002, 4(17): 2945~2948. https://www.researchgate.net/publication/11204062_Synthesis_of_-5-_e_pi_-Citreoviral_and_-Citreoviral_and_the_Kinetic_Resolution_of_an_Allylic_Silane_by_a_3_2_Annulation
-
[28]
陈勇, 邱燕, 苗筠杰等. 现代中药研究与实践, 2016, 30(3): 80~86. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=jzzy201603025&dbname=CJFD&dbcode=CJFQ
-
[29]
J M Tinsley, W R Roush. J. Am. Chem. Soc., 2005, 127(31): 10818~10819. https://www.researchgate.net/publication/7615864_Synthesis_of_-Bullatacin_via_the_Highly_Diastereoselective_32_Annulation_Reaction_of_a_Racemic_Aldehyde_and_a_Non-Racemic_Allylsilane
-
[30]
J M Tinsley, E Mertz, P Y Chong et al. Org. Lett., 2005, 7(19): 4245~4248. https://www.researchgate.net/publication/7615864_Synthesis_of_-Bullatacin_via_the_Highly_Diastereoselective_32_Annulation_Reaction_of_a_Racemic_Aldehyde_and_a_Non-Racemic_Allylsilane
-
[31]
P Va, W R Roush. J. Am. Chem. Soc., 2006, 128(50): 15960~15961. https://www.researchgate.net/publication/7683833_Total_Synthesis_of_Asimicin_via_Highly_Stereoselective_3_2_Annulation_Reactions_of_Substituted_Allylsilanes
-
[32]
A Karadeolian, M A Kerr. Angew. Chem. Int. Ed., 2010, 49(6): 1133~1135. doi: 10.1055/s-0029-1219450
-
[33]
A Karadeolian, M A Kerr. J. Org. Chem., 2010, 75(20): 6830~6841. doi: 10.1055/s-0029-1219450
-
[34]
P D Pohlhaus, S D Sanders, A T Parsons et al. J. Am. Chem. Soc., 2008, 130(27): 8642~8650. https://www.researchgate.net/publication/5313218_Scope_and_Mechanism_for_Lewis_Acid-Catalyzed_Cycloadditions_of_Aldehydes_and_Donor-Acceptor_Cyclopropanes_Evidence_for_a_Stereospecific_Intimate_Ion_Pair_Pathway
-
[35]
J Tamiya, E J Sorensen. J. Am. Chem. Soc., 2000, 122(39): 9556~9557. https://www.researchgate.net/publication/231448409_A_Concise_Synthesis_of_--Hispidospermidin_Guided_by_a_Postulated_Biogenesis
-
[36]
J Tamiya, E J Sorensen. Tetrahedron, 2003, 59(35): 6921~6932. https://www.researchgate.net/publication/229231653_A_Spontaneous_Bicyclization_Facilitates_a_Synthesis_of_--Hispidospermidin
-
[37]
S R Angle, N A El-Said. J. Am. Chem. Soc., 2002, 124(14): 3608~3613.
-
[38]
S R Angle, I Choi, F S Tham. J. Org. Chem., 2008, 73(16): 6268~6278. https://www.researchgate.net/publication/51420684_Stereoselective_Synthesis_of_3-Alkyl-2-aryltetrahydrofuran-4-ols_Total_Synthesis_of_-Paulownin
-
[39]
H Sugimura, S Sato, K Tokudome et al. Org. Lett., 2014, 16(12): 3384~3387. http://en.cnki.com.cn/Article_en/CJFDTOTAL-TJFZ201306016.htm
-
[40]
D Urabe, T Asaba, M Inoue. Chem. Rev., 2015, 115(17): 9207~9231. http://www.chemie.de/fachpublikationen/874431/cheminform-abstract-convergent-strategies-in-total-syntheses-of-complex-terpenoids.html
-
[41]
S M Nicolle, W Lewis, C J Hayes et al. Angew. Chem. Int. Ed., 2015, 54(29): 8485~8489. https://www.mendeley.com/research-papers/stereoselective-synthesis-highly-substituted-tetrahydrofurans-through-diverted-carbene-oh-insertion/
-
[42]
G Jiang, Y Wang, Z Yu. J. Org. Chem., 2013, 78(14): 6947~6955.
-
[43]
Y Hashimoto, K Itoh, A Kakehi et al. J. Org. Chem., 2013, 78(12): 6182~6195. http://www.chemie.de/fachpublikationen/573017/diastereoselective-synthesis-of-tetrahydrofurans-by-lewis-acid-catalyzed-intermolecular-carbenoid-carbonyl-reaction-cycloaddition-sequences-unusual-diastereoselectivity-of-lewis-acid-catalyzed-cycloadditions.html
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:





 下载:
下载:

