 图 1
(a) 蛋白石;(b) 典型的胶体晶体电镜图[14]
Figure 1.
(a) Natural opal; (b) Typical SEM image of colloidal crystals [14]
图 1
(a) 蛋白石;(b) 典型的胶体晶体电镜图[14]
Figure 1.
(a) Natural opal; (b) Typical SEM image of colloidal crystals [14]

Citation: Wang Huan, Shang Luoran, Rong Fei, Gu Zhongze, Zhao Yuanjin. Colloidal Crystal Beads with Biomedical Applications[J]. Chemistry, 2017, 80(3): 219-227.

胶体晶体微球及其生物医学应用#
English
Colloidal Crystal Beads with Biomedical Applications
-
Key words:
- Colloidal crystal
- / Microbeads
- / Microfluidics
- / Biomaterials
- / Biomedical engineering
-
光子晶体 (Photonic crystals,PhCs) 是一种由折射率不同的介质周期性有序排列而成的结构材料 (图 1a)[1, 2]。这种材料可以调制电磁波,并且可以通过控制介质的周期性变化以及材料的形状展现出光子禁带 (Photonic band gap,PBG) 的特性。与半导体中的电子禁带类似,光子禁带为光子晶体提供了操纵光子及其能量的可能性。因此,光子晶体的出现有可能为下一代微光学器件的发展提供革命性的技术突破[3, 4]。在过去的20年里,有许多针对新型光子晶体材料研发及相关的新现象的研究。在各种制备光子晶体材料的方法中,最有前景的技术是利用单分散胶体纳米粒子组装成有序的胶体晶体 (图 1b)[5~8]。天然光子晶体的形状往往不规则,而人工合成的胶体晶体可以制备成薄膜或者块状以满足不同研究的需求。在这些材料中,纳米粒子主要形成热力学能量最低的面心立方 (FCC) 结构。胶体晶体的光子禁带可以通过布拉格方程 (式 (1)) 和斯内尔方程 (式 (2)) 来估算[9, 10]:
其中,m是衍射级数,λ是衍射峰的波长,n是折射率,d是胶体晶体的晶格间距,θ为掠射角,n1,n2分别是介质1和介质2的折射率,θ1和θ2分别是入射角和折射角,neff为胶体晶体的平均折射率,衍射级数和空气的折射率均取1。物体的颜色由其反射出来的光决定。对于胶体晶体材料,由于观察角度的不同,所接收到的反射光线的角度也不一样。根据方程 (3),当入射角发生改变时,反射波长也会相应地发生改变,因此胶体晶体材料在不同角度观察会有颜色差异,这一特性赋予了胶体晶体材料鲜艳的颜色,并有着多种用途[8]。然而,这种角度有偏特性在构建宽视角材料和传感设备中却是一个不利因素,因为为了达到高保真的效果,需要在较宽的视角内保持颜色基本不变[11]。
 图 1
(a) 蛋白石;(b) 典型的胶体晶体电镜图[14]
Figure 1.
(a) Natural opal; (b) Typical SEM image of colloidal crystals [14]
图 1
(a) 蛋白石;(b) 典型的胶体晶体电镜图[14]
Figure 1.
(a) Natural opal; (b) Typical SEM image of colloidal crystals [14]
最近,球形胶体晶体材料引起了研究者广泛的关注[12, 13]。由于球形胶体晶体尺寸较小且具有对称结构,因此从不同角度观察时所接收到的反射光的光谱分布基本一致,即角度无偏,微球颜色由反射最强的光决定[11]。这拓宽了胶体晶体的应用范围。以含有胶体纳米粒子的液滴为模板,可以利用液体蒸发诱导纳米粒子组装,或者直接聚合来制备胶体晶体,这些方法十分简便。特别是随着微流控技术被用于制备液滴模板,球形胶体晶体的发展取得了巨大的进步。微流控技术不仅保证了液滴模板的单分散性,还增加了胶体晶体微球的结构与功能的多样性,为先进光电子器件的发展提供了一条可行的路径。
如今,光子晶体材料相关的研究不断发展,研究者们对胶体晶体微球的探索也逐渐深入,开发了多种基于胶体晶体微球的生物医学应用。然而,很少有人对胶体晶体微球及其生物医学应用进行系统性的总结。本文根据笔者课题组近年来的研究成果,结合国内外的最新研究进展,总结了胶体晶体微球在生物医学方面的重要应用。首先介绍胶体晶体微球的制备方法,之后着重阐述胶体晶体微球在生物医学上的应用,最后对胶体晶体微球的未来发展方向进行展望。
1 胶体晶体微球的分类及制备
根据胶体晶体微球拓扑结构的不同,可以将其分为均质结构、Janus或多组分结构、核壳结构和中空结构四种。根据胶体晶体中纳米结构排列的不同,又可以将胶体晶体分为密堆积胶体晶体、非密堆积胶体晶体以及反蛋白石三种。
1.1 均质结构的胶体晶体微球
1.2 Janus或多组分结构的胶体晶体微球
Janus微球是由两种不同组分形成的具有两种不同形貌和性质的微球。Janus结构的胶体晶体微球具有各向异性,因此有了更多的功能。Janus胶体晶体微球可以通过在液滴模板中的胶体纳米粒子相分离来制备[38~40]。例如,含有单分散SiO2纳米粒子和尺寸较小的磁性纳米粒子的液滴在有磁场的情况下会出现相分离。液滴干燥后,SiO2纳米粒子遵循能量最低原理形成密堆积结构,磁性纳米粒子则会在磁场的作用下只填充在微球一侧的空隙中 (图 5a)[40]。这样制备出来的Janus胶体晶体微球同时具有光子禁带结构和磁场响应的特性 (图 5b~5d),且反射光谱仍保持着较窄的半峰宽 (图 5e)。
通过双组分或多组分液滴模板也可以直接得到有两个或多个不同区域的Janus或多组分胶体晶体微球 (图 6a)[26, 41, 42]。液滴模板通过多通道毛细管微流控装置制备,不同组分的流体通过不同的通道注入。所用的流体可以是分散SiO2纳米粒子的ETPTA胶体溶液,通过调节SiO2纳米粒子的浓度可以使胶体溶液显示出不同的结构色。这些流体可以在微流控通道中形成并行流,在受到连续相的剪切力时,并行流会被剪切成一个个多组分液滴模板,液滴模板在一定距离内可以保持结构稳定。经过聚合就可以得到固化的胶体晶体微球及相应的多组分结构 (图 6b~6d)[41]。为了使所制备的Janus或多组分胶体晶体微球具有更多功能,可在其中一相乳液中加入炭黑或磁性纳米粒子,从而实现微球在电场或磁场下的可控运动[41, 43]。
1.3 核壳结构的胶体晶体微球
除了单乳液,使用内部包裹有小液滴的双乳液液滴作为模板可以制备核壳结构胶体晶体微球[44~48]。例如,利用逐步乳化液滴微流控装置,生成包裹有非密堆积胶体晶体的微球。在图 7中,纳米粒子非密堆积排布组成ETPTA内核,壳层是PEGDA,通过控制内相通道的数量可以制备出多核的微球。用同样的方法,以纳米粒子溶液作为中间相时,可以制备出壳层为非密堆积胶体晶体的微球[48]。核壳结构的胶体晶体微球也可以通过刻蚀SiO2模板的方法来制备,类似于反蛋白石微球的制备过程[49, 50]。由于微球的刻蚀过程是由外向内逐步进行的,因此通过控制刻蚀时间就可以得到核壳结构的胶体晶体微球 (图 8)。该微球具有密堆积的胶体晶体核和反蛋白石结构的水凝胶壳结构。由于这种方法制备出的胶体晶体微球的核和壳层的折射率不同,因此会出现两个不同的光子禁带。
1.4 中空结构的胶体晶体微球
基于双乳液体系,利用空化现象和胶体晶体自组装过程可以构建可悬浮的多功能胶体晶体编码微球[51, 52]。空化是指当液体内局部压力降低到一定程度时,在液体内部或液固界面上自发形成蒸汽或气体空穴 (空泡) 的现象。通常认为,液体内部或界面存在着气核,即纳米气泡。当发生空化现象时,纳米气泡通过均质或异质集结而形成较大的甚至是肉眼可见的气泡[53~56]。将微流控技术与空化现象相结合,通过微流控技术制备出尺寸在几十至几百微米范围的单分散微胶囊,其壳层为选择透过性的树脂材料,内核为胶体纳米粒子水溶液。
然后诱导微胶囊内部产生空化现象。在此过程中,微胶囊内部产生的气泡使其整体密度降低从而处于悬浮态。与此同时,胶体纳米粒子在固-液界面上自组装并最终在微胶囊壳层的内壁形成有序的六方密堆积排列的胶体晶体层,从而制备出双壳层的中空胶体晶体微球 (图 9)。中空胶体晶体微球的最外层为透明的聚合物,中间层为胶体晶体,内部为空心的气泡结构。在实际应用过程中,可以通过改变胶囊生成过程中的参数来对载体的整体密度进行调控,从而使其在待检测液体中处于悬浮态。载体的编码信息来自于其胶体晶体层的结构色,由于胶体晶体的反射光谱源自其自身的物理结构,因此其特征反射峰的位置在应用中可以保持稳定。此外,胶体晶体层被透明的聚合物壳层包裹,使其免受外界干扰,进一步提高了编码的稳定性。通过制备多核微胶囊,中空胶体晶体微球的编码量得到了很大扩增。通过在微流控乳化过程中加入磁性纳米粒子,还可实现载体的磁控运动,从而使中空胶体晶体微球的功能得到拓展。
 图 9
(a) 微流控制备液滴模板示意图;(b) 液滴模板空化及自组装示意图;(c~e) 三种不同颜色的微气泡胶体晶体微球;(f~h) 微气泡胶体晶体微球的表面电镜图、剖面图[52]
Figure 9.
Schematic of (a) the generation of droplet templates; (b) the progress of cavitation and self-assembly of the droplet templates; (c~e) Three kinds of hollow PCBs; (f~h) SEM images of the surface and the cross-section of the PCBs [52]
图 9
(a) 微流控制备液滴模板示意图;(b) 液滴模板空化及自组装示意图;(c~e) 三种不同颜色的微气泡胶体晶体微球;(f~h) 微气泡胶体晶体微球的表面电镜图、剖面图[52]
Figure 9.
Schematic of (a) the generation of droplet templates; (b) the progress of cavitation and self-assembly of the droplet templates; (c~e) Three kinds of hollow PCBs; (f~h) SEM images of the surface and the cross-section of the PCBs [52]
1.1.2 非密堆积胶体晶体微球
非密堆积胶体晶体微球可以通过含有胶体纳米粒子的水相或油相液滴模板来制备[23~26]。当液滴模板中带电荷的胶体纳米粒子达到一定浓度时,粒子之间会产生明显的斥力,从而使液滴模板中的粒子排列成类似于FCC结构的非密堆积或者体心立方 (BCC) 结构。由于纳米粒子的周期性排布,液滴模板也有了光子禁带的特性。向液滴模板中加入不带电的可聚合单体,如聚乙二醇二丙烯酰胺 (PEGDA) 和异丙基丙烯酰胺 (NIPAM) 等,聚合后可以在非密堆积的纳米粒子间形成水凝胶网格,使得纳米粒子的位置可以永久固定,从而适用于各种不同的环境 (图 3)[23]。非密堆积的胶体晶体阵列也可以由非极性的液相制得。此时,溶剂需要易于挥发,且便于粒子分散,最终形成的液滴中的油相具有较高的沸点。例如,用乙氧基化三羟甲基丙烷三丙烯酸酯 (ETPTA) 作为油相,所得的分散有SiO2纳米粒子的ETPTA可以通过搭配有紫外聚合灯的液滴微流控装置固化。固化得到的含SiO2纳米粒子的ETPTA胶体晶体微球中纳米粒子排布与聚合前的液滴模板相同,因此可以展现出明亮的结构色[26]。
1.1.3 反蛋白石微球
与反蛋白石薄膜类似,反蛋白石微球可以通过模板法或共组装法来制备。在模板法中,反蛋白石骨架材料占据着模板中的空穴位置 (图 4a,4b)。在制备反蛋白石薄膜时,填充材料通常有纳米粒子 (尺寸远小于空穴通道)、金属氧化物前聚体溶液和水凝胶预聚物溶液等[28~32]。在用刚性材料制备反蛋白石微球时,很难将反蛋白石-胶体晶体复合微球完整剥离出来[28]。然而,使用柔软的水凝胶材料时,即使复合微球完全嵌在水凝胶里面,也可以在不破坏胶体晶体微球模板的情况下剥离出复合微球;剥离出来的复合微球除去模板后,就可以得到一个完整的反蛋白石水凝胶微球。在共组装方法中,胶体晶体微球模板的形成和空穴中骨架材料的填充是同时进行的[33~37]。例如,将几百纳米的聚苯乙烯粒子和几个纳米的SiO2或TiO2粒子混合,并将其分散成液滴,干燥后即可获得共组装胶体晶体微球。理论上,聚苯乙烯纳米粒子以FCC形式密堆积排列,粒子之间的空隙被SiO2纳米粒子完全填充,两种粒子的体积比约为3.85。
实际上,由于在干燥过程中聚苯乙烯纳米粒子运动得更快,且在固化后SiO2纳米粒子没有完全填充满聚苯乙烯粒子间的空隙,完成共组装时两种粒子的体积比约为9 :1。除去聚苯乙烯粒子模板后,即可得到SiO2反蛋白石微球 (图 4c)[34]。
1.1.1 密堆积胶体晶体微球
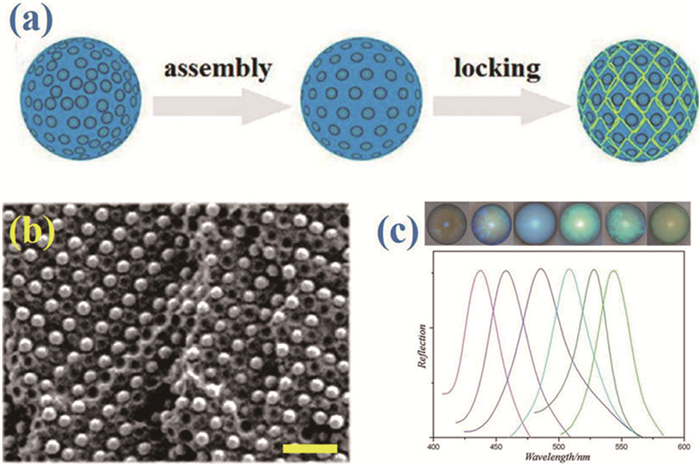
密堆积胶体晶体微球实际上就是球形胶体晶体团簇。溶剂蒸发诱导液滴模板内的胶体纳米粒子组装成球是最常用的胶体晶体微球制备方法 (图 2)[15~17]。与二维光子晶体类似,组成胶体晶体微球的粒子按FCC排布,在微球的表面形成 (111) 面。由于微球由粒子组成,表面较为粗糙,因此胶体晶体微球存在着本征缺陷和晶界。不过当微球的粒径远大于纳米粒子粒径 (数百倍) 时,这些影响可以忽略。胶体晶体微球的大小由生成的液滴模板的大小和纳米粒子的浓度共同决定,为了制备均一的胶体晶体微球,可以将不同粒径的纳米粒子胶体浓度统一,再用微流控技术制备单分散液滴模板[18~21]。值得注意的是,虽然微球经过固化,粒子以密堆积的形式排列并存在着范德华力,但是因为范德华力很弱,它的结构仍然比较脆弱,在搅拌和振荡时还是会很容易被破坏。为了解决这个问题,通常还要对微球进行高温煅烧。当温度接近于聚合物或者SiO2的玻璃化温度时,纳米粒子会变得有一定的黏性,并与周围的粒子发生轻微的融合。经过这样的处理之后,胶体晶体微球的机械强度会大幅提高,在振荡、搅拌甚至超声时仍可保持稳定[22]。
2 胶体晶体在生物医学中的应用
2.1 编码液相芯片
高通量分析在生物医学中有着广泛应用,而高通量分析的实现往往需要借助于可靠的多元编码技术。一种可行的策略就是使用微球编码。该方法通常利用微球的特征组分来编码信息,并且可以便于观察 (图 10a)。在众多的微球编码方法中,以荧光染料和量子点为代表的光学编码由于编码和检测过程简便最为常用。然而这些编码方式也暴露出许多不足,如在储存过程中发生猝灭、编码荧光与检测过程发出的荧光相互干扰等。最近,有研究将胶体晶体微球作为一种新的光学编码技术,并以其光子禁带的特征衍射峰作为编码元素。由于这种编码方式以胶体晶体微球的物理结构为基础,因此编码十分稳定,荧光背景也大大降低[57]。
 图 10
(a) 胶体晶体微球用于多元检测示意图[27];(b)10种不同胶体晶体微球的显微镜图片和光谱图[19];(c) 蛋白响应性微球的光谱偏移量与相应蛋白浓度的关系[35];(d) DNA响应性微球的光谱偏移量与相应DNA浓度的关系[28]
Figure 10.
(a) Schematic of barcode particle-based multiplexing [27]; (b) Optical micrographs and reflection spectra of 12 kinds of PhC barcodes [19]; (c) Optical responses of responsive PCBs to different concentrations of target protein [35]; (d) Optical responses of responsive PCBs to different concentrations of target DNA [28]
图 10
(a) 胶体晶体微球用于多元检测示意图[27];(b)10种不同胶体晶体微球的显微镜图片和光谱图[19];(c) 蛋白响应性微球的光谱偏移量与相应蛋白浓度的关系[35];(d) DNA响应性微球的光谱偏移量与相应DNA浓度的关系[28]
Figure 10.
(a) Schematic of barcode particle-based multiplexing [27]; (b) Optical micrographs and reflection spectra of 12 kinds of PhC barcodes [19]; (c) Optical responses of responsive PCBs to different concentrations of target protein [35]; (d) Optical responses of responsive PCBs to different concentrations of target DNA [28]
通过控制自组装胶体晶体微球纳米粒子的大小,可以得到多种不同衍射峰的胶体晶体微球 (图 10b)[19]。由于微球表面排布着六角对称的纳米粒子,胶体晶体微球不仅为探针的固定提供了更大的表面积,还提供了一个纳米级的图案化的高效反应平台[58]。为了进一步提高胶体晶体微球的检测灵敏度,可以用惰性的水凝胶材料制备胶体晶体微球,从而为反应提供更广泛的水环境[32]。此外,制备前面所述的多核的核壳结构胶体晶体微球可以增加编码的种类[44]。由于每个核都具有一个特定的反射峰,这种多核结构可以实现微球编码量的成倍增加。另外,当包裹磁性微球作为核时,可以通过施加磁场来控制微球的移动,从而显著提升生物分析过程中的灵敏度,并便于后续的分离。这些优点使得胶体晶体微球成为多元检测的理想编码载体,在生物医学检测上有着重要作用。其中最重要的应用就是非标记检测和多元分析。在非标记检测过程中,分析物与探针的反应会引起微球理化性质的变化,比如平均折射率和晶格间距的变化。这些变化会引起胶体晶体微球光子禁带和结构色的改变,从而实现检测[14, 28, 35, 59~63]。这种方法可以用来检测蛋白 (图 10c)[14, 35]和DNA (图 10d)[28, 60],并有着很高的灵敏度。在多元分析过程中,编码和分子检测都可以通过检测反蛋白石微球的反射峰来一步完成,大大简化了实验步骤,同时降低了对检测设备的需求。
2.2 细胞培养
胶体晶体微球也可以用于细胞捕获和细胞培养[49, 52, 64~66]。细胞微载体具有良好的表面粘附力,可以用于细胞的悬浮培养,同时也可以对不同细胞进行大规模培养。由于这些优点,许多不同生物材料被用于制备细胞微载体。然而,大部分细胞微载体功能单一,且由于个体之间没有差别,不能被混合在一起用于多元研究;此外,一些软凝胶由于塑性差,难以灌入微载体中。胶体晶体微球很好地解决了上述问题。胶体晶体微球不仅可以提供内部相互连通的大孔骨架结构便于软凝胶的灌注,还具有易于区分的光学编码信息,使其可以应用于多元研究。例如,向红色和绿色的胶体晶体微球中分别灌注PEGDA水凝胶和胶原,蓝色胶体晶体微球作为空白对照,混合后用于肝癌细胞 (HepG2) 的培养。由于胶原和PEGDA分别会促进和抑制细胞的粘附,共培养后可以发现绿色微球表面附着有大量细胞,而红色微球表面的细胞很少 (图 11a)[64]。此外,在微球表面修饰上树枝状大分子,并在上面连接适配体探针,可以用来捕获和检测循环肿瘤细胞 (CTCs)(图 11b)[65]。利用反蛋白石胶体晶体微球可以特异性捕获血细胞 (图 11c)[66]。利用中空胶体晶体微球可以克服一般微载体密度过大引起的沉降问题,真正实现细胞的悬浮培养[52]。这些实验结果表明,胶体晶体微球在细胞研究方面也有着重要应用价值。
2.3 药物输送及监控
传统的药物输送形式往往需要频繁地口服或者注射给药,以保持一定的药物浓度,对患者的生理和心理都会产生不好的影响,并带来诸多不便。基于微载体的输送系统能够避免生物代谢障碍,将药物准确地送至目标区域,并且能灵活地控制药物的释放总量和速率,从而具备更高的药物输送效率;使用少而稳定的药物剂量,减少了药物的毒副作用。这些特点最终提高了微载体对生物分子的利用率、药物的治疗效果和患者的安全性。传统微载体的限制在于其结构相对简单且功能单一,此外还缺乏对微载体药物释放过程的实时监控。反蛋白石是一种具有三维有序排列孔洞的材料,并具有光子禁带特性。如果反蛋白石微载体由响应性的水凝胶制成,它们就可以通过接受外界刺激而产生相应的膨胀或收缩,从而导致反射波长的变化,用作传感器来监测各种环境变化。根据这一特点,可以制备出用于药物输送的反蛋白石微球。例如,使用NIPAM水凝胶反蛋白石微球作为药物输送系统,将其装载药物后,通过控制温度来控制药物的释放,并能通过检测微球的反射峰变化实现对药物释放量的定量分析 (图 12)[67]。NIPAM水凝胶作为一种温度响应性材料,可以在较高温度触发下收缩,将包埋的药物挤压出来,而通过测量其特征反射峰的位移可以实现对药物的释放量进行实时监控,这些特性使得反蛋白石微球在药物输送领域具有极大的潜在应用价值。
 图 12
(a) 载药反蛋白石微球制备及药物缓释示意图;(b) 室温下和 (c) 温度循环下不同浓度包裹凝胶的药物释放效果[67]
Figure 12.
(a) Schematic of the fabrication and controlled drug release application of the hydrogel inverse opal particles; release of the drug from the particles with different concentrations of encapsulated hydrogel (b) at room temperature and (c) under different temperature stimuli cycles [67]
图 12
(a) 载药反蛋白石微球制备及药物缓释示意图;(b) 室温下和 (c) 温度循环下不同浓度包裹凝胶的药物释放效果[67]
Figure 12.
(a) Schematic of the fabrication and controlled drug release application of the hydrogel inverse opal particles; release of the drug from the particles with different concentrations of encapsulated hydrogel (b) at room temperature and (c) under different temperature stimuli cycles [67]
3 总结与展望
本文简述了胶体晶体微球的制备及其在生物医学应用上的一些最新进展。通过液体蒸发诱导纳米粒子组装、原位光聚合和模板法可以制备密堆积、非密堆积、反蛋白石、两相或多相结构和核壳结构等不同微纳结构的胶体晶体微球。微流控、光流控等技术以及智能响应性等材料的结合赋予了单分散胶体晶体微球新的功能,这对于其应用有重要意义。基于胶体晶体微球的各种功能,胶体晶体微球可以被应用于编码、非标记传感、细胞培养等多个领域,开启了胶体晶体微球材料领域的新篇章。
球形胶体晶体的研究目前仍然在发展当中,也面临着很多挑战。首先,虽然胶体晶体微球可以通过微流控的方法连续制备,但并不能满足实际应用过程中批量生产的需求,因此,需要摸索更先进的用于大量制备液滴模板和微球的乳化技术,如对膜乳化技术进行改进,或采用并行的微流控技术等。其次,需要设计合成新材料并将其应用到胶体晶体微球体系,提高胶体晶体微球对刺激响应的灵敏度和特异性,扩大响应范围,缩短响应时间。第三,反蛋白石胶体晶体微球有着内部相连的大孔结构,因此在药物释放、选择分离、燃料或太阳能电池以及催化载体等领域有着巨大应用潜力,而在这些方面的研究仍有待探索。第四,虽然单分散纳米粒子自下而上的组装方法在制备胶体晶体微球方面表现出了巨大的潜力,但由于这种方法在确定光子晶体的本征缺陷和实现纳米粒子的精确定位方面具有一定的局限性,因此用于微型激光器、低损耗谐振器等精密光学器件的光子晶体微球需要通过自上而下的方法来制备。最后,尽管胶体晶体微球的概念十分诱人,大部分相关技术仍然仅处于实验阶段,离商业化应用还有一段距离。为了克服这个窘境,需要技术持有者加强与企业共同合作,把胶体晶体微球推向市场。虽然胶体晶体微球的发展还有很长的距离要走,但终将会迎来一个光明的未来。
-
-
[1]
E Yablonovitch. Phys. Rev. Lett., 1987, 58(20):2059-2062. doi: 10.1103/PhysRevLett.58.2059
-
[2]
S John. Phys. Rev. Lett., 1987, 58(23):2486-2489. doi: 10.1103/PhysRevLett.58.2486
-
[3]
G Freymann, V Kitaev, B V Lotsch et al. Chem. Soc. Rev., 2013, 42(7):2528-2554. doi: 10.1039/C2CS35309A
-
[4]
Y Z Zhang, J X Wang, Y Huang et al. J. Mater. Chem., 2011, 21(37):14113-14126. doi: 10.1039/c1jm10977d
-
[5]
J X Wang, Y Z Zhang, S T Wang et al. Acc. Chem. Res., 2011, 44(6):405-415. doi: 10.1021/ar1001236
-
[6]
L He, M S Wang, J P Ge et al. Acc. Chem. Res., 2012, 45(9):1431-1440. doi: 10.1021/ar200276t
-
[7]
O Sato, S Kubo, Z Z Gu. Acc. Chem. Res., 2009, 42(1):1-10. doi: 10.1021/ar700197v
-
[8]
Y J Zhao, Z Y Xie, H C Gu et al. Chem. Soc. Rev., 2012, 41(8):3297-3317. doi: 10.1039/c2cs15267c
-
[9]
S H Park, Y Xia. Langmuir, 1999, 15(1):266-273. doi: 10.1021/la980658e
-
[10]
Z Z Gu, Q B Meng, S Hayami et al. J. Appl. Phys., 2001, 90(4):2042-2044. doi: 10.1063/1.1381540
-
[11]
H C Gu, Y J Zhao, Y Cheng et al. Small, 2013, 9(13):2266-2271. doi: 10.1002/smll.201203179
-
[12]
O D Velev, A M Lenhoff, E W Kaler. Science, 2000, 287(5461):2240-2243. doi: 10.1126/science.287.5461.2240
-
[13]
O D Velev, S Gupta. Adv. Mater., 2009, 21(19):1897-1905. doi: 10.1002/adma.200801837
-
[14]
H Wang, Q H Xu, L R Shang et al. Chem. Commun., 2016, 52(16):3296-3299. doi: 10.1039/C5CC09371F
-
[15]
X W Zhao, Y Cao, F Ito et al. Angew. Chem. Int. Ed., 2006, 45(41):6835-6838. doi: 10.1002/anie.200601302
-
[16]
V Rastogi, S Melle, O G Calderon et al. Adv. Mater., 2008, 20(22):4263-4268. doi: 10.1002/adma.200703008
-
[17]
Y Masuda, T Itoh, K Koumoto, Adv. Mater., 2005, 17(7):841-845.
-
[18]
C Sun, X W Zhao, Y J Zhao et al. Small, 2008, 4(5):592-596. doi: 10.1002/smll.200701026
-
[19]
H C Gu, F Rong, B C Tang et al. Langmuir, 2013, 29(25):7576-7582. doi: 10.1021/la4008069
-
[20]
S H Kim, S Y Lee, G R Yi et al. J. Am. Chem. Soc., 2006, 128(33):10897-10904. doi: 10.1021/ja063528y
-
[21]
K Xu, J H Xu, Y C Lu et al. Cryst. Growth Des., 2013, 13(2):926-935. doi: 10.1021/cg301654p
-
[22]
Y J Zhao, X W Zhao, C Sun et al. Anal. Chem., 2008, 80(5):1598-1605. doi: 10.1021/ac702249a
-
[23]
J Hu, X W Zhao, Y J Zhao et al. J. Mater. Chem., 2009, 19(32):5730-5736. doi: 10.1039/b906652g
-
[24]
J P Ge, H Lee, L He et al. J. Am. Chem. Soc., 2009, 131(43):15687-15694. doi: 10.1021/ja903626h
-
[25]
T Kanai, D Lee, H C Shum et al. Small, 2010, 6(7):807-810. doi: 10.1002/smll.200902314
-
[26]
S H Kim, S J Jeon, G R Yi et al. Adv. Mater., 2008, 20(9):1649-1655. doi: 10.1002/adma.200703022
-
[27]
Y J Zhao, L R Shang, Y Cheng et al. Acc. Chem. Res., 2014, 47(12):3632-3642. doi: 10.1021/ar500317s
-
[28]
Y J Zhao, X W Zhao, B C Tang et al. Adv. Funct. Mater., 2010, 20(6):976-982. doi: 10.1002/adfm.200901812
-
[29]
Y C Kim, C Y Cho, J H Kang et al. Langmuir, 2012, 28(28):10543-10550. doi: 10.1021/la3021468
-
[30]
J Y Wang, Y D Hu, R Deng et al. Langmuir, 2013, 29(28):8825-8834. doi: 10.1021/la401540s
-
[31]
J C Cui, W Zhu, N Gao et al. Angew. Chem. Int. Ed., 2014, 53(15):3844-3848. doi: 10.1002/anie.201308959
-
[32]
Y J Zhao, X W Zhao, B C Tang et al. Langmuir, 2010, 26(9):6111-6114. doi: 10.1021/la100939d
-
[33]
G R Yi, J H Moon, S M Yang. Chem. Mater., 2001, 13(8):2613-2618. doi: 10.1021/cm0102584
-
[34]
J H Moon, G R Yi, S M Yang et al. Adv. Mater., 2004, 16(7):605-609. doi: 10.1002/adma.200305446
-
[35]
Y J Zhao, X W Zhao, J Hu et al. Adv. Mater., 2009, 21(5):569-572. doi: 10.1002/adma.200802339
-
[36]
Q Yang, M Z Li, J Liu et al. J. Mater. Chem. A, 2013, 1(3):541-547. doi: 10.1039/C2TA00060A
-
[37]
S H Hong, J H Moon, J M Lim et al. Langmuir, 2005, 21(23):10416-10421. doi: 10.1021/la051266s
-
[38]
J R Millman, K H Bhatt, B G Prevo et al. Nat. Mater., 2005, 4(1):98-102.
-
[39]
V Rastogi, A A Garcıa, M Marquez et al. Macromol. Rapid Commun., 2010, 31(2):190-195.
-
[40]
L R Shang, F Q Shangguan, Y Cheng et al. Nanoscale, 2013, 5(20):9553-9557. doi: 10.1039/c3nr03218c
-
[41]
Y J Zhao, H C Gu, Z Y Xie et al. J. Am. Chem. Soc., 2013, 135(1):54-57. doi: 10.1021/ja310389w
-
[42]
Z Y Yu, C F Wang, L T Ling et al. Angew. Chem. Int. Ed., 2012, 51(10):2375-2378. doi: 10.1002/anie.201107126
-
[43]
S H Kim, S J Jeon, W C Jeong et al. Adv. Mater., 2008, 20(21):4129-4134.
-
[44]
Y J Zhao, Z Y Xie, H C Gu et al. NPG Asia Mater., 2012, 4(9):e25.
-
[45]
S H Kim, S J Jeon, S M Yang. J. Am. Chem. Soc., 2008, 130(18):6040-6046. doi: 10.1021/ja800844w
-
[46]
S H Kim, J G Park, T M Choi et al. Nat. Commun., 2014, 5:3068.
-
[47]
Y D Hu, J Y Wang, H Wang et al. Langmuir, 2012, 28(49):17186-17192. doi: 10.1021/la304058j
-
[48]
T Kanai, D Lee, H C Shum et al. Adv. Mater., 2010, 22(44):4998-5002. doi: 10.1002/adma.201002055
-
[49]
F F Fu, L R Shang, F Y Zheng et al. ACS Appl. Mater. Inter., 2016, 8(22):13840-13848. doi: 10.1021/acsami.6b04966
-
[50]
B F Ye, H B Ding, Y Cheng et al. Adv. Mater., 2014, 26(20):3270-3274. doi: 10.1002/adma.201305035
-
[51]
L R Shang, Y Cheng, J Wang et al. Lab Chip, 2016, 16(2):251-255. doi: 10.1039/C5LC01286D
-
[52]
L R Shang, F F Fu, Y Cheng et al. J. Am. Chem. Soc., 2015, 137(49):15533-15539. doi: 10.1021/jacs.5b10612
-
[53]
D G Shchukin, E Skorb, V Belova et al. Adv. Mater., 2011, 23(17):1922-1934. doi: 10.1002/adma.201004494
-
[54]
S A Nabavi, G T Vladisavljevic, S Gu et al. Langmuir, 2016, 32(38):9826-9835. doi: 10.1021/acs.langmuir.6b02420
-
[55]
K Ando, A Q Liu, C D Ohl. Phys. Rev. Lett., 2012, 109(4):044501. doi: 10.1103/PhysRevLett.109.044501
-
[56]
O Vincent, P Marmottant, S R Gonzalez-Avila et al. Soft Matter, 2014, 10(10):1455-1461. doi: 10.1039/c3sm52697f
-
[57]
Y J Zhao, X W Zhao, Z Z Gu. Adv. Funct. Mater., 2010, 20(18):2970-2988. doi: 10.1002/adfm.201000098
-
[58]
Y J Zhao, X W Zhao, X P Pei et al. Anal. Chim. Acta, 2009, 633(1):103-108. doi: 10.1016/j.aca.2008.11.035
-
[59]
Z Y Xie, K D Cao, Y J Zhao et al. Adv. Mater., 2014, 26(15):2413-2418. doi: 10.1002/adma.201304775
-
[60]
Y J Zhao, X W Zhao, J Hu et al. Angew. Chem. Int. Ed., 2009, 48(40):7350-7352. doi: 10.1002/anie.200903472
-
[61]
J P Ge, Y D Yin. Angew. Chem. Int. Ed., 2011, 50(7):1492-1522. doi: 10.1002/anie.200907091
-
[62]
W Z Shen, M Z Li, C Q Ye et al. Lab Chip, 2012, 12(17):3089-3095. doi: 10.1039/c2lc40311k
-
[63]
B F Ye, F Rong, H C Gu et al. Chem. Commun., 2013, 49(46):5331-5333. doi: 10.1039/c3cc42122h
-
[64]
W Liu, L R Shang, F Y Zheng et al. Small, 2014, 10(1):88-93. doi: 10.1002/smll.201301253
-
[65]
F Y Zheng, Y Cheng, J Wang et al. Adv. Mater., 2014, 26(43):7333-7338. doi: 10.1002/adma.201403530
-
[66]
B Zhang, Y L Cai, L R Shang et al. Nanoscale, 2016, 8(6):3841-3847. doi: 10.1039/C5NR06368J
-
[67]
B Zhang, Y Cheng, H Wang et al. Nanoscale, 2015, 7(24):10590-10594. doi: 10.1039/C5NR02324F
-
[1]
-
图 2 (a) 均质胶体晶体微球制备示意图[22];(b) 电镜下的胶体晶体微球及其表面结构[16];(c) 金相显微镜下的胶体晶体微球[22]
Figure 2 (a) Schematic of the generation of close-packed colloidal PCBs generation [22]; (b) SEM image of the bead surface; the inset is an image of a whole bead [16]; (c) Reflection image of the PCBs [22]
图b标尺为600nm,图c标尺为400μm
图 9 (a) 微流控制备液滴模板示意图;(b) 液滴模板空化及自组装示意图;(c~e) 三种不同颜色的微气泡胶体晶体微球;(f~h) 微气泡胶体晶体微球的表面电镜图、剖面图[52]
Figure 9 Schematic of (a) the generation of droplet templates; (b) the progress of cavitation and self-assembly of the droplet templates; (c~e) Three kinds of hollow PCBs; (f~h) SEM images of the surface and the cross-section of the PCBs [52]
图 (c~e) 中标尺为300μm,图f为400nm,图g为100μm, 图h为1μm
图 10 (a) 胶体晶体微球用于多元检测示意图[27];(b)10种不同胶体晶体微球的显微镜图片和光谱图[19];(c) 蛋白响应性微球的光谱偏移量与相应蛋白浓度的关系[35];(d) DNA响应性微球的光谱偏移量与相应DNA浓度的关系[28]
Figure 10 (a) Schematic of barcode particle-based multiplexing [27]; (b) Optical micrographs and reflection spectra of 12 kinds of PhC barcodes [19]; (c) Optical responses of responsive PCBs to different concentrations of target protein [35]; (d) Optical responses of responsive PCBs to different concentrations of target DNA [28]
图 12 (a) 载药反蛋白石微球制备及药物缓释示意图;(b) 室温下和 (c) 温度循环下不同浓度包裹凝胶的药物释放效果[67]
Figure 12 (a) Schematic of the fabrication and controlled drug release application of the hydrogel inverse opal particles; release of the drug from the particles with different concentrations of encapsulated hydrogel (b) at room temperature and (c) under different temperature stimuli cycles [67]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0









 下载:
下载:











 下载:
下载:

