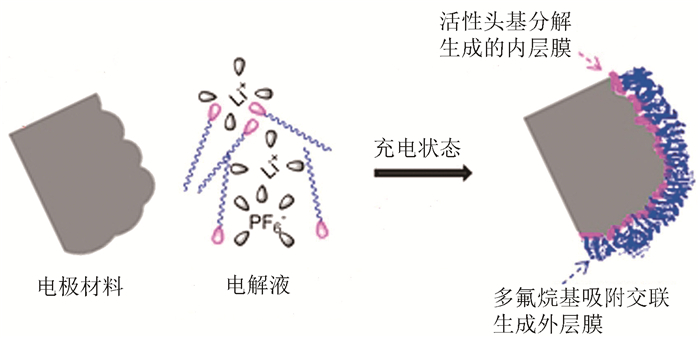
 图1
多氟烷基碳酸酯于电极表面的成膜示意图
Figure1.
Film forming of polyfluoroalkyl carbonates on electrode surface
图1
多氟烷基碳酸酯于电极表面的成膜示意图
Figure1.
Film forming of polyfluoroalkyl carbonates on electrode surface

Citation: Zhang Wenlin, Lan Xiaoyan, Shi Ziwei, Li Chunli. Research Progress in New-Type High Voltage Electrolyte used for Lithium Batteries[J]. Chemistry, 2017, 80(11): 1021-1026.

新型高电压电解液用于锂电池的研究进展
English
Research Progress in New-Type High Voltage Electrolyte used for Lithium Batteries
-
Key words:
- Ionic liquids
- / Electrolyte
- / Viscosity
- / Conductivity
-
锂电池具有能量密度大、充放电性能稳定、使用寿命长等优点,是许多大型移动设备主要的候选动力电源之一[1, 2]。提高电极材料的比容量以及电池的工作电压是获得高比能量锂电池的有效途径[3]。研究者开发了诸多高压正极材料,如富锂材料Li[NixLi(1/3-2x/3)Mn(2/3-x/3)]O2[4]、过渡金属取代的尖晶石材料(LiMxMn2-xO4,M=过渡金属)[5]和具有Ni/Co[6, 7]阳离子的聚阴离子材料,有效地提高了锂电池的能量和功率密度。目前商用的电解液主要是碳酸酯基电解液,其在工作电压达到4.5V以上时,就会发生剧烈的氧化分解反应[8],致使锂电池的嵌脱锂过程无法正常进行。因此需要开发新的高压电解液体系。
本文对新型碳酸酯类、腈类、砜类以及离子液体(ILs)类电解液体系的研究进行综述。目前高压电解液主要是通过引入官能团或加入添加剂进行优化,文中详细分析了其作为电解质在电池中的作用机理。
1 传统碳酸酯电解液
传统碳酸酯基电解液主要是由碳酸酯类有机溶剂和锂盐(LiPF6、LiBF4、LiTFSI(双三氟甲烷磺酰亚胺锂)等)按一定比例混合而成。此电解液在宽的温度范围内均为稳定液态,有很高电导率、(一般为3.0mS/cm)[9]、较高的介电常数和较强的锂盐的溶解能力,并且在4.5V电压内可以稳定存在。这种碳酸酯电解液已经被广泛应用于电池领域中,但当电压高于4.5V时,此电解液在阴极表面会被持续氧化分解,严重降低了电池的循环稳定性。影响电解质在高压条件下氧化分解的主要原因有:(1)锂盐的阳极不稳定性[10, 11],与阴极材料以及溶剂种类密切相关。Tan等[12]总结发现,在碳酸乙烯酯(EC)/1, 2-二乙氧基乙烷(DEE)溶剂中锂盐的氧化稳定性依次是ClO4->TFSI->CF3SO3->AsF6->PF6->BF4-,而EC/碳酸二甲酯(DMC)溶剂中则有ClO4-~PF6-~BF4->AsF6->TFSI->CF3SO3-。以1mol LiPF6+EC/DMC电解液为例,探究发现其适用于LiNi0.5Mn1.5O4阴极材料,而不适用LiCoO2、LiNixMnyCozO2(x+y+z=1)、LiCoPO4阴极材料。他们还从机理中分析了影响其稳定性的因素,为锂盐、溶剂的选择提供了有力的依据;(2)溶剂分子间的相互影响。已有报道[13, 14]模拟计算出在高正电位条件两个EC分子间相互作用,其中一个EC分子的羰基氧夺取另一个EC分子的H,显著降低了被剥夺H的EC分子的稳定性;(3)有机溶剂易发生氧化还原反应,其氧化、还原产物不能在电极表面形成稳定的钝化膜。研究发现在混合溶剂中,极性强的分子可快速富集到阴极表面并发生氧化分解反应[15],以此决定了电解液的电化学窗口。
2 碳酸酯类高压电解液
目前主要是从两方面着手改善碳酸酯电解液的高压性能:一是改进型碳酸酯,通过改变碳酸酯的结构来提高其稳定性;二是在碳酸酯电解液中加入其他化合物来优化电解液的性能。
2.1 改进型氟代碳酸酯
多氟烷基碳酸酯(PFAs)具有化学稳定性强、疏水性、疏油性等特点,作为电解液可在电极表面生成双层钝化膜,减少电极表面的降解和电解质的分解。其成膜机理如图 1所示[16]。(1)活性头基(碳酸酯)通过还原或氧化分解附着到电极表面生成内层膜;(2)多氟烷基链通过吸附交联生成高度稳定的、对电解质溶解性低的外层钝化膜。
Zhu等[16]分别将4种不同全氟烃基碳酸亚乙基酯(TEM-EC、PFB-EC、PFH-EC、PFO-EC)/(EC:DMC)的三元碳酸酯电解液用于Li1.2Ni0.15Mn0.55Co0.1O2/石墨的高压锂电池。比较显示当三元混合电解液中PFO-EC的含量达5(wt)%时,电池在高压条件下循环稳定性明显提高。全氟烃取代基的碳链越长,亲核能力越强,越容易在电极表面生成钝化膜,但是分子间作用力也会相应增大,致使粘度增大,电导率下降。Im等[17]制备了1mol LiPF6+FEC/FEMC(1:9)全氟化电解液,与非氟化电解液相比,其在4.7V条件下于阴极表面生成稳定钝化膜,并随着循环次数的增加;非氟化电解质的电荷转移电阻(Rct)迅速增加,而全氟化电解质的Rct的变化不大。这说明全氟化电解液在高压条件下稳定性很强,可显著改善电池的循环性能。
环状碳酸丙烯酯(PC)具有介电常数高、熔点低、较宽的电化学窗口、与阴极材料有良好的兼容性等优点[18],但PC作为单一溶剂在石墨阳极表面上的成膜能力差,易从石墨层剥离。Yun等[19]合成了三氟碳酸亚丙基酯(TFPC),研究发现TFPC中-CF3作为较强的吸电子基团,在高电势的条件下容易开环,并在石墨电极上交联形成稳定SEI钝化膜。用1mol LiPF6-PC/TFPC电解液组成电池,经多次充放电循环,其容量保持率稳定在99%~100%。Su等[20]制备了FEC/TFPC基电解液用于全电池,在高温高压条件下同样表现出良好的电化学稳定性。但TFPC的添加增加了电解液的粘度,从而使电导率有所降低。
2.2 含磷复合型碳酸酯
在碳酸酯中加入适量的添加剂如三(2, 2, 2-三氟乙基)亚磷酸酯(TTFP)[21]有诸多优点:其一,可在阴极表面形成稳定的CEI钝化膜;其二,TTFP中心的磷(Ⅲ)原子有一对孤对电子,在含LiPF6的电解液中能与PF6-配位,形成稳定的锂盐络合物[22, 23];其三,磷(Ⅲ)原子并未处于最高价态,容易被氧化生成可溶性的磷酸酯化合物,有效抑制碳酸酯的氧化分解,进一步改善电池的循环性能。Natascha等[24]分别将1(wt)%的5F-TPrP、HFiP和THFPP添加到电解液并应用于NCM111/Li半电池性能的研究。结果显示,三种添加剂均改善了电池的循环性能,并在阴极生成稳定的CEI膜。
Li等[25]研究了1(wt)%亚磷酸三甲酯(TMP)作为电解质添加剂应用于富锂层状氧化物阴极的高压锂电池。测试显示,TMP的添加显著降低了电池的初始不可逆容量,100次循环后容量保持率提升了2%,电导率和电池循环稳定性也都有明显提高。Xia等[26]把2(wt)%磷酸三丙烯(TAP)为添加剂的碳酸酯基电解质用于NMC442/石墨电池中。在电压2.8~4.5 V下的循环过程中,烯丙基电解质发生交联反应,在石墨表面形成稳定的SEI膜,但是TAP使全电池的电阻增大。
2.3 含硼复合型碳酸酯
很多含硼化合物能在不同阴极表面生成稳定的CEI膜[27],可提高其他电解质在电极表面的稳定性。Li等[28]将含5(wt)%三(三甲基硅烷)硼酸酯(TMSB)添加剂的电解液应用到Li[Li0.2Mn0.54Ni0.13Co0.13]O2为阴极材料的高压锂离子电池中,循环200次后的容量保持率提高了50%。Zuo等[29]研究了TMSB在电极表面的作用机理,缺电子的含硼类化合物易与阴离子(PF6-或F-)形成配合物,加剧了Li+和阴离子的解离,提高其电导率的同时也降低了界面阻力。Xu等[30]制备了一系列烷基三甲基硼酸锂和芳基三甲基硼酸锂作为阴极成膜添加剂。将定量的硼酸锂掺入电解液中,提高了LiNi0.5Mn1.5O4/石墨电池的容量保持率。硼酸锂盐自身氧化分解,生成低锰溶解度的硼酸盐钝化膜,提高了电化学稳定性,同时也降低了对电极材料的损害。
对碳酸酯的氟化以及在碳酸酯电解质中加入其他添加剂,均可有效提高电解液的耐高压稳定性。然而如何提高碳酸酯电解液的燃点、降低挥发度、进一步提高电池安全性能,仍是科研人员需要努力的方向。
3 腈类高压电解液
非质子脂族二腈化合物NC-(CH)n-CN(n=3-8)作为电解质具有耐高压且安全的特性,在电压7~8 V时,表现出良好的电化学稳定性,具有较高的燃点和闪点[31]。然而,脂族二腈与石墨负极的兼容性较差,在低电势下氰基很容易被还原,还原产物也不能在阴极生成稳定的SEI膜[32]。Abu-Lebdeh等[33, 34]在二腈中加入具有高还原电位的EC和成膜添加剂LiBOB组成混合电解液,以改善二腈类溶剂与石墨负极的兼容性。Gmitter等[35]在二乙腈(AND,n=4)电解质中加入碳酸亚乙烯酯(VC)和氟代碳酸亚乙基酯(FEC)促进电解液在MCMB表面生成稳定的SEI膜,显著地改善了电池的循环性能。
大部分锂盐在脂类二腈化合物中的溶解度较低,尤其是商业常用的锂盐LiPF6。为了提高二腈对锂盐的溶解度,Nuha等[36]将LiBF4和LiBOB混合,加入EC/DMC/二腈的三元电解液用于高压锂电池,测试显示,二腈类溶剂均具有稳定的循环性能,锂盐的溶解度与电池的比容量也有所提升。Xie等[37]合成的环氧乙烷二腈化合物(NEON)中环氧乙烷与Li+的鳌合作用提高了LiPF6在环氧乙烷二腈中的溶解性。通过石墨/Li半电池评价NEON基电解质的电化学性能,测试显示该电解质与石墨的兼容性较好,并生成了稳定的SEI膜。在高压条件下,LiCoO2/Li电池经50次循环后容量保持率仍为97%,表现出优异的循环稳定性。
腈类溶剂具有优良的耐高压性能,在腈类溶剂中加入EC或DMC,显著地改善了腈类电解液与石墨电极的兼容性,提高了锂盐的溶解度。如何降低腈类溶剂的毒性和生产成本,仍是该类电解液在电池应用中亟待解决的问题。
4 砜类电解液
Xu等[38]合成一系列的砜类化合物,并且测试了其物理和化学性能,发现这些砜类有机物的介电常数都在40以上,在电压5.5V以下均处于稳定状态,但其粘度大,熔点高,且与石墨负极材料的兼容性较差[39],限制了此类电解液的应用。Xue等[40]将二甲基砜(DMS)和甲磺酸乙酯(EMS)溶液混合,测得其共晶温度为23℃;随着锂盐含量的增加其共晶温度线性下降,最低可达到-15℃。DMC的加入可降低砜类溶剂的粘度,提高电解液的电导率。但是砜类溶剂的加入仍然没有降低碳酸酯的挥发性,致使电解液的闪点温度很低,安全性较差。
4.1 低聚醚砜
Sun等[41]合成了一系列低聚醚砜化合物,并检测了其物理性质,如表 1所示。不对称低聚醚砜比对称低聚醚砜熔点低得多,并随着醚链的增长,熔点不断降低。这些低聚醚砜的氧化电位都在5.3V以上,但粘度随着醚链的增长而增加,致使电导率有所降低。他们制备了MCMB25-28 |1mol LiPF6/EMES| Li电池,测试结果显示石墨的嵌锂量远低于其理论值,并随着循环次数的增加嵌锂量迅速下降,表明EMES与石墨阳极表面不断分解,且不能生成稳定的SEI膜。
砜类化合物 熔点/℃ 沸点/℃ Tg/℃ CH3CH2SO2CH3(EMS) 36.5 85~87/4.0mm(~240)b - CH3OCH2SO2CH3(MMMS) - 67/0.25mm(~265)b - CH3OCH2CH2SO2CH3(MEMS) 15.0 96~98/1.0mm(~275)b -89.5 CH3OCH2CH2SO2C2H5(EMES) 2.0 103~105/1.0mm(~286)b -91.0 CH3(OCH2CH2)2SO2C2H5(EMEES) <0a >290c -87.6 CH3(OCH2CH2)3SO2C2H5(EMEEES) <0a >290c -82.5 CH3OCH2CH2SO2CH2CH2OCH3(DMES) 47.0 >290c -90.7 a估测熔点;b由列线图估测的大气压下的沸点;c估测沸点 随后,Sun等[42]将少量的成膜剂VC掺入LiPF6/MEMS电解液并应用于LiCoO2/AG电池,检测发现该电池的循环稳定性有显著提高。Ouatani等[43]研究显示,在低聚醚砜类溶剂中加入碳酸酯溶剂可很大程度上降低砜类溶剂的粘度。
4.2 环丁砜
环丁砜(SL)是一种常见的具有高介电常数、宽的电化学窗口、强极性等特点的溶剂。但研究发现,SL在高压条件下不能在锂箔、石墨极表面生成稳定的SEI膜,致使电池的库伦效率迅速下降。为了改善其与阳极表面的兼容性,Li等[44]将LiBOB-SL/DEC应用于电池,表现出优异的循环稳定性和较高的平均电压。Mao等[45]将LiBOB-SL/DMS二元砜体系分别应用于Li/MCMB、LiFePO4/Li半电池中,检测发现LiBOB-SL/DMS电解液成膜的界面阻力明显低于单一砜成膜的界面阻力。这归因于膜中强极性-SO2-含量的增加,有利于Li+的传导,从而降低了界面阻力。
Wu等[46]制备了LiODFB-PP14TFSI/TMS电解液,分别用于以石墨、硬碳、软碳为阳极的锂电池中,在高压条件下进行循环测试,结果显示其容量保持率皆高于99.5%。此外,在SL中引入氟代烷烃可以促进其在石墨阳极生成稳定的SEI膜,提高SL的电化学稳定性。然而提高砜类电解液安全性能、降低砜的粘度仍是需要研究的方向。
5 离子液体电解液
离子液体(ILs)是由阴阳离子组成的室温熔融盐[47, 48],具有高闪点[49]、高燃点、低挥发性、高介电常数和宽电化学稳定窗口的特点。研究发现,与其他阴离子(PF6-、BF4-、Cl-等)相比,TFSI-在低电位下容易被还原成不溶Li+的化合物,并在锂、石墨阳极表面形成钝化膜。所以,目前研究ILs电解液时,阴离子多定为TFSI-。Borgel等[50]制备了以TFSI-为阴离子,哌啶鎓、吡咯烷鎓、咪唑鎓为阳离子的三种ILs。研究表明,在5.0V的高压条件下,咪唑鎓ILs电解液循环稳定性较差;吡咯类和哌啶类ILs电解液则表现出优异的循环稳定性。
Simonetti等[51]把电化学稳定性强的N-甲基-N-丁基吡咯烷双三氟甲烷磺酰亚胺盐(PYR14TFSI)与离子传导率高、熔点低、SEI生成能力强的N-甲基-N-丙基吡咯烷双三氟甲烷磺酰亚胺盐(PYR13TFSI)混合,并加入LiTFSI,按一定比例配成电解液。其电化学稳定窗口高达5.0V,且在温度为-20℃时,电导率仍高达10-3S/cm。Akiko等[52]将ILs基电解液[Py14]PF6+1mol LiPF6+EC:DMC(1:1)用于LiFePO4/Li电池,结果显示,电解液电导率有显著提高,电池可逆容量可达164mAh·g-1。
ILs可设计性强,可通过引入官能团以制备所需功能的ILs。Yong等[53]制备了三甲基硅烷基、烯丙基、氰乙基功能化季铵盐类ILs(SN1IL-TFSI、AN1IL-TFSI、CEN1IL-TFSI)。对这三种ILs分析显示,CEN1IL-TFSI的粘度最大,离子电导率最低,还原电位比其他两种ILs的还原电位要高很多;AN1IL-TFSI的粘度最低,离子电导率最高,但其热稳定性较差,在高温下易分解。他们配制了SN1IL-TFSI/DMC+0.6mol/L LiPF6+0.4mol/L LiODFB电解质(SN1IL-DMC)应用于LiCoO2/石墨全电池,该电池的首次循环比容量为152 mAh·g-1,在90次充放电循环后容量保持率仍高达99%,其平均电压一直稳定在3.8V。SEM分析显示,SN1IL-DMC电解质在阴阳极均生成稳定的钝化膜,这是此电解液能稳定用于高压锂电池的重要原因。
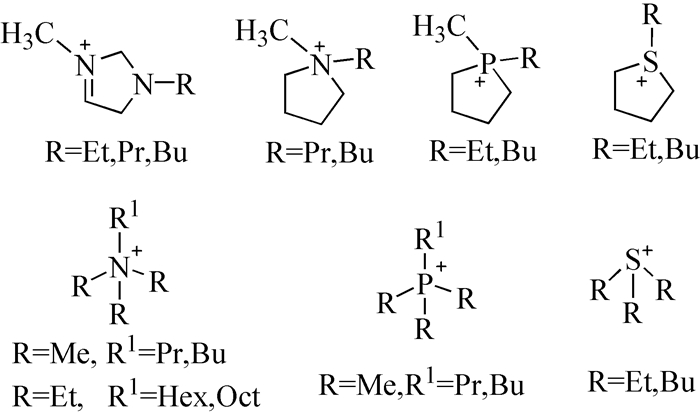
Pandiande等[54]通过理论计算来评估功能化ILs的电化学性能,准确地预测了ILs的电化学窗口的增加顺序依次是:锍ILs < 铵ILs < 鏻基ILs。探讨各种取代基如丁基、苯基和苄基(见图式 1)对鏻和锍基ILs的影响,苄基取代的鏻ILs显示出更高的热稳定性和电导率。对称和不对称锍阳离子的ILs均具有粘度低、导电性高、物理化学性质稳定的特点。在烷基、苯基、苄基官能化体系中,苯基取代的ILs的还原电位较低,电化学窗口宽。
ILs粘度大、界面性能差是制约其作为电解液发展的主要因素。Macfarlane等[55]研究发现,由于阴离子N(CN)2-比TFSI-的分子量小,与阳离子的静电作用力很弱,使得此类ILs具有较低的熔点、粘度以及较高的电导率。刘伟等[56]总结指出-CN的引入可有效改善ILs的界面性能。值得关注的是,具有路易斯碱性的N(CN)2-也可以同电解液中LiPF6分解生成的路易斯酸性的PF5反应,以减弱PF5对电池性能的负面影响。
笔者课题组合成了以N(CN)2-为阴离子的咪唑类、哌啶类、吡咯类ILs,分别在其中加入一定量的LiPF6用于高压锂电池中,并通过线性扫描伏安(LSV)、电化学阻抗法(EIS)、循环伏安(CV)等对此电解液进行评价。测试结果显示,吡咯类和哌啶类ILs电解液在2.5~4.8 V有良好的循环稳定性,但电导率都相对较低,电阻较高;咪唑类电解液电导率很高,与商业有机电解液电导率达到同等数量级,但其循环稳定性较差,还需进一步的改进。下一步研究的方向是:(1)用不同官能团取代咪唑C(2)的质子H,降低咪唑阳离子的还原性;(2)加入适量的EC来降低ILs的粘度,优化ILs的性能;(3)通过SEM检测充放电循环后电极表面的成膜情况,以及XPS检测负极表面膜的成分,进一步探讨此电解液在负极表面的成膜机理以及N(CN)2-的作用。
6 结论与展望
通过在碳酸酯、腈、砜化合物中引入官能团如-F、-COR-、-CN、-SO2-等,或者是加入其他添加剂,可使电解液在高压条件下表现出循环稳定性强、电导率高且与电极表面兼容性良好等优点。然而如何提高新型有机溶剂的安全性,优化其反应条件,仍需要进一步的研究。
ILs的绿色安全、可设计性以及高压稳定性强等优点得到广大研究者的青睐。但是ILs粘度大,与电极、隔膜的浸润性差是制约其单一溶剂应用于高压锂电池的主要因素。其中,以N(CN)2-为阴离子的ILs有望解决这一问题。因此,需要深入研究ILs结构,从分子层次上探究影响其粘度、电导率、电化学稳定性等性质的因素;进一步探索ILs电解液的氧化还原机理,归纳出不同类别、官能团、结构的ILs的电化学性质;优化生产工艺,降低生产成本,最终实现ILs作为单一溶剂应用于高压锂电池的工业化。
-
-
[1]
M Armand, J M Tarason. Nature, 2008, 451(7179): 652~657.
-
[2]
X Zhang, P N Ross, R Kostecki et al. J. Electrochem. Soc., 2000, 148(5): A463~A470. doi: 10.2172/861953
-
[3]
B Z Li, L D Xing, M Q Xu et al. Electrochem. Commun., 2013, 34: 48~51. doi: 10.2172/861953
-
[4]
X D Xiang, X Q Li, W S Li et al. J. Power Sources, 2013, 230: 89~95. doi: 10.1016/j.jpowsour.2012.12.050
-
[5]
R Santhanam, B Rambabu. J. Power Sources, 2010, 195(17): 5442~5451. doi: 10.1016/j.jpowsour.2010.03.067
-
[6]
J Liu, A Manthiram. J. Electrochem. Soc., 2008, 156(1): A66~A72.
-
[7]
J Liu, A Manthiram. J. Electrochem. Soc., 2009, 156(12): A833~A838. http://jes.ecsdl.org/content/156/11/A833.short
-
[8]
S Ferrari, E Quartarone, C Tomasi et al. J. Power Sources, 2013, 235(4): 142~147. doi: 10.1016/j.jpowsour.2013.01.149
-
[9]
罗瑞, 任婉, 蒋阳梅等. 现代化工, 2014, 34(8): 36~40. http://www.cqvip.com/QK/95539X/201408/661963007.html
-
[10]
M Arakawa, J I Yamaki. J. Power Sources, 1995, 54: 250~254. doi: 10.1016/0378-7753(94)02078-H
-
[11]
M Moshkovich, M Cojocaru, H E Gottlieb et al. Electroanal. Chem., 2001, 497: 84~96. doi: 10.1016/S0022-0728(00)00457-5
-
[12]
S Tan, Y J Ji, Z R Zhang et al. ChemPhysChem, 2014, 15(10): 1956~1969. http://www.ncbi.nlm.nih.gov/pubmed/25044525
-
[13]
L D Xing, O Borodin. Phys. Chem. Chem. Phys., 2012, 14: 12838~12843. doi: 10.1039/c2cp41103b
-
[14]
Y T Wang, L D Xing, W S Li et al. J. Phys. Chem. Lett., 2013, 4(22): 3992~3999. doi: 10.1021/jz401726p
-
[15]
J Vatamanu, O Borodin, G D Smith. J. Phys. Chem. C, 2012, 116(1): 1114~1121. doi: 10.1021/jp2101539
-
[16]
Y Zhu, Y Li, M D Casselman et al. J. Power Sources, 2014, 246(3): 184~191. doi: 10.1016/j.jpowsour.2013.07.070
-
[17]
J Im, J Lee, M H Ryou et al. J. Electrochem. Soc., 2017, 164(1): A6381~A6385. doi: 10.1149/2.0591701jes
-
[18]
R Wagmer, S Brox, D R Gallus et al. Electrochem. Commun., 2014, 40(3): 80~83.
-
[19]
J J Yun, L Zhang, Q T Qu et al. Electrochimica Acta, 2015, 167: 151~159. doi: 10.1016/j.electacta.2015.03.159
-
[20]
C C Su, M He, C Peebles et al. J. Electrochem. Soc., 2014, 157: A1777~A1781.
-
[21]
K Xu, S Zhang, J LAllen et al. J. Electrochem. Soc., 2003, 150(2): A170~A175. doi: 10.1149/1.1533041
-
[22]
S S Zhang, K Xu, T R Jow. J. Electrochem. Soc., 2002, 5(9): A206~A208. http://esl.ecsdl.org/content/5/9/A206.short
-
[23]
S S Zhang, K Xu, T R Jow. J. Power Sources, 2003, 113(1): 166~172. doi: 10.1016/S0378-7753(02)00537-2
-
[24]
N V Aspern, S Röser, B R Rad et al. J. Fluorine Chem., 2017, 198: 24~33. doi: 10.1016/j.jfluchem.2017.02.005
-
[25]
Z D Li, Y C Zhang, H F Xiang et al. J. Power Sources, 2013, 240: 471~475. doi: 10.1016/j.jpowsour.2013.04.038
-
[26]
J Xia, L Madec, L Ma et al. J. Power Sources, 2015, 295: 203~211. doi: 10.1016/j.jpowsour.2015.06.151
-
[27]
S S Zhang. J. Power Sources, 2006, 162(2): 1379~1394. doi: 10.1016/j.jpowsour.2006.07.074
-
[28]
Y Li, T Markmaitree, B L Lucht. J. Power Sources, 2011, 196(4): 2251~2254. doi: 10.1016/j.jpowsour.2010.09.093
-
[29]
X X Zuo, C J Fan, J S Liu et al. J. Power Sources, 2013, 229: 308~312. doi: 10.1016/j.jpowsour.2012.12.056
-
[30]
M Xu, L Zhou, Y Dong et al. Energy Environ. Sci., 2016, 9(4): 1308~1319. http://www.ncbi.nlm.nih.gov/pubmed/29311567
-
[31]
H Duncan, N Salem, Y Abu-Lebdeh. J. Electrochem. Soc., 160(6): A838~A848. http://jes.ecsdl.org/content/160/6/A838.short
-
[32]
T Q Yong, J L Wang, Y J Maii et al. J. Power Sources, 2014, 254(15): 29~32.
-
[33]
Y Abu-Lebdeh, I Davidson. J. Electrochem. Soc., 2009, 156(1): A60~A65. doi: 10.1149/1.3023084
-
[34]
Y Abu-Lebdeh, I Davidson. J. Power Sources, 2009, 189(1): 576~579. doi: 10.1016/j.jpowsour.2008.09.113
-
[35]
A J Gmitter, I Plitz, G G Amatucci. J. Electrochem. Soc., 2012, 159(4): A370~A379. doi: 10.1149/2.016204jes
-
[36]
N Salem, H Duncan, P Whitfield et al. ECS Meeting, 2013, 66: 323. https://core.ac.uk/display/38580962
-
[37]
B Xie, Y G Mai, J L Wang et al. Ionics, 2015, 21(4): 909~915. doi: 10.1007/s11581-014-1272-3
-
[38]
K Xu, C A Angell. J. Electrochem. Soc., 2002, 149(7): A920~A926. doi: 10.1149/1.1483866
-
[39]
左晓希, 李伟善, 刘建生等. 电池工业, 2006, 11(2): 97~99. http://www.cqvip.com/Main/Detail.aspx?id=21776671
-
[40]
L G Xue, S Y Lee, Z F Zhao et al. J. Power Sources, 2015, 295: 190~196. doi: 10.1016/j.jpowsour.2015.06.112
-
[41]
X G Sun, C A Angell. Electrochem. Commun., 2005, 7(3): 261~266. doi: 10.1016/j.elecom.2005.01.010
-
[42]
X G Sun, C A Angell. Electrochem. Commun., 2009, 11(7): 1418~1421. doi: 10.1016/j.elecom.2009.05.020
-
[43]
L E Ouatani, R Dedryvere, C Siret et al. J. Electrochem. Soc., 2009, 156(2): A103~A113. doi: 10.1149/1.3029674
-
[44]
S Y Li, Y Y Zhao, X M Shi et al. Electrochim. Acta, 2012, 65: 221~227. doi: 10.1016/j.electacta.2012.01.052
-
[45]
Mao, B Li, X Cui et al. Electrochim. Acta, 2012, 79: 197~201. doi: 10.1016/j.electacta.2012.06.102
-
[46]
F Wu, Q Z Zhu, R J Chen et al. Nano Energy, 2015, 13: 546~553. doi: 10.1016/j.nanoen.2015.03.042
-
[47]
M Hirayama, H Ido, K S Kim et al. J. Am. Chem. Soc., 2010, 132(43): 15268~15276. doi: 10.1021/ja105389t
-
[48]
张文林, 张佳莉, 靳斐等. 化工进展, 2017, 36(02): 548~554. http://www.cqvip.com/QK/95836X/201702/671286647.html
-
[49]
Q Du, X K Fu, S J Liu et al. Polym. Int., 2012, 61(2): 222~227.
-
[50]
V Borgel, E Markevich, D Aurbach et al. J. Power Sources, 2009, 189(1): 331~336. doi: 10.1016/j.jpowsour.2008.08.099
-
[51]
E Simonetti, G Maresca, G B Appetecchi et al. J. Power Sources, 2016, 331: 426~434. doi: 10.1016/j.jpowsour.2016.09.078
-
[52]
A Tsurumaki, M A Navarra, S Panero et al. J. Power Sources, 2013, 233: 104~109. doi: 10.1016/j.jpowsour.2013.01.131
-
[53]
T Q Yong, L Z Zhang, J L Wang et al. J. Power Sources, 2016, 328: 397~404. doi: 10.1016/j.jpowsour.2016.08.044
-
[54]
S Pandian, S G Raju, K S Hariharan et al. J. Power Sources, 2015, 286: 204~209. doi: 10.1016/j.jpowsour.2015.03.130
-
[55]
D R Macfarlane, S A Forsyth, J Golding et al. Green Chem., 2002, 4(5): 444~448. doi: 10.1039/b201063a
-
[56]
刘伟, 仇伟华, 王赛等. 电池, 2007, 37(1): 67~69.
-
[1]
-
表 1 砜类化合物的物理性质
Table 1. Physical properties of sulfones
砜类化合物 熔点/℃ 沸点/℃ Tg/℃ CH3CH2SO2CH3(EMS) 36.5 85~87/4.0mm(~240)b - CH3OCH2SO2CH3(MMMS) - 67/0.25mm(~265)b - CH3OCH2CH2SO2CH3(MEMS) 15.0 96~98/1.0mm(~275)b -89.5 CH3OCH2CH2SO2C2H5(EMES) 2.0 103~105/1.0mm(~286)b -91.0 CH3(OCH2CH2)2SO2C2H5(EMEES) <0a >290c -87.6 CH3(OCH2CH2)3SO2C2H5(EMEEES) <0a >290c -82.5 CH3OCH2CH2SO2CH2CH2OCH3(DMES) 47.0 >290c -90.7 a估测熔点;b由列线图估测的大气压下的沸点;c估测沸点 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:

 下载:
下载:

