 图式 1
Surfactin的结构示意图
Scheme1.
Schematic diagram of surfactin
图式 1
Surfactin的结构示意图
Scheme1.
Schematic diagram of surfactin

Citation: Li Yanyan, Zhang Jian. Research Progress in Surfactin[J]. Chemistry, 2017, 80(10): 918-924.

表面活性肽的研究进展
English
Research Progress in Surfactin
-
Key words:
- Biosurfactant
- / Surfactin
- / Microbial fermentation
- / Cyclic lipopeptide
-
表面活性肽(Surfactin)是由微生物枯草芽孢杆菌(Bacillus subtilis)经过发酵产生的次级代谢产物,属于胞外产物,呈晶状形貌[1, 2],其基本结构是以β-羟基脂肪酸和含有7个氨基酸的肽以内酯键结合而成的环状脂肽,其中脂肪酸链长为C13~C15,肽的最常见顺序为L-Glu→L-Leu→D-Leu→L-Val→L-Asp→D-Leu→ L-Leu[3]。Surfactin具有表面活性大、乳化和发泡性能良好[4, 5]、抗菌性能强、毒性低、易生物降解、对环境无污染等优异特性。Surfactin可以抗真菌和细菌,能够溶解血液红细胞、原生质体和原生质球[6],能显著降低水的表面张力和其他液-液界面张力,例如,其可将水的表面张力从72mN·m-1降低到27mN·m-1,将十六烷烃的界面张力降至1mN·m-1[7]。此外,它还可以有效保持食品的口感和风味,并且抑制食品中有害微生物的滋生,起到食品防腐的作用[8]。
目前,生物表面活性剂Surfactin在环保、石油开采、高端化妆品、医药、食品加工等行业有很广泛的用途[9],备受国内外研究者的青睐。但是Surfactin无法全面实现大规模的工业化生产,产品供应不足致使其价格昂贵。其中,限制其全面大规模工业化生产的主要因素是产量低且生产和提纯成本高,因而还需要对Surfactin继续深入研究,进一步优化发酵条件并且找到合适的纯化方法来提高产量,降低生产和纯化成本,从而促进Surfactin的进一步推广使用。
本文详细介绍了Surfactin的基本结构、主要特性、生产工艺、纯化方式以及应用,以期为Surfactin的进一步深入研究提供便利。
1 Surfactin的结构与特性
1.1 Surfactin的基本结构
生物表面活性剂Surfactin是一系列具有相似基本结构的环状脂肽的总称。其基本结构是β-羟基脂肪酸和含有7个氨基酸的肽以内酯键结合而成的环状脂肽,该肽含有7个氨基酸,排列顺序一般为L-Glu1→L-Leu2→D-Leu3→L-Val4→L-Asp5→D-Leu6→L-Leu7。其中第一位的谷氨酸(Glu)和第五位的天冬氨酸(Asp)是酸性氨基酸,这使得整个Surfactin分子可带负电且容易形成盐,并且位置7-,4-,2-的氨基酸容易被其他氨基酸替换;另外,β-羟基脂肪酸链的长度为C13~C15。Surfactin的结构示意图见图式 1[3, 10, 11]。
Surfactin系列物结构上的差别就在于几个位置的氨基酸的种类不同以及氨基酸的连接顺序不同,同时碳链的长度及支链位置也不相同。目前,已经发现并且分离出来的Surfactin结构类似物有以下12种(见表 1)[11]。
序号 氨基酸类型
及位置分子量 脂肪酸碳链
长度碳链
类型1 [Leu7]- 1008 13 anteiso 2 [Val7]- 994 13 anteiso 3 [Ile2, Val7]- 994 13 n.d. 4 [Leu7]- 1002 14 iso 5 [Val7]- 1008 14 iso/n 6 [Ile2, Val7]- 1008 14 iso 7 [Leu7]- 1036 15 anteiso 8 [Ile7]- 1022 14 iso 9 [Val7]- 1022 15 anteiso 10 [Ile2, Val7]- 1022 15 anteiso 11 [Ile7]- 1036 15 anteiso 12 [Ile2, Ile7]- 1036 15 n.d. 1.2 Surfactin的主要特性
1.2.1 表面活性
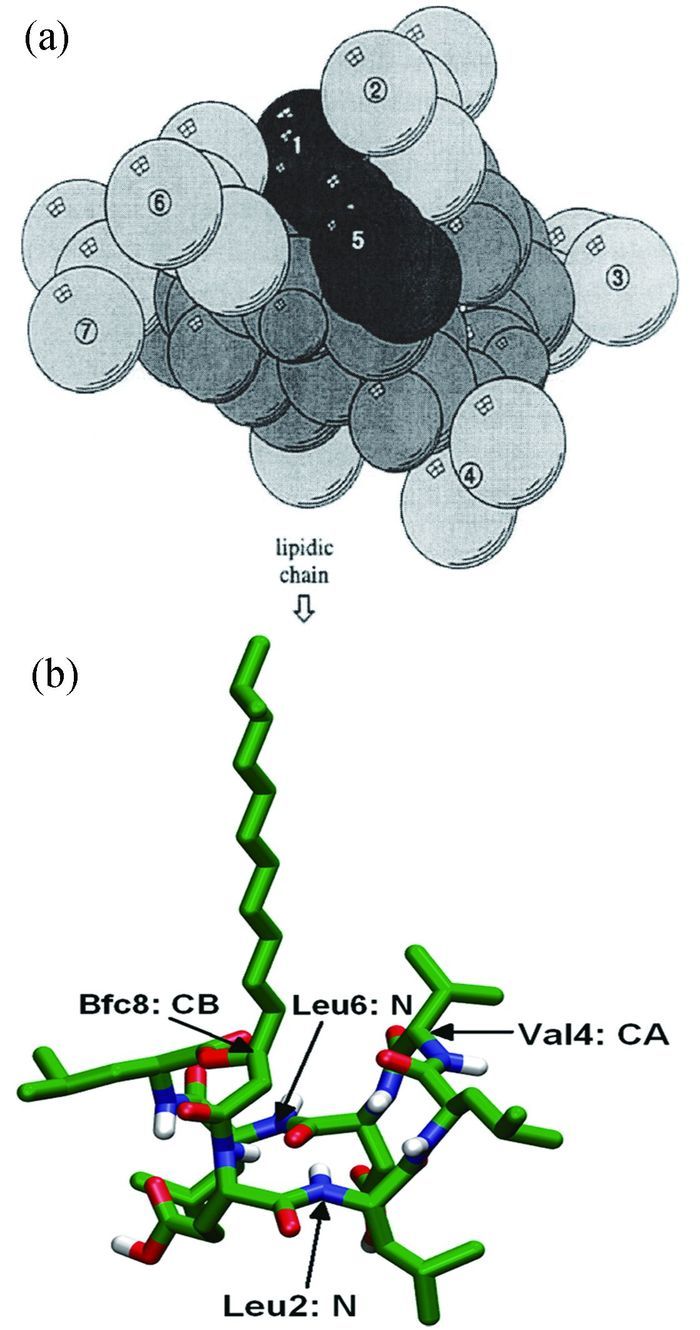
Surfactin分子的构成决定了它是同时具有亲水性和疏水性的两亲性物质[12]。它的环肽中的Glu残基和Asp残基提供了亲水结构域,其他氨基酸残基和脂肪酸链提供了疏水结构域,并且肽环中的氨基酸残基之间可以形成氢键,这促使Surfactin分子在水中形成了β折叠结构,类似于马鞍[13]。马鞍分为两面,其中一面由第1,5位氨基酸残基和相邻的第2,6位氨基酸残基构成:氨基酸残基L-Leu2和D-Leu6彼此面对,氨基酸残基L-Glu1和L-Asp5构成了极性亲水结构域;另一面由第3,4,7位氨基酸残基和脂肪酸链构成:氨基酸残基D-Leu3、L-Val4和L-Leu7与脂肪酸链构成疏水结构域[4, 14]。Surfactin分子的空间填充模型如图 2(a),二级结构模型如图 2(b)。
图(a)为Surfactin的空间填充模型,图中只有氨基酸残基的重原子被编号,灰色代表骨架原子,疏水性氨基酸残基2, 3, 4, 6, 7及脂肪酸链呈浅灰色。酸性残基1和5为黑色和深灰色。图(b)为Surfactin系列物中C15的二级结构图,图中绿色代表C原子,蓝色代表N原子,红色代表O原子,白色代表H原子,其中不显示所有非极性H原子。
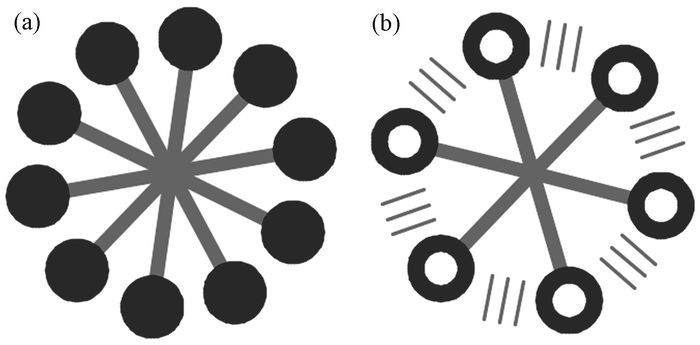
在水中形成胶束时,普通表面活性剂分子的疏水部分向内,亲水部分向外与水接触,如图 3(a)所示。Surfactin除了具有普通表面活性剂的特征外还有其独特的形式[16],即不同Surfactin分子肽环之间可以形成氢键,如图 3(b)所示,此外,Surfactin分子内部氨基酸残基之间也可形成氢键[17]。由于分子内和分子间氢键的存在使得Surfactin分子不但能够形成简单的球状胶束,甚至能在较低浓度时形成较大的聚集体从而多种胶束形态共存,这种独特的存在形式大大增加了Surfactin的表面活性[15, 17, 18]。例如,Arima等[19]研究发现0.005%的Surfactin可以将水表面张力从72mN/m降低到27mN/m。赵越[7]的研究表明Surfactin的临界胶束浓度在25mg/L以下,可以将水的表面张力从72mN/m降低至26mN/m,可以将十六烷烃的界面张力降至1mN/m;此外,Surfactin含量为0.005%的碳酸氢钠溶液(0.1moL/L)可使水的表面张力下降至28mN/m。
1.2.2 乳化性能与发泡性能
Surfactin是到目前为止公认的最强的生物表面活性剂之一,它具有良好的乳化性能和良好的发泡性能,且在水溶液中能够形成稳定的泡沫。吕应年等[11]研究发现,当Surfactin在水溶液中的浓度由0.05mg/mL增加到0.2mg/mL时,发泡体积几乎没有变化,并且形成的泡沫比牛血清白蛋白更加细腻均匀。唐胜球等[20]发现,Surfactin的脂肪链及其结构对发泡性能有一定程度的影响:当脂肪酸链中碳原子的数目为13时,Surfactin在水溶液中的乳化性能最好;当脂肪酸链中碳原子的数目为14时,Surfactin在水溶液中的发泡性能最好;当脂肪酸链中碳原子的数目为15时,泡沫体积急剧减小。
1.2.3 抗菌性能
Surfactin是由枯草芽孢杆菌发酵产生的具有抗菌活性的潜在的抗生素理想替代品之一,它既能抑制多种革兰氏阳性菌、革兰氏阴性菌和真菌等多种病原菌,又具有抗病毒、抗支原体、抗原虫等生物防治活性[21]。Surfactin还可以用于预防和控制不同环境中的单核细胞增生李斯特氏菌[22]。之前的研究表明,Surfactin可以与病原菌的细胞膜相互作用而起到抗菌效果[23, 24],但是,目前对于Surfactin与微生物细胞膜作用的具体机理尚不明确,有如下两种假说:第一种为去垢剂假说,即Surfactin的极性端肽环伸入水相,非极端脂肪酸链插入到细胞膜磷脂分子层的疏水孔中,当达到一定浓度时,就会产生类去垢剂的效应,病原菌细胞膜产生裂缝,胞内物质外泄,最终引起细胞生长受到抑制或凋亡[25, 26]。第二种为孔洞假说,该假说将Surfactin与病原菌生物膜的作用分为3个过程[27, 28]:(1)Surfactin通过与膜之间的疏水作用力将非极性端插入到膜表面;(2)水相中Surfactin带负电的氨基酸和脂质头部产生电荷排斥造成膜弯曲;(3)细胞膜不稳定并产生类似胶束的结构而造成膜裂解。
2 Surfactin的制备工艺
Surfactin是由枯草芽孢杆菌发酵产生的,故出发菌株以及发酵过程都会影响Surfactin的产量。发酵菌株可以是自然界的野生菌株,也可以是经过一定的物理化学因素诱变产生的变异菌株,而影响发酵过程的主要有培养基的营养成分、金属离子的浓度以及发酵工艺等因素。
2.1 发酵菌株
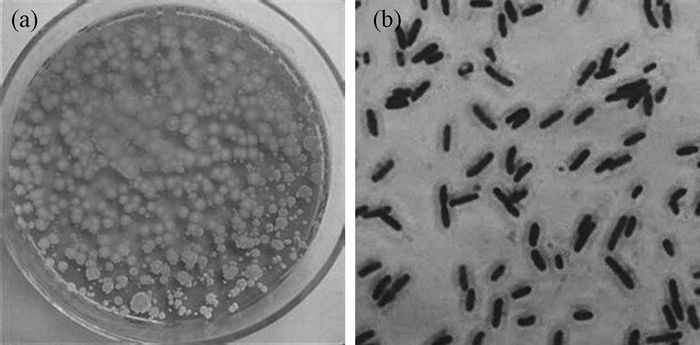
2.1.1 自然界中存在的野生菌株
枯草芽孢杆菌是一种内生芽孢的革兰氏阳性需氧细菌,属于芽孢杆菌属,如图 4。其广泛分布在土壤及腐败的有机物中,也可从由芽孢杆菌发酵的豆制食品中分离出来,且易在枯草浸汁中繁殖[29, 30]。研究表明,野生的枯草芽孢杆菌产Surfacitn的产量通常较低。Arima等[19]发现,经过24h发酵,Surfactin的产量仅有50~100 mg/L。Cooper等[21]利用含4%葡萄糖并添加了金属阳离子的无机盐培养基发酵,并将生成的产物分离出去,产量达到了780mg/L。Sen等[31]优化了培养基,获得的最高产量为760mg/L。Wei等[32]使用富含无机盐的培养基并控制pH等发酵条件,使产量达到约3.5g/L。Yeh等[33]在培养基中添加了固体载体,使产量达到了3.6g/L,而利用改进的生物反应器产量最高能达到6.45g/L[34]。虽然总体来说通过发酵条件的控制与改进使Surfactin的产量得到了提升,但使用原始野生菌株发酵产生Surfactin所得产量还是偏低。
2.1.2 变异菌株
可对自然界中存在的野生枯草芽孢杆菌进行物理因子诱变、化学试剂诱变、抗生素诱变或者多种因子复合诱变而得到变异菌株。通过研究发现,野生菌株经诱变后大部分可筛选出Surfactin产量有所提高的突变菌株。Mulligan等[35]筛选到的一株Bacillus subtilis ATCC 21332菌株,用经紫外诱变后的菌株发酵生产Surfactin的产量为用原始菌株的产量的3倍,达到1.124g/L。贡国鸿等[36]通过对Bacillus subtilis进行低能离子束诱变改良得到E8菌株,发酵产生Surfactin的产量为用原始野生菌株发酵的产量的4倍,粗产物最大量达到了12g/L。
2.2 发酵过程
2.2.1 营养成分
Surfactin的发酵生产通常都是采用合成培养基,培养基中营养成分的配比对于产物的合成非常重要,尤其碳源和L-氨基酸对于Surfactin的生产是必需的。碳源是枯草芽孢杆菌新陈代谢的基础物质,培养基中的碳源会影响Surfactin的产量和结构[37]。赵越等[7]以40g蔗糖为碳源、4g硝酸铵为氮源,在添加1mL 20μmol/L Mn2+、1mL 14μmol/L Ca2+的培养基中培养从油田水样中筛选得到的野生枯草芽孢杆菌Bacillus subtilis HSO121,得到的Surfactin粗提物的产量为150~300 mg/L。贡国鸿等[36]以4%的可溶性淀粉为碳源、0.7%硝酸钠为氮源,在含有适量Fe2+和Mn2+的优化培养基中培养E8菌株,Surfactin粗提物最高量可以达到12g/L,并且此过程的发酵时间比在摇瓶中缩短了8.16h。
2.2.2 金属离子的浓度
金属离子作为矿质元素的来源而加入培养基,是菌体新陈代谢和Surfactin合成中许多关键酶活性调节所必需的因子。Mn2+和Fe2+都是抗菌脂肽生物合成过程中重要的辅酶。We等[38]报道,Mn2+能提高枯草芽孢杆菌ATCC 21332代谢脂肽类物质的量,尤其是Surfactin的量提高最为明显:当培养基中添加0.001mmoL/L Mn2+时,Surfactin的产量从0.33g/L提高至2.60g/L,甚至高于大部分诱变菌株的产量。同时他们研究发现,在富含Fe2+的培养基中,Surfactin的产量会明显提高。除上述Mn2+、Fe2+外,Mg2+和K+的添加也会促进Surfactin的生成与分泌。研究表明,在枯草芽孢杆菌的发酵过程中,Mg2+能够促进Surfactin的合成[39],而K+可促进合成后Surfactin的分泌[40]。
2.2.3 发酵工艺
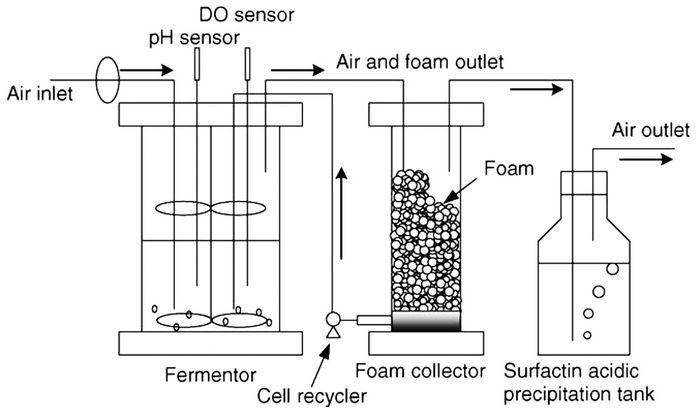
传统的生产工艺是采用发酵罐培养菌体从而生产Surfactin,故发酵的工艺参数如温度、pH、搅拌速率、通气量等都会对枯草芽孢杆菌的生长及Surfactin的合成产生重要影响。目前已经研究出固定化细胞发酵、固态发酵、无泡发酵及泡沫回流发酵等多种新型发酵工艺来提高Surfactin的产量[14]。叶茂松等[41]设计了一种回收利用泡沫的发酵罐(如图 5),此发酵罐利用泡沫收集装置收集泡沫中的脂肽,并且他得出Surfactin的最适生产条件为:培养基中起始葡萄糖浓度为40g/L,转速为300r/min,供氧速率为3.0L/min,此时Surfactin的产量最高可达6.45g/L。
3 Surfactin的纯化
由于Surfactin是由微生物发酵得到的一系列具有相似基本结构的环状脂肽,因此Surfactin粗提物必须经过纯化处理才能得到相对较纯的产品。常用的分离提纯手段包括萃取、泡沫回收分离、酸沉淀、树脂吸附、离心、超滤、色谱等。Chen等[42]提出一种需要对发酵液进行预处理的分离纯化方法:先用酸沉淀回收Surfactin,再用pH=11的NaOH溶液溶解上一步的沉淀,然后将两个阶段得到的最终溶液进行PVDF树脂吸附处理。该方法的回收率较高并且可以得到高纯度的Surfactin,但所采取的酸沉淀回收Surfactin的步骤将进一步增加方法的复杂性,并且有可能影响Surfactin生产的最终成本。此外该方法没有进行Surfactin最终产品性质的测定以评价整个过程的效率。Isa等[43]通过超滤膜过滤纯化Surfactin产品。该方法通过两次超滤过程从发酵液中选择性分离Surfactin,通过MWCO(截留分子量)=10000Da的半多孔膜来完成第一次超滤,在这个阶段,主要实现Surfactin与糖和盐的分离,而蛋白质与Surfactin保持在一起,在第二次超滤中,Surfactin基本上与蛋白质分离。与其他方法相比,此法不需要发酵液的相变或预处理,能得到性质不变且高纯度的产物,操作简单。
4 Surfactin的应用
4.1 Surfactin在医学领域的应用
与普通抗生素相比,Surfactin作为一种抗菌脂肽具有安全环保、几乎无耐药性、无残留等优点[21, 44]。Hwang等[45]通过给感染细菌败血症的小鼠注射一定剂量的Surfactin,观察到小鼠血液中的细菌数量约为未注射Surfactin的老鼠的1/400,从而证明Surfactin对细菌败血症有很好的治疗效果。此外,在临床上Surfactin能有效防治粪产碱菌(Alcaligenes faecalis)、变形杆菌、绿脓杆菌、大肠杆菌和金黄色葡萄球菌等多种耐药菌[46],而且Surfactin可抑制鼠细胞脂多糖(lipopolysaccharides,LPS)介导生成的炎症介质,减缓由LPS引起的真核细胞感染[47]。近几年来,Surfactin在抗病毒制剂[48]、抗肿瘤制剂[49]、溶血栓制剂[50]、口服免疫佐剂[51]、乙肝疫苗[52]以及糖尿病治疗[53]等方面中的应用研究也取得了重大突破。
4.2 Surfactin在食品工业领域的应用
食品生产过程中需要添加某些食品添加剂来保持食品的口感、质地和风味,保持食品不被腐化,有的食品的生产过程还需要进行乳化。Surfactin由于其独特的分子结构及生物性能而广泛应用于食品工业领域,这其中主要利用Surfactin的乳化活性、抑菌防腐及改变食品风味等优良性能。食品加工过程中,添加Surfactin有利于脂肪乳化,有效控制了脂肪聚集,利于食品的加工,并且添加Surfactin能有效保持食品的风味和质地[54]。另外,Surfactin的抗菌活性能有效抑制食品中有害微生物的滋生,起到食品防腐的作用,有利于食品的保鲜[55]。Surfactin在某些食品的生产过程在扮演着十分重要的角色。
4.3 Surfactin在石油开采领域的应用
Surfactin在石油开采领域主要用于驱油、原油破乳以及处理含石油烃的土壤。石油开采需要进行有效驱油和原油破乳两个过程。目前,我国大部分油田处于二次驱油阶段,有的甚至处于三次驱油阶段,因此在开采过程中运用有效驱油剂以及原油破乳剂非常必要。与其他驱油、破乳剂的添加剂相比,Surfactin驱油、破乳更有效、对环境及土壤无污染且作用途径特殊。对于驱油作用,Surfactin一方面通过改变石油中重烃组分的润滑性和润湿性、降解石油中长链饱和烃成分,从而降低原油的粘稠度,使石油从储油层中脱落;另一方面由于本身的酸性,Surfactin可提高储油层岩石的溶解度,使原油的渗透量和面积增大[56, 57]。对于原油破乳作用,主要是运用电化学的相关方法和膜电阻的相关原理,将Surfactin添加到破乳剂当中,使得原油界面的膜电容随着时间增加而不断加大,大大加快了膜的破裂速率,从而提高原油破乳的效率[56, 58];并且添加Surfactin到破乳剂中,能够有效降低水和原油的界面张力[59],从而使油膜的厚度变薄,加速其破裂的过程,达到良好的破乳效果。Surfactin除了用于驱油和破乳以外,也可用于处理土壤中石油烃的污染问题。Singh等[60]以Surfactin为洗涤剂的主要成分来洗涤含有石油烃的土壤,发现石油烃的去除率可达64.5%。
5 结语
本文详细综述了Surfactin的基本结构、主要特性、生产工艺、纯化方式以及应用。不难发现,Surfactin的生产是一个采用微生物发酵技术以碳氢化合物等可再生能源为原料的对环境无污染的生物化学过程,符合现代绿色化学发展的趋势。Surfactin独特的分子结构及生物性能使其具有强大的表面活性、良好的乳化和发泡性能、优良的抗菌性能、以及低毒性、低残留、易生物降解、环境无污染等特性,被广泛应用于环保、石油开采、高端化妆品、医药、食品加工等行业。化学技术的不断进步和生物工程的迅速发展为Surfactin更加深入的研究提供了必要条件。
Surfactin的优异性质决定了它的广泛用途,并广受欢迎,但是目前有一些因素限制了它的使用。一方面,Surfactin微观层面的研究尚待进一步发掘。对Surfactin分子在界面处的结构性质、Surfactin分子之间的相互作用以及Surfactin分子与体相分子之间的相互作用了解得尚不全面,无法详细指导Surfactin的应用以及无法明确Surfactin的作用机理。另一方面,Surfactin在生产工艺和纯化方式方面仍存在一定挑战。Surfactin的产量低且生产和提纯成本高,无法实现全面大规模的商业化生产,产品供应不足致使价格昂贵。针对以上问题,我们提出以下几点建议:
(1) 未来对Surfactin进行分子水平的研究,有利于明确Surfactin分子在界面处的结构性质。Surfactin分子之间的相互作用以及Surfactin分子与体相分子之间的相互作用,有望进一步指导Surfactin的应用以及明确Surfactin的表面活性作用机理。
(2) 就Surfactin的生产工艺来说,生产菌株、发酵过程等因素都会影响到Surfactin的生产以及产量。有效进行生产菌株的改造并对发酵过程进行优化与控制是至关重要的。通过以下三方面的措施有望改善Surfactin的生产、提高Surfactin的产量且降低生产成本。一是在生产菌株方面,通过基因重组技术构建新型基因工程菌或采用诱变技术得到变异菌株,运用高通量筛选技术得到Surfactin高产菌株作为发酵出发菌株来改善Surfactin的生产并提高产量;二是在发酵过程方面,运用响应面法对Surfactin发酵过程中培养基的营养成分如碳源、氮源等以及金属离子的种类和浓度等因素进行全因子优化实验,得出最佳发酵条件来优化发酵过程,从而提高Surfactin的产量;三是在培养基成分的碳源选择方面,选择富含油、甘油、糖以及含木质纤维素的工业残留物经过酶水解处理,以得到的水解产物作为生产Surfactin的碳源,这不仅可以解决这些工业残留物引起的环境污染问题,还可以降低Surfactin的生产成本。
(3) 对于Surfactin发酵工艺后的提取纯化方式,目前多采用离心或者超滤,导致提纯成本高。寻找新的低成本的纯化方式,应是未来纯化工艺的重点发展方向。
随着化学技术的不断进步和生物工程的迅速发展,后续研究者可借助先进技术对Surfactin进行更深层次的研究,进一步促进Surfactin的工业化生产并推广使用。生物表面活性剂Surfactin在未来必会实现大规模的商业化生产,其应用也会取得突破性的进展。
-
-
[1]
R Sen, T Swaminathan. Appl. Microbiol. Biotechnol., 1997, 47(4):358~363. doi: 10.1007/s002530050940
-
[2]
李晶, 杨谦.安徽农业科学, 2008, 36(1):106~111.
-
[3]
S A Onaizi, M S Nasser, F A Twaiq. Colloid Polym. Sci., 2014, 292(7):1649~1656. doi: 10.1007/s00396-014-3223-y
-
[4]
F Peypoux, J M Bonmation, J Wallach. Appl. Microbiol. Biotechnol., 1999, 51(5):553~63. doi: 10.1007/s002530051432
-
[5]
丁立孝, 贺国庆, 孔青.生物技术, 2003, 15(5):52~54.
-
[6]
L Thimon, F Peypoux, R Maget-Dana et al. Biotechnol. Appl. Biochem., 1992, 16(2):144~151.
-
[7]
赵越. 华东理工大学博士学位论文. 2012.
-
[8]
S M Mandal, A E A D Barbosa, O L Franco. Biotechnol. Adv., 2013, 31(2):338~345. doi: 10.1016/j.biotechadv.2013.01.004
-
[9]
孙文, 王泽建, 刘洁等. CN:103059107, 2013.
-
[10]
J R Lu, X B Zhao, M Yaseen. Curr. Opin. Colloid Interf. Sci., 2007, 12(2):60~67.
-
[11]
吕应年, 杨世忠, 牟伯中.生物技术通报, 2004, (6):11~16.
-
[12]
K Tsujii. Surface Activity:Principles, Phenomena, and Applications. San Diego:Academic Press, 1998.
-
[13]
X Gallet, M Deleu, H Razafindralambo et al. Langmuir, 1999, 15(7):2409~2413. doi: 10.1021/la980954r
-
[14]
张莉. 南京农业大学硕士学位论文, 2013. http://cdmd.cnki.com.cn/article/cdmd-10307-2008031530.htm
-
[15]
H Z Gang, J F Liu, B Z Mu. J. Phys. Chem. B, 2011, 115(44):12770~12777. doi: 10.1021/jp206350j
-
[16]
Y Ishigami, M Osman, H Nakahara et al. Colloid. Surf. B, 1995, 4(6):341~348. doi: 10.1016/0927-7765(94)01183-6
-
[17]
刘静. 华东理工大学博士学位论文, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10251-2010138228.htm
-
[18]
邹清青, 欧阳琛璨, 堀川贵生等.中国洗涤用品工业, 2016(2):50~54.
-
[19]
K Arima, A Kakinuma, G Tamura. Biochem. Biophys. Res. Commun., 1968, 31(3):488~494.
-
[20]
唐胜球, 董小英, 邹晓庭.黑龙江畜牧兽医, 2007, 304(05):28~29. doi: 10.3969/j.issn.1004-7034.2007.05.011
-
[21]
D G Cooper, C R MacDonald, S J B Du et al. Appl. Environ. Microbiol., 1981, 42(3):408~412.
-
[22]
D C Sabate, M C Audisio. Microbiol. Res., 2013, 168(3):125~129. doi: 10.1016/j.micres.2012.11.004
-
[23]
C Carrillo, J A Teruel, F J Aranda et al. Biochim. Biophys. Acta, 2003, 1611(1-2):91~97. doi: 10.1016/S0005-2736(03)00029-4
-
[24]
翟少伟, 李剑, 史庆超.动物营养学报, 2015, 27(5):1333~1340.
-
[25]
H Heerklotz, J Seelig. Eur. Biophys. J., 2007, 36(4/5):305~314.
-
[26]
H Patel, Q Huynh, D Bärlehner et al. Biophys. J., 2014, 106(10):2115~2125. doi: 10.1016/j.bpj.2014.04.006
-
[27]
S Buchoux, J Lai-Kee-Him, M Garnier et al. Biophys. J., 2008, 95(8):3840~3849. doi: 10.1529/biophysj.107.128322
-
[28]
K C Huang, C M Lin, H K Tsao et al. J. Chem. Phys., 2009, 130(24):122~126.
-
[29]
杨洁. 西北农林科技大学硕士学位论文. 2012. http://cdmd.cnki.com.cn/Article/CDMD-10712-1012436634.htm
-
[30]
N S Shaligram, R S Singhal. Food Technol. Biotechnol., 2010, 48:119~134.
-
[31]
R Sen, T Swaminathan. Appl. Microbiol. Biotechnol., 1997, 47(4):358~363. doi: 10.1007/s002530050940
-
[32]
Y H Wei, I M Chu. Biotechnol. Lett., 2002, 24(6):479~482. doi: 10.1023/A:1014534021276
-
[33]
M S Yeh, Y H Wei, J S Chang. Biotechnol. Prog., 2005, 21(4):1329~1334.
-
[34]
M S Yeh, Y H Wei, J S Chang. Proc. Biochem., 2006, 41(8):1799~1805. doi: 10.1016/j.procbio.2006.03.027
-
[35]
C N Mulligan, T Y K Chow, B F Gibbs. Appl. Microbiol. Biotechnol., 1989, 31(5):486~489.
-
[36]
贡国鸿, 刘清梅, 袁成凌等. 工业生物技术研发及生产生物质能和生物基化学品技术交流与发展研讨会, 2007.
-
[37]
翟亚楠, 郭昊, 魏浩等.中国生物工程杂志, 2011, 31(11):114~122.
-
[38]
Y H Wei, I Chu. Enzyme Micro. Tech., 1998, 22(8):724~728. doi: 10.1016/S0141-0229(98)00016-7
-
[39]
K Reuter, M R Mofid, M A Marahiel et al. EMBO J., 1999, 18(23):6823~6831. doi: 10.1093/emboj/18.23.6823
-
[40]
R F Kinsinger, M C Shirk, R Fall. J. Bacteriol., 2003, 185(18):5627~5631. doi: 10.1128/JB.185.18.5627-5631.2003
-
[41]
M S Yeh, Y H Wei, J S Chang. Proc. Biochem., 2006, 41(8):1799~1805. doi: 10.1016/j.procbio.2006.03.027
-
[42]
H L Chen, R S Juang. J. Membr. Sci., 2008, 325(2):599~604. doi: 10.1016/j.memsci.2008.08.017
-
[43]
M H M Isa, R A Frazier, P Jauregi. Sep. Purif. Technol., 2008, 64(2):176~182. doi: 10.1016/j.seppur.2008.09.008
-
[44]
G Seydlova, J Svobodova. Cent. Eur. J. Med., 2008, 3(2):123~133.
-
[45]
Y H Hwang, B K Park, J H Lim et al. Eur. J. Pharm., 2007, 556(1-3):166~171. doi: 10.1016/j.ejphar.2006.10.031
-
[46]
P Das, S Mukherjee, R Sen. J. Appl. Microbiol., 2008, 104(6):1675~1684. doi: 10.1111/j.1365-2672.2007.03701.x
-
[47]
M H Hwang, Z Q Chang, E H Kang et al. Biotechnol. Lett., 2008, 30(2):229~233. doi: 10.1007/s10529-007-9552-x
-
[48]
X Huang, Z Lu, H Zhao. Int. J. Pept. Res. Ther., 2006, 12(4):373~377.
-
[49]
J H Lee, S H Nam, W T Seo et al. Food Chem., 2012, 131(4):1347~1354. doi: 10.1016/j.foodchem.2011.09.133
-
[50]
G Dehghannoude, M Housaindokht, B S Bazzaz. J. Microbiol., 2005, 43(3):272~276.
-
[51]
Z Gao, X Zhao, S Lee et al. Vaccine, 2013, 31(26):2796~2803. doi: 10.1016/j.vaccine.2013.04.028
-
[52]
H Pan, X Zhao, Z Gao et al. Protein Peptide Lett., 2014, 21(9):901~910. doi: 10.2174/0929866521666140418100743
-
[53]
Z Gao, X Zhao, T Yang et al. Vaccine, 2014, 32(50):6812~6819. doi: 10.1016/j.vaccine.2014.08.082
-
[54]
S M Mandal, A E A D Barbosa, O L Franco. Biotechnol. Adv., 2013, 31(2):338~345. doi: 10.1016/j.biotechadv.2013.01.004
-
[55]
K R Meena, S S Kanwar. Biomed. Res. Int., 2015, 2015(3):1~9.
-
[56]
何欣.化学工程与装备, 2016(4):94~95. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=fjhg201604027&dbname=CJFD&dbcode=CJFQ
-
[57]
刘飞, 赵祥颖, 田延军等.中国酿造, 2011, 30(6):159~162. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=zngz201106047&dbname=CJFD&dbcode=CJFQ
-
[58]
张良晓, 杨祥, 陈艳玲.四川化工, 2005, 8(4):13~15. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=shyf200504005&dbname=CJFD&dbcode=CJFQ
-
[59]
刘江红, 陈逸桐, 贾云鹏等.化学通报, 2013, 76(7):590~593. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxtb201307002&dbname=CJFD&dbcode=CJFQ
-
[60]
A K Singh, S S Cameotra. Environ. Sci. Poll. Res., 2013, 20(10):7367~7376.
-
[1]
-
序号 氨基酸类型
及位置分子量 脂肪酸碳链
长度碳链
类型1 [Leu7]- 1008 13 anteiso 2 [Val7]- 994 13 anteiso 3 [Ile2, Val7]- 994 13 n.d. 4 [Leu7]- 1002 14 iso 5 [Val7]- 1008 14 iso/n 6 [Ile2, Val7]- 1008 14 iso 7 [Leu7]- 1036 15 anteiso 8 [Ile7]- 1022 14 iso 9 [Val7]- 1022 15 anteiso 10 [Ile2, Val7]- 1022 15 anteiso 11 [Ile7]- 1036 15 anteiso 12 [Ile2, Ile7]- 1036 15 n.d. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:




 下载:
下载:

