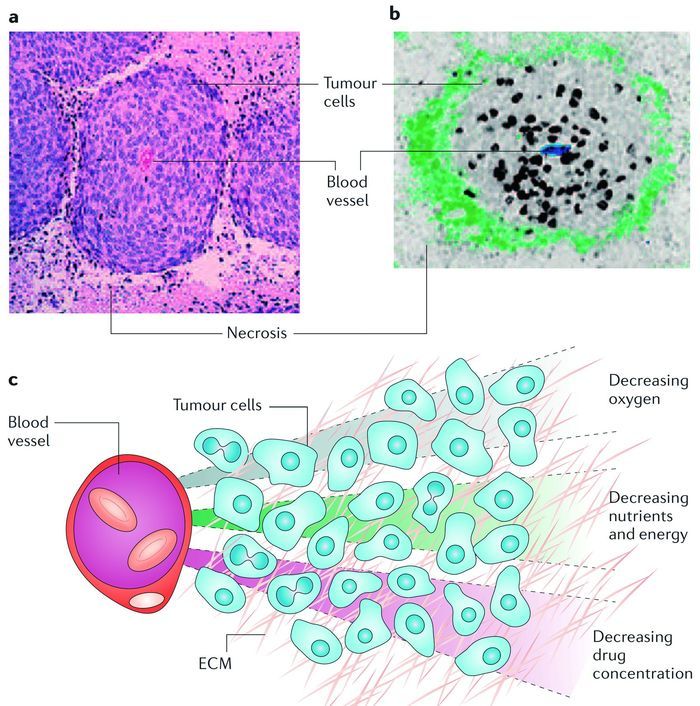
 图1
肿瘤细胞远离血管从而导致药效差的潜在原因[19]
Figure1.
Potential reasons why cells distant from blood vessels might be resistant to treatment[19]
图1
肿瘤细胞远离血管从而导致药效差的潜在原因[19]
Figure1.
Potential reasons why cells distant from blood vessels might be resistant to treatment[19]

Citation: Zhou Guoyong, Luo Yingchun, Li Heping. Progress in Polymer Nano Carriers for Improving Deep Tumor Penetration[J]. Chemistry, 2017, 80(10): 891-899.

促进纳米载体肿瘤组织渗透性的研究进展
English
Progress in Polymer Nano Carriers for Improving Deep Tumor Penetration
-
Key words:
- Tumor penetration
- / Anticancer drug
- / Nano-carriers
- / Tumor therapy
-
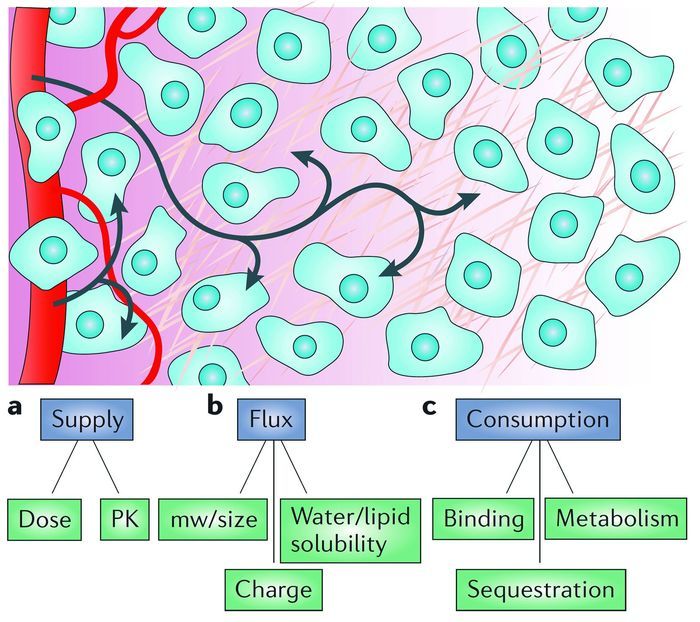
目前,肿瘤仍然严重地威胁着人类的健康和生命,已成为一个严峻的公共卫生问题[1]。尽管二十多年前,肿瘤微环境刺激响应性的负载抗癌药物纳米载体(以下简称载体)已开始应用于肿瘤诊疗领域,并取得了喜人的研究进展与成果[2~14]。然而其不足之处是,当载体在肿瘤病灶部位聚集之后大多数蓄集于肿瘤组织外围,而载体需向肿瘤组织深处传输方可发挥药效。实现载体在大多数肿瘤细胞、甚至每个肿瘤细胞内均匀分布,并达到肿瘤细胞的致死浓度,以有效阻止肿瘤细胞恶性繁殖、提高肿瘤治疗效率,仍然是一项巨大的挑战[15~18]。
抗癌药物的作用机理一般可分为阻止DNA复制和抑制肿瘤细胞的有丝分裂两大类。但是,无论何种类型,都需要抗肿瘤药物达到肿瘤细胞凋亡浓度才可实现终止肿瘤细胞繁殖、抑制肿瘤的目标,发挥肿瘤治疗疗效[20]。目前所存在的问题是:(1)由于肿瘤血管网的杂乱无章与淋巴功能的缺失特点,无法调节组织液实现动态平衡[21, 22];(2)肿瘤血管的高渗特点最终造成肿瘤组织间隙液压(Interstitial fluid pressure)较高[23],且这种高压的特点严重影响载体在肿瘤组织的渗透性;(3)在肿瘤组织中,肿瘤血管间及肿瘤细胞外基质结构的不均衡性、肿瘤微环境基质细胞类型的差异,影响其渗透性;通过肿瘤血管进行载体传输时,肿瘤血管间的特点对于载体在肿瘤组织的渗透性有阻碍作用;(4)载体通过肿瘤间质/肿瘤细胞外基质到肿瘤细胞的障碍较大,新的肿瘤血管血液粘度较大,血流缓慢且呈现非均匀性[24, 25];(5)肿瘤的外围血管密度高,而肿瘤中心部位处血管密度低,肿瘤细胞的快速增殖迫使血管相互分开,肿瘤血管之间距离增大,肿瘤组织内血管密度减少,同时肿瘤细胞与肿瘤血管的距离增加(>100μm)[26](如图 1所示);(6)肿瘤中心部位具有致密的间质结构[25],这一特点也进一步加大了载体在肿瘤组织的渗透难度;(7)载体的结构、载体所释放的药物的代谢及理化性质等因素也会影响渗透性[19]。
 图1
肿瘤细胞远离血管从而导致药效差的潜在原因[19]
Figure1.
Potential reasons why cells distant from blood vessels might be resistant to treatment[19]
图1
肿瘤细胞远离血管从而导致药效差的潜在原因[19]
Figure1.
Potential reasons why cells distant from blood vessels might be resistant to treatment[19]
以上肿瘤微环境的特点、载体本身的结构与药物的特性,导致肿瘤组织中仅存在较低的填隙式扩散,渗透性差,大多数载体仍停留于肿瘤血管附近,无法实现将抗癌药物均匀传输至整个肿瘤组织内部,最终造成药物在肿瘤组织中浓度分布极不均一[27],如图 2所示。在局部区域,特别是肿瘤组织深处,药物浓度很低,甚至为零,根本未达到肿瘤细胞的致死浓度[15],无法实现药物诱导肿瘤细胞凋亡,最终结果是疗效差或者无疗效。与此同时反而产生副作用,往往导致肿瘤细胞多药耐药性[28, 29],这也是肿瘤治疗疗效较低[30~33]、化疗效果较差或者治疗失败的主要原因之一[34, 35]。由于以上肿瘤微环境(肿瘤基质)的各种特点,加之载体自身的多方面原因,急需解决提高载体肿瘤组织渗透性进而提高肿瘤治疗疗效这一关键性的、基础性的、共性的科学问题。
1 载体渗透肿瘤组织机理
载体若要实现肿瘤组织渗透往往须经三个步骤:首先,将载体通过血管传输至肿瘤组织;然后,载体在肿瘤组织内部传输,到达肿瘤血管壁,再穿过肿瘤间质、细胞外基质等障碍;最后,载体在肿瘤组织释放药物,或者被肿瘤细胞吞噬、药物被释放而发挥抗肿瘤作用,进而提高疗效[36, 37],如图 3所示。在正常组织中,载体往往通过扩散和对流进行传输,但是对于肿瘤组织而言,由于其间隙液压较高和独特的血管结构特点,如仅通过扩散和对流等方式进行传输,效果不佳,难以达到肿瘤组织深部传输的目标,往往需要借助超声、光热效应等物理作用或者肿瘤细胞穿膜肽等技术,以激活载体的渗透功能,或者通过设计载体结构,赋予其肿瘤组织渗透性,实现肿瘤组织深部传输[38, 39]。
1.1 外部刺激响应性载体渗透机理
物理刺激响应性载体通常指一类能够根据其所处的生理环境作出特定响应的载体,主要由超声、温度、激光、光化学等外部刺激作用促使载体在特定的时间、特定的地点以特定的量进行药物释放行为。物理刺激响应性对于提高载体在肿瘤组织中的渗透性具有重要作用[37, 40]。
1.1.1 超声响应性载体渗透机理
超声可实时成像,在引导组织器官原位无损活检及介入治疗等方面发挥着重要作用。可以利用超声波可远距离传播的特点,充分发挥其非侵入性、可视性、组织渗透性和聚焦性等优势[41]。再者,其具有热效应、空化效应、力学效应与化学效应等,可将载体结构破坏,促进药物释放;同时超声作用可改善肿瘤组织的通透性[42]。更为重要的是,由于声液滴汽化作用[43, 44],小液滴气化,压强与温度升高,形成微流,肿瘤血管中血液流速增加,由肿瘤血管至血管壁和肿瘤细胞外基质的传输能力显著提升[45]。此外,超声作用还可以增加肿瘤血管和肿瘤细胞膜的通透性,增进载体在肿瘤组织的扩散性、渗透能力[46]。
1.1.2 光热效应载体渗透机理
发射波长在近红外区的激光在活体内渗透性较好,当其照射(位于肿瘤部位的)具有响应性的载体时[47],若入射光波的传播常数与表面等离子波的传播常数相匹配时,则会引起自由电子产生共振,即表面等离子共振。此时载体吸收光能并瞬间转化为热能,从而导致载体聚集的肿瘤部位温度升高,血液粘度降低,肿瘤血液流速增加,传输速度与运载能力增加,组织器官的通透性显著增强,使其在肿瘤组织中的渗透性提高[48]。另外,较高的温度又可进一步增加抗肿瘤药物的药效[29]。
1.2 肿瘤组织穿透肽功能化载体的透渗机理
具有穿透功能的短肽被称之为肿瘤组织穿透肽,有的还具有主动靶向功能,如iRGD具有肿瘤组织靶向与渗透性双重功能[49, 50]。载体在肿瘤组织聚集,然后在肿瘤组织深部实现给药,并在肿瘤细胞核内达到一定的浓度,是发挥抑制肿瘤细胞生长药效的必要条件[51~53]。肿瘤组织穿透肽的渗透机理为其激活了胞吞转运的相关途径,但是其又不同于胞饮作用,它通过一个较为复杂的过程[53]。首先结合肿瘤受体,发生溶蛋白性裂解;再结合第二个受体依赖神经菌毛素(neuropilin-1/-2),激活传输路径,进而具有渗透作用[53],如图 4(A)所示。Sugahara等[54]研究了肿瘤组织穿透肽iRGD介导的十多种物质(从0.6kDa的分子至130nm的粒子),均具有良好的渗透效果。
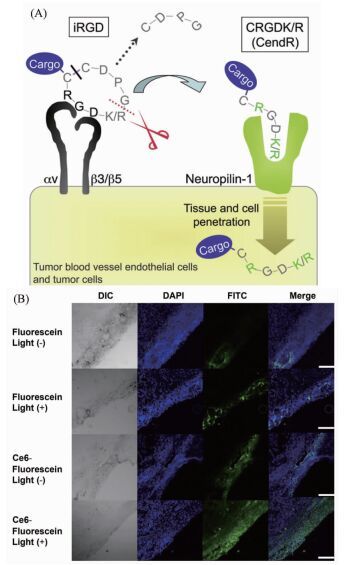 图4
(A) iRGD多步绑定渗透机理[53];(B)在激光或非激光照射下,荧光素进入肿瘤组织与细胞的共聚焦显微成像[59]
Figure4.
(A) Multistep binding and penetration mechanism of iRGD[53]; (B) In vivo tissue penetration of fluorescein, CLSM image of the tissue penetration of eluted fluorescein from each membrane into the tumor tissue with or without laserirradiation[59]
图4
(A) iRGD多步绑定渗透机理[53];(B)在激光或非激光照射下,荧光素进入肿瘤组织与细胞的共聚焦显微成像[59]
Figure4.
(A) Multistep binding and penetration mechanism of iRGD[53]; (B) In vivo tissue penetration of fluorescein, CLSM image of the tissue penetration of eluted fluorescein from each membrane into the tumor tissue with or without laserirradiation[59]
另外,蛋白水解酶[55]修饰的右旋糖苷[56]以及适配子[57]修饰的载体均可提高肿瘤组织的渗透性。另外,还可通过药代动力学策略来提高载体在肿瘤组织中的渗透性[58]。
1.3 载体以光敏化反应产生单线态氧渗透机理
光敏化反应可产生一种强的氧化剂,被称之为单线态氧。如图 4(B)所示,Min等[59]通过光敏化反应产生单线态氧,破坏上皮层,改善肿瘤组织结构,以促进肿瘤组织渗透性。以亲水性的荧光素作为参照组来考察肿瘤组织渗透情况,结果表明实验组的渗透效果显著。肿瘤血管内皮细胞的形态学调变在医药领域是一个较为常见的技术,通过单线态氧可降低上皮层的密度[60],从而实现载体在肿瘤组织的渗透性[61]。
2 促进肿瘤组织渗透性的策略
2.1 调控载体特性
调控载体的粒径[63]、Zeta电位、形状、结构与化学组成,特别是表面高分子链的亲/疏水性、生理稳定性、肿瘤细胞表面受体的靶向情况等特性均会影响其在血液循环、肿瘤组织渗透性、肿瘤细胞内吞等多个环节的性能[36, 64]。
2.1.1 载体的粒径
载体的粒径影响生物物质分布、细胞内吞[47, 65~71]等,是影响渗透的重要因素之一。具体而言,小粒径的载体往往在肿瘤组织聚集效果不理想,载药效率低,而较大粒径的载体肿瘤组织渗透性欠佳。在设计载体时,往往需要在肿瘤组织聚集与肿瘤组织渗透性之间综合考虑载体粒径问题,以寻求平衡,即在传输的不同阶段需要载体具有不同的粒径,也有可能存在最佳的粒径[72~74]。如图 5所示,Cabral等[75]研究了粒径与肿瘤组织渗透性之间的关系,结果显示,小于50nm的载体对于贫供血肿瘤有较好的组织渗透性;而对于高渗透结构的血管性瘤,载体粒径小于100nm时,对于肿瘤外渗和渗透无影响。所有聚合物胶束(粒径30、50、70和100 nm)均可穿透小鼠的高度可渗透性肿瘤组织,但只有30nm的胶束可以渗透胰腺肿瘤以达到抗肿瘤作用。
张灿等[76, 77]利用智能化载体粒径变化的思想,设计了可逆溶胀收缩凝胶,其可在肿瘤细胞内发生膨胀,而在正常组织又复原,实现肿瘤组织渗透性纳米药物传输。王均等[78]报道了具有超高pH响应性的智能纳米超结构载体,其在肿瘤的酸性微环境中可快速改变尺寸,改善肿瘤穿透性,如图 6(A)所示。SCNs/Pt的一个独特之处在于,它们在中性pH下尺寸约为80nm,但是在肿瘤微酸性环境中能够瞬间解离为粒径小于10nm的模块。这种快速的尺寸切换功能不仅可以通过增强的渗透性和保留效应促进纳米颗粒外渗和积聚,还可以使纳米粒子扩散更快,更高效地实现肿瘤渗透。
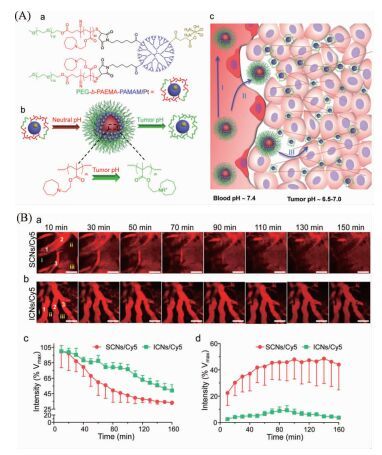 图6
A):(a) PEG-b-PAEMA-PAMAM/Pt的结构;(b) PEG-b-PAEMA-PAMAM/Pt在中性pH下自组装为pH敏感纳米簇,在肿瘤组织裂解为微小粒子;(c) SCNs/Pt作为一个充满活力的纳米平台克服在肿瘤组织弱渗透性的生理障碍;(B)通过尾静脉注射后,在体内实时观察SCNs/Cy5与ICNs/Cy5的分布,及血管内部与外部荧光强度与穿透时间的关系[78]
Figure6.
(A): (a) Structure of PEG-b-PAEMA-PAMAM/Pt; (b) Schematic illustration showing the self-assembly of PEG-b-PAEMA-PAMAM/Pt into the pH-sensitive cluster nanobombs (SCNs/Pt) at neutral pH and the disintegration of SCNs/Pt into small particles at tumor acidic pH; (c) Schematic illustration of SCNs/Pt as a robust nanoplatform to overcome biological barriers to in vivo drug delivery in poorly permeably pancreatic tumor models. (B): In vivo real-time observation of the microdistribution of(a) SCNs/Cy5 and(b) ICNs/Cy5 in BxPC-3 xenografts after intravenous administration. Scale bar=100 μm. Time-penetration average fluorescence intensity evolution of the intravascular compartments(c) and extravascular compartments(d)[78]
图6
A):(a) PEG-b-PAEMA-PAMAM/Pt的结构;(b) PEG-b-PAEMA-PAMAM/Pt在中性pH下自组装为pH敏感纳米簇,在肿瘤组织裂解为微小粒子;(c) SCNs/Pt作为一个充满活力的纳米平台克服在肿瘤组织弱渗透性的生理障碍;(B)通过尾静脉注射后,在体内实时观察SCNs/Cy5与ICNs/Cy5的分布,及血管内部与外部荧光强度与穿透时间的关系[78]
Figure6.
(A): (a) Structure of PEG-b-PAEMA-PAMAM/Pt; (b) Schematic illustration showing the self-assembly of PEG-b-PAEMA-PAMAM/Pt into the pH-sensitive cluster nanobombs (SCNs/Pt) at neutral pH and the disintegration of SCNs/Pt into small particles at tumor acidic pH; (c) Schematic illustration of SCNs/Pt as a robust nanoplatform to overcome biological barriers to in vivo drug delivery in poorly permeably pancreatic tumor models. (B): In vivo real-time observation of the microdistribution of(a) SCNs/Cy5 and(b) ICNs/Cy5 in BxPC-3 xenografts after intravenous administration. Scale bar=100 μm. Time-penetration average fluorescence intensity evolution of the intravascular compartments(c) and extravascular compartments(d)[78]
胶束负载化疗药物的抗肿瘤效果主要取决于两个方面:在肿瘤区域的积累和肿瘤深部的渗透。这两个过程对粒径有不同的要求。通常认为确保渗透性和保留性(Permeability and retention,ERP)的最佳粒径为约100nm,而要深入到肿瘤内部需要更小的尺寸[78],如图 6(B)所示。为了解决这两个不同的要求,沙先谊等[79]构建了基于交联胶束骨架的尺寸可调胶束纳米团簇(MNC)。胶束的粒径为14.6±0.8nm,形成MNC后,粒径增加到104.2±8.1nm,可以有效利用EPR效应。在溶酶体中,MNC可转变为独立胶束,更有利于进行穿透。体内抗肿瘤结果表明,尺寸可调的MNC对于肿瘤治疗比普通胶束更有效。上述设计思想充分考虑了载体在传输的不同阶段需要有不同的粒径的特性,充分利用载体不同粒径的优势,实现载体在肿瘤组织中的高渗透性[80]。
通过设计载体粒径智能化,使其在肿瘤微组织中粒径较小,适宜肿瘤组织渗透需求;而在正常组织中粒径较大,满足EPR肿瘤聚集功能的需求,为实现肿瘤组织的高渗透性提供了必要的基础性条件[65]。
2.1.2 载体的Zeta电位
载体的Zeta电位包括正电荷、负电荷与中性电荷三种类型。由于血液这种胶体粒子带有负电荷等原因,血液、肾脏等清除载体的速率高度依赖载体表面的电荷等因素[81]。具体来说,与负电荷/中性电荷载体相比,常见的PEG修饰的正电荷载体具有优异的渗漏性和渗透性,容易被肿瘤细胞吞噬,具有较好的抗肿瘤效果,但是其血液循环时间较短,肿瘤组织聚集效果较差;另外,载体的强正电荷可能会阻碍对肿瘤组织的渗透性,造成此现象的原因被称之为“结合位点障碍”。也就是说,如果载体与第一个靶体结合太牢固,会导致渗透能力降低[82]。负电荷载体具有较长的血液循环时间与较好的肿瘤间质传输性能,但是不易被肿瘤细胞吞噬。中性电荷载体扩散速度大于负载电荷的载体,血液循环时间相对较长[83]。
王均等[84]研究发现,表面电荷严重影响抗癌纳米药物的肿瘤渗透和治疗功效,其中,带正电荷的PEG修饰载体有显著的渗透肿瘤间质特点。同样地,Miura等[85]也研究发现阳离子聚合物胶束呈现较好的渗透性,大多数的阳离子胶束以单聚体的形式通过细胞内途径穿透,阳离子单体主要利用网格蛋白介导的胞吞作用和巨胞饮进入细胞。此外,如图 7所示,帅心涛等采用载体电荷翻转思想进行抗癌药物的传输,并取得了较好的药物传输与肿瘤治疗效果[86~89]。
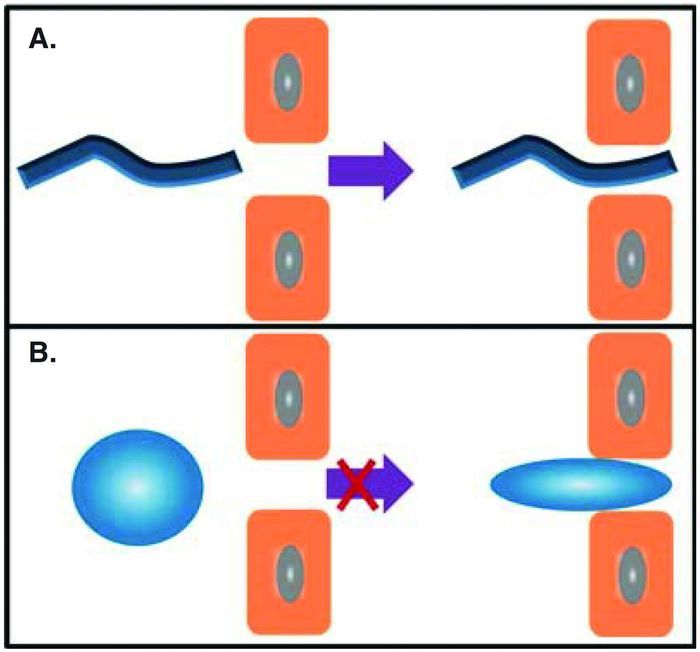
2.1.3 载体的形状
载体的形状对生物循环、生物分布、细胞摄取和总体药物功效均有影响。载体的形状在通过肿瘤间质与被细胞吞噬时,影响其扩散与入胞速率,如图 8所示。另外,非球形的载体,很可能由于阻力与肿瘤细胞内吞的缘故,容易穿过肿瘤血管内皮细胞的间隙。盘状载体、蠕虫状载体、球形载体的渗透性依次增加[90~92]。
此外,载体的亲/疏水性及靶向配体的电荷、密度、大小与方向等因素都会影响载体的肿瘤组织渗透性与入胞,进而影响肿瘤治疗疗效[11]。
2.1.4 载体的化学组成与结构
载体的化学组成与结构影响载体肿瘤组织渗透、肿瘤细胞内吞与血液循环等行为[94, 95]。研究者们采用双层包覆的遮蔽体系技术、疏水作用自组装、脂质体介导天然膜囊泡负载光敏剂等策略赋予载体渗透能力,实现肿瘤组织渗透、聚集与克服多药耐药性[96~99]等目标。
2.2 改善肿瘤组织微环境
肿瘤组织微环境是肿瘤细胞赖以生存的复杂微环境,是肿瘤赖以生存的基础,主要有多种不同的细胞外基质与基质细胞组成,对于肿瘤的发生、转移具有重要的作用。改变肿瘤微环境的某些特点,如减缓肿瘤间质高血压、规范肿瘤血管网络、降低肿瘤间质密度与肿瘤细胞密度等有助于提高肿瘤组织的渗透性。
肿瘤血管运输、肿瘤血管壁与肿瘤基质等因素往往影响载体在肿瘤组织的渗透性[100]。另外,肿瘤体积的大小、淋巴结也对载体渗透性有一定影响。
2.2.1 减缓肿瘤间质高压
肿瘤间质高压与肿瘤低氧、微血管密度、淋巴结转移等关系密切[101]。将人工淋巴系统植入肿瘤,可减缓肿瘤间质高压,促进载体在肿瘤组织的渗透,以达到肿瘤细胞致死量,提高肿瘤治疗效果。Griffonetienne等[102]通过紫杉烷诱导细胞凋亡来降低血管压。Sen等[103]通过温和的升温来减缓肿瘤间质高压与增加含氧量,提高肿瘤治疗效果。
2.2.2 规范肿瘤血管网络系统
由于载体往往通过血管中的血液流动来输送,规范杂乱无章的血管,有利于载体的传输,进而有助于提高肿瘤组织的渗透性。规范肿瘤血管网络系统,需要使肿瘤血管系统的正常化,在此期间,肿瘤异常的微血管和微环境趋向“正常化”,有利于改善药物的输运并提高肿瘤细胞对放化疗的敏感性[104]。
2.2.3 降低肿瘤间质密度
肿瘤间质密度对于载体的传输有较大影响,特别是在肿瘤中心部位,肿瘤间质密度较高,使用抗粘结剂,可以减小肿瘤间质密度,降低抗癌药物的剂量[62],提高肿瘤组织的渗透效果。
3 肿瘤组织渗透性的评价方法
肿瘤组织渗透性的评价方法包括多细胞球体模型、多层细胞培养与体内模型等多种方法。
3.1 多细胞球体模型
多细胞球体模型,作为与肿瘤微环境类似的结构,是最基本的药物评价方法之一。在摇瓶培养的多细胞球体是肿瘤细胞的球形聚集体,可以显示实体肿瘤的诸多特征,包括细胞外基质的发展、分泌薄壁细胞、紧密连接的上皮细胞、营养盐浓度梯度、从外到中心的细胞周期等[105, 106]。Lee等[107]通过多细胞球体评价由3-甲磺酰氨基苯硼酸-苯硼酸官能化的硫酸软骨素-脱氧胆酸为基础制备的载体的渗透性,由于唾液酸在肿瘤组织中的作用,使载体具有肿瘤组织渗透性。Peng等[108]以多细胞球体模型通过激光共聚焦检测阿霉素荧光强度的方法,评价载体在肿瘤组织的渗透效果。
3.2 多层细胞培养
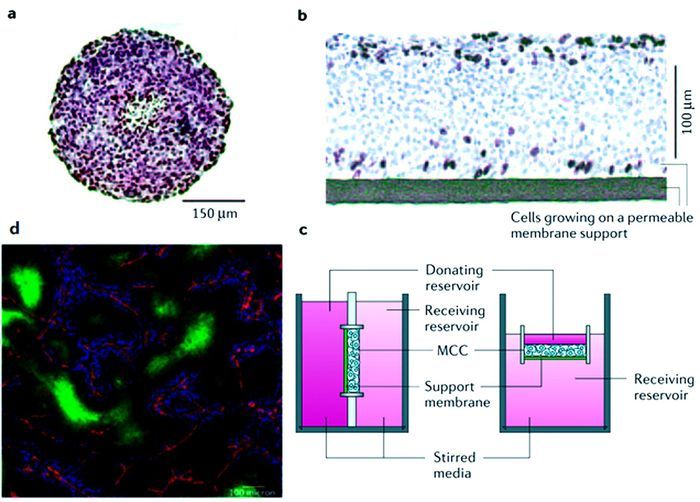
多层细胞培养方法是在活体之外研究载体在肿瘤细胞的渗透情况,其中,肿瘤细胞生长于厚度约200~250 μm的可渗透的支持膜[109]。该技术可以用于多种抗癌药物的肿瘤组织的渗透性评价[110],另外还可以通过检测透过膜的抗癌药物的量来评价渗透性能,如图 9所示。
3.3 体内模型
构建活体肿瘤模型,通过标记有肿瘤血管与载体药物等信息的肿瘤组织切片,观察载体或者其所释放药物与肿瘤血管(血管内皮细胞标记物CD31)的分布情况,以考察其渗透性[111]。结果表明,随着与肿瘤血管的距离增加,药物的浓度呈指数下降,在距离血管约40~50 μm的范围内浓度减少到血管周围浓度的一半。这一技术还可用于研究实体肿瘤内其他药物的分布以及评价改善药物分布策略的效果。
4 结论与展望
按照抗肿瘤药物传输的基本原则[112],首先要解决靶向问题,即实现肿瘤组织靶向传输,在病灶部位定点聚集;另外一个重要问题是载体聚集于肿瘤部位之后,在肿瘤组织内部传输的问题,这也是本文重点论述的问题。理想的状态是将载体传输至肿瘤组织深处,到达每一个肿瘤细胞,而非仅仅传输至肿瘤血管附近的肿瘤细胞。载体的粒径、形貌、表面电位、组成、结构等理化性质,以及肿瘤微环境的肿瘤间质高压、肿瘤血管、肿瘤细胞外基质与肿瘤细胞密度等特点均直接影响其在肿瘤组织中的渗透性能。另外,载体所释放的抗肿瘤药物自身的特性以及药物代谢动力学特性也会影响肿瘤组织渗透性。
肿瘤组织渗透性是载体传输体系中急需要解决的重要问题,同时也是提高化疗药物疗效的一个主要障碍[113]。面对复杂的肿瘤环境,载体需更加智能化,在传输的不同阶段,最好具有不同的粒径[91]。另外,载体的形状也很有可能具有特异性,棒状、蠕虫状等非球型的胶束载体有望成为下一代载体的新形态[93]。
值得注意的是,表面电荷为负电荷/中性电荷的载体有利于通过血液循环实现肿瘤组织聚集,而在肿瘤组织聚集之后,载体表面带正电荷有利于提高肿瘤组织渗透功能,也就说,载体在传输的不同阶段需要带不同的电荷。对于主动靶向而言,以肿瘤组织穿透肽等具有肿瘤/细胞穿透功能的生物活性物质进行表面修饰,可提高肿瘤组织的渗透性。
提高载体在肿瘤组织中的渗透性对于促进抗癌药物在整个肿瘤组织的均匀分布、达到有效的浓度、快速且高效地诱导肿瘤细胞凋亡、延缓或者克服肿瘤细胞多药耐药性、提高抗癌药物在肿瘤组织中的生物利用度、切实提高肿瘤治疗疗效等具有重要意义。此方面的研究已成为肿瘤化疗研究的重点方向之一,有望成为载体应用于肿瘤诊疗有关的纳米医学领域的重要突破口之一,必将受到越来越多国内外科研人员的重视。
-
-
[1]
W Chen, R Zheng, P D Baade et al. CA-Cancer J. Clin., 2016, 66:115~132. doi: 10.3322/caac.21338
-
[2]
S Mura, J Nicolas, P Couvreur. Nat. Mater., 2013, 12:991~1003. doi: 10.1038/nmat3776
-
[3]
C Shi, D Guo, K Xiao et al. Nat. Commun., 2015, 6:7449~7449. doi: 10.1038/ncomms8449
-
[4]
Q Hu, W Sun, Y Lu et al. Nano Lett., 2016, 16:1118~1126. doi: 10.1021/acs.nanolett.5b04343
-
[5]
A P Blum, J K Kammeyer, A M Rush et al. J. Am. Chem. Soc., 2015, 137(6):2140~2154. doi: 10.1021/ja510147n
-
[6]
Q Sun, Z Kang, L Xue et al. J. Am. Chem. Soc., 2015, 137(18):6000~6010. doi: 10.1021/jacs.5b01435
-
[7]
K Cai, X He, Z Song et al. J. Am. Chem. Soc., 2015, 137(10):3458~3461. doi: 10.1021/ja513034e
-
[8]
M W Tibbitt, J E Dahlman, R Langer. J. Am. Chem. Soc., 2016, 138(3):704~717. doi: 10.1021/jacs.5b09974
-
[9]
Y Liu, D Zhang, Z Qiao et al. Adv. Mater., 2015, 27(34):5034~5042 doi: 10.1002/adma.201501502
-
[10]
L Zeng, Y Pan, Y Tian et al. Biomaterials, 2015, 57:93~106. doi: 10.1016/j.biomaterials.2015.04.006
-
[11]
N Bertrand, J Wu, X Xu et al. Adv. Drug Deliv. Rev., 2014, 66(24):2~25.
-
[12]
Y Cheng, R A Morshed, B Auffinger et al. Adv. Drug Deliv. Rev., 2014, 66(1):42~57.
-
[13]
Z Ge, S Liu. Chem. Soc. Rev., 2013, 42(17):7289~7325. doi: 10.1039/c3cs60048c
-
[14]
T Wu, Y Dai. Cancer Lett., 2017, 387:61~68. doi: 10.1016/j.canlet.2016.01.043
-
[15]
S J Grainger, J V Serna, S Sunny et al. Mol. Pharm., 2010, 7(6):2006~2019. doi: 10.1021/mp100280b
-
[16]
X Cun, J Chen, S Ruan et al. ACS Appl. Mater. Interf., 2015, 7:27458~27466. doi: 10.1021/acsami.5b09391
-
[17]
M Yu, I F Tannock. Cancer Cell, 2012, 21(6):327~329.
-
[18]
J Du, L A Lane, S Nie. J. Control. Rel., 2015, 219:205~214. doi: 10.1016/j.jconrel.2015.08.050
-
[19]
A I Minchinton, I F Tannock. Nat. Rev. Cancer, 2006, 6(8):583~592. doi: 10.1038/nrc1893
-
[20]
E Lim, T Kim, S Paik et al. Chem. Rev., 2015, 115(1):327~394. doi: 10.1021/cr300213b
-
[21]
A J Leu, D A Berk, A Lymboussaki et al. Cancer Res., 2000, 60(16):4324~4327.
-
[22]
R K Jain, L L Munn, D Fukumura. Nat. Rev. Cancer, 2002, 2(4):266~276. doi: 10.1038/nrc778
-
[23]
M Stohrer, Y Boucher, M Stangassinger et al. Cancer Res., 2000, 60(15):4251~4255.
-
[24]
H Suzuki, Y H Bae. Biomaterials, 2016, 98:120~130. doi: 10.1016/j.biomaterials.2016.04.037
-
[25]
V P Chauhan, T Stylianopoulos, Y Boucher et al. Annu. Rev. Chem. Biomol. Eng., 2011, 2:281~298.
-
[26]
R H Thomlinson, L H Gray. Br. J. Cancer, 1956, 9(4):539~549.
-
[27]
S Hauert, S Berman, R Nagpal et al. Nano Today, 2013, 8(6):566~576. doi: 10.1016/j.nantod.2013.11.001
-
[28]
Z Li, H Wang, Y Chen et al. Small, 2016, 12(20):2731~2340. doi: 10.1002/smll.v12.20
-
[29]
H Yu, Z Cui, P Yu et al. Adv. Funct. Mater., 2015, 25(17):2489~2500. doi: 10.1002/adfm.201404484
-
[30]
I F Tannock, C M Lee, J K Tunggal et al. Clin. Cancer Res., 2002, 8(3):878~884.
-
[31]
K N Sugahara, T Teesalu, P P Karmali et al. Cancer Cell, 2009, 16(6):510~520. doi: 10.1016/j.ccr.2009.10.013
-
[32]
D Ni, H Ding, S Liu et al. Small, 2015, 11(21):2518~2526. doi: 10.1002/smll.v11.21
-
[33]
Y Kim, J Bae, T Shin et al. J. Control. Rel., 2015, 216(1):56~68.
-
[34]
X Jiang, H Xin, J Gu et al. Biomaterials, 2013, 34(6):1739~1746. doi: 10.1016/j.biomaterials.2012.11.016
-
[35]
R M Phillips, P M Loadman, B P Cronin. Br. J. Cancer, 1998, 77(12):2112~2119. doi: 10.1038/bjc.1998.355
-
[36]
A E Nel, L Madler, D Velegol et al. Nat. Mater., 2009, 8:543~557. doi: 10.1038/nmat2442
-
[37]
J Su, H Sun, Q Meng et al. Adv. Funct. Mater., 2016, 26(8), 1243~1252.
-
[38]
H Traboulsi, H Larkin, M A Bonin et al. Bioconj. Chem., 2015, 26(3):405~411. doi: 10.1021/acs.bioconjchem.5b00023
-
[39]
Z Qian, A Martyna, R L Hard et al. Biochemistry, 2016, 55:2601~2612. doi: 10.1021/acs.biochem.6b00226
-
[40]
E Fleige, M A Quadir, R Haag. Adv. Drug Deliv. Rev., 2012, 64(9):866~884. doi: 10.1016/j.addr.2012.01.020
-
[41]
K Kooiman, H J Vos, M Versluis et al. Adv. Drug Deliv. Rev., 2014, 72(22):28~48.
-
[42]
I F Tannock, C Lee, J K Tunggal et al. Clin. Cancer Res., 2002, 8(3):878~884.
-
[43]
J Y Lee, D Carugo, C Crake et al. Adv. Mater., 2015, 27(37):5484~5492. doi: 10.1002/adma.201502022
-
[44]
B Theek, M Baues, T Ojha et al. J. Control. Rel., 2016, 231:77~85. doi: 10.1016/j.jconrel.2016.02.021
-
[45]
Y C Chang. Theranostics, 2016, 6(3):392~403. doi: 10.7150/thno.13727
-
[46]
S R Sirsi, M A Borden. Adv. Drug Deliv. Rev., 2014, 72(1):3~14.
-
[47]
J Cao, S Huang, Y Chen et al. Biomaterials, 2013, 34:6272~6283. doi: 10.1016/j.biomaterials.2013.05.008
-
[48]
L Wang, Y Yuan, S Lin et al. Biomaterials, 2016, 78:40~49. doi: 10.1016/j.biomaterials.2015.11.024
-
[49]
C Puig-Saus, L A Rojas, E Laborda et al. Gene Ther., 2014, 21(8):767~774. doi: 10.1038/gt.2014.52
-
[50]
K N Sugahara, P Scodeller, G B Braun et al. J. Control. Rel., 2015, 212:59~69. doi: 10.1016/j.jconrel.2015.06.009
-
[51]
K Wang, X Zhang, Y Liu et al. Biomaterials, 2014, 35(30):8735~8747. doi: 10.1016/j.biomaterials.2014.06.042
-
[52]
K N Sugahara, T Teesalu, P P Karmali et al. Science, 2010, 328(5981):1031~1035. doi: 10.1126/science.1183057
-
[53]
K N Sugahara, T Teesalu, P P Karmali et al. Cancer Cell, 2009, 16(6):510~520. doi: 10.1016/j.ccr.2009.10.013
-
[54]
E Jin, B Zhang, X Sun et al. J. Am. Chem. Soc., 2013, 135(2):933~940. doi: 10.1021/ja311180x
-
[55]
M R Villegas, A Baeza, M Vallet-Regí. ACS Appl. Mater. Interf., 2015, 7(43):24075~24081. doi: 10.1021/acsami.5b07116
-
[56]
S M Sagnella, H Duong, A MacMillan et al. Biomacromolecules, 2014, 15(1):262~275. doi: 10.1021/bm401526d
-
[57]
X Li, X Zhu, L Qiu. Acta Biomater., 2016, 35:269~279. doi: 10.1016/j.actbio.2016.02.012
-
[58]
A M Al-Abd, Z K Aljehani, R W Gazzaz et al. J. Control. Rel., 2015, 219:269~277. doi: 10.1016/j.jconrel.2015.08.055
-
[59]
D Min, D Jeong, M G Choi et al. Biomaterials, 2015, 52(1):484~493.
-
[60]
F Curnis, A Sacchi, A Corti. J. Clin. Invest., 2002, 110(4):475~482. doi: 10.1172/JCI0215223
-
[61]
M Rescigno, M Urbano, B Valzasina et al. Nat. Immunol., 2001, 2(4):361~367. doi: 10.1038/86373
-
[62]
H Kuh, S H Jang, M G Wientjes et al. J. Pharmacol. Exp. Ther., 1999, 290(2):871~880.
-
[63]
R Tong, H D Hemmati, R Langer et al. J. Am. Chem. Soc., 2012, 134(21):8848~8855. doi: 10.1021/ja211888a
-
[64]
E Vlashi, L E Kelderhouse, J E Sturgis et al. ACS Nano, 2013, 7(10):8573~8582. doi: 10.1021/nn402644g
-
[65]
S Ruan, X Cao, X Cun et al. Biomaterials, 2015, 60:100~110. doi: 10.1016/j.biomaterials.2015.05.006
-
[66]
S Ruan, Q He, H Gao. Nanoscale, 2015, 7(21):9487~9496. doi: 10.1039/C5NR01408E
-
[67]
X Cun, S Ruan, J Chen et al. Acta Biomater., 2016, 31(1):186~196.
-
[68]
Z Popovic, W Liu, V P Chauhan et al. Angew. Chem. Int. Ed., 2010, 49(46):8649~8652.
-
[69]
W Jiang, B Y S Kim, J T Rutka et al. Nat. Nanotechnol., 2008, 3(3):145~150. doi: 10.1038/nnano.2008.30
-
[70]
A S Mikhail, S Eetezadi, S N Ekdawi et al. Int. J. Pharm., 2014, 464(12):168~177.
-
[71]
L Tang, N P Gabrielson, F M Uckun et al. J. Mol. Pharm., 2013, 10(3):883~892. doi: 10.1021/mp300684a
-
[72]
L Tang, X Yang, Q Yin et al. PNAS, 2014, 111(43):15344~15349. doi: 10.1073/pnas.1411499111
-
[73]
J Wang, W Mao, L L Lock et al. ACS Nano, 2015, 9(7):7195~7206. doi: 10.1021/acsnano.5b02017
-
[74]
V P Chauhan, T Stylianopoulos, J D Martin et al. Nat. Nanotechnol., 2012, 7(6):383~388. doi: 10.1038/nnano.2012.45
-
[75]
H Cabral, Y Matsumoto, K Mizuno et al. Nat. Nanotechnol., 2011, 6(12):815~823. doi: 10.1038/nnano.2011.166
-
[76]
R Mo, Q Sun, J Xue et al. Adv. Mater., 2012, 24(27):3659~3665. doi: 10.1002/adma.v24.27
-
[77]
C Ju, R Mo, J Xue et al. Angew. Chem. Int. Ed., 2014, 53(24):6367~6372.
-
[78]
H J Li, J Z Du, J Liu et al. ACS Nano, 2016, 10(7):6753~6761. doi: 10.1021/acsnano.6b02326
-
[79]
H Liang, X Ren, J Qian et al. ACS Appl. Mater. Interf., 2016, 8(16):10136~10146. doi: 10.1021/acsami.6b00668
-
[80]
H Li, J Du, X Du et al. PNAS, 2016, 113(15):4164~4169. doi: 10.1073/pnas.1522080113
-
[81]
M R Longmire, P L Choyke, H Kobayashi. Nanomedicine:NBM, 2008, 3(5):703~717. doi: 10.2217/17435889.3.5.703
-
[82]
S Wang, P Huang, X Chen. Adv. Mater., 2016, 28(34):7340~7364 doi: 10.1002/adma.201601498
-
[83]
T Stylianopoulos, M Poh, N Insin et al. Biophys. J., 2010, 99(5):1342~1349. doi: 10.1016/j.bpj.2010.06.016
-
[84]
H Wang, Z Zuo, J Du et al. Nano Today, 2016, 11(2):133~144. doi: 10.1016/j.nantod.2016.04.008
-
[85]
S Miura, H Suzuki, Y H Bae. Nano Today, 2014, 9(6):695~704. doi: 10.1016/j.nantod.2014.10.003
-
[86]
J Li, X Yu, Y Wang et al. Adv. Mater., 2014, 26(48):8217~8224. doi: 10.1002/adma.201403877
-
[87]
X Liu, J Xiang, D Zhu et al. Adv. Mater., 2016, 28(9):1743~1752. doi: 10.1002/adma.201504288
-
[88]
Z Zhou, Y Shen, J Tang et al. Adv. Funct. Mater., 2009, 19(22):3580~3589. doi: 10.1002/adfm.v19:22
-
[89]
G Zhou, Y Xu, M Chen et al. Polym. Chem., 2016, 7(23):3857~3863. doi: 10.1039/C6PY00427J
-
[90]
V P Chauhan, Z Popovic', O Chen et al. Angew. Chem. Int. Ed., 2011, 50(48):11417~11420.
-
[91]
B D Chithrani, A A Ghazani, W C W Chan. Nano Lett., 2006, 6(4):662~668. doi: 10.1021/nl052396o
-
[92]
R Agarwal, V Singh, P Jurney et al. PNAS, 2013, 110:17247~17252. doi: 10.1073/pnas.1305000110
-
[93]
N P Truong, M R Whittaker, C W Mak et al. Expert Opin. Drug Del., 2014, 12(1):129~142.
-
[94]
S Schottler, G Becker, S Winzen et al. Nat. Nanotechnol., 2016, 11(4):372~377. doi: 10.1038/nnano.2015.330
-
[95]
J S Suk, Q Xu, N Kim et al. Adv. Drug Deliv. Rev., 2016, 99:28~51. doi: 10.1016/j.addr.2015.09.012
-
[96]
G Wang, Y Chen, P Wang et al. Acta Biomater., 2016, 29:248~260. doi: 10.1016/j.actbio.2015.10.017
-
[97]
T Ji, Y Ding, Y Zhao et al. Adv. Mater., 2015, 27(11):1865~1873. doi: 10.1002/adma.v27.11
-
[98]
J Lee, J Kim, M Jeong et al. Nano Lett., 2015, 15(5):2938~2944. doi: 10.1021/nl5047494
-
[99]
A Wang, D Liang, Y Liu et al. Biomaterials, 2015, 53:160~172. doi: 10.1016/j.biomaterials.2015.02.077
-
[100]
N Wolmark, E R Fisher, H S Wieand et al. Cancer, 1984, 53(12):2707~2712. doi: 10.1002/(ISSN)1097-0142
-
[101]
E K Rofstad, K Galappathi, B S Mathiesen. Neoplasia, 2014, 16(7):586~594. doi: 10.1016/j.neo.2014.07.003
-
[102]
G Griffonetienne, Y Boucher, C Brekken et al. Cancer Res., 1999, 59(15):3776~3782.
-
[103]
A Sen, M L Capitano, J A Spernyak et al. Cancer Res., 2011, 71(11):3872~3880. doi: 10.1158/0008-5472.CAN-10-4482
-
[104]
李隆敏, 许桐瑛, 朱文婷等.中国肿瘤, 2016, 25(12):988~993. doi: 10.11735/j.issn.1671-170X.2016.12.B002
-
[105]
R M Sutherland. Science, 1988, 240(4849):177~184. doi: 10.1126/science.2451290
-
[106]
K Shield, M L Ackland, N Ahmed et al. Gynecol. Oncol., 2009, 113(1):143~148. doi: 10.1016/j.ygyno.2008.11.032
-
[107]
J Lee, S Chung, H Cho et al. Adv. Funct. Mater., 2015, 25(24):3705~3717. doi: 10.1002/adfm.v25.24
-
[108]
Z Peng, J Kopecek. J. Am. Chem. Soc., 2015, 137(21):6726~6729. doi: 10.1021/jacs.5b00922
-
[109]
K O Hicks, S Ohms, P L Van Zijl et al. Br. J. Cancer, 1997, 76(7):894~903. doi: 10.1038/bjc.1997.481
-
[110]
R M Phillips, P M Loadman, B P Cronin. Br. J. Cancer, 1998, 77(12):2112~2119. doi: 10.1038/bjc.1998.355
-
[111]
A Azagury, L Khoury, Y Adato et al. J. Control. Rel., 2015, 200(1):35~41.
-
[112]
Y Brudno, D J Mooney. J. Control. Rel., 2015, 219:8~17. doi: 10.1016/j.jconrel.2015.09.011
-
[113]
Y H Yun, B K Lee, K Park. J. Control. Rel., 2015, 219:2~7. doi: 10.1016/j.jconrel.2015.10.005
-
[1]
-
图 4 (A) iRGD多步绑定渗透机理[53];(B)在激光或非激光照射下,荧光素进入肿瘤组织与细胞的共聚焦显微成像[59]
Figure 4 (A) Multistep binding and penetration mechanism of iRGD[53]; (B) In vivo tissue penetration of fluorescein, CLSM image of the tissue penetration of eluted fluorescein from each membrane into the tumor tissue with or without laserirradiation[59]
图 6 A):(a) PEG-b-PAEMA-PAMAM/Pt的结构;(b) PEG-b-PAEMA-PAMAM/Pt在中性pH下自组装为pH敏感纳米簇,在肿瘤组织裂解为微小粒子;(c) SCNs/Pt作为一个充满活力的纳米平台克服在肿瘤组织弱渗透性的生理障碍;(B)通过尾静脉注射后,在体内实时观察SCNs/Cy5与ICNs/Cy5的分布,及血管内部与外部荧光强度与穿透时间的关系[78]
Figure 6 (A): (a) Structure of PEG-b-PAEMA-PAMAM/Pt; (b) Schematic illustration showing the self-assembly of PEG-b-PAEMA-PAMAM/Pt into the pH-sensitive cluster nanobombs (SCNs/Pt) at neutral pH and the disintegration of SCNs/Pt into small particles at tumor acidic pH; (c) Schematic illustration of SCNs/Pt as a robust nanoplatform to overcome biological barriers to in vivo drug delivery in poorly permeably pancreatic tumor models. (B): In vivo real-time observation of the microdistribution of(a) SCNs/Cy5 and(b) ICNs/Cy5 in BxPC-3 xenografts after intravenous administration. Scale bar=100 μm. Time-penetration average fluorescence intensity evolution of the intravascular compartments(c) and extravascular compartments(d)[78]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:








 下载:
下载:

