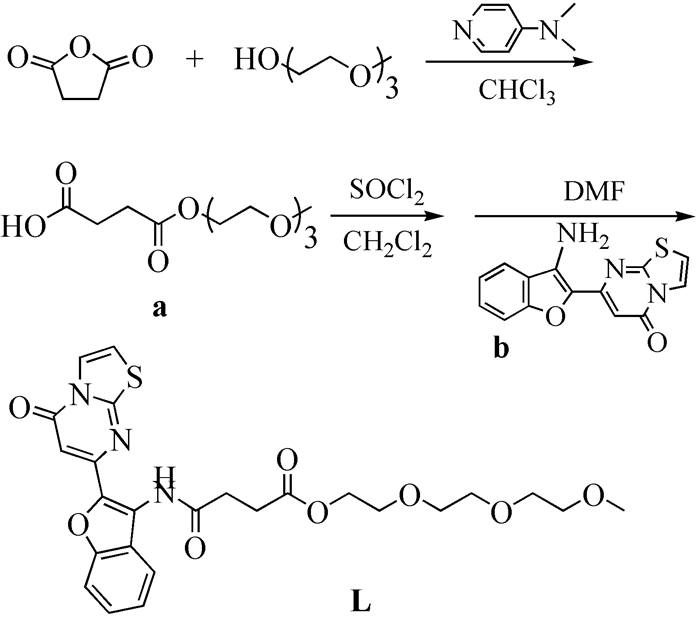
 图 图式 1
探针L的合成路线
Figure 图式 1.
Synthesis route of probe L
图 图式 1
探针L的合成路线
Figure 图式 1.
Synthesis route of probe L

Citation: Zhong Keli, Xiu Ping, Guo Baofeng, Wang Daolin, Tang Lijun. Synthesis of a Thiazolo[3, 2-a]pyrimidine Derivative and Its Recognition Performance for Fe3+ in Aqueous Medium[J]. Chemistry, 2017, 80(1): 84-88.

噻唑并[3, 2-a]嘧啶衍生物的合成及其在水介质中识别Fe3+的性能
-
关键词:
- 噻唑并[3, -a]嘧啶
- / 合成
- / Fe3+
- / 荧光探针
- / 识别
English
Synthesis of a Thiazolo[3, 2-a]pyrimidine Derivative and Its Recognition Performance for Fe3+ in Aqueous Medium
-
Key words:
- Thiazolo[3, 2-a]pyrimidine
- / Synthesis
- / Fe3+
- / Fluorescent probe
- / Recognition
-
噻唑并[3, 2-a]嘧啶化合物及其衍生物是一类重要的氮、硫杂环化合物,由于具有良好的生物活性和药理活性,如镇痛[1]、抗氧化[2]、抗惊厥[3]、抗肿瘤[4]、抗病毒[5]、抗菌[6~8]等,其研究备受人们的关注[9]。
铁离子是生命体必须的离子之一,很多细胞水平的生物及化学过程都需要铁的参与[10],一旦生物体内铁元素缺乏就会发生各种生理系统紊乱[11~13];同时,铁过量沉积会导致中枢神经系统出现疾病,如帕金森氏症和阿尔茨海默氏病[14]。此外,过量的铁离子对环境也产生严重危害[15],如破坏植物体内代谢平衡,影响植被生长。因此,铁离子的检测对于环境及生命科学都具有重要的意义。目前,荧光检测法由于具有选择性好、灵敏度高、成本低、简便快捷等特点而得到快速发展[16, 17]。近年来已经报道了许多小分子荧光探针来检测Fe3+[18~21],但开发不受其他离子干扰、能在水溶液中识别Fe3+的荧光探针,仍是重要的研究方向[22]。
本文在合成7-(3-氨基苯并呋喃-2-基)-噻唑并[3, 2-a]嘧啶-5-酮时,为改善其水溶性而引入三乙二醇单甲醚(合成路线见图式1)得到了化合物L,使其易溶于常规溶剂中,为该化合物在药理方面的研究提供了基础。同时,由于L中含有多个N、O、S杂原子,可为金属离子的螯合提供结合位点。荧光光谱研究表明,L在水溶液中能够选择性地识别Fe3+,而其他金属离子对识别作用没有干扰。本文为噻唑并[3, 2-a]嘧啶类化合物的应用开拓了新途径,具有较好的借鉴意义。
1 实验部分
1.1 试剂与仪器
JY12001电子天平(塞多利斯科学仪器(北京)有限公司);DF-101S集热式恒温加热磁力搅拌器和RE-2000旋转蒸发仪(郑州长城科工贸有限公司);400 MHz核磁共振谱仪(美国Agilent公司);970CRT荧光分光光度计(上海三科仪器有限公司),上海大普有限公司数字酸度计。
本实验所用固体原料和溶剂均为市售分析纯级,其中三乙二醇单甲醚、丁二酸酐、二氯亚砜、4-二甲氨基吡啶均购自阿拉丁试剂股份有限公司;二甲基甲酰胺(DMF)、二氯甲烷均需干燥处理后使用。柱色谱所用硅胶(100~200目)为青岛裕名化工厂产品;实验用水为去离子水。化合物b根据文献[23]方法制备。
1.2 合成
1.3 实验方法
1.4 光谱测定
1.2.2 化合物L的合成
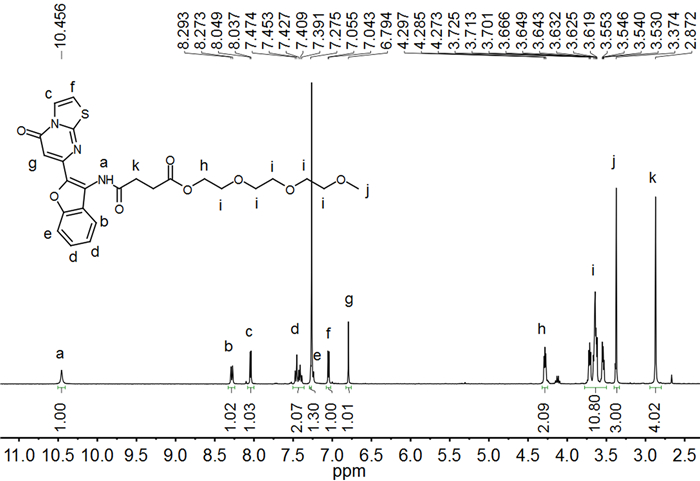
在单口瓶中加入2.64g (10mmol)化合物a和20mL CH2Cl2,常温搅拌,在N2保护下滴加催化剂量(约1mL)的DMF,冰浴下用恒压滴液漏斗将溶于15mL CH2Cl2的氯化亚砜逐滴加入到单口瓶中,得黄色透明溶液。搅拌30min后撤去冰浴,常温下反应8h,反应液变为黄色混浊液。过滤,滤液旋干后得到1.07g (粗产率为38%)黄色油状物,不用提纯,直接溶解在30mL DMF中,然后加入1.13g (4.0mmol)化合物b,常温搅拌6h,停止反应后转移至分液漏斗中,加入大量水,用CH2Cl2萃取多次,有机溶剂干燥,过滤,所得产物用硅胶柱色谱分离提纯,以二氯甲烷:乙酸乙酯=2:1(体积比)为洗脱剂梯度分离,得到0.88g化合物L,产率为42.1%。1H NMR (400MHz,CDCl3)δ:10.46(s,1H),8.28(d,J=8.1Hz,1H),8.04(d,J=4.9Hz,1H),7.44(m,2H),7.28(s,1H),7.05(d,J=4.9Hz,1H),6.79(s,1H),4.28(t,3H),3.53~3.73(m,10H),3.37(s,3H),2.87(s,4H);13C NMR (101MHz,CDCl3)δ:172.63,169.08,162.93,158.05,154.45,153.47,127.61,126.21,125.77,122.95,122.39,111.45,110.80,98.48,71.88,70.55,69.04,64.02,59.05,58.49,31.88,29.38;HRMS m/z:C25H27N3O8S [M+Na]+,计算值552.1519;实测值552.1409。
1.2.1 化合物a的合成
在100mL单口瓶中分别加入2.97g (18mmol)三乙二醇单甲醚、4.0g (40mmol)丁二酸酐和0.25g (2.0mmol)4-二甲氨基吡啶,用40mL氯仿溶解,回流12h。冷却、旋干溶剂、加入80mL蒸馏水溶解,用正己烷:乙酸乙酯=1:1(体积比)的混合溶剂萃取,再用CH2Cl2萃取,合并有机层,用Na2SO4干燥,过滤,旋干溶剂,得到4.24g化合物a,粗产率为81.2%。1H NMR (400MHz,DMSO-d6)δ:12.24(s,1H),4.13(t,2H),3.61(t,2H),3.53(m,6H),3.44(m,2H),3.26(s,3H),2.52(m,4H)。
1.3.2 探针L标准溶液的配制
准确称取13.2570mg化合物L,用0.1mL二甲基亚砜(DMSO)溶解,转移至25mL容量瓶中,定容至刻度,摇匀,得到1×10-3mol/L的母液,使用时根据所需浓度稀释。
1.3.3 各种金属离子溶液的配制
以Fe3+为例:准确称取0.1353g FeCl3·6H2O溶解后置于10mL容量瓶中,用去离子水定容至刻度,摇匀,既得5×10-2mol/L的溶液,其他阳离子溶液配制方法相同。
1.3.1 4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)缓冲溶液(1×10-2mol/L)的配制
在烧杯中加入1.192g HEPES和480mL去离子水,搅拌溶解后,在酸度计的监控下边搅拌边缓慢滴加氢氧化钠溶液,直至溶液达到所需的pH。
1.4.2 探针L对金属阳离子的抗干扰实验
将探针L用pH 6.4的HEPES溶液稀释成1×10-5mol/L,向试管中分别加入2mL探针L溶液和40μL金属离子溶液,放置10min后再各加入40μL Fe3+溶液,摇匀后放置30min,测试荧光光谱。
1.4.3 pH对探针L荧光光谱影响实验
取适量探针L(1×10-5mol/L,pH 6.4)的HEPES溶液,用1mol/L NaOH调节pH至11.4;再取适量探针L的HEPES溶液,用1mol/L的HCl调节pH至2.4。取三份L的HEPES溶液,一份为空白对照,一份加入Fe2+,另一份加入Fe3+,摇匀后放置30min,测试荧光光谱。
1.4.1 探针L对金属阳离子选择性试验
将探针L用HEPES溶液稀释成1×10-5mol/L,向试管中加入2mL探针L(1×10-5mol/L,pH=6.4),用微量进样器加入40μL金属离子溶液,摇匀后静止放置30min,以350nm为激发波长,扫描330~700 nm范围内的荧光发射光谱(灵敏度为2,Ex缝宽为5nm,Em缝宽为5nm)。
2 结果与讨论
2.1 化合物L的表征
以三乙二醇单甲醚和丁二酸酐为原料,经过酯化、酰基化后,所得产物a与7-(3-氨基苯并呋喃-2-基)-噻唑并[3, 2-a]嘧啶-5-酮(b)反应,得到探针L,其1H NMR如图 1所示。图中,δ 10.45归属于酰胺氮上的氢,6.79~8.29范围内的峰归属于芳香环上的氢,2.87处为丁二酰亚甲基上的氢,3.37处为醚链上甲基的氢,3.53~4.29的峰为醚链上亚甲基上的氢。探针L的13C NMR中,δ 172.63、169.08、162.93为3个羰基碳的化学位移峰,98.48~158.05为芳香环上碳的峰,58.49~71.88范围内为烷氧基碳的峰,31.88和29.38是丁二酰亚甲基碳的峰。此外,高分辨质谱实测值也与计算值吻合,进一步证明成功得到了所设计的目标分子L。
2.2 受体L对Fe3+的滴定
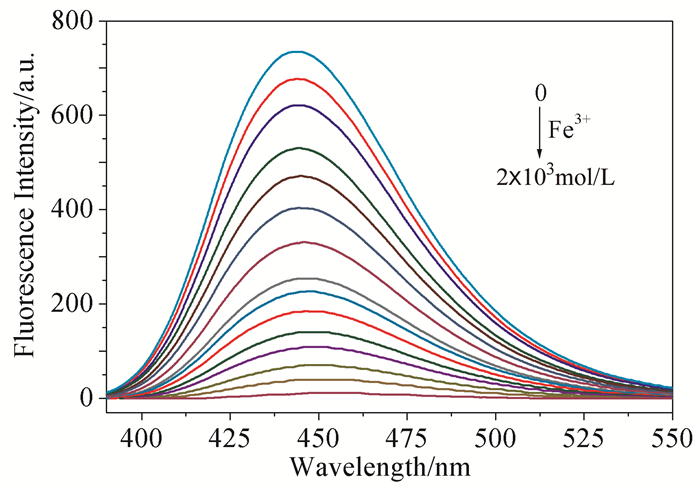
不同浓度Fe3+对探针L的荧光强度的影响见图 3,当Fe3+的浓度逐渐增大时,体系荧光强度逐渐降低,直到加入的Fe3+达到2×10-3mol/L时,荧光强度降到最低,继续增加Fe3+的浓度,荧光强度不再变化,即达到了平衡状态。Fe3+加入量为200倍时达到平衡,说明探针L识别Fe3+的灵敏性一般。
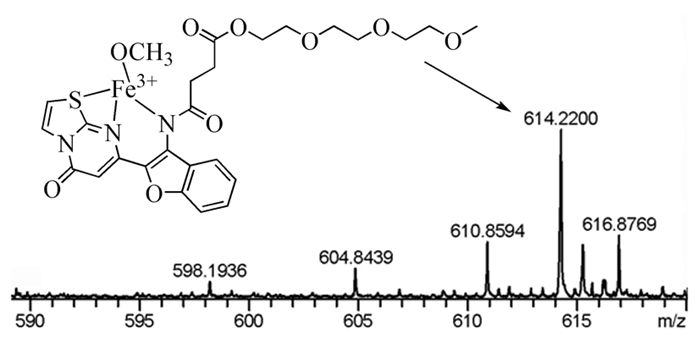
为了确定探针L与Fe3+的结合模式,我们将探针L和Fe3+溶解在甲醇中进行了高分辨质谱测试,结果如图 4所示。[L-H++CH3O-+Fe3+]的质核比为614.2200,而计算值为614.0957,这说明探针L与Fe3+是1:1结合的。其可能的结合模式如图 4内插图所示。我们推测可能是由于铁离子的顺磁性而导致探针L结合Fe3+后荧光猝灭。
2.2 受体L对Fe3+的识别
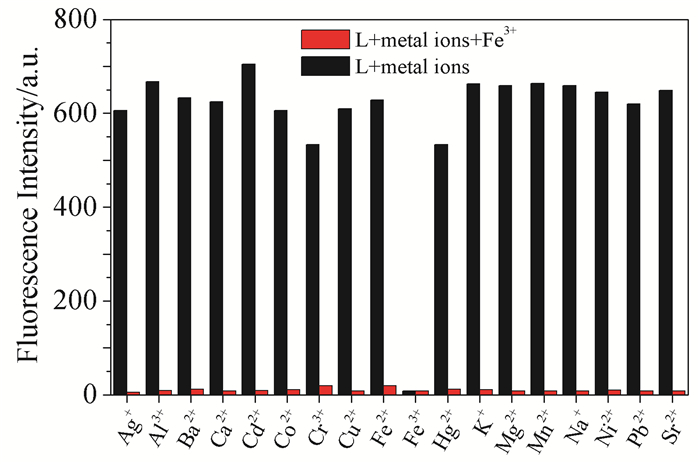
在波长350nm激发下,1×10-5mol/L探针L的HEPES溶液(pH 6.4)在444nm处有很强的荧光发射峰。向探针L溶液中分别加入2×10-3mol/L不同种类的金属阳离子,再次测定其荧光发射光谱。从图 2可看出,Hg2+和Cr3+可引起荧光强度轻微下降,而Fe3+引起荧光强度降低了98.7%,而加入其他阳离子,如Na+、Ni2+、Ba2+、Mg2+、Ag+、K+、Ca2+、Fe2+、Mn2+、Pb2+、Sr2+、Co2+、Zn2+、Cd2+、Al3+和Cu2+等,荧光强度均无明显变化,这表明探针L对Fe3+具有很高的识别能力,选择性比较专一。
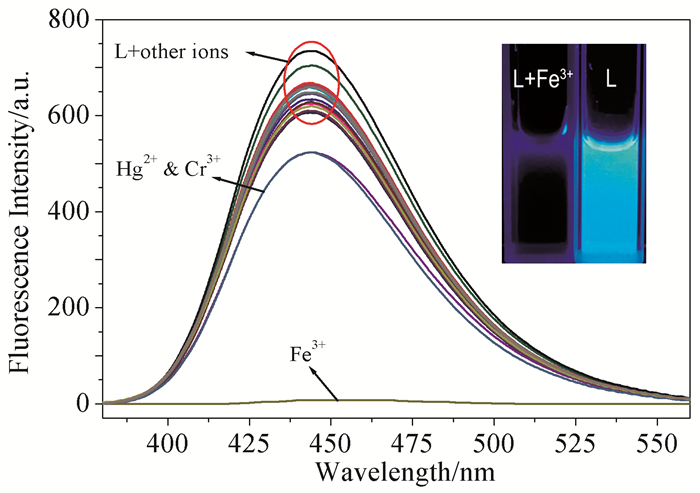 图 2
探针L (1×10-5 mol/L)在HEPES缓冲溶液中分别加入各种阳离子后的荧光强度变化(λex=350nm);内插图:在365nm紫外灯照射下,探针L及加Fe3+后的颜色变化
Figure 2.
Fluorescence spectra of probe L in HEPES buffer (1×10-5 mol/L) upon addition of various metal cations (λex=350nm); Inset: The color changes of probe L without and with Fe3+ under a portable UV lamp at 365nm
图 2
探针L (1×10-5 mol/L)在HEPES缓冲溶液中分别加入各种阳离子后的荧光强度变化(λex=350nm);内插图:在365nm紫外灯照射下,探针L及加Fe3+后的颜色变化
Figure 2.
Fluorescence spectra of probe L in HEPES buffer (1×10-5 mol/L) upon addition of various metal cations (λex=350nm); Inset: The color changes of probe L without and with Fe3+ under a portable UV lamp at 365nm
2.3 共存离子对Fe3+识别的影响
共存离子干扰是影响探针识别性能的一个重要因素,因此我们研究了在金属离子共存条件下探针L对Fe3+的识别性能,如图 5所示。L与Hg2+或Cr3+结合后荧光强度略有降低,随后加入Fe3+,也发生了显著荧光猝灭;其他金属离子存在下,探针L对Fe3+的荧光响应不受影响,说明L识别Fe3+具有较好的抗干扰能力。
2.4 受体L对Fe3+的检测限
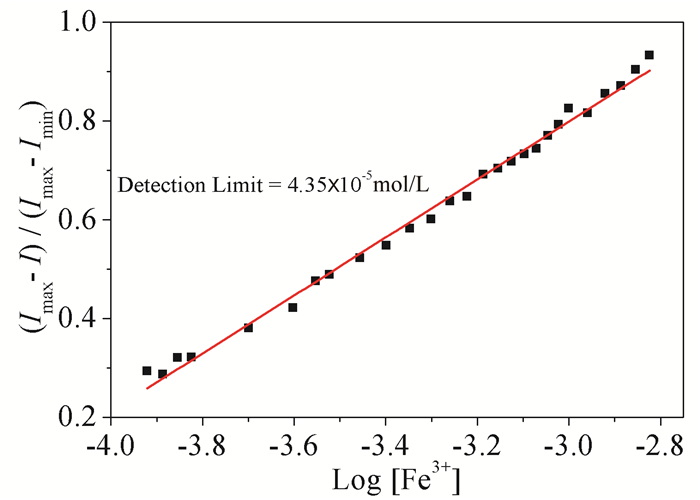
为了验证探针L的灵敏度和实际应用价值,以log[Fe3+]为横坐标,以(Imax-I)/(Imax-Imin)为纵坐标,利用Origin软件对荧光滴定数据进行线性拟合,结果见图 6。得到线性相关系数为0.9934的一条直线,检测限为4.35×10-5mol/L[24],达到了微摩尔级,说明该受体有较好的灵敏度和潜在的实际应用价值。
2.5 pH对受体L荧光光谱的影响
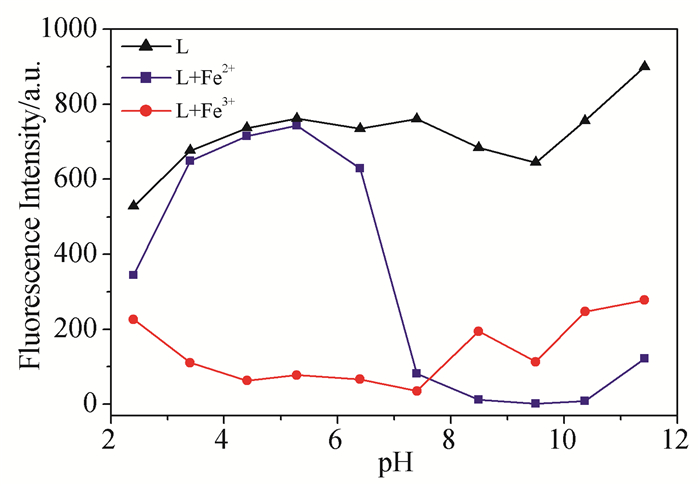
为了考察探针L识别Fe3+的pH适用范围,以及同系Fe2+的影响,测试了不同pH下探针L及其加入Fe3+和Fe2+后444nm处的荧光强度变化,如图 7所示。从图中可看出pH在2.4至11.4,探针L都表现出较强的荧光;而加入Fe3+后荧光强度在此范围内都发生明显猝灭,但是探针L加入Fe2+后在8.4至11.4范围内荧光强度也显著猝灭,说明在这个范围内Fe2+会对Fe3+的识别产生干扰。综合以上分析,可得出探针L识别Fe3+的适用pH范围是3.4至6.4,在此pH范围内不受Fe2+的干扰。
3 结论
本文以7-(3-氨基苯并呋喃-2-基)-噻唑并[3, 2-a]嘧啶-5-酮为荧光团和螯合基团,设计合成了一种新型水溶性荧光探针L。在HEPES溶液中,探针L对Fe3+表现出了较高的选择性,其他阳离子没有干扰,检测限可达4.35×10-5mol/L。通过高分辨质谱证明该探针与Fe3+的结合模式是1:1。探针L适用于酸性环境(pH 3.4~6.4)中对Fe3+的检测,有一定的实际应用价值。
-
-
[1]
O Alam, S A Khan, N Siddiqui et al. Eur. J. Med. Chem., 2010, 45(11):5113-5119. doi: 10.1016/j.ejmech.2010.08.022
-
[2]
S Maddila, G Damu, E Oseghe et al. J. Korean Chem. Soc., 2012, 56(3):334-340. doi: 10.5012/jkcs.2012.56.3.334
-
[3]
N A Abd El-Latif, A E G E Amr, A A Ibrahiem. Monatshefte Für Chemie/Chemical Monthly, 2007, 138(6):559-567. http://dx.doi.org/Monatshefte F
-
[4]
B S Holla, B S Rao, B Sarojini et al. Eur. J. Med. Chem., 2004, 39(9):777-783. doi: 10.1016/j.ejmech.2004.06.001
-
[5]
S F Mohamed, E M Flefel, A E G E Amr et al. Eur. J. Med. Chem., 2010, 45(4):1494-1501. doi: 10.1016/j.ejmech.2009.12.057
-
[6]
J Hu, Y Wang, X Wei et al. Eur. J. Med. Chem., 2013, 64:292-301. doi: 10.1016/j.ejmech.2013.04.010
-
[7]
B Pan, R Huang, L Zheng et al. Eur. J. Med. Chem., 2011, 46(3):819-824. doi: 10.1016/j.ejmech.2010.12.014
-
[8]
M Ashok, B S Holla, N S Kumari. Eur. J. Med. Chem., 2007, 42(3):380-385. doi: 10.1016/j.ejmech.2006.09.003
-
[9]
张磊, 林娅, 王京等.有机化学, 2015, 35(2):497-504. http://mall.cnki.net/magazine/Article/YJHU201502029.htm
-
[10]
H Miyaji, J L Sessler. Angew. Chem., 2001, 113(1):158-161. doi: 10.1002/1521-3757(20010105)113:1 < 158::AID-ANGE158 > 3.0.CO; 2-J
-
[11]
Y M Ma, R C Hider. Bioorg. Med. Chem., 2009, 17(23):8093-8101. doi: 10.1016/j.bmc.2009.09.052
-
[12]
A S Dornelles, V A Garcia, M N de Lima et al. Neurochem. Res., 2010, 35(4):564-571. doi: 10.1007/s11064-009-0100-z
-
[13]
R R Crichton, D Dexter, R J Ward. Coord. Chem. Rev., 2008, 252(10):1189-1199.
-
[14]
J R Burdo, J R Connor. Biometals, 2003, 16(1):63-75. doi: 10.1023/A:1020718718550
-
[15]
Z Li, L Zhang, X Li et al. Dyes Pigm., 2012, 94(1):60-65. doi: 10.1016/j.dyepig.2011.11.007
-
[16]
Z Guo, S Park, J Yoon et al. Chem. Soc. Rev., 2014, 43(1):16-29. doi: 10.1039/C3CS60271K
-
[17]
H N Kim, Z Guo, W Zhu et al. Chem. Soc. Rev., 2011, 40(1):79-93. doi: 10.1039/C0CS00058B
-
[18]
S Ji, X Meng, W Ye et al. Dalton Transac., 2014, 43:1583-1588. doi: 10.1039/C3DT52422A
-
[19]
Y Zhou, H Zhou, J Zhang et al. Spectrochim. Acta, Part A, 2012, 98:14-17. doi: 10.1016/j.saa.2012.08.025
-
[20]
屈红利, 王森浩, 张爱英等.化学研究与应用, 2015, 27(11):1631-1637. http://www.cqvip.com/QK/97748X/201511/666656313.html
-
[21]
苏娜, 杨美盼, 孟文斐等.有机化学, 2015, 35(1):175-180. http://sioc-journal.cn/Jwk_yjhx/CN/article/downloadArticleFile.do?attachType=PDF&id=344618
-
[22]
汤立军, 郑竹轩, 边延江.化学通报, 2015, 78(5):388-395. http://www.hxtb.org/ch/reader/view_abstract.aspx?file_no=20141016003&flag=1
-
[23]
D L Wang, D Wang, L Yan et al. Chin. Chem. Lett., 2016, 27(6):953-956. doi: 10.1016/j.cclet.2016.02.007
-
[24]
W Lin, L Yuan, Z Cao et al. Chem. Eur. J., 2009, 15(20):5096-5103. doi: 10.1002/chem.200802751
-
[1]
-
图 2 探针L (1×10-5 mol/L)在HEPES缓冲溶液中分别加入各种阳离子后的荧光强度变化(λex=350nm);内插图:在365nm紫外灯照射下,探针L及加Fe3+后的颜色变化
Figure 2 Fluorescence spectra of probe L in HEPES buffer (1×10-5 mol/L) upon addition of various metal cations (λex=350nm); Inset: The color changes of probe L without and with Fe3+ under a portable UV lamp at 365nm
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:







 下载:
下载:

