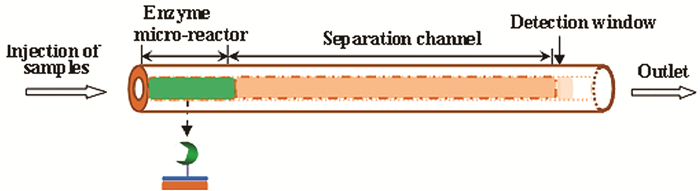
 图 1
固定化酶微反应器在线集成毛细管电泳系统示意图
Figure 1.
Schematic illustration of an on-line immobilized enzyme micro-reactor integrated into capillary electrophoresis
图 1
固定化酶微反应器在线集成毛细管电泳系统示意图
Figure 1.
Schematic illustration of an on-line immobilized enzyme micro-reactor integrated into capillary electrophoresis

Citation: Liu Jia, Zhang Lei, Shen Gangyi. Research Advance on Immobilized Enzyme Using Graphene as Carrier[J]. Chemistry, 2017, 80(1): 41-46.

石墨烯固定化酶研究进展
English
Research Advance on Immobilized Enzyme Using Graphene as Carrier
-
Key words:
- Immobilized enzyme
- / Graphene
- / Preparaiton
- / Application
-
固定化酶是指固定或束缚在某一不溶性载体或特定区域上的、可发挥其生物活性且能重复使用的酶。固定化酶不仅保留了游离酶专一、温和的催化特点,还明显提高了催化效率和稳定性,且可多次重复使用。特别是其催化过程易调控,非常利于与多种装置耦合和功能化集成,既可开展大规模工业生产,又能进行如图 1所示的微型生化催化反应与在线分析检测[1~3]。
 图 1
固定化酶微反应器在线集成毛细管电泳系统示意图
Figure 1.
Schematic illustration of an on-line immobilized enzyme micro-reactor integrated into capillary electrophoresis
图 1
固定化酶微反应器在线集成毛细管电泳系统示意图
Figure 1.
Schematic illustration of an on-line immobilized enzyme micro-reactor integrated into capillary electrophoresis
自Nelson等[4]首次发现具有催化活性的固定化蔗糖酶以来,特别是随着酶工程学发展的日益深入,固定化酶研究取得了迅猛发展,并由此开启了固定化酶研究的时代。截至目前,有关固定化酶技术的专利、文献已超过5000多篇[5],以固定化酶技术为核心,发展并建立了酶催化反应器、酶生物电极传感器、酶芯片、酶工程等多种类型的酶生物反应器新技术和应用。固定化酶技术已成为化学、物理、生物等多学科有机结合并共同关注的交叉亮点。
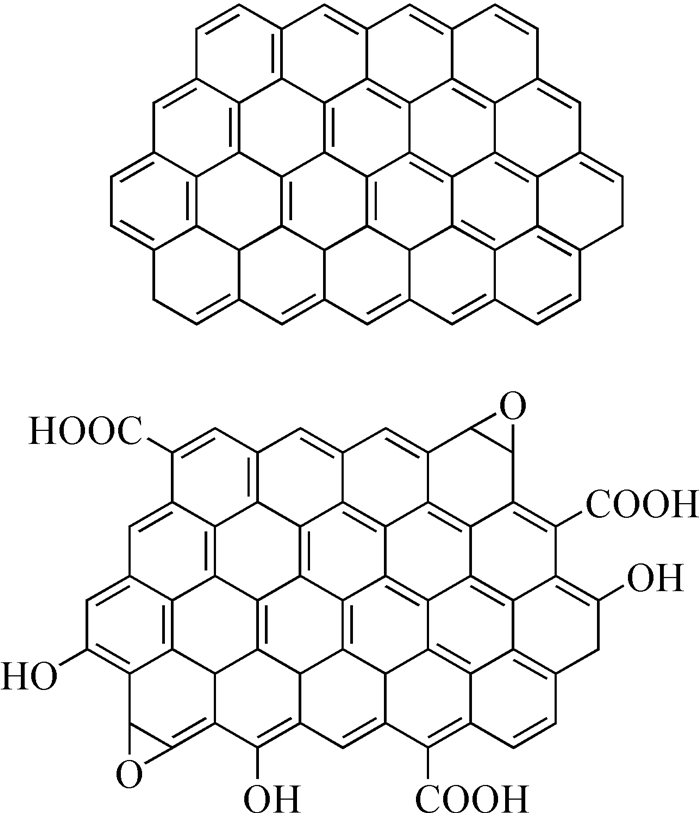
固定化酶的性能与载体的物化性质密切相关。近年来,随着纳米科学和材料科学的迅速发展,纳米材料作为固酶载体尤受青睐[6~12]。国内外众多研究人员分别以碳纳米管[8]、金纳米颗粒[9]、介孔材料[10]、磁性纳米粒子[11]、石墨烯(Gr)[12]等多种纳米材料为载体进行了固定化酶的研究。其中Gr (图 2)作为近年来研究的一类明星材料[13, 14],其理论比表面积高达2630m2/g,可有效地增加固酶量。Gr的高电导率(电子迁移率约2×105cm2/(V·s))能加速酶和底物之间的电子交换,极大促进酶的催化效率。Gr还具有良好的生物相容性,非常利于酶活保持。此外,对Gr进行修饰可得到氧化石墨烯(GO)等多种衍生物,物化性能易于调控优化。鉴于Gr独特的物化性能,其作为固酶载体优势突出,潜力巨大。
本文介绍了近年来以Gr为固酶载体的制作方法及应用研究,并对该领域今后的发展前景进行了展望。
1 Gr固定化酶的制备
固定化酶的催化活性因载体与酶结合方式不同而差异明显,酶与载体的固定方法及特点是相关领域研究的重点。本文着重从载体和酶的不同结合方式,分类讨论近年来基于Gr的各种固定化酶制备方法。
1.1 物理吸附法
物理吸附法是主要通过分子间弱相互作用力,如范德华力、离子键合、氢键、电荷转移、亲疏水性等将酶固定于载体表面的一种方法。GO自身具有大的比表面积,既能增加固酶量也可提高其稳定性。此外GO和羧基化石墨烯等衍生物表面含有丰富的功能基团,易于和酶形成静电引力等多种分子间相互作用力。这不仅使酶容易固定于其表面,也为其后续的催化反应提供了良好的环境。鉴于该法简便、快速、有效且易实现,因而在Gr为载体的固定酶技术中应用最为广泛。
Yang等[15]通过静电吸附作用把胰蛋白酶固定于GO表面,制备了基于GO载体的多层酶微反应器。该反应器展现了良好的重现性,重复20多次,RSD < 2.8%;5天中重复使用100多次,酶的活性仍能保持初始活性的79.5%。Ye等[16]采用直接自组装法将葡萄糖氧化酶固定在电化学还原的羧基化石墨烯修饰的玻碳电极上,实现了酶与电极表面之间直接的电子转移,大大提高了电催化性能。Han等[17]则将乙酰胆碱酯酶固定在多孔性GO修饰的玻碳电极上。相对于单层GO,多孔性GO不仅可以提供大的表面积,还能促进反应物的扩散和传质。利用该方法制备的生物传感器对乙酰胆碱具有高亲和力,实验测定的米氏常数值低至0.73mmol/L。
单一Gr作为固酶载体性能受限,构建基于Gr的复合型固酶载体,通过优化其物化性能来优化固定化酶的性能和拓展其功能,是目前物理吸附法制备Gr固定化酶的重点。
金属纳米颗粒具有良好的电子传递性能和生物相容性,将其结合在Gr上可进一步提高固定化酶的催化活性。Ashutosh等[18]先基于层层组装法将胆固醇氧化酶、胆固醇酯酶固定于Gr表面,再将金纳米颗粒组装到Gr固定化酶中,制备了Gr-酶-金纳米颗粒夹心式生物酶电极。与单一Gr为基质的传感器相比,该电极表现出更高的灵敏度和更快的响应时间。Pan等[19]则把络氨酸酶固定于Gr-金纳米复合材料上,制备了生物传感器。这种生物传感器对双酚A的检测限可低至1nmol/L。Sundaram等[20]将双金属纳米颗粒用于GO的改性,构筑了GO-金/钯双金属纳米颗粒复合材料,然后将葡萄糖氧化酶固定于该载体上,大大提高了酶的催化活性。该生物传感器表现出更高的灵敏度,同时还不受其他常见的可氧化物的干扰。另外Retna等[21]还制备了GO-树枝状钯纳米复合型固酶材料,用于提高传感器的性能。
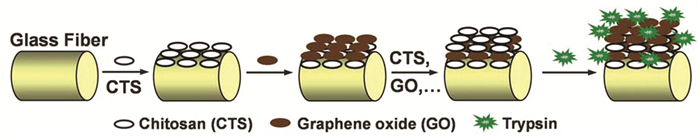
生物聚电解质壳聚糖(CS)具有良好的亲水性和生物相容性,Chen等[22]通过将CS引入GO来改善固定化酶的催化活性。基于层层组装作用,他们制备了一种玻璃光纤胰蛋白酶微反应器。制备过程如图 3所示:玻璃光纤冲洗干净后先浸没于CS中,使玻璃带正电荷;然后将其浸泡于GO溶液中,带负电的GO因静电吸附而固定于CS表面;经过数次循环组装后,最后把胰蛋白酶固定于表面修饰了GO的玻璃光纤上。该固定化胰蛋白酶可使分析物的酶解时间从自由酶溶液中的12h降低至10s,大大加快酶解效率。Yuan等[23]则制备了铂钯纳米粒子掺杂的CS-Gr混合纳米复合材料,将胆固醇氧化酶固定于该载体上制备了生物传感器。这种纳米复合材料不仅提高了从酶到电极表面的电子转移速率,也提高了酶的固定量。该传感器对胆固醇显示出很高的特异性,使响应时间缩短到7s,而且完全消除了尿酸、抗坏血酸和葡萄糖等物质的干扰。此外,Zhang等[24]还采用环糊精功能化的Gr来固定辣根过氧化酶。
碳量子点具有光致发光特性和良好的水溶性,将其引入既可改善固酶的活性,也能提高检测的灵敏性,Chang等[25]制备了碳量子点修饰的功能化rGO,用于葡萄糖氧化酶的固定。该传感器实现了对H2O2和葡萄糖的高灵敏检测。磁性材料结合Gr后作为固酶载体,既能改善酶的性能,又利于对其定向操控,大大拓展了固定化酶的应用。张丽华等[26]把磁性纳米颗粒Fe3O4键合于GO上,构建一种新的GO-NH-Fe3O4纳米复合材料,然后通过π-π堆积和氢键作用把胰蛋白酶固定。实验测得酶的结合量高达0.275mg/mg,而且GO-CO-NH-Fe3O4还是很好的微波辐射吸收剂,在微波辅助作用下,酶的水解效率大大提高。
1.2 化学键合法
相对于物理吸附法,化学键合法所制备的固定化酶具有稳定性强、酶活不易损失等优点。特别是GO表面所含有的羧基、羟基等活性基团,非常利于酶在GO上的化学键合。但实际使用中,由于GO的溶解性差、化学反应时易聚集等缺点,相对而言,目前在固定化酶中没有物理吸附法应用广泛。
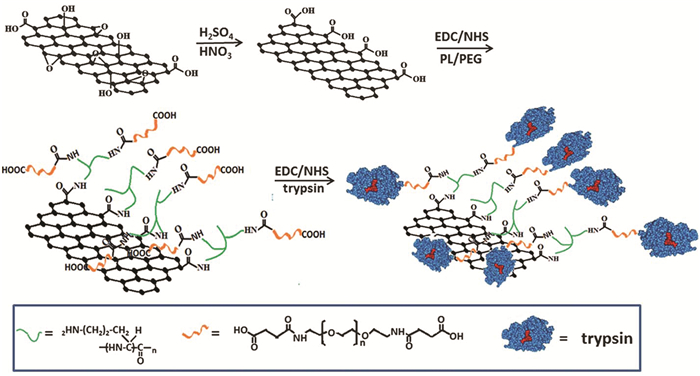
Wei等[27]采用化学键合法把胰蛋白酶共价固定于GO上,过程如图 4所示:先把Gr氧化为GO;以1-乙基-3-(3-N,N-二甲基氨基丙基)-碳二亚胺(EDC)/羟基琥珀酰亚胺(NHS)为催化剂,活化GO上的羧基;以多聚赖氨酸(PL)和聚乙二醇二甘醇酸(PEG)为功能连接臂把胰蛋白酶共价固定。该方法不仅使得胰蛋白酶的固定量提高(423±30 μg/mL),而且酶活的稳定性大大提高,15s内可连续水解数百个蛋白质样品。Jiang等[28]则将Gr复合材料用于酶的共价固定。他们先在CS表面共价接枝Gr,改善其生物相容性和亲水性,再结合钯纳米颗粒来提高催化过程中的电子转移速率,最后把葡萄糖氧化酶共价固定于载体上。基于钯纳米颗粒和Gr的电催化活性协同效应,以及CS-Gr复合膜优异的生物相容性,大大提高了葡萄糖氧化酶的亲和力,实验测定的米氏常数可低至1.2mmol/L。Wang等[29]将辣根过氧化酶固定在Gr上,该方法制备的生物传感器展现了良好的重现性和稳定性。Li等[30]把酸性果胶酶共价固定于GO表面上,固定量高达2400mg/g。并通过添加表面活性剂PEG6000,有效防止了酸性条件下果胶酶在GO上发生聚集,同时提高了酶的活性和水解效率。
1.3 包埋法
除了前两种方法,包埋法也被用于Gr固定化酶的制备中。虽然包埋法也借助化学或物理等作用来固定酶,但酶通常是渗透至载体的孔道或三维网络中。这样可有效避免物理吸附法固定化酶易产生的脱落现象以及化学法固定化酶时对酶活的损伤,固定化效率高。鉴于二维Gr的孔径尺寸难以有效地把酶包埋至孔径中,因此需借助其他大孔径材料来实现对酶的包埋。
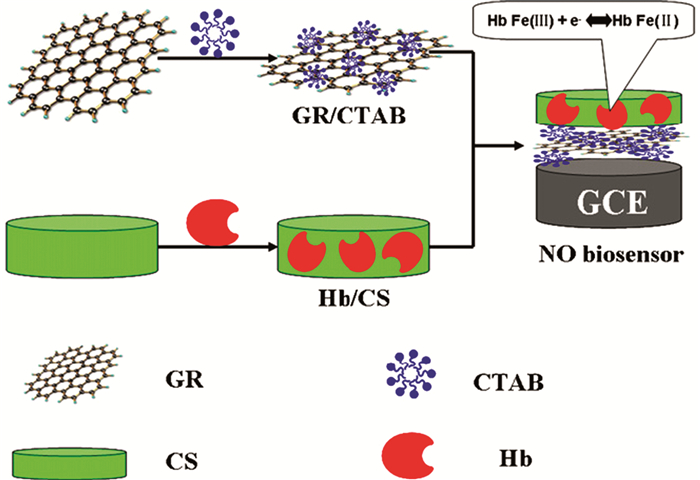
CS作为一种天然高分子,除了良好的生物相容性,还具有多孔的三维结构,为酶包埋提供了优良场所,而且,CS带负电荷,易与Gr结合。Brett等[31]将葡萄糖氧化酶和氮掺杂的Gr分散包埋于CS溶液中。基于CS和带负电荷的聚苯乙烯磺酸盐的静电作用,将其层层组装于金电极,制备了葡萄糖生物传感器。实验结果显示,添加氮掺杂的Gr后,能明显提高电极的电导率,进而增加检测灵敏度。为了降低因Gr在电极材料上的聚集而导致涂敷时的不均匀性,Zhao等[32]利用表面活性剂来改善Gr的分散性。如图 5所示,他们把Gr分散于十六烷基三甲基溴化铵(CTAB)溶液后,涂敷于玻璃碳电极(GCE)表面,制备了表面均一的Gr修饰电极;然后把血红蛋白(Hb)分散于CS中,利用CS的孔径来包埋Hb;最后基于CS与Gr的静电作用力将Hb固定于电极上。该传感器对NO具有非常高的灵敏度,检出限低至6.75 × 10-9 mol/L。Chai等[33]则将葡萄糖氧化酶包埋在3-巯丙基三甲氧基硅烷(MPTS)三维网络中。然后利用MPTS上的巯基,将其键合于金纳米粒子-聚苯胺-Gr修饰的电极上。
2 石墨烯固定化酶的应用
石墨烯固定化酶在酶反应器、生物传感以及酶工程学等领域已展现出广阔的应用潜力。但由于其在工业生产方面所面临的技术和成本等局限,开展大规模的工业化应用尚待时日。当前,石墨烯固定化酶的应用集中于酶微反应器和生物传感器等微型化生化分析检测方面。
2.1 在酶微反应器中的应用
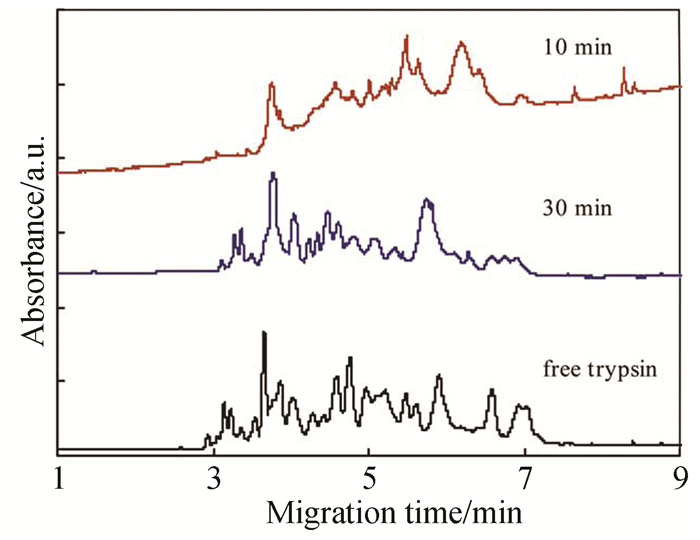
酶微反应器作为一种低耗、高效且易于实现在线化、自动化的酶反应工具,在蛋白质组学、药物筛选等领域有广泛应用。Gr作为微反应器的固酶载体,可提高反应器整体催化效能,进而推动了酶微反应器的研究和应用。图 6显示了以Gr为载体制备的毛细管电泳胰蛋白酶微反应器对牛血清白蛋白(BSA)的水解情况。从图中对比可以看出,酶微反应器在30min内对BSA的酶解效果与自由酶水解12h相当。
此外,Lu等[34]还把石墨烯固定化胰蛋白酶反应器和基质辅助激光解析电离成像质谱结合起来,首次实现组织蛋白的原位水解与鉴定,对于蛋白质组学研究具有重要意义。
2.2 在生物传感器中的应用
生物传感器具有灵敏度高、选择性好、特异性强、分析速度快、动态在线分析等特点,在食品分析、环境监测、药物研发、生化检测、医学诊断、等领域中应用广泛。Gr优良的电化学性质可显著提高生物传感器的灵敏度和响应信号,缩短响应时间。
相比酶微反应器,生物传感器特别是酶电极生物传感器是石墨烯固定化酶当前的应用重点。Liu等[35]利用芘对Gr表面进行修饰,制备了葡萄糖氧化酶生物电极。该传感器可实际应用于人血清样品中葡萄糖的分析。Zheng等[36]利用3-氨丙基三乙氧基硅烷与Gr反应,在此基础上进一步固定葡萄糖氧化酶,制备了酶生物传感器。该传感器对实际样品中的血糖检测范围为1.4~28 mmol/L。Zeng等[37]制备的十二烷基苯磺酸钠修饰的石墨烯固定化辣根过氧化酶生物电极,对H2O2表现出良好的电催化性能。Zheng等[38]将辣根过氧化酶固定在金/铂纳米粒子修饰的Gr-碳纳米管玻璃电极上,制备了H2O2生物传感器,拓展了Gr复合材料在酶促聚合反应方面的应用。该传感器对H2O2检测的线性范围可达5.0×10-4~1.0×10-1 mmol/L,检出限低至1.7×10-4mmol/L (S/N=3)。Lu等[39]制备Gr-金纳米杂化片层,由于金纳米颗粒和Gr的协同作用,这种复合的纳米层对NADH的催化氧化展现了良好的性能,其线性范围为5~377 μmol/L,检测限为1.5μmol/L。Liu等[40]通过将乙酰胆碱酯酶固定在3-羧基苯硼酸-Gr-金纳米复合物修饰的电极上,制备了可用于检测有机磷类和氨基甲酸酯类农药的生物传感器,并且明显降低了两类物质的检测限。
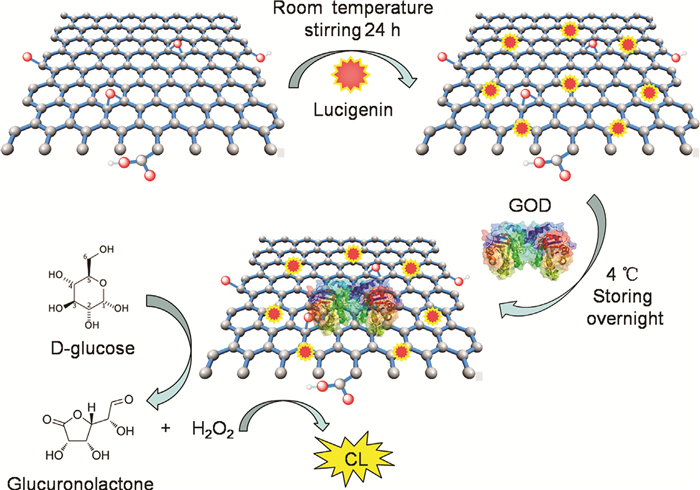
此外,Cui等[41]还利用Gr和光泽精之间的π-π相互作用制备了葡萄糖光学传感器,如图 7所示。该制备方法避免了复杂的制作程序,且具有良好的稳定性、重现性和普适性。通过将葡萄糖氧化酶替换为其他酶,如尿酸酶和胆碱氧化酶等,可用来检测尿酸和胆碱等小分子物质。而且,这种检测手段特异性强,无需血清样品的预处理。该传感器有望应用于疾病的诊断和生物医学等领域。
3 结语
Gr作为近年来广受关注的“明星”材料,拥有其独特的物化和生化性能,在固定化酶领域中潜力巨大且可拓展性强,具有极大的开发研究价值。然而需要指出的是,石墨烯固定化酶的制备和应用目前虽已取得很大进展,但与Gr在其他领域中应用和发展的“热火朝天”现状相比,仍处于初级阶段,亟待加速。
今后,在基础研究方面,石墨烯固定化酶技术还需重点在以下几方面取得突破:(1) 加强揭示Gr如何有效促进固定化酶性能的理论研究;(2) 石墨烯固定化酶制备方法相对其他载体较为单一,酶活性虽较高但稳定性较差,需综合各种固酶技术的优势,在兼顾固定化酶活性的基础上提高其稳定性;(3) 开发多种类型的Gr衍生物,改善其憎水性和易聚集性的缺陷,使其更利于固酶:(4) 发展基于石墨烯的复合型载体,充分利用多种材料的协同效应来改善和优化固酶的性能;(5) 结合石墨烯材料的特点,发展以芯片酶微反应器为代表的微型化通量化酶反应器,以及进行在线原位检测的微传感技术的研究。
在实际应用方面,要努力以生命科学领域中的应用为中心,把石墨烯固定化酶技术扩展到环境监测、临床检测、药物研发以及生物化工等多个领域。要进一步优化其制备工艺,实现规模化生产,以期为酶工程领域的生产化应用奠定基础。
-
-
[1]
邹承鲁.中国生化与分子生物学学报, 1999, 15:351-354. http://www.cnki.com.cn/Article/CJFDTotal-SWHZ903.000.htm
-
[2]
申刚义, 于婉婷, 刘美蓉等.化学进展, 2013, 25:1198-1207. http://www.cnki.com.cn/Article/CJFDTotal-HXJZ201307016.htm
-
[3]
J Iqbal, S Iqba, C E Müller. Analyst, 2013, 138:3104-3116. doi: 10.1039/c3an00031a
-
[4]
J M Nelson, E G Griffin. J. Am. Chem. Soc., 1916, 38:1109-1115. doi: 10.1021/ja02262a018
-
[5]
载体固定化酶:原理、应用和设计, 曹秋林(荷兰)著, 杨晟, 袁中一译.北京:化学工业出版社, 2008.
-
[6]
Y Li, X Q Xu, C H Deng et al. J. Proteome Res., 2007, 6:3849-3855. doi: 10.1021/pr070132s
-
[7]
L Wang, R Xu, Y Chen et al. J. Mol. Catal. B-Enzym., 2011, 69:120-126. doi: 10.1016/j.molcatb.2011.01.005
-
[8]
T T Trupti, K Kikuo, R Pankaj et al. Langmuir, 2015, 31:13054-13061. doi: 10.1021/acs.langmuir.5b03273
-
[9]
S J Guo, H Li, J Liu et al. Appl. Mater. Interf., 2015, 7:20937-20944. doi: 10.1021/acsami.5b06472
-
[10]
G L Zhang, M L Yang, D Q Cai et al. Appl. Mater. Interf., 2014, 6:8042-8047. doi: 10.1021/am502154w
-
[11]
X Y Mu, J Qiao, L Qi et al. Appl. Mater. Interf., 2014, 6:21346-21354. doi: 10.1021/am5063025
-
[12]
X Q You, J P James. Sensor. Actuat. B, 2014, 202:1357-1365. doi: 10.1016/j.snb.2014.04.079
-
[13]
K S Novoselov, A K Geim, S V Morozov et al. Science, 2004, 306:666-669. doi: 10.1126/science.1102896
-
[14]
A K Geim, K S Novoselov. Nat. Mater., 2007, 6:183-191. doi: 10.1038/nmat1849
-
[15]
Z G Yin, W W Zhao, M M Tian et al. Analyst, 2014, 139:1973-1979. doi: 10.1039/c3an02241b
-
[16]
B Liang, L Fang, G Yang et al. Biosens. Bioelectron., 2013, 43:131-136. doi: 10.1016/j.bios.2012.11.040
-
[17]
Y P Li, Y F Bai, G Y Han et al. Sensor. Actuat. B., 2013, 185:706-712. doi: 10.1016/j.snb.2013.05.061
-
[18]
P Onor, T Atul, A P F Turner et al. Biosens. Bioelectron., 2013, 49:53-62. doi: 10.1016/j.bios.2013.04.004
-
[19]
D D Pan, Y Y Gua, H Z Lan. Anal. Chim. Acta, 2015, 853:297-302. doi: 10.1016/j.aca.2014.11.004
-
[20]
J Yang, S Y Deng, J P Lei et al. Biosens. Bioelectron., 2011, 29:159-166. doi: 10.1016/j.bios.2011.08.011
-
[21]
R S Dey, C R Raj. Biosens. Bioelectron., 2014, 62:357-364. doi: 10.1016/j.bios.2014.06.063
-
[22]
H M Bao, Q W Chen, L Y Zhang. Analyst, 2011, 136:5190-5196. doi: 10.1039/c1an15690j
-
[23]
S R Cao, L Zhang, Y Q Chai et al. Talanta, 2013, 109:167-172. doi: 10.1016/j.talanta.2013.02.002
-
[24]
L M Lu, X L Qiu, X B Zhang et al. Biosens. Bioelectron., 2013, 45:102-107. doi: 10.1016/j.bios.2013.01.065
-
[25]
T Y Yeh, C I Wang, H T Chang. Talanta, 2013, 115:718-723. doi: 10.1016/j.talanta.2013.06.035
-
[26]
B Jiang, K J Jang, Q Zhao. J. Chromatogr. A, 2012, 1254:8-13. doi: 10.1016/j.chroma.2012.07.030
-
[27]
G B Xu, X Y Chen, J H Hu et al. Analyst, 2012, 137:2757-2761. doi: 10.1039/c2an35093a
-
[28]
Q Zeng, J S Cheng X F Liu et al. Biosens. Bioelectron., 2011, 26:3456-3463. doi: 10.1016/j.bios.2011.01.024
-
[29]
J Y Liu, E K Wang, J Wang et al. Electrochim. Acta. 2015, 161:17-22.
-
[30]
Y Liu, Q Li, Y Y Feng et al. Chem. Lett., 2014, 68(6):732-738.
-
[31]
M M Barsan, M David, M Florescu et al. Bioelectrochemistry, 2014, 99:46-52. doi: 10.1016/j.bioelechem.2014.06.004
-
[32]
W Wen, W Chen, Q Q Ren et al. Sensor Actuat. B, 2012, 166-167:444-450.
-
[33]
L J Bai, B Yan, Y Q Chai et al. Analyst, 2013, 138:6595-6599. doi: 10.1039/c3an00983a
-
[34]
J Jiao, A Z Miao, X Y Zhang et al. Analyst, 2013, 138, 1645-1468.
-
[35]
J Q Liu, N Kong, A H Li. Analyst, 2013, 138:2567-2575. doi: 10.1039/c3an36929c
-
[36]
D Zheng, S K Vashist, K A Rubeaan et al. Talanta, 2012, 99, 22-28.
-
[37]
Q Zeng, J S Cheng, L H Tang et al. Adv. Funct. Mater., 2010, 20:3366-3372. doi: 10.1002/adfm.201000540
-
[38]
Q L Sheng, M Z Wang, J B Zheng et al. Chin. J. Anal. Chem., 2009, 37(11):1557-1565. doi: 10.1016/S1872-2040(08)60139-5
-
[39]
L Li, H Hu, L Deng. Talanta, 2013, 113:1-6. doi: 10.1016/j.talanta.2013.03.074
-
[40]
T Liu, H C Su, X J Qu et al. Sensor. Actuat. B., 2011, 160:1255-1261. doi: 10.1016/j.snb.2011.09.059
-
[41]
L F Gao, H L Zhang, H Cui. Biosens. Bioelectron., 2014, 57:65-70. doi: 10.1016/j.bios.2014.01.057
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0


 下载:
下载:






 下载:
下载:

