 图 1
催化剂的XRD谱图
Figure 1.
XRD patterns of catalysts
图 1
催化剂的XRD谱图
Figure 1.
XRD patterns of catalysts

Citation: WANG Liang-liang, WANG Ming-hong, FEI Zhao-yang, ZHANG Zhu-xiu, CHEN Xian, TANG Ji-hai, CUI Mi-fen, QIAO Xu. Preparation of amorphous MnOx/TiO2 catalyst and its performance in low temperature NH3-SCR[J]. Journal of Fuel Chemistry and Technology, 2017, 45(8): 993-1000.

非晶态MnOx/TiO2催化剂的制备及其低温NH3-SCR性能
English
Preparation of amorphous MnOx/TiO2 catalyst and its performance in low temperature NH3-SCR
-
氮氧化物(NOx)不但会引起酸雨、光化学烟雾、雾霾等污染问题,而且会破坏臭氧层,严重危害人类的健康。因此,环保部门出台了严格的氮氧化物排放标准[1-3]。以氨气为还原气的选择性催化还原法(NH3-SCR)是目前应用最广泛的治理NOx的方法,其核心是高性能催化剂[4]。目前, 商业化催化剂主要为V2O5-WO3(MoO3)/TiO2[5],这类催化剂存在活性温度窗口窄,高温下催化剂易烧结及V2O5污染环境等问题[6]。此外,工业上NH3-SCR装置常布置于除尘和脱硫之前,烟气中粉尘会造成催化剂磨损和堵塞,以及高浓度SO2会使催化剂中毒,严重影响催化剂的使用寿命。为解决上述问题,研究人员将NH3-SCR装置布置于除尘和脱硫之后,这虽然能避免粉尘和SO2对催化剂的钝化影响,但烟气的温度明显降低,因此, 迫切需要开发低温NH3-SCR催化剂。
由于MnOx具有多价态锰离子、大量的不同氧物种以及优异的低温NH3-SCR性能,锰基催化剂被广泛地研究[7, 8]。近年来,研究人员采用不同制备过程以获取理想的高性能MnOx/TiO2催化剂。Jiang等[9]通过三种不同方法制备MnOx/TiO2催化剂,其中, 溶胶凝胶法制备的MnOx/TiO2催化剂中组分之间存在强相互作用,且大量锰氧化物以非晶态形式存在,表现出最优异的NH3-SCR催化性能。此外,Zhang等[10]利用超声过程显著地提高了MnOx/TiO2催化剂的分散性,加强了Mn与Ti之间的相互作用,催化剂具有大量的Lewis酸及高浓度的表面锰原子,表现出优异的低温NH3-SCR活性。近期,Park等[11]借助化学蒸发凝聚技术合成TiO2,并制备出具有纳米级、高分散的非晶态锰氧化物的活性组分及较高表面Lewis酸的MnOx/TiO2催化剂,其展示出优异的低温NH3-SCR性能及抗SO2能力。在前期的研究中[12],作者制备出完全非晶态结构的Ce-Ti催化剂,Ce与Ti之间存在强相互作用,且比晶态结构催化剂具有更高的表面酸量及更强的氧化还原能力。在中温区间表现出优异的NH3-SCR催化活性,且具有优异的抗H2O和SO2毒化性能。
为开发与低温NH3-SCR工艺相配套的高活性催化剂,本实验研究钛酸四丁酯发生水解作用生成TiO2凝胶,其表面具有大量羟基,当羟基失去氢离子后与Mn2+相互吸引结合,促进Mn2+在TiO2表面发生原位自发沉积,经过焙烧制备具有非晶态结构MnOx/TiO2(s)催化剂。并通过XRD、TEM、N2吸附-脱附、XPS、H2-TPR、NH3-TPD等一系列表征手段研究不同的制备方法对催化剂的结构、性质以及低温NH3-SCR活性的影响。为自发沉积法制备的非晶态催化剂在低温NH3-SCR反应中的应用提供参考。
1 实验部分
1.1 催化剂的制备
称取0.05 mol钛酸四丁酯、0.1 mol冰醋酸充分溶解于0.8 mol无水乙醇中,配制成A溶液。再称取0.4 mol无水乙醇、0.6 mol水及0.05 mol的Mn(NO3)2均匀混合得到B溶液。在剧烈搅拌下将B溶液以一定速率滴入A溶液,继续搅拌0.5 h滴加4.5 g甲酰胺,搅拌1 h后滴加70.0 g环氧丙烷,升温至60 ℃冷凝回流6 h,后在室温下老化12 h。用无水乙醇洗涤两次,在60 ℃下干燥50 h,并于500 ℃焙烧5 h,所得样品即为所需的催化剂,记为MnOx/TiO2(s)。
作为对比催化剂,MnOx-TiO2(c)催化剂采用共沉淀法制备,MnOx/TiO2(i)催化剂采用浸渍法制备,催化剂的nMn/nTi与MnOx/TiO2(s)实际的nMn/nTi相同。MnOx-TiO2(c)催化剂的制备:称取0.05 mol Ti(SO4)2和0.037 mol Mn(NO3)2于100 mL去离子水中,搅拌至完全溶解,用氨水调节pH值为10,在室温下老化2 d,过滤得滤饼。MnOx/TiO2(i)催化剂的制备:称取0.05 mol P25和0.037 mol Mn(NO3)2溶于100 mL去离子水,在室温下老化2 d,过滤得滤饼。将这两种制备方法所得的滤饼于100 ℃烘箱中干燥24 h,于500 ℃焙烧5 h,所得样品即为所需催化剂。
1.2 催化剂的表征
XRD采用日本Rigaku公司的SmartLab衍射仪进行检测,利用Cu Kα为射线源(λ = 0.154 nm),管电压40 kV,管电流100 mA,扫描步长0.02°,10°-80°扫描;N2吸附-脱附测试在日本BEL公司的BELSORP-Ⅱ型吸附仪上测试,样品首先在200 ℃下真空脱水2 h,然后再测试,运用BET方程计算比表面积,并使用BJH模型计算催化剂的孔容以及平均孔径。用BET方程计算样品的比表面积,并使用BJH模型计算样品的孔容和孔径分布;TEM是在日本JEOL公司的JEM-100型透射电子显微镜上测试;XPS分析在日本PHI 5000 VersaProbe使用Al Kα为射线,以C 1s峰(BE=284.8 eV)作为Mn 2p和O 1s的结合能的校准标准;H2-TPR和NH3-TPD均在美国Micromeritics公司的Auto Chem 2920仪器上进行测试。
1.3 催化剂的性能评价
NH3-SCR活性采用规格为Φ20 mm×660 mm的固定床反应器进行测定评价。催化剂(16-40目)填装2 mL于反应器中部,通过三段加热炉进行加热和升温控制。模拟烟道气组成:0.1% NO、0.1% NH3、3% O2、0.01% SO2(需用时)、10% H2O(需用时)、N2为平衡气,气体总流量为500 mL/min,设计空速为15 000 h-1,各气体流量均由质量流量计控制。毒化实验采用阶跃应答技术,首先在200 ℃稳定反应体系1 h,后将毒化气体(0.01% SO2和10%水蒸气)引入反应体系。尾气中NO的含量由德国MRU公司VARIO工业型烟气分析仪测定,脱硝率按照如下公式计算:
式中,xNO为NO转化率;cin表示NO在反应器入口处的浓度;cout表示NO经过反应器反应后的浓度。
2 结果与讨论
2.1 XRD分析
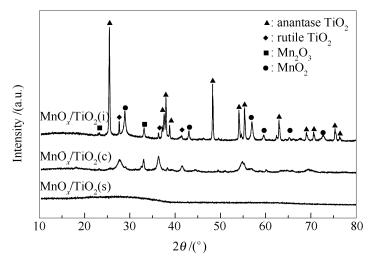
图 1为MnOx/TiO2(i)、MnOx/TiO2(c)和MnOx/TiO2(s)催化剂的XRD谱图。
由图 1可知,MnOx/TiO2(i)催化剂观察到锐钛矿相TiO2衍射峰(JCPDS: 21-1272) 和金红石相TiO2衍射峰(JCPDS: 21-1276),此外还观察到MnO2衍射峰(JCPDS: 42-1317) 和Mn2O3衍射峰(JCPDS: 41-1442),表明锰在P25表面主要以MnO2和Mn2O3的形式存在。MnOx/TiO2(c)催化剂观察到锐钛矿相和金红石相TiO2衍射谷峰包,及MnO2和Mn2O3的小谷峰衍射峰,表明MnOx/TiO2(c)催化剂相较于MnOx/TiO2(i)具有较低结晶度。对于MnOx/TiO2(s)催化剂,并未观察到明显的衍射峰,表明自发沉积法制备的MnOx/TiO2(s)催化剂可能为完全非晶形结构[13, 14]。
2.2 TEM分析
图 2为MnOx/TiO2(s)催化剂的HRTEM、STEM和TEM-EDS mapping照片。由图 2(a)可知,MnOx/TiO2(s)催化剂由大量纳米颗粒凝聚形成,HRTEM照片并未出现晶格条纹,且对应的SAED(内嵌)照片既无多晶环也无点阵,与XRD结论相符合,即MnOx/TiO2(s)催化剂为完全非晶态结构。此外,还借助了TEM-EDS mapping分析催化剂中各元素分散状态。由图 2(b)和图 2(c)可知,MnOx/TiO2(s)催化剂中各元素均匀分散,通过三元素重叠图可更为明显地观察到各元素高度分散,这进一步表明, 自发沉积法制备的MnOx/TiO2(s)催化剂为高度融合的完全非晶态结构。
2.3 N2吸附-脱附分析
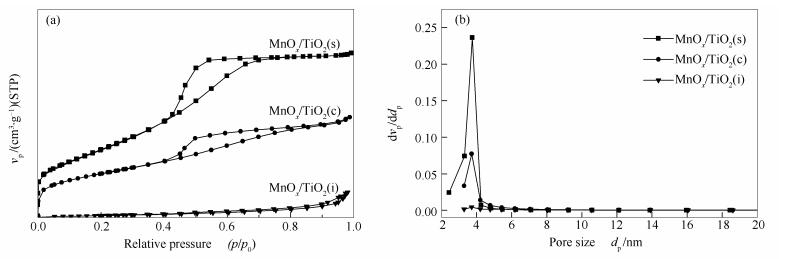
图 3为MnOx/TiO2(s)、MnOx/TiO2(c)和MnOx/TiO2(i)催化剂的N2吸附-脱附等温线和孔径分布。由图 3(a)可知,各催化剂的吸附等温线均属于第Ⅳ类型,MnOx/TiO2(s)和MnOx/TiO2(c)属于典型的介孔结构,具有H2型回滞环特征,其孔道主要是由细颈、广体的“墨水瓶”孔构成[15],MnOx/TiO2(i)则为H3型回滞环,其孔道较多为堆积型孔。由图 3(b)可知,MnOx/TiO2(s)的平均孔径集中分布在3.9 nm左右。各催化剂的比表面积、孔容及平均孔径见表 1。由表 1可知,MnOx/TiO2(s)催化剂具有最大的比表面积和孔容,分别为185.3 m2/g和0.18 cm3/g;MnOx/TiO2(c)催化剂次之,分别为112.8 m2/g和0.11 cm3/g;MnOx/TiO2(i)催化剂最小,分别为6.4 m2/g和0.03 cm3/g。研究表明[16]较大的比表面积有利于活性组分高度分散提供更多的活性点位及反应气体的吸附,从而促进NH3-SCR催化反应。
2.4 XPS分析
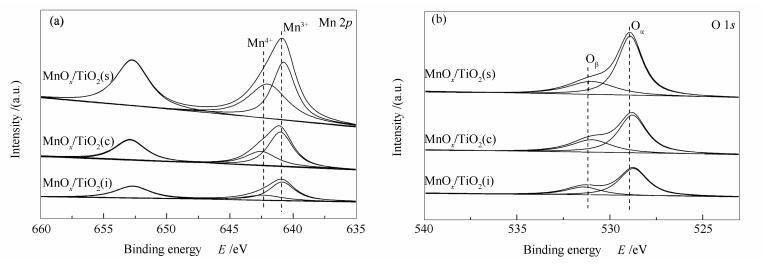
图 4为MnOx/TiO2(s)、MnOx/TiO2(c)和MnOx/TiO2(i)催化剂的XPS谱图。由图 4(a)可知,各催化剂均出现两个特征峰,分别归属于Mn 2p3/2(641.0±0.3 eV)和Mn 2p1/2(652.8 eV)。通过对Mn 2p3/2进行分峰拟合可知,在各催化剂表面锰物种主要以Mn4+与Mn3+形式存在。采用Mn4+/(Mn4++Mn3+)的比例衡量Mn4+离子浓度,且高浓度Mn4+离子有利于提高催化活性[17]。因此,各催化剂的Mn4+/(Mn4++Mn3+)的比例见表 2。由图 4(b)可知,各催化剂O 1s的XPS谱图均观察到两个特征峰,分别为位于528.9 eV处的晶格氧(Oα)特征峰和531.3 eV处的表面吸附氧(Oβ)特征峰。由于Oβ的迁移性比Oα强,因而Oβ表现出更高的氧化活性,所以Oβ的浓度影响NH3-SCR活性[18]。由表 2可知,MnOx/TiO2(s)、MnOx/TiO2(c)和MnOx/TiO2(i)催化剂的Mn4+离子浓度分别为51.14%、33.71%、30.48%,Oβ浓度别为34.02%、32.06%、30.92%。其中,MnOx/TiO2(s)催化剂具有最高浓度的Mn4+和Oβ,更有利于将NO氧化为NO2,促使发生“fast-SCR”反应,从而显著地提升其低温NH3-SCR活性[19-21]。
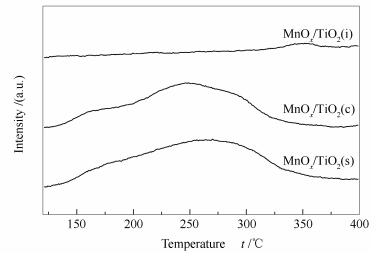
2.5 H2-TPR分析
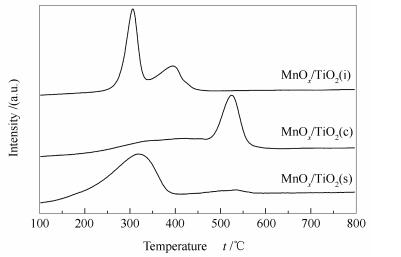
图 5为MnOx/TiO2(s)、MnOx/TiO2(c)和MnOx/TiO2(i)催化剂的H2-TPR谱图。
由图 5可知,MnOx/TiO2(c)和MnOx/TiO2(i)催化剂在200-700 ℃均出现二个还原峰,低温还原峰归属于Mn4+物种还原为Mn3+,高温还原峰为Mn3+物种还原为Mn2+[22]。MnOx/TiO2(s)催化剂只有一个低温还原峰,且对应的还原峰值温度为320 ℃,这是由于MnOx/TiO2(s)催化剂中Mn与Ti的强相互作用导致其起始还原峰温度均低于MnOx/TiO2(c)和MnOx/TiO2(i)催化剂[23]。根据表 1可知,MnOx/TiO2(s)催化剂耗氢量最高(69.46 cm3/gcat),MnOx/TiO2(c)催化剂耗氢量次之(68.03 cm3/gcat),MnOx/TiO2(i)催化剂耗氢量最少(59.03 cm3/gcat)。催化剂的低温氧化还原能力影响其低温催化活性[24, 25],虽然MnOx/TiO2(i)催化剂两个还原峰的温度比较低,但其耗氢量最少,所以表现出较弱的氧化还原能力。MnOx/TiO2(c)催化剂与MnOx/TiO2(s)催化剂耗氢量相近,但其还原峰温度较高,表明MnOx/TiO2(c)催化剂低温时不易发生氧化还原反应。而MnOx/TiO2(s)催化剂的耗氢量最高且起始还原温度最低,这说明其具有最强的低温氧化还原能力。不同的制备方法使得活性物种与载体之间具有不同的相互作用,其中, 自发沉积法制备的MnOx/TiO2(s)催化剂中Mn与Ti的相互作用最强,Ti离子促进了MnOx物种的还原[14],且MnOx/TiO2(s)催化剂耗氢量最高,所以自发沉积法制备的MnOx/TiO2(s)催化剂表现出最强的低温氧化还原能力。
2.6 NH3-TED分析
图 6为MnOx/TiO2(s)、MnOx/TiO2(c)和MnOx/TiO2(i)催化剂的NH3-TPD谱图。
由图 6可以看出,各催化剂均只有一个脱附峰,MnOx/TiO2(s)和MnOx/TiO2(c)催化剂在150-325 ℃出现一个宽氨气脱附峰,而MnOx/TiO2(i)只在350 ℃处出现一个微弱的氨气脱附峰。由表 1可知,MnOx/TiO2(s)催化剂的酸量为最高(0.37 mmol/gcat),MnOx/TiO2(c)催化剂的酸量次之(0.32 mmol/gcat),MnOx/TiO2(i)催化剂的酸量最少(0.01 mmol/gcat)。在NH3-SCR反应中,催化剂的表面酸量决定其吸附-脱附NH3的能力,而NH3在催化剂表面吸附是反应过程中的重要步骤,较多的表面酸量更有利于NH3吸附在催化剂的表面形成配位态NH3活性物种[12, 26]。MnOx/TiO2(s)具有最多的表面酸量,这更有利于NH3-SCR反应的进行。
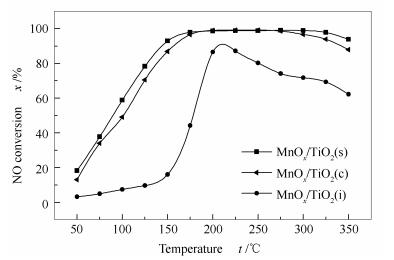
2.7 催化剂NH3-SCR活性测试
图 7为MnOx/TiO2(s)、MnOx/TiO2(c)和MnOx/TiO2(i)催化剂在50-350 ℃的NH3-SCR脱硝活性测试结果。由图 7可知,MnOx/TiO2(s)催化剂在50-150 ℃ NO转化率呈现快速增长,150 ℃时MnOx/TiO2(s)催化剂NO转化率92.8%,在150-350 ℃ NO转化率保持在90%以上,高温区间催化NO转化率出现轻微的下降主要由于高温段出现NH3非选择性氧化反应造成的。共沉淀法制备的MnOx/TiO2(c)催化剂随着反应温度的提高NO转化率也表现出先上升后下降趋势,但在低温段和高温段脱硝活性均弱于MnOx/TiO2(s)催化剂,MnOx/TiO2(c)催化剂具有这样活性得益于较低结晶度及各项性能。浸渍法制备的MnOx/TiO2(i)催化剂在整个测试温度区间表现出较低NO转化率,仅在225 ℃时达到最高的NO转化率,为87.15%。活性测试结果表明,催化剂的制备方法影响催化性能,MnOx/TiO2(s)催化剂表现出最优异的低温催化活性,进一步证明MnOx/TiO2催化剂的催化活性主要受到结晶度、酸量及氧化还原能力的影响[9]。
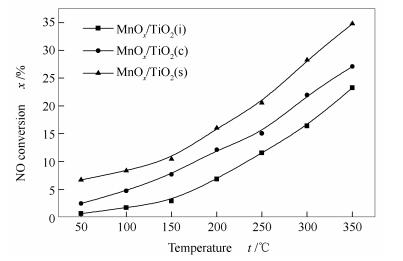
2.8 催化剂氧化NO活性测试
图 8为MnOx/TiO2(s)、MnOx/TiO2(c)和MnOx/TiO2(i)催化剂催化氧化NO为NO2的活性测试结果。由图 8可知,随着反应温度的提高,MnOx/TiO2均表现出对于NO氧化活性增加趋势。其中,MnOx/TiO2(s)催化剂具有最高的氧化NO活性,MnOx/TiO2(i)催化剂对于NO氧化活性最低,这与其低温段NH3-SCR低活性结果相一致。通过前期研究[27, 28]发现,优异的低温NH3-SCR催化剂具有NO氧化为NO2高活性,这主要由于NO2可以通过“fast SCR”路径: NO + NO2 + 2NH3 → 2N2 + 3H2O,提高低温NH3-SCR活性。此外,催化剂表面的Mn4+及吸附氧的浓度与NO氧化为NO2的活性密切相关,通过上述XPS的结果可知,MnOx/TiO2(s)催化剂具有最高的表面Mn4+和吸附氧的浓度,更容易发生“fast SCR”反应,这也是其具有较优异的低温NH3-SCR活性主要原因之一。
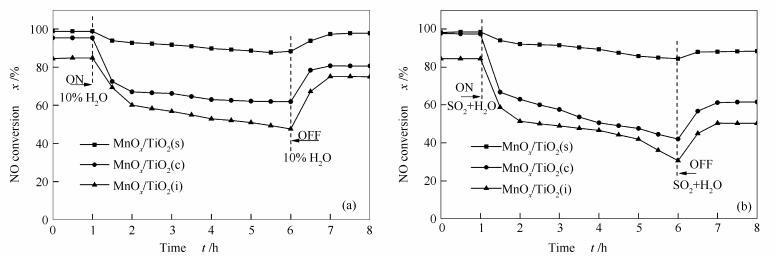
2.9 SO2和H2O对催化活性的影响
虽然低温NH3-SCR装置排布在脱硫与除尘之后,但在烟道气中仍含有一定量的SO2和H2O,因此,考察SO2和H2O对催化剂的性能影响是评估催化剂优劣的重要因素之一。图 9为MnOx/TiO2(s)、MnOx/TiO2(c)和MnOx/TiO2(i)催化剂在200 ℃时的0.01% SO2和10% H2O阶跃应答实验结果。由图 9(a)可知,在通入10% H2O前,反应体系达到最佳脱硝率且稳定1 h,当通入H2O后,各催化剂脱硝率均出现不同程度的下降,经过5 h后MnOx/TiO2(s)催化剂的NO转化率从98.8%降到88.5%,下降了10.3%;而MnOx/TiO2(c)催化剂的NO转化率由95.4%降至62%,MnOx/TiO2(i)催化剂的NO转化率由84%降至47.6%。表明采用自发沉积法制备的MnOx/TiO2(s)催化剂表现出较其他催化剂更强的抗H2O性能。为考察SO2和H2O共同存在时催化剂的稳定性,将反应体系先稳定1 h,后将0.01% SO2和10% H2O同时通入到反应体系,由图 9(b)可知,当两种气体通入到体系MnOx/TiO2(c)和MnOx/TiO2(i)催化剂NO转化率急剧下降,0.5 h后分别由97.5%下降到66.7%和84.4%下降到58.8%,而MnOx/TiO2(s)催化剂NO转化率下降相对缓和,5 h后催化活性由98.6%下降到84.5%。当SO2和H2O停止通入后,各催化剂NO转化率均出现不同程度的上升,但无法恢复到初始活性,说明催化剂出现了部分不可逆中毒,这主要是由于H2O分子与原料气产生竞争吸附及SO2在催化剂表面形成硫酸盐物种覆盖活性点位所导致的[29]。MnOx/TiO2(s)催化剂在SO2和H2O同时存在条件下,表现出较其他催化剂更强的抗SO2和H2O能力,这一优异性能可能是由于MnOx/TiO2(s)催化剂在制备过程中形成介孔非晶态多孔结构,Mn与Ti之间存在的强烈作用及多活性点位造成的[30]。
3 结论
采用三种不同的制备方法制备MnOx/TiO2催化剂,其中,自发沉积法制备的MnOx/TiO2(s)催化剂表现出最优的NO转化率,在150 ℃时NO转化率高达92.8%,在150-350 ℃ NO转化率保持在90%以上。主要由于MnOx/TiO2(s)具有介孔非晶态结构,较大的比面积和孔容,较多的表面酸量,较强的氧化还原能力及Mn与Ti之间存在强的作用。此外催化剂表面高Mn4+浓度和表面吸附氧,有利于将NO氧化为NO2,促进发生“fast-SCR”反应,进而提高催化剂的低温活性。更重要的是,与MnOx/TiO2(s)和MnOx/TiO2(i)相比,MnOx/TiO2(s)表现更强的抗毒化能力,这主要归因于催化剂具有介孔非晶态结构。
-
-
[1]
HU H, CAI S, LI H , HUANG L, SHI L, ZHANG D. Mechanistic aspects of deNOx processing over TiO2 supported Co-Mn oxide catalysts: Structure-activity relationships and in situ DRIFTs analysis[J]. ACS Catal, 2015, 5(10): 6069-6077. doi: 10.1021/acscatal.5b01039
-
[2]
LU X, SONG C, CHANG C C, TENG Y, TONG Z, TANG X. Manganese oxides supported on TiO2-Graphene nanocomposite catalysts for selective catalytic reduction of NOx with NH3 at low temperature[J]. Ind Eng Chem Res, 2014, 53(29): 11601-11610. doi: 10.1021/ie5016969
-
[3]
朱斌, 费兆阳, 陈献, 汤吉海, 崔咪芬, 乔旭. Al-PILC负载铜铁复合氧化物在NH3选择性催化还原NO中的协同作用[J]. 燃料化学学报, 2014,42,(9): 1102-1110. ZHU Bin, FEI Zhao-yang, CHEN Xian, TANG Ji-Hai, CUI Mi-fen, QIAO Xu. Synergetic effect of Cu-Fe composite oxides supported on Al-PILC for SCR of NO with NH3[J]. J Fuel Chem Technol, 2014, 42(9): 1102-1110.
-
[4]
POURKHALIL M, MOGHADDAM A Z, RASHIDI A, TOWFIGHI J, MORTAZAVI Y. Preparation of highly active manganese oxides supported on functionalized MWNTs for low temperature NOx reduction with NH3[J]. Appl Surf Sci, 2013, 279(2): 250-259.
-
[5]
TANG F, XU B, SHI H. The poisoning effect of Na+ and Ca2+ ions doped on the V2O5/TiO2 catalysts for selective catalytic reduction of NO by NH3[J]. Appl Catal B: Environ, 2010, 94(1/2): 71-76.
-
[6]
YANG J, YANG Q, SUN J, LIU Q C, ZHAO D. Effects of mercury oxidation on V2O5-WO3/TiO2 catalyst properties in NH3-SCR process[J]. Catal Commun, 2015, 59: 147-156.
-
[7]
MENG D, ZHAN W, GUO Y, GUO Y, WANG L, LU G. A highly effective catalyst of Sm-MnOx for the NH3-SCR of NOx at low temperature: the promotional role of Sm and its catalytic performance[J]. ACS Catal, 2015, 5(10): 5973-5983. doi: 10.1021/acscatal.5b00747
-
[8]
MU W, ZHU J, ZHANG S, GUO Y, SU L, LI X. Novel proposition on mechanism aspects over Fe-Mn/ZSM-5 catalyst for NH3-SCR of NOx at low temperature: rate and direction of multifunctional electron-transfer-bridge and in-situ DRIFTs analysis[J]. Catal Sci Technol, 2016, 6(20): 7532-7548. doi: 10.1039/C6CY01510G
-
[9]
JIANG B Q, LIU Y, WU Z B. Low-temperature selective catalytic reduction of NO on MnOx/TiO2 prepared by different methods[J]. J Hazard Mater, 2009, 162: 1249-1254. doi: 10.1016/j.jhazmat.2008.06.013
-
[10]
ZHANG Y, ZHAO X, XU H, SHEN K, ZHOU C, JIN B, SUN K. Novel ultrasonic-modified MnOx/TiO2 for low-temperature selective catalytic reduction (SCR) of NO with ammonia[J]. J Colloid Interface Sci, 2011, 36(1): 212-218.
-
[11]
PARK E, KIM M, JUNG H, CHIN S, JURNG J. Effect of sulfur on Mn/Ti catalysts prepared using chemical vapor condensation (CVC) for low-temperature NO reduction[J]. ACS Catal, 2013, 3(7): 1518-1525. doi: 10.1021/cs3007846
-
[12]
刘俊, 王亮亮, 费兆阳, 陈献, 汤吉海, 崔咪芬, 乔旭. 非晶态CeO2@TiO2催化剂的结构、性质及其选择催化还原脱硝性能[J]. 燃料化学学报, 2016,44,(8): 954-960. LIU Jun, WANG Liang-liang, FEI Zhao-yang, CHEN Xian, TANG Ji-hai, CUI Mi-fen, QIAO Xu. Structure and properties of amorphous CeO2@TiO2catalyst and its performance in the selective catalytic reduction of NO with NH3[J]. J Fuel Chem Technol, 2016, 44(8): 954-960.
-
[13]
ZHANG Z P, CHEN L Q, LI Z B. Activity and SO2 resistance of amorphous CeaTiOx catalysts for the selective catalytic reduction of NO with NH3: In-situ DRIFT studies[J]. Catal Sci Technol, 2016, 6(19): 7151-7162. doi: 10.1039/C6CY00475J
-
[14]
LI P, XIN Y, LI Q, WANG Z, ZHANG Z, ZHENG L. Ce-Ti amorphous oxides for selective catalytic reduction of NO with NH3: Confirmation of Ce-O-Ti Active Sites[J]. Environ Sci Technol, 2012, 46: 9600-9605. doi: 10.1021/es301661r
-
[15]
CHEN X, XU X, FEI Z, XIE X, Lou J, TANG J, CUI M, QIAO X. CeO2 nanodots embedded in a porous silica matrix as an active yet durable catalyst for HCl oxidation[J]. Catal Sci Technol, 2016, 6(13): 5116-5123. doi: 10.1039/C5CY02300A
-
[16]
FANG Z T, LIN T, XU H D, WU G X, CHEN Y Q. Novel promoting effects of cerium on the activities of NOx reduction by NH3 over TiO2-SiO2-WO3 monolith catalysts[J]. J Rare Earth, 2014, 32(10): 952-959. doi: 10.1016/S1002-0721(14)60168-X
-
[17]
PAN S, LUO H, LI L, WEI Z, HUANG B. H2O and SO2 deactivation mechanism of MnOx/MWCNTs for low-temperature SCR of NOx with NH3[J]. J Mol Catal A: Chem, 2013, 377: 154-161. doi: 10.1016/j.molcata.2013.05.009
-
[18]
FANG C, ZHANG D, SHI L, GAO R, LI H, YE L. Highly dispersed CeO2 on carbon nanotubes for selective catalytic reduction of NO with NH3[J]. Catal Sci Technol, 2012, 3(3): 803-811.
-
[19]
LIU F, HE H, DING Y, ZHANG C. Effect of manganese substitution on the structure and activity of iron titanate catalyst for the selective catalytic reduction of NO with NH3[J]. Appl Catal B: Environ, 2009, 93(1): 3760-3769.
-
[20]
SUN P, GUO R T, LIU S M, WANG S X, PAN W G, LI M Y. The enhanced performance of MnOx catalyst for NH3-SCR reaction by the modification with Eu[J]. Appl Catal A: Gen, 2017, 531: 129-138. doi: 10.1016/j.apcata.2016.10.027
-
[21]
王明洪, 王亮亮, 刘俊, 费兆阳, 陈献, 汤吉海, 崔咪芬, 乔旭. 过渡金属对选择性催化还原脱硝CeO2@TiO2催化剂低温活性的促进作用[J]. 燃料化学学报, 2017,45,(4): 497-504. WANG Ming-hong, WANG Liang-liang, LIU Jun, FEI Zhao-yang, CHEN Xian, TANG Ji-hai, CUI Mi-fen, QIAO Xu. Promoting effect of transition metal on low-temperature deNOx activity of CeO2@TiO2 catalyst for selective catalytic reduction[J]. J Fuel Chem Technol, 2017, 45(4): 497-504.
-
[22]
ETTIREDDY P R, ETTIREDDY N, MAMEDOV S, BOOLCHAND P, SMIRNIOTIS P G. Surface characterization studies of TiO2 supported manganese oxide catalysts for low temperature SCR of NO with NH3[J]. Appl Catal B: Environ, 2007, 76(1/2): 123-134.
-
[23]
FANG D, XIE J, HUA H, HU Y, FENG H, FU Z. Identification of MnOx species and Mn valence states in MnOx/TiO2 catalysts for low temperature SCR[J]. Chem Eng J, 2015, 271(1): 23-30.
-
[24]
ARAKAWA K, MATSUDA S, KINOSHITA H. SO2 poisoning mechanism of NOx selective reduction catalysts[J]. Appl Surf Sci, 1997, 121/122: 382-386. doi: 10.1016/S0169-4332(97)00338-3
-
[25]
ARAMEDNDIA M A, BORAU V, JIMENEZ C. Synthesis and characterization of ZrO2 as an acid-base catalyst dehydration-dehydrogenation of propan-2-ol[J]. J Chem Soc, 1997, 93(7): 1431-1438.
-
[26]
SUN M T, HUANG B C, M J W. Morphological effects of manganese dioxide on catalytic reactions for low-temperature NH3-SCR[J]. Acta Phys Chim Sin, 2016, 32(6): 1501-1510.
-
[27]
VÉLEZ R P, ELLMERS I, HUANG H, BENTRUP U, SCHVNEMANN V, GRVNERT W. Identifying active sites for fast NH3-SCR of NO/NO2 mixtures over Fe-ZSM-5 by operando EPR and UV-vis spectroscopy[J]. J Catal, 2014, 316(3): 103-111.
-
[28]
LIU F, HE H, ZHANG C, FENG Z, ZHENG L, XIE Y. Selective catalytic reduction of NO with NH3 over iron titanate catalyst: Catalytic performance and characterization[J]. Appl Catal B: Environ, 2010, 96(3/4): 408-420.
-
[29]
LIU C, SHI J W, GAO C, NIU C M. Manganese oxide-based catalysts for low-temperature selective catalytic reduction of NOx with NH3: A review[J]. Appl Catal A: Gen, 2016, 522: 54-69. doi: 10.1016/j.apcata.2016.04.023
-
[30]
YU J, GUO F, WANG Y, ZHU J, LIU Y, SU F. Sulfur poisoning resistant mesoporous Mn-based catalyst for low-temperature SCR of NO with NH3[J]. Appl Catal B: Environ, 2010, 95(1/2): 160-168.
-
[1]
-
表 1 催化剂的物理化学性质
Table 1. Physical chemical properties of the catalysts

表 2 催化剂的表面原子浓度
Table 2. Surface atomic concentration of the catalysts

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0



 下载:
下载:








 下载:
下载:

