
Citation: HUANG Chun-jie, CHEN Shao-yun, FEI Xiao-yao, LIU Dai, CHEN Jian, ZHANG Yong-chun. Preparation of nanometer CuO-ZnO-ZrO2 catalysts through citrate-gel process and their catalytic properties for methanol synthesis from CO2[J]. Journal of Fuel Chemistry and Technology, 2016, 44(3): 375-384.

柠檬酸盐凝胶法制备纳米CuO-ZnO-ZrO2的工艺分析及CO2加氢制甲醇的性能
-
关键词:
- 柠檬酸盐凝胶法
- / CuO-ZnO-ZrO2
- / CO2催化加氢
- / 甲醇
English
Preparation of nanometer CuO-ZnO-ZrO2 catalysts through citrate-gel process and their catalytic properties for methanol synthesis from CO2
-
Key words:
- citrate-gel process
- / CuO-ZnO-ZrO2
- / CO2 catalytic hydrogenation
- / methanol
-
CO2是主要的温室气体,也是最丰富的碳资源之一。自然界中化石燃料及碳基能源燃烧都会产生CO2。近年来,这两种能源消耗量的持续增长造成了全球CO2排放量的剧增,由此引发的能源危机和温室效应日益严重[1]。甲醇是重要的化工原料,同时具有非常好的燃烧特性,已成理想的运输燃料替代品[2]。目前,主要用合成气生产甲醇,大量关于该工艺中反应机理的研究提出,甲醇有可能直接通过合成气中的CO2在催化剂表面加氢这条唯一的途径生成,同时CO通过水煤气变换反应生成CO2补充碳源[3-5]。基于在环境和能源问题上的重要意义,CO2催化加氢制甲醇技术引起了工业界和研发领域的广泛关注,是一个极具前景的碳资源循环利用过程。
目前,对CO2制甲醇的研究主要集中在催化剂方面,特别是表现出优良性能的CuO-ZnO-ZrO2(CZZ) 催化剂[4, 6]。Arena等[7]用超声辅助反向共沉淀法制备CZZ催化剂,讨论CO2加氢的反应模型;Li等[8]和Gao等[9]报道了共沉淀法制备Cu/Zn/Al/Zr催化剂具有高稳定性;Yang等[10]利用浸渍法,郭晓明等[11, 12]利用燃烧法,Shi等[13]利用浸渍燃烧法与溶胶凝胶法[14]制备了铜基催化剂,表现出良好的CO2加氢性能。然而,共沉淀法常有残留金属离子[15],或沉淀不均匀影响催化剂表面组成,并且和浸渍法都存在相分离过程,催化剂组分配比易偏离于设计值;燃烧法由于前驱体分解过程中放热剧烈,制备的催化剂比表面积较低,孔秀琴等[16]用溶胶-凝胶自燃烧法制备CuO-ZnO/Al2O3催化剂比表面积为26.4 m2/g;溶胶凝胶法则需要昂贵的金属醇盐作为原料。柠檬酸(C6H8O7) 是一种三元酸,四齿配体,可以与盐溶液中的金属自由离子形成可溶性金属螯合物,移去水分时会发生凝胶化现象形成湿凝胶,进一步干燥生成泡沫状干凝胶前驱体[17]。这一制备方法的特点是在溶液中通过分子尺度上的混合,保证均匀性;生成的复合前驱体与最终多组分产物具有完全相同的金属配比,能准确控制化学计量比。柠檬酸用作络合剂,以硝酸盐为原料制备催化剂,原料来源广泛,工艺过程简单,具有严格保持配料比例、分散度高、化学均匀性好和粒径细等特点,近年来被广泛用于复合超细氧化物粉体材料的制备[18-20]。
研究用柠檬酸凝胶法直接制备纳米CuO-ZnO-ZrO2催化剂,并将其用于CO2加氢制甲醇反应。重点研究了湿凝胶干燥时间对CuO-ZnO-ZrO2催化剂结构和催化活性的影响,与两种燃烧法制备相同配比的CuO-ZnO-ZrO2催化剂的结构和性能进行了比较分析,还考察了柠檬酸用量的影响。
1 实验部分
1.1 催化剂的制备
按CuO:ZnO:ZrO2的质量比7:2:1称取一定量的分析纯硝酸盐Cu (NO3)2·3H2O、Zn (NO3)2·6H2O和Zr (NO3)4·5H2O,加入200 mL去离子水使其溶解。在60 ℃水浴和搅拌下,将上述溶液与配制好的柠檬酸溶液(0.6 mol/L) 快速混合,持续加热搅拌得到蓝色透明的溶液。将该溶液转移至旋转蒸发器中,在60 ℃下真空蒸发脱水,得到黏度较大的湿凝胶。分别用以下三种方式对湿凝胶进行干燥处理:
鼓风干燥处理:将湿凝胶置于112 ℃干燥箱内烘干得到泡沫状的干凝胶。将此干凝胶粉碎后,在马弗炉中以1 ℃/min加热至350 ℃,焙烧4 h。按干燥时间标记催化剂为CZZ-24 h、CZZ-48 h和CZZ-72 h。
缓慢燃烧处理:将湿凝胶放在加热器上烘烤,随水分逐渐蒸发变成蓝色偏硬的干凝胶,继续加热会自发地发生蔓延性燃烧,过程持续5.0-6.0 min。燃烧结束后得到黑色固体,将固体在350 ℃下焙烧4 h。制得的催化剂记为CZZ-bake。
迅速燃烧处理:将湿凝胶转移至预热到350 ℃的马弗炉中进行烘干,凝胶因水分的快速蒸发而急速膨胀起泡,进而燃烧,同时放出大量气体。整个过程在2-5 min内完成,得到疏松的泡沫状黑色固体。燃烧结束后密闭马弗炉,将所得泡沫状黑色固体在350 ℃下焙烧4 h。制得的催化剂记为CZZ-comb。
考察柠檬酸用量的影响时采用鼓风干燥方法制备出干凝胶,按柠檬酸的用量定为化学计量比的100%、125%和150%,将所制备催化剂分别表示为:CZZ-100、CZZ-125和CZZ-150。(CZZ-100与CZZ-48 h为同一样品)。
1.2 催化剂的性能评价
催化剂的性能评价在固定床反应器(不锈钢反应管内径10 mm) 中进行。反应前催化剂先在V(H2)/V(N2)=10:90混合气中于250 ℃预处理2 h。反应条件为240 ℃,2.6 MPa,原料气组分比为V(H2)/V(CO2)=3:1,空速为3 600 h-1。反应180 min稳定后,将产物气体通入已运行稳定的气相色谱中采样分析。Porapak Q型填料柱和热导池(TCD) 用于CO2、CO和CH3OH的分离与检测。CO2的转化率由N2-内标法测算,CO和甲醇等各类含碳产物的选择性和时空产率由C-基归一法计算。为了防止产物气中的水和甲醇在反应器出口与六通阀之间的管线内冷凝,均采用加热带恒温在120 ℃左右。
1.3 催化剂的表征
采用瑞士生产的梅特勒托利多TGA/SDT851e型热重分析仪检测样品的热失重及放热性质。在空气气氛中进行实验,气体流量为100 mL/min,升温速率为10 ℃/min。在美国康塔仪器公式生产的AUTOSORB-1-MP型吸附仪上表征催化剂的BET比表面积及孔结构。测试前样品在300 ℃真空中处理2 h,吸附介质为高纯氮。在液氮冷却条件下(-196 ℃) 进行吸附/脱附实验。采用日本理学D/max-2400型X射线粉末衍射仪上对催化剂的晶相结构进行表征。采用石墨单色器,光源为Cu Kα射线,管电压40 kV,管电流100 mA,速率0.02(°)/min,5°-80°扫描,用Scherrer公式计算样品的平均晶粒粒径。在荷兰FEI公司生产的NOVA NanoSEM 450型场发射扫描电镜上观察样品的形貌。加速电压为3 kV。测试前,对样品进行喷Cr处理以改善其导电性,时间为40 s。在浙江泛泰仪器有限公司生产的FINESORB 3010型化学吸附仪上测试催化剂的还原性能,耗氢量用TCD检测。装填量为50 mg (100-200目),用Ar作载气,还原气为H2/Ar混合气(H2体积分数占10%)。气体流量均为15 mL/min,升温速率10 ℃/min。催化剂的CO2-TPD和H2-TPD检测也在同一化学吸附仪上进行,吸附质为高纯CO2或10% H2/Ar,载气分别为He或Ar。催化剂装填100 mg (100-200目),在250 ℃用10% H2/Ar预还原2 h,冷却至室温后用载气吹扫5 min。通入吸附质40 min,流量为15 mL/min。切换载气吹扫,20 min后开启程序升温至900 ℃脱附,升温速率为10 ℃/min,用TCD检测脱附产物。采用X射线光电子能谱仪(XPS,ESCALAB MK II,光源为Al Kα) 分析催化剂的表面组成及电子态。
2 结果与讨论
2.1 催化性能
在固定床反应装置上进行了CZZ催化剂温和条件下的加氢反应,含碳产物主要为甲醇和CO,反应性能见表 1。
Catalyst CO2
conversation
x/%CH3OH
selectivity
s/%WTY of CH3OH
/(g· kg-1· h-1)CZZ-24 h 22.2 27.4 78.3 CZZ-48 h 22.3 38.1 109.4 CZZ-72 h 24.5 33.5 105.6 CZZ-bake 19.9 23.9 44.4 CZZ-comb 12.9 26.8 61.3 CZZ-125 26.4 24.5 83.2 CZZ-150 27.0 23.6 81.9 reaction conditions: t=240 ℃, p=2.6 MPa, WHSV=3 600 h-1, and CO2/H2(mol ratio)=1:3 表 1 不同Cu-ZnO-ZrO2催化剂的催化性能
Table 1. Catalytic properties of different Cu-ZnO-ZrO2 catalysts对比甲醇时空收率(WTYMeOH) 时发现,湿凝胶处理方式能显著影响催化剂的性能,燃烧法制备的样品CZZ-bake和CZZ-comb的值分别为44.4和61.3 g/(kg·h),明显低于112 ℃干燥处理制备的样品,这是因为CO2转化率明显较低所致。CZZ-24 h的WTYMeOH提高到78.3 g/(kg·h),随干燥时间的延长,CZZ-48 h的WTYMeOH提高至109.4 g/(kg·h)。进一步延长干燥时间所得催化剂CZZ-72 h的活性略有升高,但甲醇选择性受到影响,从38.1%降至33.5%,最终WTYMeOH轻微降低为105.6 g/(kg·h)。增加柠檬酸用量时,CZZ-125和CZZ-150的CO2转化率提高,但同时选择性降低,甲醇活性有轻微降低,这说明柠檬酸用量增大不利于催化剂的甲醇活性。
2.2 催化剂的物化性质与结构特性
柠檬酸盐湿凝胶中的水分通过干燥过程被逐渐除去,同时在此过程中会有黄褐色的NO2气体逸出,判断其由硝酸根分解生成。干凝胶在随后的焙烧过程中会发生缓慢且温和的燃烧现象,热分解形成纳米氧化物粉体[18]。采用不同湿凝胶干燥时间和方式制备的催化剂BET比表面积见表 2。
Catalyst ABET
/(m2·g-1)v
/(cm3·g-1)CuO crystallite size
d /nmCZZ-24 h 38.7 0.20 14.9 CZZ-48 h 43.5 0.17 11.8 CZZ-72 h 39.7 0.09 12.0 CZZ-bake 15.9 0.09 23.9 CZZ-comb 16.3 0.06 16.2 表 2 不同凝胶干燥时间和方式制备CZZ催化剂的物化性质
Table 2. Physicochemical properties of calcined CZZ catalysts由表 2可知,样品CZZ-24 h、CZZ-48 h和CZZ-72 h的比表面积分别为38.7、43.5及39.7 m2/g,这表明改变干燥时间能够影响催化剂的比表面积。干燥时间较短,凝胶中硝酸根会分解不完全,在随后焙烧时遇到还原性的柠檬酸即发生剧烈的氧化还原反应,表现为爆炸性燃烧,并导致氧化物微粒喷溅,造成损失。延长干燥时间至48 h,凝胶中硝酸根残留量减少,上述喷溅现象得以减轻,焙烧过程中轻微的氧化还原反应有利于粒子间的移动,焙烧后所得催化剂具有最大的比表面积。进一步延长干燥时间至72 h时,硝酸根已充分分解,焙烧时发生的反应主要为柠檬酸络合物分解和游离柠檬酸的燃烧分解,避免了氧化还原反应的发生,所以没有微粒喷溅现象出现,但又抑制了粒子间的移动。样品CZZ-72 h的比表面积较CZZ-48 h略有降低,其原因可归结为柠檬酸燃烧和分解放热所导致的催化剂颗粒聚集(这一结果可由SEM照片佐证)。采用燃烧法处理湿凝胶过程中,水分的蒸发、凝胶的发泡和燃烧同时发生,制得的催化剂CZZ-bake和CZZ-comb的比表面积分别为15.9和16.3 m2/g,明显低于112 ℃鼓风干燥处理制备的催化剂。这一结果与其他用柠檬酸燃烧法制备铜基催化剂[13, 16]的BET比表面积数据相近。究其原因,应是采用燃烧法时,催化剂前驱体在短时间内燃烧放热,使温度迅速升高导致催化剂颗粒团聚,从而降低了比表面积。表 2中列出了采用不同湿凝胶干燥时间和方式制备的催化剂的孔容。CZZ-24 h的孔容值为最高0.20 cm3/g,随干燥时间的延长,孔容逐渐降低。这是因为焙烧过程中氧化还原反应程度和燃烧过程的不同,催化剂堆积孔道发生改变而造成的影响。CZZ-bake和CZZ-comb的孔容分别为0.09和0.06 cm3/g,都小于112 ℃鼓风干燥处理制备的催化剂孔容,这表明燃烧法对催化剂孔结构的破坏程度更高。CO2加氢反应主要发生在催化剂表面,比表面积大,孔结构丰富的催化剂上反应物与活性组分接触更充分,更有利于加氢反应。112 ℃鼓风干燥处理制备的催化剂比表面积明显大于燃烧法制备的催化剂,这必将导致其在加氢性能上具有明显优势。
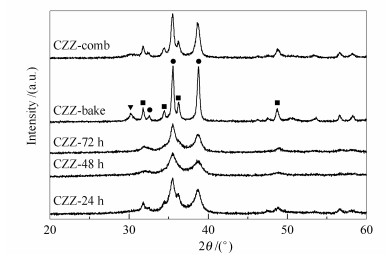
图 1为不同湿凝胶干燥时间和方式制备催化剂的XRD谱图。CuO (JCPDS 80-1268) 的特征衍射峰出现在35.6°、38.8°和48.9°处。由图 1可知,样品CZZ-24 h中CuO的衍射峰较强,CZZ-48 h的峰减弱变宽,CZZ-72 h的峰形略微变强。这说明112 ℃干燥样品48 h时,样品中活性组分CuO的晶化度最低。由图 1还可知,催化剂CZZ-bake和CZZ-comb中CuO的衍射峰变得尖锐。表 2中列出了通过Scherrer方程及CuO的衍射峰(2θ=38.8°) 计算得到的平均晶粒粒径。随干燥时间的延长,CuO晶粒粒径减小,从14.9 nm (CZZ-24 h) 减小至的11.8 nm (CZZ-48 h),样品CZZ-72 h的晶粒粒径变化不大。采用燃烧法催化剂,其中,CuO的晶粒粒径明显增大,分别达到了16.2 nm (CZZ-comb) 和23.9 nm (CZZ-bake)。该结果表明,112 ℃干燥的处理方式及延长干燥时间都有利于催化剂中活性组分CuO的分散,从而更有利于催化剂的加氢性能。34.5°和36.3°的衍射峰归属于ZnO晶相(JCPDS36-1451)。在图 1中ZnO衍射峰变化尤为明显,CZZ-24 h中只出现低强度的ZnO衍射峰,峰形宽化,CZZ-48 h和CZZ-72 h谱图里ZnO的衍射峰没有出现,说明其已分散在催化剂中。燃烧法制备的样品都出现明显的ZnO衍射峰,其中,样品CZZ-bake的峰形最为尖锐,表明燃烧法制备的催化剂ZnO分散度较差。四方晶相ZrO2(t-ZrO2) 的衍射峰(30.3°) 只在CZZ-bake样品中出现,表明该样品中ZrO2分散的较差。XRD结果表明,燃烧法制备的催化剂晶体颗粒更大,不利于组分间的分散与相互接触,影响了活性组分Cu与氧化物的协同效应,是其催化CO2加氢性能较低的主要原因。
2.3 催化剂的形貌
图 2为催化剂的SEM照片。经过不同干燥方式处理所得的催化剂,其颗粒形貌以球形为主。样品CZZ-24 h (图 2(a)) 表面分散着大小均匀的颗粒,有团聚现象出现,并含有丰富的堆积孔道。CZZ-48 h样品中颗粒粒径均匀,边界清晰,团聚现象减轻。CZZ-72 h中没有大颗团聚体,但小颗粒互相之间发生聚集,间隙变小。样品CZZ-bake有明显团聚现象,颗粒长大,相互接触边界消失发生烧结。CZZ-comb催化剂既存在由快速燃烧过程喷溅而成的分散小颗粒,也有轻微团聚的大颗粒。催化剂颗粒的变化趋势说明缓慢燃烧法制备的催化剂时,柠檬酸分解缓慢,热量未能及时放出,不利于组分间的移动而更易团聚烧结;快速燃烧法制备过程燃烧剧烈,粒子间移动频繁,最终催化剂CZZ-comb颗粒更分散;112 ℃干燥处理制备催化剂时,金属柠檬酸络合物在发泡过程中已形成分散的结构,所以最终制得的催化剂团聚现象较轻,利于组分间均匀分散,相互接触更多,在反应过程中Cu与氧化物的协同效应更强,有利于CO2加氢反应。其中,干燥时间为48 h时催化剂的颗粒具有最佳的分散性,这也是CZZ-48 h比表面积最大的原因。
2.4 催化剂的还原性能
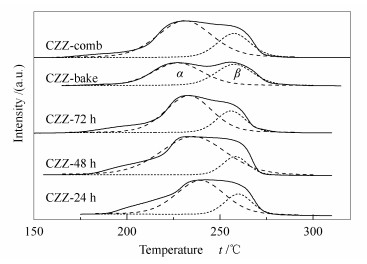
不同湿凝胶干燥时间和方式制备催化剂的H2-TPR谱图见图 3。测试样品均在175-280 ℃出现一个宽峰,峰形不对称,有明显的尖峰或拖尾,表明整个还原过程包含了几个不同的还原阶段。分峰处理该还原峰后得到两个Gauss峰(α峰和β峰)。表 3为还原峰的峰温(tα和tβ) 和α峰在总的还原峰中所占面积的比例。低温峰(α峰) 归属于高分散CuO的还原过程。这部分CuO与ZnO和ZrO2之间存在一定的相互作用[21]。高温峰(β峰) 则由于体相CuO的还原产生[22]。
 表 3
催化剂的还原峰温度及还原峰在H2-TPR谱图中所占的面积比例
Table 3.
Temperatures of reduction peaks and their contributions to the H2-TPR profiles over catalysts
表 3
催化剂的还原峰温度及还原峰在H2-TPR谱图中所占的面积比例
Table 3.
Temperatures of reduction peaks and their contributions to the H2-TPR profiles over catalysts
Catalyst tα /℃ tβ /℃ Aα/(Aα+Aβ) /% CZZ-24 h 238 257 72 CZZ-48 h 235 257 75 CZZ-72 h 232 257 73 CZZ-bake 226 257 59 CZZ-comb 230 257 74 Aα and Aβ represent the areas of α and β peaks,respectively 表 3 催化剂的还原峰温度及还原峰在H2-TPR谱图中所占的面积比例
Table 3. Temperatures of reduction peaks and their contributions to the H2-TPR profiles over catalysts由表 3可知,112 ℃干燥处理的样品中,随干燥时间的延长tα的值在238-232 ℃呈轻微下降趋势,说明干燥时间越长样品中的CuO越容易被还原。α峰面积占的比例均高于β峰,说明样品中大部分的CuO以高分散的形式存在,CZZ-48 h的α峰面积比值最大。对于CZZ-comb,由于燃烧过程较为剧烈,可以溅出细的微粒,这些微粒中的CuO更易被还原,故其tα值(230 ℃) 低于112 ℃干燥处理的样品。CZZ-bake的α峰面积占的比例最低,高分散的CuO含量最低,tα值为226 ℃,也明显低于其他样品,这是因为该样品中组分各自长成晶体(由XRD结果可知),导致仅有的少部分高分散的CuO与另两种组分间的相互作用较弱,所以还原温度向低温区移动。同时,因CZZ-bake中CuO未被有效分散,烧结严重,可能导致部分体相深处的CuO无法被还原,所以出现CZZ-bake中可被还原物相组成的量较其他样品明显偏少。所有样品的tβ都处于257 ℃,说明这一系列催化剂体相CuO的还原性能是一样的。不同干燥方式制备的催化剂的还原性能有明显差异,与112 ℃干燥处理的样品比较,燃烧法制备的样品中Cu与氧化物之间的相互作用较弱,催化剂反应性能较差。关联H2-TPR与性能评价结果发现活性组分与氧化物之间的相互作用能影响催化剂的加氢性能:相互作用弱,CuO易被还原,但还原后的催化剂加氢性能较低;相互作用太强也不利于催化性能。CZZ-48 h中高分散CuO含量最高,CuO与其他组分相互作用适中,所以具有最佳的甲醇活性。
2.5 H2-TPD表征
研究表明,H2的吸附性能是影响铜基催化剂催化性能的重要因素[21]。图 4为预还原后不同催化剂的H2-TPD谱图。
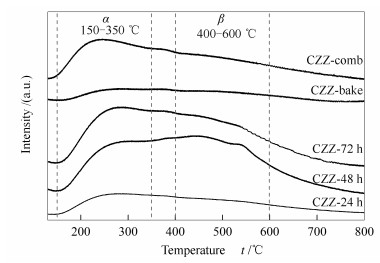
图 4中所有样品在测试温度范围内均出现两个H2的脱附峰α和β,表明催化剂表面存在两种强度的H2吸附位:弱吸附(150-350 ℃) 和解离吸附(400-600 ℃)[23]。CZZ-48 h与CZZ-72 h具有相似的,大峰包状的脱附峰,峰面积明显大于CZZ-24 h,这说明随干燥时间的延长,吸附于催化剂表面的H2的量明显增加,意味着催化剂对H2的吸附活化作用较强,因此,催化性能也相应较高。对比α脱附峰可知,CZZ-comb上H2具有有效的吸附,而CZZ-bake吸附量较小。比较β峰峰形可知,CZZ-24 h、CZZ-bake和CZZ-comb的β峰不明显,而CZZ-48 h与CZZ-72 h出现明显的β脱附峰,其中,CZZ-48 h谱图中峰高最高,面积最大,说明112 ℃干燥48 h制备的催化剂对H2的解离吸附能力最强。值得注意的是,样品CZZ-bake曲线中的α峰和β峰均较平,是因为样品中组分各自成晶(由XRD结果可知),不够分散,严重降低了催化剂表面对H2的吸附能力,催化反应性能也较差。
2.6 CO2-TPD表征
利用CO2-TPD表征催化剂表面碱性位的浓度和强度,结果见图 5。
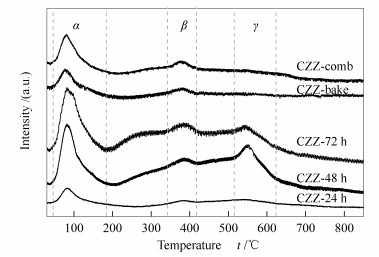
由图 5可知,所有样品主要的脱附峰(α) 都出现在100 ℃左右,归属于CO2的弱吸附,为催化剂表面的弱碱位。340-410 ℃的脱附峰(β) 为中强碱位[24],510-620 ℃的高温脱附峰(γ) 对应的是强碱位。α峰和β峰对应的表面碱性位对CO2的吸附有利于催化剂的加氢反应性能[21]。γ峰对应的强碱位上,CO2的脱附温度明显高于甲醇合成时的反应温度,意味着这部分CO2很难脱附,基本不参加反应[21]。样品CZZ-48 h与CZZ-72 h谱图差别较小,总的峰面积明显高于其他样品,说明其有更大的CO2吸附量,同时这两种催化剂α脱附峰面积也明显比其他样品的大。Arena等[25]提出CO2主要在催化剂的表面氧化物如ZnO、ZrO2上吸附和活化,之后在Cu (还原态) 上加氢生成甲醇,这就要求Cu与氧化物之间高度均匀地接触,所以催化剂的CO2吸附活化性能与比表面积和各组分的分散度有关,即组分相同的催化剂,比表面积越大,组分更分散,活性吸附位就越多,CO2吸附性能更好。112 ℃干燥处理得到的催化剂CZZ-48 h与CZZ-72 h具有优良的结构特性,从而表现出更高的CO2加氢制甲醇性能。与燃烧法制备的CZZ-comb和CZZ-bake相比,样品CZZ-24 h的CO2脱附量虽然较低,但其中的活性组分CuO更分散,与ZnO、ZrO2之间高度均匀地接触,协同作用更强,有利于在反应条件下催化剂表面吸附活化后的CO2进一步加氢生成甲醇,所以在性能评价实验中体现出更高的活性。
2.7 不同柠檬酸用量制备的催化剂前驱体TG-DTG表征
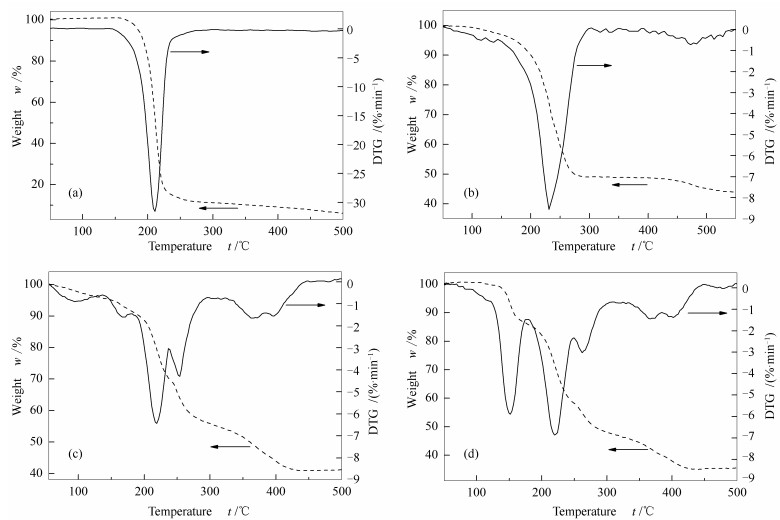
图 6为无水柠檬酸与不同柠檬酸用量干凝胶(前驱体) 的TG-DTG曲线,不同柠檬酸用量制备的干凝胶失重行为存在明显差异。由图 6(a)可知,柠檬酸从150 ℃开始分解,至240 ℃分解完成,在DTG曲线上此分解峰位于210 ℃,失重85%。图 6(b)显示,CZZ-100前驱体受热时,从110 ℃开始缓慢失重,对应着少量的水分蒸发,150-280 ℃失重较快,最终失重率为55%。与柠檬酸相比, DTG曲线上的峰值温度升高,位于240 ℃。表明纯柠檬酸与前驱体的受热分解不同,后者在更高的温度下进行,这是由前驱体中金属离子与柠檬酸根之间的络合作用引起的[26]。图 6(c)和图 6(d)列出的分别是CZZ-125和CZZ-150的TG-DTG曲线。热分解过程均从130 ℃开始,到450 ℃结束,分四个阶段。170 ℃之前主要是干凝胶脱水,催化剂有约10%的失重;200-240 ℃失重明显加速,125-CZZ失重30%,CZZ-150中由于含更多的柠檬酸,所以失重较高,达40%。这一阶段对应着柠檬酸与硝酸根之间发生燃烧放热使得温度升高以及剩余柠檬酸的分解[27],故而迅速失重。240-300 ℃的失重过程并未放缓,出现一个小的放热峰,应为剩余柠檬酸金属络合物的分解。样品CZZ-125和CZZ-150在330-450 ℃有一缓慢失重放热过程,对应的是有机残留物的热解,最终失重率分别为60%和65%。对比上述结果说明,金属-柠檬酸络合物在空气中受热时,由于柠檬酸用量的不同,经历的燃烧和热解过程有所区别。柠檬酸量等于化学计量比时,前驱体中金属均匀并稳定地以柠檬酸络合物形式存在,燃烧分解很快完成,350 ℃焙烧后没有有机物残留。以络合物或游离形式存在的柠檬酸如果过量,柠檬酸金属络合物不够均匀,焙烧时没有在同一过程中分解,过量的柠檬酸分解也会放出更多的热量。这都将影响催化剂中各组分的分散情况(由2.8 XRD结果可以佐证),降低活性组分与氧化物的协同作用,所以CZZ-125和CZZ-150虽然具有较高的CO2转化率,但其甲醇选择性明显低于CZZ-100。此外,在350 ℃焙烧后,CZZ-125和CZZ-150中可能有未充分分解的有机残留物。
2.8 不同柠檬酸用量制备的催化剂XRD表征
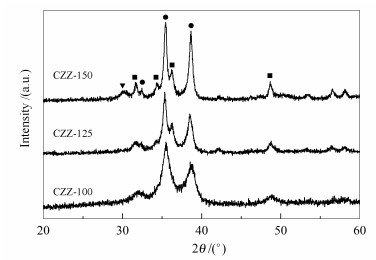
不同柠檬酸用量的催化剂XRD谱图见图 7。
由图 7可知,CZZ-100中CuO的特征衍射峰最为宽化,未出现ZnO与ZrO2的特征衍射峰,证明该样品中组分分散最好。样品CZZ-125和CZZ-150中的CuO峰逐渐变尖锐,开始出现ZnO的特征衍射峰,ZrO2只在CZZ-150中出现。表明随柠檬酸用量的增加,样品分散度逐渐下降,由热重结果可知,这是由于过量的柠檬酸分解放热导致组分烧结所致。过量的柠檬酸不利于组分间的分散与充分接触,势必导致催化剂加氢性能有所下降。
2.9 不同柠檬酸用量制备的催化剂XPS表征
表 4为使用不同柠檬酸用量制得的三种催化剂表面Cu、Zn、C和O的组成比例。
 表 4
不同柠檬酸用量制备CuO-ZnO-ZrO2的XPS数据
Table 4.
Surface concentrations of CZZ catalysts prepared from different amounts of citric acid
表 4
不同柠檬酸用量制备CuO-ZnO-ZrO2的XPS数据
Table 4.
Surface concentrations of CZZ catalysts prepared from different amounts of citric acid
Catalyst Surface concentrations wat/% Cu 2p Zn 2p Zr 3d C 1s O 1s CZZ-100 19.6 11.9 6.0 0 62.6 CZZ-125 17.1 10.3 4.1 15.2 53.3 CZZ-150 16.2 9.0 4.1 13.3 57.5 表 4 不同柠檬酸用量制备CuO-ZnO-ZrO2的XPS数据
Table 4. Surface concentrations of CZZ catalysts prepared from different amounts of citric acid随柠檬酸用量的增加,三种金属在表面的含量都有轻微的降低。CZZ-100的表面碳含量为0,CZZ-125和CZZ-150的表面分别有15.2%和13.3%的含碳量。该结果与热重分析所得结果相一致,柠檬酸用量大于化学计量比时,催化剂表面会有少量未分解的有机物残留,焙烧后以无定型碳的形式覆盖在活性组分表面;而在使用等化学计量比时,焙烧过程有机物被分解完全,这使得所得催化剂表面的金属活性成分能够充分暴露出来,所以具有最佳的CO2加氢制甲醇性能。
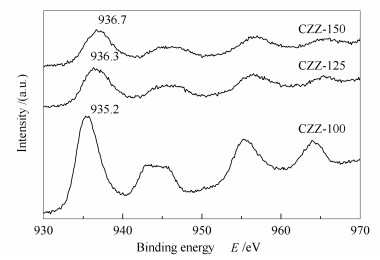
图 8为CZZ-100、CZZ-125和CZZ-150催化剂的Cu 2p的XPS谱图。
由图 8可知,三种催化剂中高位端940-947 eV有强卫星伴峰出现,这表明铜在催化剂表面以Cu2+形式存在[28, 29]。催化剂CZZ-125与CZZ-150中Cu 2p3/2的结合能分别为936.3和936.7 eV,明显高于CZZ-100中的935.2 eV,这说明焙烧过程中不同柠檬酸用量造成催化剂铜物种的能量状态和所处化学环境不同,导致其还原后催化性能也不同。
3 结论
柠檬酸盐凝胶法是成本低廉、简单高效的制备纳米CuO-ZnO-ZrO2催化剂的方法。湿凝胶干燥时间、干燥方式及柠檬酸用量的不同,都会对催化剂结构和CO2加氢制甲醇性能造成影响。研究发现,与燃烧法相比,采用常规干燥方式,延长凝胶干燥时间能防止催化剂焙烧时发生喷溅,更有利于催化剂中各组分的分散,可以制备出BET比表面积大的催化剂,同时具有更优良的CO2及H2的吸附活化表面性质,在加氢反应中体现出高活性。用柠檬酸盐凝胶法制备CZZ催化剂时,柠檬酸用量等于化学计量比时催化剂的性能最佳,柠檬酸过量会造成分解残留覆盖在表面活性物种而不利于CO2加氢反应。
-
-
[1]
OLAH G A, PRAKASH G K S, GOEPPERT A. Anthropogenic chemical carbon cycle for a sustainable future[J]. J Am Chem Soc, 2011, 133(33): 12881-12898. doi: 10.1021/ja202642y
-
[2]
OLAH G A. Towards oil independence through renewable methanol chemistry[J]. AngewChemInt Ed, 2013, 52(1): 104-107.
-
[3]
MEITZNER G, IGLESIA E. New insights into methanol synthesis catalysts from X-ray absorption spectroscopy[J]. Catal Today, 1999, 53(3): 433-441. doi: 10.1016/S0920-5861(99)00135-2
-
[4]
丛昱, 包信和, 张涛, 孙孝英, 梁东白, 田金忠, 黄宁表. 超细Cu-ZnO-ZrO2催化剂上甲醇合成的TPSR和TPD研究[J]. 燃料化学学报, 2000,28,(3): 238-243. CONG Yu, BAO Xin-he, ZHANG Tao, SUN Xiao-ying, LIANG Dong-bai, TIAN Jin-zhong, HUANG Ning-biao. TPSR and TPD studies of ultrafine Cu-ZnO-ZrO2 catalysts for methanol synthesis[J]. J Fuel Chem Technol, 2000, 28(3): 238-243.
-
[5]
SUN Q, LIU C W, PAN W, ZHU Q M, DENG J F. In situ IR studies on the mechanism of methanol synthesis over an ultrafine Cu/ZnO/Al2O3 catalyst[J]. ApplCatal A: Gen, 1998, 171: 301-308.
-
[6]
丛昱, 田金忠, 黄宁表, 徐长海, 张涛, 孙孝英, 关文, 梁东白. 超细Cu-ZnO-ZrO2催化剂的制备及其催化CO2加氢合成甲醇的性能[J]. 催化学报, 2000,21,(3): 247-250. CONG Yu, TIAN Jin-zhong, HUANG Ning-biao, XU Zhang-hai, ZHANG Tao, SUN Xiao-ying, GUAN Wen, LIANG Dong-bai. Preparation of ultrafine Cu-ZnO-ZrO2catalysts and CO2 hydrogenation performance[J]. Chin J Catal, 2000, 21(3): 247-250.
-
[7]
ARENA F, BARBERA K, ITALIANO G, BONURAG , SPADARO L, FRUSTERI F. Synthesis, characterization and activity pattern of Cu-ZnO/ZrO2 catalystsin the hydrogenation of carbon dioxide to methanol[J]. J Catal, 2007, 249(2): 185-194. doi: 10.1016/j.jcat.2007.04.003
-
[8]
LI C M, YUAN X D, FUJIMOTO K. Development of highly stable catalyst for methanol synthesis from carbon dioxide[J]. Appl Catal A: Gen, 2014, 469: 306-311. doi: 10.1016/j.apcata.2013.10.010
-
[9]
GAO P, LI F, XIAO F K, ZHAO N, WEI W, ZHONG L S, SUN Y H. Effect of hydrotalcite-containing precursors on the performance of Cu/Zn/Al/Zr catalysts for CO2 hydrogenation: Introduction of Cu2+ at different formation stages of precursors[J]. Catal Today, 2012, 194(1): 9-15. doi: 10.1016/j.cattod.2012.06.012
-
[10]
YANG R Q, YU X C, ZHANG Y, LI W Z, TSUBAKI N. A new method of low-temperature methanol synthesis on Cu/ZnO/Al2O3 catalysts from CO/CO2/H2[J]. Fuel, 2008, 87(4/5): 443-450.
-
[11]
GUO X M, MAO D S, WANG S, WU G S, LU G Z. Combustion synthesis of CuO-ZnO-ZrO2 catalysts for the hydrogenation of carbon dioxide to methanol[J]. Catal Commun, 2009, 10(13): 1661-1664. doi: 10.1016/j.catcom.2009.05.004
-
[12]
郭晓明, 毛东森, 卢冠忠, 王嵩. CuO-ZnO-ZrO2的柠檬酸燃烧法制备及其催化CO2加氢合成甲醇的性能[J]. 物理化学学报, 2012,28,(1): 170-176. GUO Xiao-ming, MAO Dong-sen, LU Guan-zhong, WANG Song. Preparation of CuO-ZnO-ZrO2 by citric acid combustion method and its catalytic property for methanol synthesis from CO2 hydrogenation[J]. Acta Phys-Chem Sin, 2012, 28(1): 170-176.
-
[13]
SHI L, YANG R Q, TAO K, YONEYAMA Y, TAN Y S, TSUBAKI N. Surface impregnation combustion method to prepare nanostructured metallic catalysts without further reduction: As-burnt Cu-ZnO/SiO2 catalyst for low-temperature methanol synthesis[J]. Catal Today, 2012, 185(1): 54-60. doi: 10.1016/j.cattod.2011.10.015
-
[14]
朱毅青, 文艺, 赖梨芳, 宗封琦, 王剑. 超细CuO/ZnO/TiO2-SiO2的表征和CO2加氢合成甲醇性能研究[J]. 燃料化学学报, 2004,32,(4): 486-491. ZHU Yi-qing, WEN Yi, LAI Li-fang, ZONG Feng-qi, WANG Jian. Characterization and catalytic activity evaluation of ultrafine CuO/ZnO/TiO2-SiO2 catalysts for CO2 hydrogenation to methanol[J]. J Fuel Chem Technol, 2004, 32(4): 486-491.
-
[15]
JUN K W, SHEN W J, RAO KS R, LEE K W. Residual sodium effect on the catalytic activity of Cu/ZnO/Al2O3 in methanol synthesis from CO2 hydrogenation[J]. Appl Catal A: Gen, 1998, 174: 231-238. doi: 10.1016/S0926-860X(98)00195-1
-
[16]
孔秀琴, 唐兴江, 许珊, 王晓来. 溶胶-凝胶自燃烧法制备的CuO-ZnO/Al2O3及催化二氧化碳加氢制甲醇的性能研究[J]. 分子催化, 2013,27,(2): 159-165. KONG Xiu-qin, TANG Xing-jiang, XU Shan, WANG Xiao-lai. Preparation of CuO-ZnO/Al2O3 by sol-gel auto-combustion method and its catalytic property for methanol synthesis from CO2 hydrogenation[J]. J Mol Catal, 2013, 27(2): 159-165.
-
[17]
林建新, 王自庆, 张留明, 倪军, 王榕, 魏可镁. 柠檬酸络合法制备Ba促进ZrO2负载Ru催化剂上氨合成反应性能[J]. 催化学报, 2012,33,(7): 1075-1079. LIN Jian-xin, WANG Zi-qing, ZHANG Liu-ming, NI Jun, WANG Rong, WEI Ke-mei. Ammonia synthesis over ruthenium catalysts using barium-doped zirconia as supports prepared by citric acid method[J]. Chin J Catal, 2012, 33(7): 1075-1079.
-
[18]
景茂祥, 沈湘黔, 沈裕军. 柠檬酸盐凝胶法制备纳米氧化镍的研究[J]. 无机材料学报, 2004,19,(2): 289-294. JING Mao-xiang, SHEN Xiang-qian, SHEN Yu-jun. Preparation of nanometer nickel oxide by the citrate-gel process[J]. J Inorg Mater, 2004, 19(2): 289-294.
-
[19]
BONURA G, CORDARO M, CANNILLA C, ARENA F, FRUSTERI F. The changing nature of the active site of Cu-Zn-Zr catalysts for the CO2 hydrogenation reaction to methanol[J]. Appl Catal B: Environ, 2014, 52-153: 152-161.
-
[20]
KARELOVIC A, BARGIBANT A, FERNÁNDEZ C, RUIZ P. Effect of the structural and morphological properties of Cu/ZnO catalysts prepared by citrate method on their activity toward methanol synthesis from CO2 and H2 under mild reaction conditions[J]. Catal Today, 2012, 197(1): 109-118. doi: 10.1016/j.cattod.2012.07.029
-
[21]
张鲁湘, 张永春, 陈绍云. 助剂TiO2对CO2催化加氢制甲醇催化剂CuO-ZnO-Al2O3性能的影响[J]. 燃料化学学报, 2011,39,(12): 912-917. doi: 10.1016/S1872-5813(12)60002-4ZHANG Lu-xiang, ZHANG Yong-chun, CHEN Shao-yun. Effect of promoter TiO2 on the performance of CuO-ZnO-Al2O3 catalyst for CO2 catalytic hydrogenation to methanol[J]. J Fuel Chem Technol, 2011, 39(12): 912-917. doi: 10.1016/S1872-5813(12)60002-4
-
[22]
ZHANG Y P, FEI J H, YU Y M, ZHENG X M. Methanol synthesis from CO2 hydrogenation over Cu based catalyst supported on zirconia modified Al2O3[J]. Energy Convers Manage, 2006, 47(18/19): 3360-3367.
-
[23]
DONG X, ZHANG H B, LIN G D, YUAN Y Z, TSAI K R. Highly active CNT-promoted Cu-ZnO-Al2O3 catalyst for methanol synthesis from H2/CO/CO2[J]. Catal Lett, 2003, 85(3): 237-246.
-
[24]
李基涛, 张伟德, 陈明旦, 区泽棠. 铜基催化剂上CO2吸附的TPD和TPSR研究[J]. 天然气化工, 1998,23,(5): 14-17. LI Ji-tao, ZHANG Wei-de, CHEN Ming-dan, QU Ze-tang. TPD and TPSR study of CO2 adsorption on Cu-based catalysts[J]. J Nat Gas Chem, 1998, 23(5): 14-17.
-
[25]
ARENA F, ITALIANO G, BARBERA K, BORDIGA S, BONURA G, SPADARO L, FRUSTERI F. Solid-state interactions, adsorption sites and functionality of Cu-ZnO/ZrO2 catalysts in the CO2 hydrogenation to CH3OH[J]. Appl Catal A: Gen, 2008, 350: 16-23. doi: 10.1016/j.apcata.2008.07.028
-
[26]
庄豪仁, 李承恩, 殷之文. PLZT柠檬酸盐前驱体的热分解[J]. 无机材料学报, 1988,3,(1): 27-31. ZHUANG Hao-ren, LI Cheng-en, YIN Zhi-wen. Pyrolysis of PLZT citrate precursor[J]. J Inorg Mater, 1988, 3(1): 27-31.
-
[27]
SHI L, ZENG C Y, JIN Y Z, WANG T J, TSUBAKI N. A sol-gel auto-combustion method to prepare Cu/ZnO catalysts for low-temperature methanol synthesis[J]. Catal Sci Technol, 2012, 2: 2569-2577. doi: 10.1039/c2cy20423a
-
[28]
徐征, 毛利群, 千载虎, 盛世善, 熊国兴. CO2加氢低压合成甲醇催化剂CuO/ZnO/ZrO2的光电子能谱研究[J]. 燃料化学学报, 1992,20,(3): 272-277. XU Zheng, MAO Li-qun, QIAN Zai-hu, SHENG Shi-shan, XIONG Guo-xing. Photoelectron spectroscopic study of CuO/ZnO/ZrO2 catalyst in low pressure methanol synthesis from CO2 and H2[J]. J Fuel Chem Technol, 1992, 20(3): 272-277.
-
[29]
BIESINGER M C, LAU L W M, GERSON A R, SMART R S C. Resolving surface chemical states in XPS analysis of first row transition metals, oxides and hydroxides: Sc, Ti, V, Cu and Zn[J]. Appl Surf Sci, 2010, 257(3): 887-898. doi: 10.1016/j.apsusc.2010.07.086
-
[1]
-
表 1 不同Cu-ZnO-ZrO2催化剂的催化性能
Table 1. Catalytic properties of different Cu-ZnO-ZrO2 catalysts
Catalyst CO2
conversation
x/%CH3OH
selectivity
s/%WTY of CH3OH
/(g· kg-1· h-1)CZZ-24 h 22.2 27.4 78.3 CZZ-48 h 22.3 38.1 109.4 CZZ-72 h 24.5 33.5 105.6 CZZ-bake 19.9 23.9 44.4 CZZ-comb 12.9 26.8 61.3 CZZ-125 26.4 24.5 83.2 CZZ-150 27.0 23.6 81.9 reaction conditions: t=240 ℃, p=2.6 MPa, WHSV=3 600 h-1, and CO2/H2(mol ratio)=1:3 表 2 不同凝胶干燥时间和方式制备CZZ催化剂的物化性质
Table 2. Physicochemical properties of calcined CZZ catalysts
Catalyst ABET
/(m2·g-1)v
/(cm3·g-1)CuO crystallite size
d /nmCZZ-24 h 38.7 0.20 14.9 CZZ-48 h 43.5 0.17 11.8 CZZ-72 h 39.7 0.09 12.0 CZZ-bake 15.9 0.09 23.9 CZZ-comb 16.3 0.06 16.2 表 3 催化剂的还原峰温度及还原峰在H2-TPR谱图中所占的面积比例
Table 3. Temperatures of reduction peaks and their contributions to the H2-TPR profiles over catalysts
Catalyst tα /℃ tβ /℃ Aα/(Aα+Aβ) /% CZZ-24 h 238 257 72 CZZ-48 h 235 257 75 CZZ-72 h 232 257 73 CZZ-bake 226 257 59 CZZ-comb 230 257 74 Aα and Aβ represent the areas of α and β peaks,respectively 表 4 不同柠檬酸用量制备CuO-ZnO-ZrO2的XPS数据
Table 4. Surface concentrations of CZZ catalysts prepared from different amounts of citric acid
Catalyst Surface concentrations wat/% Cu 2p Zn 2p Zr 3d C 1s O 1s CZZ-100 19.6 11.9 6.0 0 62.6 CZZ-125 17.1 10.3 4.1 15.2 53.3 CZZ-150 16.2 9.0 4.1 13.3 57.5 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 0
- HTML全文浏览量: 0



 下载:
下载:







 下载:
下载:

