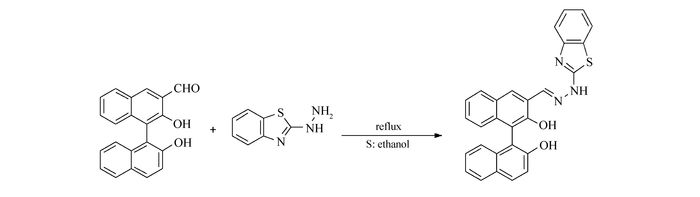
 Scheme1.
Synthetic route of probe 1
Scheme1.
Synthetic route of probe 1

Citation: LIU Chuantao, XIAO Ting, WANG Fang, CHEN Xiaoqiang. Synthesis of Binol-based Fluorescence Probe and Recognition of Arginine[J]. Chinese Journal of Applied Chemistry, 2018, 35(1): 40-45. doi: 10.11944/j.issn.1000-0518.2018.01.170317

一种基于联萘衍生物荧光探针的合成及其对精氨酸的识别
English
Synthesis of Binol-based Fluorescence Probe and Recognition of Arginine
-
Key words:
- binaphthol
- / fluorescence probe
- / arginine
- / chirality
-
氨基酸是生命体的基本物质,在人体健康、疾病诊断方面具有重要作用。近年来,检测氨基酸的方法受到广泛关注[1-2]。精氨酸在人体中作为非必需氨基酸,在细胞分裂中起重要作用,能促进伤口的愈合和人体胶原组织的合成[3-5]。精氨酸还具有能够调节免疫功能的作用,能够有效地防止胸腺的退化,一旦缺乏精氨酸,人体内的氮便会失去维持人体机能正常的生理功能,从而导致了人体体内的血氨升高[6-7]。此外,精氨酸还被用作治疗内分泌疾病的药物[8]。
目前,检测氨基酸的方法有很多种,传统的检测方法包括高效液相色谱、气相色谱、离子交换色谱和电化学方法等,这些方法的不足之处在于仪器设备昂贵、操作繁琐、灵敏度低。相对来说,荧光探针技术因具有高选择性、高灵敏度、低检测限、操作简单等优点备受关注[9-17]。因此,利用荧光探针来定性与定量检测精氨酸是一种值得推广的方法。
近年来,关于检测氨基酸荧光探针的研究已有一些报道,其中反应型探针有多种类型,例如,迈克尔加成反应、与醛基的环化加成反应和二硫键断裂[18-22]。联萘作为轴手性荧光基团不仅具有较长的发射波长,而且其本身具有手性碳原子,表现出良好的可检测性,适合生物样本的检测[22-25]。本文利用联萘衍生物作为荧光母体,通过在醛基上引入2-肼基苯并噻唑,制备荧光探针3-(2-(2-苯丙噻唑基)亚肼基甲基)-1, 1′-联萘基-2,2′-二酚(1),并考察了该探针在检测精氨酸时其手性结构和荧光性能的变化。
1 实验部分
1.1 试剂和仪器
(R)-2, 2′-二羟基-[1, 1′-联萘]-3-醛(≥98%)购于大赛璐药物手性技术有限公司);2-肼基苯并噻唑(≥99%)购于梯希爱化成工业发展有限公司;无水乙醇(≥99.7%)购于国药集团化学试剂有限公司)。所有实验中使用的水均为去离子水。
Bruker AM 400MHZ型核磁共振谱仪(NMR, 德国布鲁克公司);6530型质谱仪(安捷伦科技有限公司);α-1860型紫外可见光谱仪(UV-Vis,上海谱元公司);RF-5301/PC型荧光分光光度计(日本岛津公司);J-1500型JASCO圆二色光谱仪(CD, 日本分光株式会社)。
1.2 探针1的合成
探针1的合成路线见Scheme 1,具体的实验步骤为:在100 mL单口烧瓶中,加入100 mg (R)-2, 2′-二羟基-[1, 1′-联萘]-3-醛、70 mg 2-肼基苯并噻唑,溶解于60 mL的无水乙醇中,在N2气保护的条件下,80 ℃,回流,反应过夜,出现沉淀,过滤,收集产物。产物经无水乙醇反复冲洗后,得到淡黄色固体90 mg,产率约60%。1H NMR(400 MHz, DMSO), δ:9.37(s, 1H), 8.24(s, 1H), 7.95(t, J=8.04 Hz, 2H), 7.89(d, J=9.08 Hz, 2H), 7.36(d, J=8.88 Hz, 2H), 7.31(d, J=5.84 Hz, 2H), 7.26(d, J=6.82 Hz, 4H), 7.20(d, J=6.94 Hz, 2H), 6.98(d, J=7.22 Hz, 3H); 13C NMR(100 MHz, DMSO), δ:153.52, 134.62, 134.41, 129.42, 129.02, 128.59, 128.40, 128.20, 127.94, 126.58, 124.85, 124.65, 123.81, 122.87, 122.25, 121.33, 119.02, 117.32;HRMS(ESI)计算值C28H19N3O2S [M + H]+:462.1198,实测值:462.1224(图S1、S2、S3)。
2 结果与讨论
2.1 探针1对精氨酸的紫外可见吸收光谱响应
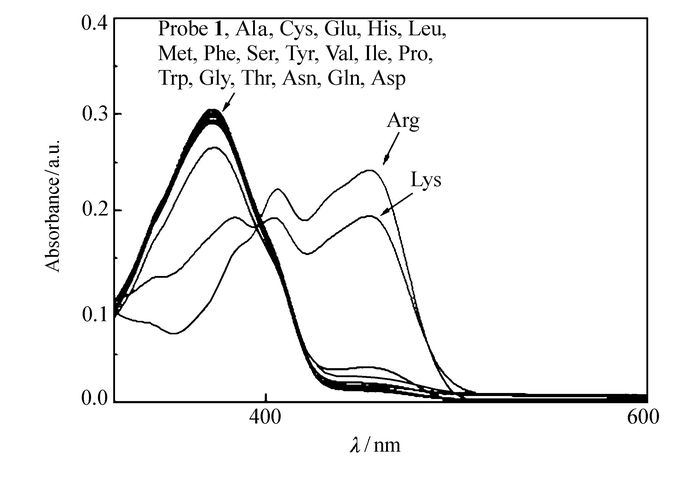
如图 1所示,在紫外可见吸收光谱中,10 μmol/L探针1的二甲基亚砜(DMSO)溶液中,在372 nm处表现出一个主要吸收峰。当加入镁离子配合后,在精氨酸存在的情况下,在406 nm及455 nm处出现两个新的吸收点,原372 nm处的吸收点消失,这表示体系逐渐生成了新的配合产物。由于406 nm及455 nm两处新的吸收点的出现,肉眼可明显观察到溶液体系的颜色由淡黄色逐渐变为浅绿色(见辅助材料图S4)。除赖氨酸有少许干扰外其它18种氨基酸如谷氨酸(Glu)、丙氨酸(Ala)、亮氨酸(Leu)、异亮氨酸(Ile)、脯氨酸(Pro)、苯丙氨酸(Phe)、丝氨酸(Ser)、苏氨酸(Thr)、酪氨酸(Tyr)、酪氨酸(Cys)、组氨酸(His)、蛋氨酸(Met)、缬氨酸(Val)、色氨酸(Trp)、甘氨酸(Gly)、苏氨酸(Thr)、天冬酰胺(Asn)和谷氨酰胺(Gln)等均无响应。从而实现了对精氨酸选择性的直接观察。
2.2 探针1对精氨酸的荧光光谱响应
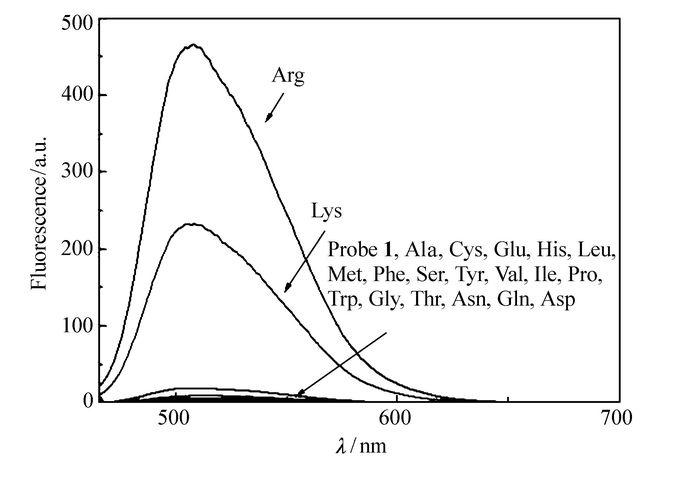
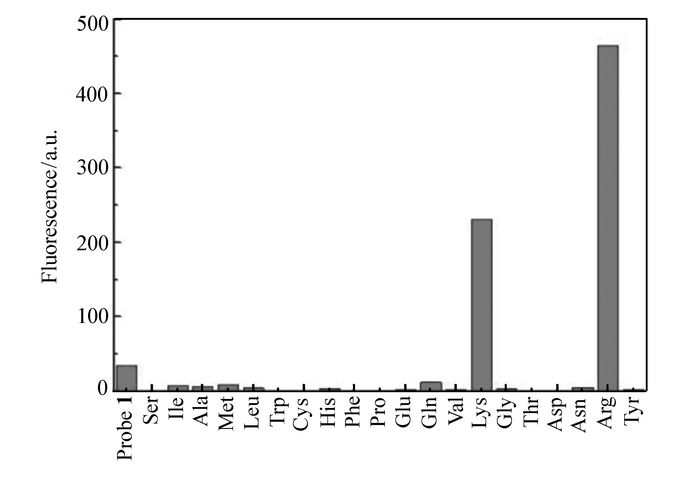
如图 2所示,探针1的DMSO溶液无荧光,当加入镁离子配合后,随着精氨酸的加入,在507 nm处表现出明显的荧光增强。其最大发射波长强度增大400余倍。除赖氨酸有少许干扰外,其它18种人体常用氨基酸均无明显变化。图 3为507 nm处各离子吸收强度的柱状图。由此柱状图明显看出,探针1加入镁离子后对精氨酸具有高度选择性。
2.3 探针1对精氨酸的圆二色光谱响应
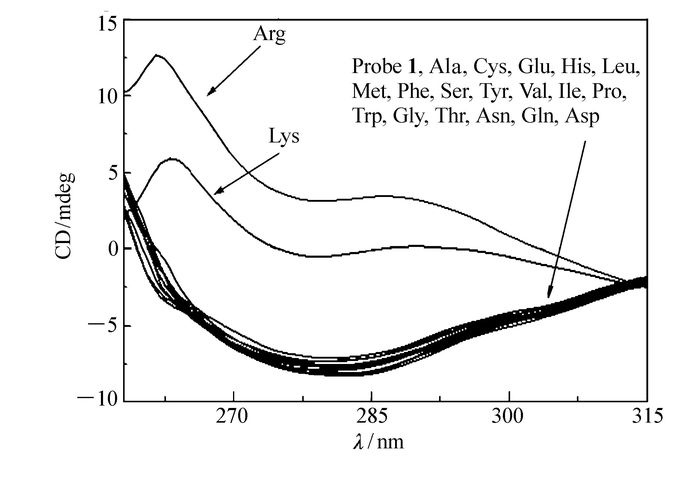
如图 4所示,当加入镁离子配合后,随着精氨酸的加入,探针1圆二色光谱表现出明显的变化。除赖氨酸有少许干扰外,其它18种人体常用氨基酸均无明显变化。探针1在加入镁离子后,其余18种氨基酸的圆二色光谱吸收系数之差均为负值,而当加入赖氨酸及精氨酸后,圆二色谱图有很大的变化,特别是精氨酸的加入,使其在275 nm处吸收系数之差由原来的-4转变成12.5。这种圆二色谱的正负构型变化证明了探针分子与镁离子配合以后,通过与精氨酸离子相互作用,发生联萘酚结构中的轴手性变化。
2.4 探针1对Arg的滴定曲线
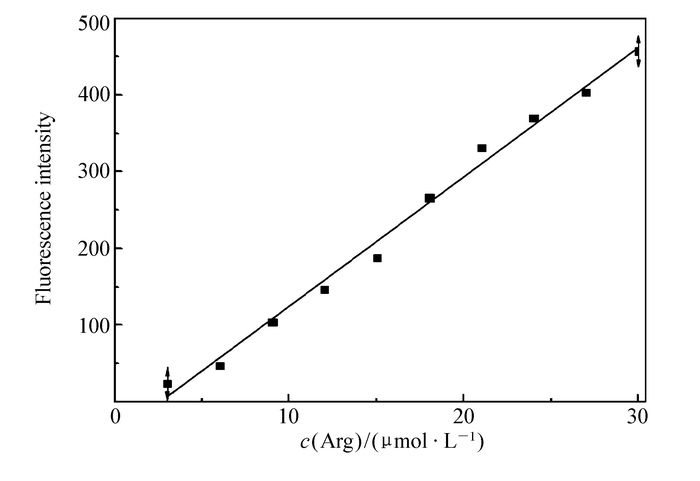
为了进一步探究不同浓度的精氨酸对探针荧光光谱曲线的影响,在DMSO溶液中,pH=7.4,探针浓度为10 μmol/L的测试条件下,检测该探针随着精氨酸量的变化所引起荧光发射光谱的变化。如图 5所示,当加入适量的镁离子配合后,随着精氨酸不断加入,探针在507 nm处的发射峰不断增强,最后当精氨酸加到3化学计量时,发射峰的强度不再变化,在507 nm处其荧光增强了近400倍。此外,探针1的荧光逐渐由无色变为绿色。通过507 nm处荧光强度对精氨酸的浓度作图,可以得到一条良好的线性关系曲线(图 6)。根据下列公式计算检测限:检测限=3σ/k,其中,σ为未添加检测物时探针分子荧光光谱变化的标准偏差,k为曲线斜率。通过计算,该荧光探针对精氨酸的检测限为1.3 μmol/L。
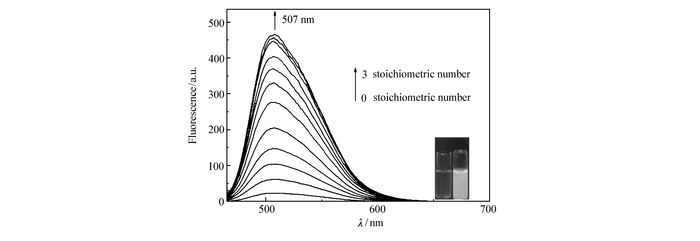 图5
探针1(10 μmol/L)+Mg2+(10 μmol/L)在DMSO溶液中不同浓度精氨酸(0~30 μmol/L)下的荧光光谱图;插图:探针1加入精氨酸后荧光变化图(激发波长:460 nm, 狭缝:3 nm/5 nm)
Figure5.
Fluorescence spectra of probe 1(10 μmol/L)+Mg2+(10 μmol/L) upon addition of increasing concentration of Arg(0~30 μmol/L) in DMSO solution. Inset: photograph of fluorescence emission color changes of the probe 1 solution on the addition of Arg(λEx:460 nm, Slit:3 nm/5 nm)
图5
探针1(10 μmol/L)+Mg2+(10 μmol/L)在DMSO溶液中不同浓度精氨酸(0~30 μmol/L)下的荧光光谱图;插图:探针1加入精氨酸后荧光变化图(激发波长:460 nm, 狭缝:3 nm/5 nm)
Figure5.
Fluorescence spectra of probe 1(10 μmol/L)+Mg2+(10 μmol/L) upon addition of increasing concentration of Arg(0~30 μmol/L) in DMSO solution. Inset: photograph of fluorescence emission color changes of the probe 1 solution on the addition of Arg(λEx:460 nm, Slit:3 nm/5 nm)
2.5 探针1响应时间的关系曲线
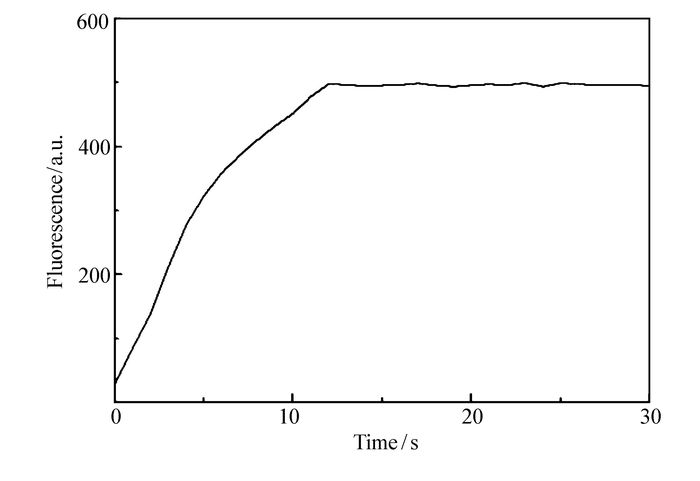
从图 7中可以看出,当加入适当镁离子的前提下,在加入3化学计量的精氨酸后,探针1在15 s内荧光强度增加到最大值。表明该探针能够对精氨酸作出快速响应。因此,该荧光探针将有望用于实时监测某些特定体系中的精氨酸含量。
3 结论
以联萘衍生物为荧光团,设计合成了具有荧光增强性能的精氨酸探针1。探针1与镁离子的配合物可以高灵敏、高选择性识别精氨酸,3化学计量精氨酸的加入可达到400多倍的荧光增强。同时,其反应速度快、检测限低的特点,证明以联萘衍生物作为荧光团母体的精氨酸探针在氨基酸的检测领域具有良好发展和研究前景。
辅助材料(Supporting Information)[探针1的核磁谱图、质谱图和探针1加入精氨酸后颜色变化图]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
-
-
[1]
Gong D Y, Tian Y J, Yang C D. A Fluorescence Enhancement Probe Based on BODIPY for the Discrimination of Cysteine from Homocysteine and Glutathione[J]. Biosens Bioelectron, 2016, 85: 178-183. doi: 10.1016/j.bios.2016.05.013
-
[2]
Liu G T, Liu D, Han X. A Hemicyanine-Based Colorimetric and Ratiometric Fluorescent Probe for Selective Detection of Cysteine and Bioimaging in Living Cell[J]. Talanta, 2017, 170: 406-412. doi: 10.1016/j.talanta.2017.04.038
-
[3]
Cheng D X, Zhu H Y. Determination of L-Arginine Content in Radix isatidis by a Composite Fluorescent Probe of Pd(Ⅱ)[J]. J Food Drug Anal, 2014, 22(4): 537-541. doi: 10.1016/j.jfda.2014.04.006
-
[4]
Shahida P S D, Affrose A, Pitchumani K. Plumbagin as Colorimetric and Ratiometric Sensor for Arginine[J]. Sens Actuators B:Chem, 2015, 221: 521-527. doi: 10.1016/j.snb.2015.06.149
-
[5]
Shang X F, Li J, Guo K R. Development and Cytotoxicity of Schiff Base Derivative as a Fluorescence Probe for the Detection of L-Arginine[J]. J Mol Struct, 2017, 1134: 369-373. doi: 10.1016/j.molstruc.2016.12.105
-
[6]
Shang X F, Luo L M, Ren K. Synthesis and Cytotoxicity of Azo Nano-Materials as New Biosensors for L-Arginine Determination[J]. Mater Sci Eng C, 2015, 51: 279-286. doi: 10.1016/j.msec.2015.03.005
-
[7]
Yu M M, Du W W, Li H. Near-infrared Ratiometric Fluorescent Detection of Arginine in Lysosome with a New Hemicyanine Derivative[J]. Biosens Bioelectron, 2017, 92: 385-389. doi: 10.1016/j.bios.2016.10.090
-
[8]
Lu X H, Wang W, Dong Q. A Multi-Functional Probe to Discriminate Lys, Arg, His, Cys, Hcy and GSH from Common Amino Acids[J]. Chem Commun, 2015, 51(8): 1498-501. doi: 10.1039/C4CC07757A
-
[9]
杨婷婷, 郭志前, 邵安东. 基于苯并吡喃腈的激活型半胱氨酸荧光探针[J]. 应用化学, 2016,33,(4): 397-405. doi: 10.11944/j.issn.1000-0518.2016.04.160053YANG Tingting, GUO Zhiqian, SHAO Andong. A Turn-on Fluorescent Probe for Cysteine Based on Benzopyran[J]. Chinese J Appl Chem, 2016, 33(4): 397-405. doi: 10.11944/j.issn.1000-0518.2016.04.160053
-
[10]
Wang F, Nandhakumar R, HU Y. BINO(L)-based Chiral Receptors as Fluorescent and Colorimetric Chemosensors for Amino Acids[J]. J Org Chem, 2013, 78(22): 11571-11576. doi: 10.1021/jo401789a
-
[11]
Wang F, Nandhakumar R, Moon J H. Ratiometric Fluorescent Chemosensor for Silver Ion at Physiological pH[J]. Inorg Chem, 2011, 50(6): 2240-2245. doi: 10.1021/ic1018967
-
[12]
Chen X Q, Nam S W, KIM G H. A Near-Infrared Fluorescent Sensor for Detection of Cyanide in Aqueous Solution and Its Application for Bioimaging[J]. Chem Commun, 2010, 46(47): 8953-8955. doi: 10.1039/c0cc03398g
-
[13]
Liu C T, Xiao T, Wang Y C. Rhodamine Based Turn-on Fluorescent Sensor for Hg2+ and Its Application of Microfluidic System and Bioimaging[J]. Tetrahedron, 2017, 73(34): 5189-5193. doi: 10.1016/j.tet.2017.07.012
-
[14]
Wanderley M M, Wang C, Wu C D. A Chiral Porous Metal-organic Framework for Highly Sensitive and Enantioselective Fluorescence Sensing of Amino Alcohols[J]. J Am Chem Soc, 2012, 134(22): 9050-9053. doi: 10.1021/ja302110d
-
[15]
陈秀英, 郭琳, 郑昌戈. 苯并噻唑类核酸分子荧光探针的合成及光谱性质[J]. 应用化学, 2012,29,(8): 892-897. CHEN Xiuying, GUO Lin, ZHENG Changge. Synthesis and Spectral Properities of Benzothiazole Cyanine Dyes for Nucleic Acid Fluorescence Probe[J]. Chinese J Appl Chem, 2012, 29(8): 892-897.
-
[16]
Alexey S, Monica P, Aaron J R. Anode Catalysts for Direct Hydrazine Fuel Cells:From Laboratory Test to an Electric Vehicle[J]. Angew Chem Int Ed, 2014, 53: 10336-10339. doi: 10.1002/anie.201404734
-
[17]
Wang H L, Zhou G D, Mao C. A Fluorescent Sensor Bearing Nitroolefin Moiety for the Detection of Thiols and Its Biological Imaging[J]. Dyes Pigm, 2013, 96(1): 232-236. doi: 10.1016/j.dyepig.2012.07.013
-
[18]
Zhou M, Smith A M, Das A K. Self-assembled Peptide-Based Hydrogels as Scaffolds for Anchorage-dependent Cells[J]. Biomaterials, 2009, 30(13): 2523-2530. doi: 10.1016/j.biomaterials.2009.01.010
-
[19]
Akira N, Mikio Y, Manami N. Direct Extract Derivatization for Determination of Amino Acids in Human Urine by Gas Chromatography and Mass Spectrometry[J]. J Chromatogr B, 2002, 776: 49-55. doi: 10.1016/S1570-0232(02)00075-2
-
[20]
Cao G P, Yang R Y, Zhuang Y F. Simple and Sensitive Determination of Trace Nitrite in Water by Zero-Crossing First-Derivative Synchronous Fluorescence Spectrometry Using 6-Amino-1, 3-naphthalenedisulfonic Acid as a New Fluorescent Probe[J]. Anal Bioanal Chem, 2017, 409(19): 4637-4646. doi: 10.1007/s00216-017-0409-4
-
[21]
Prasad S, Mandal I, Singh S. Near UV-Visible Electronic Absorption Originating from Charged Amino Acids in a Monomeric Protein[J]. Chem Sci, 2017, 8(8): 5416-5433. doi: 10.1039/C7SC00880E
-
[22]
Smidlehner T, Piantanida I. Novel DNA/RNA-targeting Amino Acid Beacon for the Versatile Incorporation at Any Position Within the Peptide Backbone[J]. Amino Acids, 2017, 49(8): 1381-1388. doi: 10.1007/s00726-017-2438-x
-
[23]
Chen C, Huang Q F, Zou S. Asymmetric Alkyne Addition to Aldehydes Catalyzed by Schiff Bases Made from 1, 1'-Bi-2-naphthol and Chiral Benzylic Amines[J]. Tetrahedron:Asymmetry, 2014, 25(3): 199-201. doi: 10.1016/j.tetasy.2013.12.013
-
[24]
Huang Z, Yu S S, Zhao X. A Convenient Fluorescent Method to Simultaneously Determine the Enantiomeric Composition and Concentration of Functional Chiral Amines[J]. Chem Eur J, 2014, 20(50): 16458-16461. doi: 10.1002/chem.201405143
-
[25]
Xu X C, Trindle C O, Zhang G Q. Fluorescent Recognition of Hg2+ by a 1, 1'-Binaphthyl-based Macrocycle:A Highly Selective Off-On-Off Response[J]. Chem Commun, 2015, 51(40): 8469-8472. doi: 10.1039/C5CC02457A
-
[1]
-
图 5 探针1(10 μmol/L)+Mg2+(10 μmol/L)在DMSO溶液中不同浓度精氨酸(0~30 μmol/L)下的荧光光谱图;插图:探针1加入精氨酸后荧光变化图(激发波长:460 nm, 狭缝:3 nm/5 nm)
Figure 5 Fluorescence spectra of probe 1(10 μmol/L)+Mg2+(10 μmol/L) upon addition of increasing concentration of Arg(0~30 μmol/L) in DMSO solution. Inset: photograph of fluorescence emission color changes of the probe 1 solution on the addition of Arg(λEx:460 nm, Slit:3 nm/5 nm)
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 7
- 文章访问数: 1405
- HTML全文浏览量: 241


 下载:
下载:







 下载:
下载:

