 图 1
处于上市和临床试验阶段的SGLT2抑制剂的结构
Figure 1.
Molecular structures of SGLT2 inhibitors that are now lunched and in clinical trials
图 1
处于上市和临床试验阶段的SGLT2抑制剂的结构
Figure 1.
Molecular structures of SGLT2 inhibitors that are now lunched and in clinical trials

Citation: Shi Yongheng, Zhou Chunmei, Zhang Panlong, Liu Jiping, Zhao Guilong, Wang Yuli. Design, Synthesis and Hypoglycemic Activity of Cyclopropane-Bearing C-Glucosides as Sodium-Glucose Cotransporter 2 Inhibitors[J]. Chinese Journal of Organic Chemistry, 2016, 36(3): 604-612. doi: 10.6023/cjoc201508003

含环丙烷结构的C-葡萄糖苷类钠-葡萄糖共转运子2抑制剂的设计、合成与降血糖活性研究
English
Design, Synthesis and Hypoglycemic Activity of Cyclopropane-Bearing C-Glucosides as Sodium-Glucose Cotransporter 2 Inhibitors
-
Key words:
- cyclopropane
- / C-glucoside
- / SGLT2 inhibitor
- / synthesis
- / hypoglycemic activity
-
糖尿病是一种以高血糖为特征的慢性代谢性疾病, 发病原因是胰腺β细胞分泌的胰岛素相对不足和/或者组织细胞对胰岛素的敏感度降低.如果血糖控制不好, 糖尿病将引发严重的并发症.尽管现在临床上有很多种糖尿病治疗药物, 但是在很多情况下, 高血糖仍然难以得到有效控制, 因此临床上仍然亟需具有新颖作用机制的降血糖药物.
血液中的葡萄糖在肾小管中被过滤而进入原尿, 过滤到原尿中的葡萄糖绝大多数在肾近端小管中被重新吸收回到血液中[1], 负责这一重新吸收过程的是钠-葡萄糖共转运子2 (SGLT2).因此, 抑制SGLT2可以抑制葡萄糖的重新吸收, 从而降低血糖.相对传统降血糖药物, SGLT2抑制剂是一类具有全新作用机制的药物.
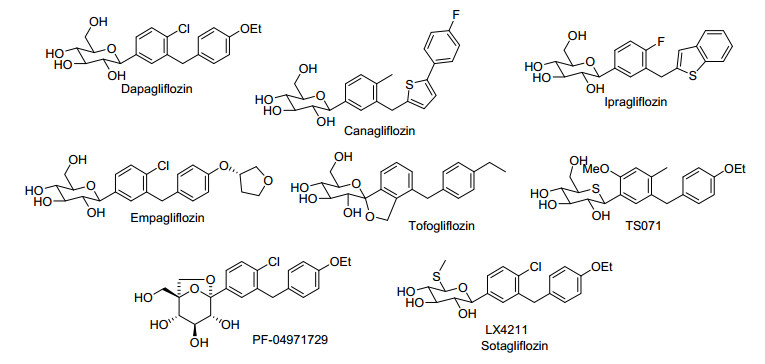
SGLT2抑制剂多是糖苷类化合物, 是从天然产物根皮苷中改造而来的[2].由于对O-糖苷药效和安全性的担忧, 现在已经上市和在研的SGLT2抑制剂均是C-糖苷, 如Dapagliflozin[3]、Canagliflozin[4]、Empagliflozin[5]、Ertugliflozin[6]等(图 1), Dapagliflozin已分别在欧洲、美国批准上市.
 图 1
处于上市和临床试验阶段的SGLT2抑制剂的结构
Figure 1.
Molecular structures of SGLT2 inhibitors that are now lunched and in clinical trials
图 1
处于上市和临床试验阶段的SGLT2抑制剂的结构
Figure 1.
Molecular structures of SGLT2 inhibitors that are now lunched and in clinical trials
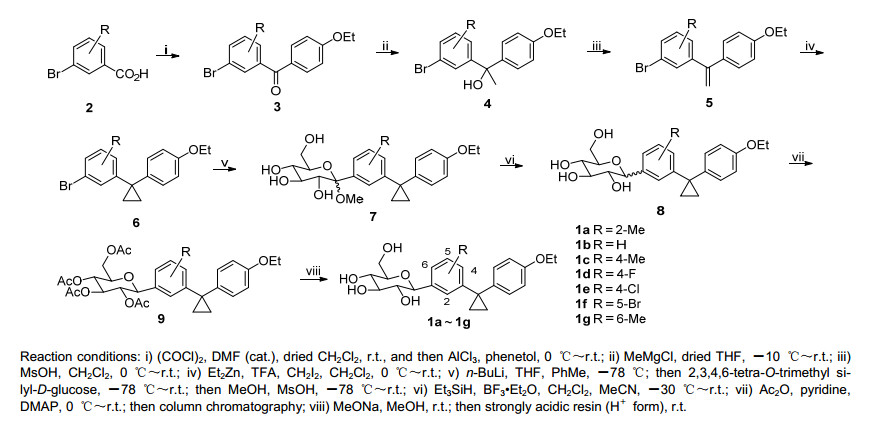
本研究是在前期工作的基础上[7~10], 并结合其他已报道的SGLT2抑制剂[11], 以dapagliflozin为结构基础进行改造, 设计并合成了一系列含有环丙烷结构结构的新颖C-糖苷, 期望发现具有更好降血糖活性的SGLT2抑制剂(Scheme 1).
1 结果与讨论
1.1 合成
化合物3-溴苯甲酸2在催化量DMF的催化下在CH2Cl2中室温下用(COCl)2处理, 得到其对应的酰氯, 后者在无水AlCl3催化下与苯乙醚Friedel-Crafts酰基化反应得到二苯甲酮3.化合物3与格氏试剂MeMgCl反应, 得到叔醇4.叔醇4在二氯甲烷中在甲磺酸催化下脱水, 得到二苯乙烯5.利用改进的Simmons-Smith试剂(Et2Zn/TFA/CH2I2)[12]在室温下将二苯乙烯5转化为二苯基环丙烷6.试图尝试其他的条件来实现该转化, 但是均没有成功(表 1).如表 1所示, 使用传统的Simmons-Smith试剂(Et2Zn/CH2I2)[13], 在各种溶剂(THF、CH2Cl2和PhMe)和温度下(-20 ℃至回流)均没有反应发生.利用改进的试剂(Et2Zn/TFA(三氟乙酸)/CH2I2), 在四氢呋喃(THF), 在各种温度下(-20 ℃至回流)均没有反应发生, 但是在CH2Cl2中进行时, 在低温(0 ℃)下时没有反应发生, 在室温下时反应发生, 但是非常缓慢(48 h内收率5%), 在回流温度下进行时, 反应较快, 结果较为理想(48 h内92%).
 表 1
尝试过的将烯5转化为环丙烷6所使用过的条件
Table 1.
The result of the screening of reaction conditions for the conversion of olefin 5 to cyclopropane 6
表 1
尝试过的将烯5转化为环丙烷6所使用过的条件
Table 1.
The result of the screening of reaction conditions for the conversion of olefin 5 to cyclopropane 6
Entry Reagent Solvent Temperature/
℃Yield/% 1 Et2Zn/CH2I2 THF -20 to reflux No reaction 2 Et2Zn/CH2I2 CH2Cl2 -20 to reflux No reaction 3 Et2Zn/CH2I2 PhMe -20 to reflux No reaction 4 Et2Zn/TFA/CH2I2 THF -20 to reflux No reaction 5 Et2Zn/TFA/CH2I2 CH2Cl2 0 No reaction 6 Et2Zn/TFA/CH2I2 CH2Cl2 25 5 7 Et2Zn/TFA/CH2I2 CH2Cl2 0 to reflux 92 表 1 尝试过的将烯5转化为环丙烷6所使用过的条件
Table 1. The result of the screening of reaction conditions for the conversion of olefin 5 to cyclopropane 6使用上述改进的Simmons-Smith试剂, 尽管在小规模的反应中具有步骤短、操作方便、收率高等优点, 但是由于Et2Zn和CH2I2试剂非常昂贵, 在放大反应中成本非常高.因此在后期的研究中我们开发了一种两步反应的路线(Scheme 2).如Scheme 2所示, 烯5a在想转移条件下进行二氯环丙烷化, 得到化合物二氯环丙烷10. 10使用传统的LiAlH4还原, 未见6a生成.
化合物6在-78 ℃下用n-BuLi处理进行溴-锂交换, 得到对应的苯基锂, 后者与2, 3, 4, 6-四-O-三甲基硅基-D-葡萄糖酸内酯[1]进行亲核加成, 加成物而后在甲磺酸催化下与甲醇反应得到对应的甲基糖苷7. 7在BF3•Et2O催化下用Et3SiH在低温下还原, 得到还原产物8, 8主要是β的构型, 含有少量α异构体.由于8的极性较大, 其α和β异构体差别较小, 因此难以使用柱层析等分离.将8使用常规条件全乙酰化得到对应的全乙酰化物, 使用柱层析将α异构体除去, 得到其纯的β异构体9.用MeONa处理脱去9中所有的乙酰基, 得到最终产物1a~1g.
3.1 体内降糖活性测试
化合物1a~1g的体内降血糖活性测试采用大鼠尿糖排泄实验(UGE)评价[2].
测试实验使用体重为200~220 g的Sprague Dawley雄性大鼠.实验前选取24 h内尿量正常的大鼠随机分组, 每组8只, 分别为空白组、模型组、阳性药dapagliflozin组(18 mg/kg)和标题化合物组(18 mg/kg).各组大鼠实验前禁食16 h, 灌胃给予待测化合物1a~1g 0.5 h后再灌胃给予葡萄糖(2 g/kg).而后收集给药后0~24 h时间段的尿液, 用葡萄糖氧化酶法测定该时间段的尿糖值, 每个尿液样品测定3次取平均值, 结果如表 2所示.
 表 2
目标化合物1a~1g和dapagliflozin在尿糖排泄实验中0~24 h的排糖量
Table 2.
The urinary glucose excreted over 0~24 h for compounds 1a~1g and dapagliflozin in urinary glucose excretion (UGE) testry glucose excreted over 0~24 h for compounds 1a~1g and dapagliflozin in urinary glucose excretion (UGE) test
表 2
目标化合物1a~1g和dapagliflozin在尿糖排泄实验中0~24 h的排糖量
Table 2.
The urinary glucose excreted over 0~24 h for compounds 1a~1g and dapagliflozin in urinary glucose excretion (UGE) testry glucose excreted over 0~24 h for compounds 1a~1g and dapagliflozin in urinary glucose excretion (UGE) test
Entry Compound (18 mg/kg) Glucose (mg/200 g) 1 Control 0 2 Vehicle 133±15 a 3 Dapagliflozin 1203±62 b 4 1a 329±29 5 1b 735±43 c 6 1c 838±50 b 7 1d 807±44 b 8 1e 912±54 b 9 1f 487±36 c 10 1g 556±32 c aP < 0.05 vs data from control group. bP < 0.01 and cP < 0.05 vs data from vehicle group. 表 2 目标化合物1a~1g和dapagliflozin在尿糖排泄实验中0~24 h的排糖量
Table 2. The urinary glucose excreted over 0~24 h for compounds 1a~1g and dapagliflozin in urinary glucose excretion (UGE) testry glucose excreted over 0~24 h for compounds 1a~1g and dapagliflozin in urinary glucose excretion (UGE) test从表 1可以看出, 所有设计的化合物1a~1g的活性均比阳性对照dapagliflozin差(329~912 vs 1203), 说明本研究所设计的在dapagliflozin两个苯环之间的亚甲基改造为环丙烷对生物活性不利.对于所合成的化合物1a~1g, 其活性顺序为1e>1c>1d>1b>1g>1f>1a, 很显然, 在靠近糖环的苯环上的4-位上的取代基的活性能够使活性升高(1e>1c>1d>1b), 而在2-、5-和6-三个位置上的取代基能够使活性降低(1b>1g>1f>1a), 这种靠近糖环的苯环上的取代基对活性的影响的构效关系说明了阳性对照药dapagliflozin结构设计的合理性, 也与我们前期的研究结果基本一致[8, 9].
2 结论
本文在前期研究的基础上, 以dapaglflozin为结构母核, 以取代的苯甲酸和葡萄糖酸内酯为起始原料, 经过酰氯化、傅克酰基化、亲核反应、脱水成烯和Simmons-Smith反应、碳碳偶合、糖环羟基保护与脱保护等反应, 合成了一系列含有环丙烷结构的C-葡萄糖苷类SGLT2 (sodium-glucose cotransporter 2)抑制剂, 以1H NMR和HRMS进行结构表征, 并测试了其促尿糖活性, 显示出较好的降糖活性, 但比阳性药daagliflozin差, 表明两苯环之间亚甲基处进行结构改造是不利于生物活性的, 这对于SGLT2抑制剂的研究具有重要的指导意义.
3 实验部分
3.1 仪器与试剂
熔点采用X-4型数显显微熔点测定仪测定, 温度计未校正; 1H NMR采用Bruker AV400型核磁共振仪测定, DMSO-d6作溶剂, TMS内标; 高分辨质谱采用Agilent Q-TOF 6510系统测定, 电喷雾离子化(ESI)技术.化合物2, 3, 4, 6-四-O-三甲基硅基-D-葡萄糖酸内酯由D-葡萄糖酸内酯为原料使用已知的方法合成得到[3].干燥的溶剂使用标准方法制备.
3.2 实验方法
3.2.3 1-(取代3-溴苯基)-1-(4-乙氧基苯基)环丙烷(6a~6g)的制备
60 mL (60 mmol, 1 mol/L) Et2Zn的正己烷溶液在氮气气氛保护下用注射器加入到50 mL干燥的CH2Cl2中, 搅拌并冷却到0 ℃.用注射器慢慢滴加5.82 g (60 mmol)三氟乙酸(TFA)溶于5 mL干燥的CH2Cl2中制成的溶液, 滴加完毕后反应化合物在该温度下继续搅拌0.5 h.用注射器慢慢滴加16.07 g (60 mmol) CH2I2溶于10 mL干燥的CH2Cl2中制成的溶液, 滴加完毕后反应混合物在该温度下继续搅拌0.5 h.用注射器慢慢滴加15 mmol化合物5a~5g溶于5 mL干燥的CH2Cl2中制成的溶液.滴加完毕后, 反应化合物在室温下搅拌1 h, 而后升温回流48 h.
反应混合物用200 mL CH2Cl2稀释, 用饱和NH4Cl溶液洗涤3次, 无水Na2SO4干燥, 在旋转蒸发仪上蒸去溶剂, 得到6a~6g的粗品, 柱层析纯化得到6a~6g的纯品.
1-(3-溴-2-甲基苯基)-1-(4-乙氧基苯基)环丙烷(6a):无色晶体, 产率85%. m.p. 65~66 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.51 (dd, J=0.8, 8.0 Hz, 1H), 7.42 (dd, J=1.0, 7.4 Hz, 1H), 7.14 (t, J=7.8 Hz, 1H), 6.84 (d, J=8.8 Hz, 2H), 6.75 (d, J=8.8 Hz, 2H), 3.92 (q, J=6.9 Hz, 2H), 2.25 (s, 3H), 1.24~1.31 (m, 5H), 1.19 (s, 2H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+ H]+): 327.0783, found 327.0788.
1-(3-溴苯基)-1-(4-乙氧基苯基)环丙烷(6b):无色晶体, 产率74%. m.p. 73~74 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.32~7.35 (m, 1H), 7.27~7.28 (m, 1H), 7.15~7.23 (m, 4H), 6.83 (d, J=8.4 Hz, 2H), 3.98 (q, J=6.9 Hz, 2H), 1.29 (t, J=7.0 Hz, 3H), 1.17~1.24 (m, 4H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
1-(5-溴-2-甲基苯基)-1-(4-乙氧基苯基)环丙烷(6c):无色油状物, 产率85%. 1H NMR (DMSO-d6, 400 MHz)δ: 7.55 (d, J=2.4 Hz, 1H), 7.36 (dd, J=2.0, 8.0 Hz, 1H), 7.12 (d, J=8.4 Hz, 1H), 6.88 (d, J=9.2 Hz, 2H), 6.77 (d, J=8.8 Hz, 2H), 3.94 (q, J=6.9 Hz, 2H), 2.13 (s, 3H), 1.26~1.29 (m, 5H), 1.17~1.19 (m, 2H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
1-(5-溴-2-氟苯基)-1-(4-乙氧基苯基)环丙烷(6d):无色晶体, 产率76%. m.p. 51~52 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.55 (dd, J=2.6, 6.6 Hz, 1H), 7.27~7.30 (m, 1H), 7.16 (d, J=8.8 Hz, 2H), 6.86 (t, J=9.2 Hz, 1H), 6.77 (d, J=8.4 Hz, 2H), 3.97 (q, J=7.1 Hz, 2H), 1.37 (t, J=7.0 Hz, 3H), 1.24~1.27 (m, 2H), 1.19~1.21 (m, 2H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)环丙烷(6e):无色油状物, 产率82%. 1H NMR (DMSO-d6, 400 MHz)δ: 7.80 (d, J=2.4 Hz, 1H), 7.49, 7.551 (dd, J=2.4, 8.4 Hz, 1H), 7.37 (d, J=8.8 Hz, 1H), 7.01 (d, J=8.8 Hz, 2H), 6.78 (d, J=8.8 Hz, 2H), 3.95 (q, J=6.9 Hz, 2H), 1.22~1.32 (m, 7H). HR-MS calcd for C16H22BrO2 ([M(79Br)+ H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
1-(3, 5-二溴苯基)-1-(4-乙氧基苯基)环丙烷(6f):无色晶体, 产率76%. m.p. 68~69 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.59 (t, J=1.6 Hz, 1H), 7.30 (d, J=1.6 Hz, 2H), 7.20 (d, J=8.4 Hz, 2H), 6.85 (d, J=8.8 Hz, 2H), 3.98 (q, J=7.1 Hz, 2H), 1.24~1.31 (m, 5H), 1.16~1.22 (m, 2H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+ H]+): 327.0783, found 327.0788.
1-(3-溴-4-甲基苯基)-1-(4-乙氧基苯基)环丙烷(6g):无色晶体, 产率81%. m.p. 68~69 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.29 (d, J=1.6 Hz, 1H), 7.21 (d, J=7.6 Hz, 1H), 7.14 (d, J=8.8 Hz, 2H), 7.07 (dd, J=1.8, 7.8 Hz, 1H), 6.82 (d, J=8.4 Hz, 2H), 3.97 (q, J=6.9 Hz, 2H), 1.29 (t, J=7.0 Hz, 3H), 1.16~1.20 (m, 4H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
3.2.5 (1S)-1-脱氧-1-{取代-3-[1-(4-乙氧基苯基)环丙-1-基]苯基}-D-葡萄糖(1a~1g)的制备
将0.1 g金属钠加入10 mL无水甲醇中, 室温下搅拌, 直到金属钠消失.而后加入5 mmol化合物9a~9g, 继续搅拌1 h.而后加入2 g强酸性阳离子交换树脂, 室温下搅拌过夜, 直到pH=7.
抽滤除去树脂, 滤液在选装蒸发仪上蒸去溶剂, 得到的残余物在真空泵上室温下继续干燥, 得到产物1a~1g的纯品.
(1S)-1-脱氧-1-{3-[1-(4-乙氧基苯基)环丙-1-基]-2-甲基-苯基}-D-葡萄糖(1a):白色泡沫状固体, 产率98%. 1H NMR (DMSO-d6, 400 MHz)δ: 7.30 (t, J=7.8 Hz, 2H), 7.16 (t, J=7.6 Hz, 1H), 6.87 (d, J=8.8 Hz, 2H), 6.74 (d, J=8.8 Hz, 2H), 4.88 (bs, 2H), 4.71 (d, J=4.8 Hz, 1H), 4.39 (s, 1H), 4.29 (d, J=8.8 Hz, 1H), 3.92 (q, J=7.1 Hz, 2H), 3.65~3.68 (m, 1H), 3.39~3.42 (m, 1H), 3.27~3.33 (m, 2H), 3.15~3.20 (m, 2H), 2.22 (s, 3H), 1.25~1.28 (m, 5H), 1.12~1.28 (m, 2H). HR-MS calcd for C24H34NO6 ([M+NH4]+): 432.2386; found 432.2392.
(1S)-1-脱氧-1-{3-[1-(4-乙氧基苯基)环丙-1-基]苯基}-D-葡萄糖(1b):白色泡沫状固体, 产率98%. 1H NMR (DMSO-d6, 400 MHz)δ: 7.08~7.21 (m, 6H), 6.80 (d, J=8.8 Hz, 2H), 4.88 (bs, 2H), 4.69 (d, J=4.4 Hz, 1H), 4.39 (bs, 1H), 3.93~3.99 (m, 3H), 3.68 (d, J=11.2 Hz, 1H), 3.40~3.43 (m, 1H), 3.14~3.27 (m, 4H), 1.28 (t, J=7.0 Hz, 3H), 1.13~1.21 (m, 4H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
(1S)-1-脱氧-1-{3-[1-(4-乙氧基苯基)环丙-1-基]-4-甲基苯基}-D-葡萄糖(1c):白色泡沫状固体, 产率99%. 1H NMR (DMSO-d6, 400 MHz)δ: 7.34 (s, 1H), 7.14~7.16 (m, 1H), 7.09 (d, J=8.0 Hz, 1H), 6.87 (d, J=8.8 Hz, 2H), 6.75 (d, J=8.8 Hz, 2H), 4.89~4.92 (m, 2H), 4.73 (d, J=6.0 Hz, 1H), 4.43 (t, J=5.8 Hz, 1H), 4.00 (d, J=9.2 Hz, 1H), 3.93 (q, J=6.9 Hz, 2H), 3.69~3.73 (m, 1H), 3.44~3.47 (m, 1H), 3.25~3.28 (m, 1H), 3.15~3.22 (m, 3H), 2.14 (s, 3H), 1.24~1.29 (m, 5H), 1.15~1.18 (m, 2H). HR-MS calcd for C24H34NO6 ([M+NH4]+): 432.2386; found 432.2393.
(1S)-1-脱氧-1-{3-[1-(4-乙氧基苯基)环丙-1-基]-4-氟苯基}-D-葡萄糖(1d):白色泡沫状固体, 产率100%. 1H NMR (DMSO-d6, 400 MHz)δ: 7.44 (dd, J=2.0, 7.6 Hz, 1H), 7.24~7.27 (m, 1H), 7.03~7.08 (m, 3H), 6.77 (d, J=8.4 Hz, 2H), 4.91~4.93 (m, 2H), 4.79 (d, J=5.6 Hz, 1H), 4.44 (t, J=5.8 Hz, 1H), 4.02 (d, J=9.2 Hz, 1H), 3.94 (q, J=6.9 Hz, 2H), 3.70 (d, J=5.6 Hz, 1H), 3.43~3.48 (m, 1H), 3.11~3.30 (m, 4H), 1.27 (t, J=7.0 Hz, 3H), 1.13~1.24 (m, 4H). HR-MS for C23H31FNO6 ([M+ NH4]+): 436.2135; found 436.2129; for C23H27FNaO6 ([M+Na]+): 441.1689, found 441.1675.
(1S)-1-脱氧-1-{4-氯-3-[1-(4-乙氧基苯基)环丙-1-基]苯基}-D-葡萄糖(1e):白色泡沫状固体, 产率99%. 1H NMR (DMSO-d6, 400 MHz)δ: 7.54 (d, J=1.6 Hz, 1H), 7.35 (d, J=8.0 Hz, 1H), 7.27 (dd, J=1.8, 8.2 Hz, 1H), 6.97 (d, J=8.8 Hz, 2H), 6.76 (d, J=8.8 Hz, 2H), 4.94 (d, J=4.8 Hz, 2H), 4.85 (d, J=6.0 Hz, 1H), 4.46 (t, J=5.8 Hz, 1H), 4.07 (d, J=9.2 Hz, 1H), 3.94 (q, J=7.1 Hz, 2H), 3.72 (dd, J=1.6, 10.4 Hz, 1H), 3.44~3.50 (m, 1H), 3.10~3.30 (m, 4H), 1.26~1.34 (m, 5H), 1.16~1.23 (m, 2H). HR-MS calcd for C23H31ClNO6 ([M+NH4]+): 452.1840, found 452.1847.
(1S)-1-脱氧-1-{3-溴-5-[1-(4-乙氧基苯基)环丙-1-基]苯基}-D-葡萄糖(1f):白色泡沫状固体, 产率98%. 1H NMR (DMSO-d6, 400 MHz)δ: 7.32 (s, 1H), 7.15~7.20 (m, 4H), 6.83 (d, J=8.8 Hz, 2H), 4.91 (t, J=4.0 Hz, 1H), 4.82 (d, J=5.6 Hz, 1H), 4.44 (t, J=5.8 Hz, 1H), 3.93~4.00 (m, 3H), 3.67 (dd, J=5.8, 11.0 Hz, 1H), 3.41~3.47 (m, 1H), 3.13~3.26 (m, 3H), 3.04~3.09 (m, 1H), 1.29 (t, J=7.0 Hz, 3H), 1.16~1.23 (m, 4H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
(1S)-1-脱氧-1-{5-[1-(4-乙氧基苯基)环丙-1-基]-2-甲基苯基}-D-葡萄糖(1g):白色泡沫状固体, 产率100%. 1H NMR (DMSO-d6, 400 MHz)δ: 7.20 (s, 1H), 7.10 (d, J=8.4 Hz, 2H), 6.97~7.02 (m, 2H), 6.79 (d, J=8.8 Hz, 2H), 4.88~4.91 (m, 2H), 4.74 (d, J=5.6 Hz, 1H), 4.39 (t, J=5.8 Hz, 1H), 4.20 (d, J=9.2 Hz, 1H), 3.96 (q, J=6.9 Hz, 2H), 3.67 (dd, J=5.6, 10.0 Hz, 1H), 3.11~3.43 (m, 5H), 2.27 (s, 3H), 1.28 (t, J=7.0 Hz, 3H), 1.13~1.19 (m, 4H). HR-MS calcd for C24H34NO6 ([M+NH4]+): 432.2386, found 432.2397.
辅助材料(Supporting Information) 所合成化合物的1H NMR, HR-MS谱图.这些材料可以免费从本刊网站http://sioc-journal.cn/
3.2.4 (1S)-2, 3, 4, 6-四-O-乙酰基-1-脱氧-1-{取代-3-[1-(4-乙氧基苯基)环丙-1-基]苯基}-D-葡萄糖(9a~9g)的制备
10 mmol溴化物6a~6g溶于20 mL干燥的THF中, 在N2气氛中冷却到-78 ℃, 搅拌, 用注射器慢慢滴加6.3 mL (10 mmol) n-BuLi溶液(1.6 mol/L的正己烷溶液).滴加完毕后, 反应物在-78 ℃下继续搅拌1 h, 而后再在-78 ℃下用注射器慢慢滴加5.60 g (12 mmol) 2, 3, 4, 6-四-O-三甲基硅基-D-葡萄糖酸内酯溶于15 mL干燥的甲苯中制成的溶液.滴加完毕后, 反应混合物在-78 ℃下继续搅拌1 h, 在-78 ℃下用注射器慢慢滴加1.92 g (20 mmol)甲磺酸溶于10 mL甲醇制成的溶液.滴加完毕后, 反应混合物慢慢升至室温, 并在室温下搅拌过夜.
反应混合物小心倾倒到冰水中, 用的二氯甲烷(50 mL×3)萃取.合并萃取相, 用饱和食盐水洗涤, 无水Na2SO4干燥, 在旋转蒸发仪上蒸去溶剂得到一油状残余物, 即为7a~7g的粗品.该粗品不用纯化, 直接用于下一步反应.
将该7a~7g的粗品溶于15 mL干燥的CH2Cl2和15 mL干燥的MeCN中, 冷却到-30 ℃, 搅拌, 加入3.49 g (30 mmol) Et3SiH, 而后用注射器慢慢滴加2.13 g (15 mmol) BF3•Et2O.滴加完毕后, 反应混合物在该温度下继续搅拌15 min, 而后逐渐升温至室温, 并在室温下搅拌过夜.
反应混合物用冰水浴冷却, 慢慢加入20 mL饱和NaHCO3溶液, 加完后继续搅拌0.5 h, 而后用盐酸调节pH=3~4, 用二氯甲烷(50 mL×3)萃取.合并萃取相, 用饱和食盐水洗涤, 无水Na2SO4干燥, 在旋转蒸发仪上蒸去溶剂得到一油状残余物, 即为8a~8g的粗品.该粗品不用纯化, 直接用于下一步反应.
上述8a~8g的粗品溶于30 mL干燥的吡啶中, 冰水浴冷却下搅拌, 而后慢慢滴加10 mL重蒸的Ac2O, 滴加完毕后再加入0.20 g 4-二甲氨基吡啶(DMAP).反应混合物在室温下搅拌过夜.
反应混合物在搅拌下倾倒到200 mL冰水中, 用的二氯甲烷(50 mL×3)萃取.合并萃取相, 用饱和食盐水洗涤, 无水Na2SO4干燥, 在旋转蒸发仪上蒸去溶剂得到一油状残余物, 即为9a~9g的粗品.该粗品用柱层析纯化, 得到纯品9a~9g.
(1S)-2, 3, 4, 6-四-O-乙酰基-1-脱氧-1-{3-[1-(4-乙氧基苯基)环丙-1-基]-2-甲基-苯基}-D-葡萄糖(9a):白色固体, 产率65%. m.p. 151~152 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.30~7.34 (m, 2H), 7.20 (t, J=7.8 Hz, 1H), 6.71~6.78 (m, 4H), 5.41 (t, J=9.2 Hz, 1H), 5.03~5.08 (m, 3H), 4.04~4.14 (m, 3H), 3.92 (q, J=6.9 Hz, 2H), 2.20 (s, 3H), 2.00 (s, 3H), 1.99 (s, 3H), 1.91 (s, 3H), 1.62 (s, 3H), 1.36 (bs, 1H), 1.26 (t, J=6.8 Hz, 3H), 1.15~1.17 (m, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+ H]+): 327.0783, found 327.0788.
(1S)-2, 3, 4, 6-四-O-乙酰基-1-脱氧-1-{3-[1-(4-乙氧基苯基)环丙-1-基]苯基}-D-葡萄糖(9b):白色固体, 产率62%. m.p. 109~110 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.24 (t, J=7.6 Hz, 1H), 7.09~7.17 (m, 5H), 6.80 (t, J=8.8 Hz, 2H), 5.32 (t, J=9.6 Hz, 1H), 5.05 (t, J=9.8 Hz, 1H), 4.95 (t, J=9.6 Hz, 1H), 4.61 (d, J=9.6 Hz, 1H), 4.01~4.12 (m, 3H), 3.96 (q, 2H, J=6.9 Hz), 2.00 (s, 3H), 1.99 (s, 3H), 1.91 (s, 3H), 1.66 (s, 3H), 1.28 (t, J=6.8 Hz, 3H), 1.16~1.18 (m, 4H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
(1S)-2, 3, 4, 6-四-O-乙酰基-1-脱氧-1-{3-[1-(4-乙氧基苯基)环丙-1-基]-4-甲基苯基}-D-葡萄糖(9c):白色固体, 产率68%. m.p. 154~155 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.32 (s, 1H), 7.12~7.19 (m, 2H), 6.80 (d, J=8.8 Hz, 2H), 6.73 (d, J=8.8 Hz, 2H), 5.36 (t, J=9.4 Hz, 1H), 5.02~5.12 (m, 2H), 4.67 (d, J=9.6 Hz, 1H), 4.06~4.14 (m, 3H), 3.93 (q, J=6.9 Hz, 2H), 2.14 (s, 3H), 2.02 (s, 3H), 2.01 (s, 3H), 1.94 (s, 3H), 1.73 (s, 3H), 1.25~1.29 (m, 5H), 1.18~1.20 (m, 1H), 1.07~1.11 (m, 1H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
(1S)-2, 3, 4, 6-四-O-乙酰基-1-脱氧-1-{3-[1-(4-乙氧基苯基)环丙-1-基]-4-氟苯基}-D-葡萄糖(9d):白色固体, 产率69%. m.p. 146~147 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.43~7.45 (m, 1H), 7.28~7.31 (m, 1H), 7.09~7.14 (m, 1H), 7.01 (d, J=8.4 Hz, 2H), 6.77 (d, J=8.4 Hz, 2H), 5.35 (t, J=9.4 Hz, 1H), 5.11 (t, J=9.6 Hz, 1H), 5.03 (t, J=9.6 Hz, 1H), 4.69 (d, J=9.6 Hz, 1H), 4.11~4.13 (m, 2H), 4.05~4.08 (m, 1H), 3.94 (q, J=6.9 Hz, 2H), 2.02 (s, 3H), 2.01 (s, 3H), 1.94 (s, 3H), 1.71 (s, 3H), 1.11~1.29 (m, 7H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
(1S)-2, 3, 4, 6-四-O-乙酰基-1-脱氧-1-{4-氯-3-[1-(4-乙氧基苯基)环丙-1-基]苯基}-D-葡萄糖(9e):白色固体, 产率64%. m.p. 162~163 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.53 (d, J=2.0 Hz, 1H), 7.40 (d, J=8.0 Hz, 1H), 7.30 (dd, J=2.0, 8.4 Hz, 1H), 6.92 (d, J=8.8 Hz, 2H), 6.75 (d, J=8.8 Hz, 2H), 5.36 (t, J=9.6 Hz, 1H), 5.12 (t, J=9.8 Hz, 1H), 5.05 (t, J=9.8 Hz, 1H), 4.73 (d, J=9.6 Hz, 1H), 4.13~4.14 (m, 2H), 4.05~4.09 (m, 1H), 3.94 (q, J=6.9 Hz, 2H), 2.02 (s, 3H), 2.01 (s, 3H), 1.94 (s, 3H), 1.75 (s, 3H), 1.13~1.31 (m, 7H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
(1S)-2, 3, 4, 6-四-O-乙酰基-1-脱氧-1-{3-溴-5-[1-(4-乙氧基苯基)环丙-1-基]苯基}-D-葡萄糖(9f):白色固体, 产率64%. m.p. 162~163 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.53 (d, J=2.0 Hz, 1H), 7.40 (d, J=8.0 Hz, 1H), 7.30 (dd, J=2.0, 8.4 Hz, 1H), 6.92 (d, J=8.8 Hz, 2H), 6.75 (d, J=8.8 Hz, 2H), 5.36 (t, J=9.6 Hz, 1H), 5.12 (t, J=9.8 Hz 1H), 5.05 (t, J=9.8 Hz, 1H), 4.73 (d, J=9.6 Hz, 1H), 4.13~4.14 (m, 2H), 4.05~4.09 (m, 1H), 3.94 (q, J=6.9 Hz, 2H), 2.02 (s, 3H), 2.01 (s, 3H), 1.94 (s, 3H), 1.75 (s, 3H), 1.13~1.31 (m, 7H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
(1S)-2, 3, 4, 6-四-O-乙酰基-1-脱氧-1-{5-[1-(4-乙氧基苯基)环丙-1-基]-2-甲基苯基}-D-葡萄糖(9g):白色固体, 产率60%. m.p. 116~118 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.01~7.13 (m, 5H), 6.78 (d, J=8.8 Hz, 2H), 5.39 (t, J=9.4 Hz, 1H), 5.21 (t, J=9.6 Hz, 1H), 5.04 (t, J=9.6 Hz, 1H), 4.89 (d, J=10 Hz, 1H), 4.05~4.10 (m, 3H), 3.95 (q, J=6.9 Hz, 2H), 2.30 (s, 3H), 2.01 (s, 3H), 1.98 (s, 3H), 1.93 (s, 3H), 1.69 (s, 3H), 1.28 (t, J=7.0 Hz, 3H), 1.07~1.17 (m, 4H). HR-MS calcd for C16H22BrO2 ([M(79Br)+ H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
3.2.1 (取代3-溴苯基)(4-乙氧基苯基)甲酮(3a~3g)的制备
50 mmol取代3-溴苯甲酸(2)溶于100 mL干燥的CH2Cl2中, 室温下搅拌, 滴加3滴干燥的DMF, 而后滴加70 mmol重蒸的(COCl)2, 滴加完毕后反应混合物在CaCl2干燥管保护下室温下继续搅拌过夜.
将反应混合物在旋转蒸发仪上整去溶剂和过量的(COCl)2, 残余物溶于50 mL干燥的CH2Cl2中, 冰水浴冷却下搅拌, 加入50 mmol苯乙醚, 而后分批加入60 mmol无水AlCl3.加完后, 反应混合物在室温下搅拌过夜.
反应混合物慢慢倾倒到300 mL冰水中, 搅拌, 分出有机相.水相再用100 mL CH2Cl2萃取.合并有机相, 用饱和食盐水洗涤, 无水Na2SO4干燥, 在旋转蒸发仪上蒸去溶剂, 得到化合物3的粗品.该粗品用柱层析纯化, 而后用石油醚/乙酸乙酯(V:V=20:1)室温下搅拌, 抽滤, 室温下真空干燥, 得到化合物3的纯品.
(3-溴-2-甲基苯基)(4-乙氧基苯基)甲酮(3a):无色晶体, 产率85%. m.p. 81~82 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.74~7.77 (m, 1H), 7.66 (d, J=8.8 Hz, 2H), 7.23~7.28 (m, 2H), 7.04 (d, J=8.8 Hz, 2H), 4.11 (q, J=7.1 Hz, 2H), 2.18 (s, 3H), 1.34 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
(3-溴苯基)(4-乙氧基苯基)甲酮(3b):无色晶体, 产率87%. m.p. 85~86 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.83 (d, J=8.0 Hz, 1H), 7.79 (t, J=1.6 Hz, 1H), 7.73 (d, J=8.8 Hz, 2H), 7.65 (d, J=7.6 Hz, 1H), 7.50 (t, J=8.0 Hz, 1H), 7.07 (d, J=8.8 Hz, 2H), 4.14 (q, J=6.9 Hz, 2H), 1.35 (t, J=6.8 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
(5-溴-2-甲基苯基)(4-乙氧基苯基)甲酮(3c):无色晶体, 产率83%. m.p. 89~90 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.66 (d, J=8.8 Hz, 2H), 7.60, 7.62 (dd, J=2.0, 8.0 Hz, 1H), 7.44 (d, J=2.0 Hz, 1H), 7.30 (d, J=8.4 Hz, 1H), 7.05 (d, J=8.8 Hz, 2H), 4.12 (q, J=6.9 Hz, 2H), 2.11 (s, 3H), 1.34 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
(5-溴-2-氟苯基)(4-乙氧基苯基)甲酮(3d):无色晶体, 产率88%. m.p. 54~55 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.79~7.83 (m, 1H), 7.70~7.74 (m, 3H), 7.36 (t, J=9.2 Hz, 1H), 7.04~7.08 (m, 2H), 4.14 (q, J=6.9 Hz, 2H), 1.34 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
(5-溴-2-氯苯基)(4-乙氧基苯基)甲酮(3e):无色晶体, 产率90%. m.p. 69~70 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.75 (dd, J=2.4, 8.4 Hz, 1H), 7.72 (d, J=2.0 Hz, 1H), 7.54 (d, J=8.4 Hz, 1H), 7.06 (d, J=8.8 Hz, H), 7.67 (d, J=8.8 Hz, H), 4.13 (q, J=6.9 Hz, 2H), 1.34 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+ H]+): 327.0783, found 327.0788.
(3, 5-二溴苯基)(4-乙氧基苯基)甲酮(3f):无色晶体, 产率80%. m.p. 107~108 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 8.11 (t, J=1.8 Hz, 1H), 7.78 (d, J=2.0 Hz, 2H), 7.74 (d, J=8.8 Hz, 2H), 7.08 (d, J=9.2 Hz, 2H), 4.14 (q, J=6.9 Hz, 2H), 1.35 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
(3-溴-4-甲基苯基)(4-乙氧基苯基)甲酮(3g):无色晶体, 产率84%. m.p. 81~82 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.83 (d, J=1.2 Hz, 1H), 7.73 (d, J=8.8 Hz, 2H), 7.59 (dd, J=1.4, 7.8 Hz, 1H), 7.53 (d, J=7.6 Hz, 1H), 7.08 (d, J=8.8 Hz, 2H), 4.15 (q, J=6.9 Hz, 2H), 2.45 (s, 3H), 1.37 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
3.2.2 1-(取代3-溴苯基)-1-(4-乙氧基苯基)乙烯(5a~5g)的制备
30 mmol化合物3溶于150 mL干燥的THF中, 搅拌.在-10 ℃下用注射器慢慢滴加12 mL (36 mmol, 3 mol/L) MeMgCl的THF溶液.滴加完毕后, 反应混合物在室温下继续搅拌3 h.
反应混合物在搅拌下慢慢倾倒到500 mL冰水中, 用浓盐酸调节pH=3~4, 用CH2Cl2萃取(100 mL×3), 合并萃取相, 用饱和食盐水洗涤, 无水Na2SO4干燥, 在旋转蒸发仪上蒸去溶剂, 得到4a~4g的粗品, 该粗品不用纯化直接用于下一步反应.
4a~4g的粗品溶于100 mL二氯甲烷中, 冰水浴冷却下搅拌, 加入0.48 g (5 mmol)甲磺酸.加完后, 反应混合物在室温下继续搅拌3 h.
反应混合物依次用100 mL 5% Na2CO3溶液和饱和食盐水洗涤, 无水Na2SO4干燥, 在旋转蒸发仪上蒸去溶剂, 得到5a~5g的粗品, 柱层析纯化得到5a~5g的纯品.
1-(3-溴-2-甲基苯基)-1-(4-乙氧基苯基)乙烯(5a):无色晶体, 产率67%. m.p. 51~52 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.60 (dd, J=2.0, 7.2 Hz, 1H), 7.14~7.20 (m, 4H), 6.87 (d, J=8.4 Hz, 2H), 5.78 (s, 1H), 5.03 (s, 1H), 4.00 (q, J=6.9 Hz, 2H), 2.06 (s, 3H), 1.30 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
1-(3-溴苯基)-1-(4-乙氧基苯基)乙烯(5b):无色晶体, 产率60%. m.p. 68~69 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.52~7.55 (m, 1H), 7.416~7.424 (m, 1H), 7.33 (t, J=7.8 Hz, 1H), 7.26~7.29 (m, 1H), 7.19 (d, J=8.4 Hz, 2H), 6.92 (d, J=8.8 Hz, 2H), 5.45 (s, 1H), 5.40 (s, 1H), 4.03 (q, J=6.9 Hz, 2H), 1.32 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
1-(5-溴-2-甲基苯基)-1-(4-乙氧基苯基)乙烯(5c):无色晶体, 产率63%. m.p. 43~44 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.46 (dd, J=2.2, 8.2 Hz, 1H), 7.29 (d, J=2.0 Hz, 1H), 7.20 (d, J=8.4 Hz, 1H), 7.13 (d, J=8.4 Hz, 2H), 6.88 (d, J=8.8 Hz, 2H), 5.76 (s, 1H), 5.06 (s, 1H), 4.01 (q, J=7.1 Hz, 2H), 1.95 (s, 3H), 1.31 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+ H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
1-(5-溴-2-氟苯基)-1-(4-乙氧基苯基)乙烯(5d):无色晶体, 产率71%. m.p. 46~48 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.59~7.63 (m, 1H), 7.46~7.49 (m, 1H), 7.23~7.26 (m, 1H), 7.20 (d, J=8.8 Hz, 2H), 6.89 (d, J=8.8 Hz, 2H), 5.77 (s, 1H), 5.30 (s, 1H), 4.02 (q, J=6.9 Hz, 2H), 1.32 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
1-(5-溴-2-氯苯基)-1-(4-乙氧基苯基)乙烯(5e):无色晶体, 产率71%. m.p. 65~66 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.68 (dd, J=2.6, 8.6 Hz, 1H), 7.53 (d, J=2.4 Hz, 1H), 7.46 (d, J=8.8 Hz, 1H), 7.14 (d, J=8.8 Hz, 2H), 6.88 (d, J=8.8 Hz, 2H), 5.84 (s, 1H), 5.16 (s, 1H), 4.03 (q, J=6.9 Hz, 2H), 1.32 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+ H]+): 327.0783, found 327.0788.
1-(3, 5-二溴苯基)-1-(4-乙氧基苯基)乙烯(5f):无色晶体, 产率62%. m.p. 80~81 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.80 (t, J=1.8 Hz, 1H), 7.43 (d, J=1.6 Hz, 2H), 7.19 (d, J=8.4 Hz, 2H), 6.92 (d, J=8.8 Hz, 2H), 5.49 (s, 1H), 5.47 (s, 1H), 4.03 (q, J=6.9 Hz, 2H), 1.32 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+ H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
1-(3-溴-4-甲基苯基)-1-(4-乙氧基苯基)乙烯(5g):无色晶体, 产率84%. m.p. 55~56 ℃; 1H NMR (DMSO-d6, 400 MHz)δ: 7.42 (d, J=1.6 Hz, 1H), 7.34 (d, J=8.0 Hz, 1H), 7.19 (d, J=8.4 Hz, 3H), 6.91 (d, J=8.8 Hz, 2H), 5.39 (s, 1H), 5.37 (s, 1H), 4.03 (q, J=6.9 Hz, 2H), 2.35 (s, 3H), 1.32 (t, J=7.0 Hz, 3H). HR-MS calcd for C16H22BrO2 ([M(79Br)+H]+): 325.0803, found 325.0805; for C16H22BrO2 ([M(81Br)+H]+): 327.0783, found 327.0788.
-
-
[1]
Katsuno, K.; Fujimori, Y.; Takemura, Y.; Sergliflozin, J. Pharmaco. Exp. Ther. 2007, 320(1), 323.
-
[2]
Washburn, W. N. J. Med. Chem. 2009, 52, 1785. doi: 10.1021/jm8013019
-
[3]
Meng, M.; Ellsworth, B. A.; Nirschl, A. A.; McCann, P. J.; Patel, M.; Girotra, R. N.; Wu, G.; Sher, P. M.; Morrison, E. P.; Biller, S. A.; Zahler, R.; Deshpande, P. P.; Pullockaran, A.; Hagan, D. L.; Morgan, N.; Taylor, J. R.; Obermeier, M. T.; Humphreys, W. G.; Khanna, A.; Discenza, L.; Robertson, J. M.; Wang, A.; Han, S.; Wetterau, J. R.; Janovitz, E. B.; Flint, O. P.; Whaley, J. M.; Washburn, W. N. J. Med. Chem. 2008, 51, 1145. doi: 10.1021/jm701272q
-
[4]
Nomura, S.; Sakamaki, S.; Hongu, M. J. Med. Chem. 2010, 53(17), 6355.
-
[5]
Himmelsbach, F.; Eckhardt, M.; Eickelmann, P.; Barsoumian, E. L.; Thomas, L. WO 2005092877, 2005 [Chem. Abstr. 2005, 143, 286629].
-
[6]
Mascitti, V.; Maurer. T. S.; Robinson, R. P.; Bian, J. J. Med. Chem. 2011, 54(8), 2952.
-
[7]
(史永恒, 赵桂龙, 刘巍, 邵华, 汤立达, 王玉丽, 徐为人, 中国药物化学杂志, 2011, 21, 57.) http://www.cnki.com.cn/Article/CJFDTotal-ZGYH201101013.htmShi, Y. H.; Zhao, G. L.; Liu, W.; Shao, H.; Tang, L. D.; Wang, Y. L.; Xu, W. R. Chin. J. Med. Chem. 2011, 21, 57 (in Chinese). http://www.cnki.com.cn/Article/CJFDTotal-ZGYH201101013.htm
-
[8]
Shi, Y. H.; Zhao, G. L.; Lou, Y. Y.; Wang, Y. L.; Shao, H.; Liu, W.; Xu, W. R.; Tang, L. D. Chin. J. Chem. 2011, 29, 1192. doi: 10.1002/cjoc.201190222
-
[9]
Zhao, W. J.; Shi, Y. H.; Zhao, G. L.; Wang, Y. L.; Shao, H.; Tang, L. D.; Wang, J. W. Chin. Chem. Lett. 2011, 22, 1215.
-
[10]
(邵华, 高云龙, 楼袁媛, 王玉丽, 刘巍, 徐为人, 王建武, 赵桂龙, 汤立达, 有机化学, 2011, 31, 836.) http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract340142.shtmlShao, H.; Gao, Y. L.; Lou, Y. Y.; Wang, Y. L.; Liu, W.; Xu, W. R.; Wang, J. W.; Zhao, G. L.; Tang, L. D. Chin. J. Org. Chem. 2011, 31, 836 (in Chinese). http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract340142.shtml
-
[11]
Cai, W. Q.; Jiang, L. L.; Xie, Y. F.; Liu, Y. Q.; Liu, W.; Zhao, G. L. Med. Chem. 2015, 11(4), 317. doi: 10.2174/1573406411666150105105529
-
[12]
Lorenz, J. C.; Long, J.; Yang, Z.; Xue, S.; Xie, Y.; Shi, Y. J. Org. Chem. 2004, 69, 327. doi: 10.1021/jo030312v
-
[13]
Hirabayashi, K.; Mori, A.; Hiyama, T. Tetrahedron Lett. 1997, 38, 461. doi: 10.1016/S0040-4039(96)02326-X
-
[1]
-
表 1 尝试过的将烯5转化为环丙烷6所使用过的条件
Table 1. The result of the screening of reaction conditions for the conversion of olefin 5 to cyclopropane 6
Entry Reagent Solvent Temperature/
℃Yield/% 1 Et2Zn/CH2I2 THF -20 to reflux No reaction 2 Et2Zn/CH2I2 CH2Cl2 -20 to reflux No reaction 3 Et2Zn/CH2I2 PhMe -20 to reflux No reaction 4 Et2Zn/TFA/CH2I2 THF -20 to reflux No reaction 5 Et2Zn/TFA/CH2I2 CH2Cl2 0 No reaction 6 Et2Zn/TFA/CH2I2 CH2Cl2 25 5 7 Et2Zn/TFA/CH2I2 CH2Cl2 0 to reflux 92 表 2 目标化合物1a~1g和dapagliflozin在尿糖排泄实验中0~24 h的排糖量
Table 2. The urinary glucose excreted over 0~24 h for compounds 1a~1g and dapagliflozin in urinary glucose excretion (UGE) testry glucose excreted over 0~24 h for compounds 1a~1g and dapagliflozin in urinary glucose excretion (UGE) test
Entry Compound (18 mg/kg) Glucose (mg/200 g) 1 Control 0 2 Vehicle 133±15 a 3 Dapagliflozin 1203±62 b 4 1a 329±29 5 1b 735±43 c 6 1c 838±50 b 7 1d 807±44 b 8 1e 912±54 b 9 1f 487±36 c 10 1g 556±32 c aP < 0.05 vs data from control group. bP < 0.01 and cP < 0.05 vs data from vehicle group. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 2129
- HTML全文浏览量: 259


 下载:
下载:

 下载:
下载:

