 图 图式1
脱镁叶绿酸-a(b)的甲烯和乙烯基化
Figure 图式1.
The methylation and vinylation of pheophorbide-a(b)
图 图式1
脱镁叶绿酸-a(b)的甲烯和乙烯基化
Figure 图式1.
The methylation and vinylation of pheophorbide-a(b)

Citation: Li Yanlong, Li Jiazhu, Zhang Shanguo, Wang Jinjun. Synthesis of (Methylenated)vinylated Chlorophyllous Chlorins and Study on Their Photosensitive Bactericidal Activities[J]. Chinese Journal of Organic Chemistry, 2016, 36(3): 562-571. doi: 10.6023/cjoc201508032

(甲)乙烯基化的叶绿素类二氢卟吩衍生物的合成及其光敏杀菌活性
English
Synthesis of (Methylenated)vinylated Chlorophyllous Chlorins and Study on Their Photosensitive Bactericidal Activities
-
Key words:
- chlorophyll-a
- / chlorin
- / chemical modification
- / photosensitive bactericidal activity
- / synthesis
-
3-位乙烯基是众多叶绿素(Chls)和细菌叶绿素(BChls)的标识性结构, 也是影响这些天然产物自身性质的关键性取代基团[1~3].在天然属卟啉、二氢卟吩或者细菌二氢卟吩的π-共轭体系中, 3-位乙烯基不仅能够有效地延展四吡咯大环的最大可见光的吸收波长(Qy), 还可以广泛地形成各种典型的烯键反应而构建出特定的化学结构.例如, 叶绿素-a的3-位碳碳双键经四氧化锇氧化成甲酰基而转化成叶绿素-d, 以卤化氢加成并水解为羟乙基则形成细菌叶绿素-d[4~6].除了用于叶绿素类族中天然产物之间的转换以外, 3-位乙烯基的化学修饰还可以键连和构建具有特殊属性的连带成分, 并已引人关注地应用于光医学、超分子化学和分析化学等诸多方面[7, 8].在叶绿素化学的理论和应用研究中, 叶绿素降解产物周环上所形成的甲烯基结构同样表现出极为活泼的反应活性, 并在新型叶绿素衍生物合成中受到人们的关注[9, 10].探讨叶绿素降解产物的官能团引入和化学结构修饰, 是非对称性四吡咯大环化合物的合成及其应用研究的重要基础工作.叶绿素系列天然产物中的3-位乙烯基的特殊作用启示我们尝试新的合成策略, 通过多种常见的化学反应, 在四吡咯大环分子的不同位置上构建具有较高反应活性的端位碳碳双键, 为有效合成具有新颖结构和应用前景的叶绿素类二氢卟吩建立新的反应位点.
本文以脱镁叶绿酸为起始原料, 利用其周环上的活性反应区域实施化学修饰, 在不同的位置上引进甲烯基或者乙烯基, 并对新形成的化合物进行官能转换, 完成了一系列未见报道的多端烯基取代的叶绿素类二氢卟吩衍生物的合成, 同时, 对部分新化合物的光敏杀菌活性进行了测试.
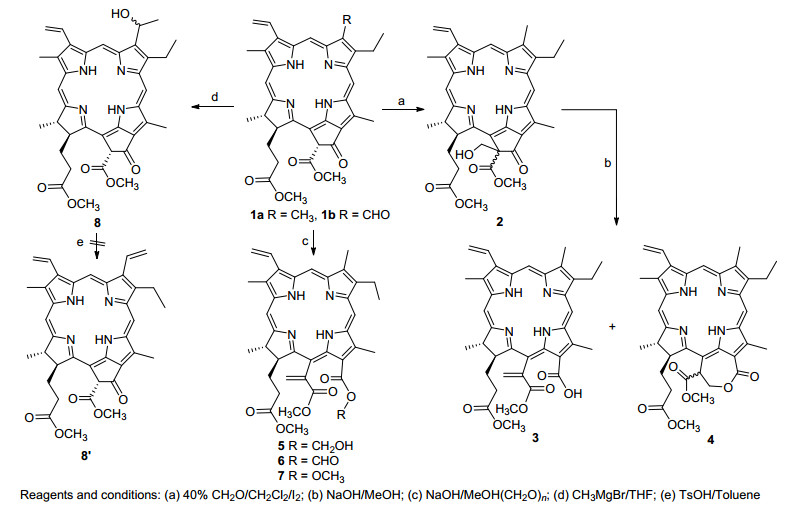
在碘催化下, 脱镁叶绿酸-a甲酯(1a, MPa)和40%的甲醛水溶液发生亲核加成反应给出差向异构体混合物2, 再于氢氧化钾甲醇溶液中开环脱水, 分离出15a-甲烯基二氢卟吩-e6 3 (27%)和少量开环成酯的二氢卟吩内酯4 (4%).如果在氢氧化钠饱和的甲醇溶液中使得MPa与多聚甲醛反应, 则分别给出三个连有甲烯基的二氢卟吩衍生物5 (12%)、6 (8%)和7 (26%).选择脱镁叶绿酸-b甲酯(1b, MPb)与甲基溴化镁进行格氏反应, 以56%的产率得到二氢卟吩醇酯8.在对甲苯磺酸催化剂下, 于甲苯中对其进行酸催化脱水, 但反应结果给出难于分离的复杂混合物, 未获得以期在7-位上形成碳碳双键的双乙烯基取代的二氢卟吩8' (Scheme 1).
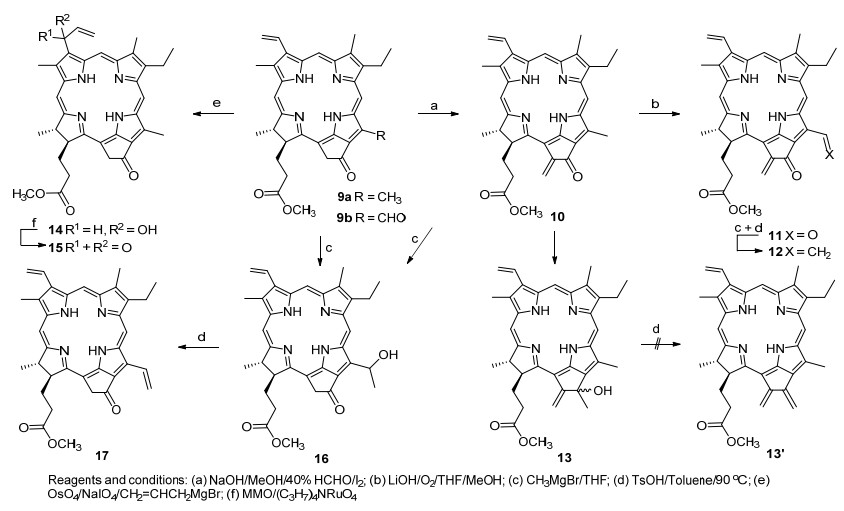
另一条合成路线起始于焦脱镁叶绿酸.在碱性条件下, 焦脱镁叶绿酸-a甲酯(9a, MPPa)与甲醛顺利地发生羟醛缩合反应, 并分离出38%的二氢卟吩烯酮10, 再经氢氧化锂促进与空气氧发生氧化作用, 得到12-甲酰基取代的二氢卟吩醛11 (21%), 甲基溴化镁与其进行的格氏反应选择性地发生在12-位甲酰基上, 直接脱水后分离出含有三个端烯结构的二氢卟吩12 (41%); 而二氢卟吩烯酮(10)与甲基溴化镁的格氏反应则只发生在E-环的酮羰基上, 以中等产率给出加成产物二氢卟吩二烯醇13 (42%), 继续在甲苯中对其实施酸催化脱水, 同样由于产物混杂的原因, 未获得期待的具有1, 3-丁二烯结构的叶绿素衍生物13'. MPPa (9a)的3-位乙烯基经四氧化锇和高碘酸钠的氧化形成甲酰基, 直接与乙烯基溴化镁的亲核加成则生成51%的二氢卟吩醇14, 再选用四正丙基过钌酸铵(TPAP)和N-甲基吗啉N-氧化物(NMMO)混合氧化剂, 将其氧化成C(3)-烯丙酰基取代的二氢卟吩二酮15 (47%).二氢卟吩醛9b与甲基溴化镁的格氏反应顺利地分离出57%的二氢卟吩醇16, 进一步的酸催化脱水则高产率转化成二氢卟吩二烯17 (68%) (Scheme 2).
1 结果与讨论
1.1 叶绿素降解产物周环上的甲烯或乙烯基的形成过程
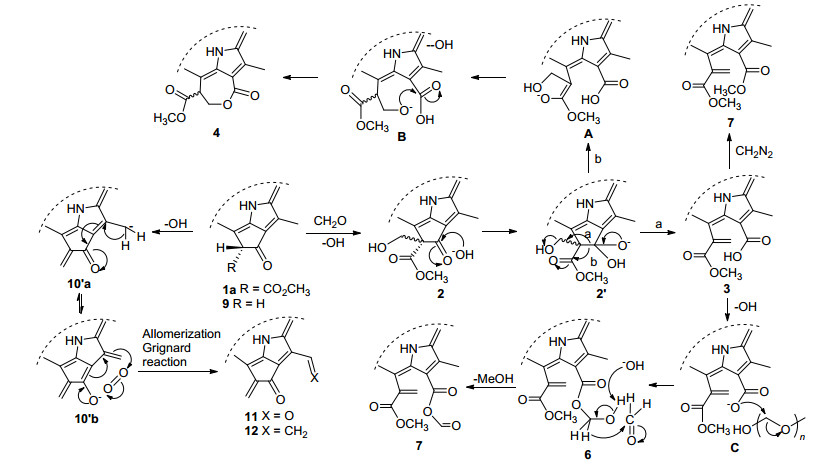
叶绿素降解产物的活性反应区域主要分布在N21-N23轴向的两端, 即A-子环和C-子环所连带的化学结构.外接E-环上的α, β-不饱和酮酯与甲醛很容易发生羟醛缩合并生成132-羟甲基脱镁叶绿酸2, 在碱性条件下水解则形成亲核加成四面体2'.该中间体可以沿着两条途径发生开环:在a-路线中, 失去氢氧负离子后于15a-位上形成碳碳双键给出二氢卟吩3; 另一条路线b则首先形成烯醇氧负离子A, 再经分子内质子交换转化成醇氧负离子B, 然后发生分子内酯化并生成二氢卟吩内酯4.脱镁叶绿酸1a在与多聚甲醛反应的过程中同样可以生成二氢卟吩酸3, 在有碱环境中形成羧氧负离子C, 继续与多聚甲醛发生的亲核取代而给出二氢卟吩羟甲基酯6, 而后, 其13-位上端位羟基失去质子并与甲醛发生类坎尼查罗反应, 最终氧化成C-子环上连有酸酐结构二氢卟吩7 (Scheme 3).
焦脱镁叶绿酸9在碱性环境中与甲醛也可以很顺利地进行羟醛缩合, 所形成的反应产物10在外接环上构建了烯酮结构.由于12-位甲基通过插烯结构与E-环羰基形成联系, 因此, 相应地显示出较强的α-氢反应活性.首先, 在氢氧化锂促进下形成负碳离子10'a, 进而互变异构成烯醇氧负离子10'b, 接着与空气中的氧分子发生作用生成氧化产物11, 其C(12)-甲酰基与甲基溴化镁的格氏反应以及直接的酸催化脱水, 在12-位上引进了一个乙烯基, 顺利地得到连有三个端烯的二氢卟吩12 (Scheme 3).
烯酮10的131-位酮羰基在冰浴中与甲基溴化镁可以优先于C(17)-尾端酯基发生反应, 其目的是期望格氏产物13脱水后在外接环上形成一个丁二烯结构, 可能因为设计产物13'的反应活性太强, 或者外接环张力过大(其外接环上的5个碳原子都是以sp2的杂化形式存在), 所以, 该反应得到非常复杂的混合产物; 当3-位引入甲酰基后, 乙烯基溴化镁发生格氏反应选择性地发生在3a-位上, 其外接环的酮羰基和17-位的长链酯羰基对反应均未参与反应, 然后经混合氧化剂氧化, 在3-位上构建了具有高反应活性的端位烯酮结构.
1.2 (甲)乙烯化叶绿素类二氢卟吩的光敏杀菌活性
光动力治疗(Photodynamic therapy, PDT)是通过光、氧和光敏剂的组合作用而实施的一种非侵入性临床治疗方法, 它利用光敏剂对生物组织的选择性光损伤而达到治疗目的.近年来, 卟啉类光敏剂的光动力抑菌研究已经广泛地应用于治疗各种细菌感染疾病[11], 但有关深度修饰的叶绿素降解产物的相应研究则鲜为报道.因此, 探讨新型叶绿素类二氢卟吩的光敏杀菌作用具有重要的意义.分别选择1a、3、5、7、10~13和17为待测化合物, 以青霉素钠为对照品, 在光照条件下, 对金黄色葡萄球菌(Staphylococcus aureus ATCC 25922)和大肠杆菌(Escherichia coli ATCC 25923)的光动力抑制作用进行测定, 其测定结果如表 1所示.
 表 1
光照下叶绿素类二氢卟吩对金黄色葡萄球菌(ATCC 25923)和大肠杆菌(ATCC 25922)的抑制作用
Table 1.
The bactericidal activities of chlorophyllous chlorins on Staphylococcus aureus (ATCC 25923) and Escherichia coli (ATCC 25922) under photoirradiation
表 1
光照下叶绿素类二氢卟吩对金黄色葡萄球菌(ATCC 25923)和大肠杆菌(ATCC 25922)的抑制作用
Table 1.
The bactericidal activities of chlorophyllous chlorins on Staphylococcus aureus (ATCC 25923) and Escherichia coli (ATCC 25922) under photoirradiation
浓度/
(mmol•L -1)菌落数(金黄色葡萄球菌/大肠杆菌) 1a 3 5 7 10 11 12 13 17 青霉素钠 0.01 520/2810 470/2390 440/2290 525/2940 680/3632 515/2690 790/2645 465/2400 630/3780 4680/— 0.02 240/2160 190/1630 185/1550 260/2260 430/2720 225/2090 335/2040 200/1870 400/3010 4400/— 0.03 90/1080 66/860 60/729 105/1410 210/1860 82/1910 185/1410 72/1008 230/1938 2200/— 0.06 6/180 0/140 0/120 10/300 40/810 4/920 82/215 0/145 66/1005 1890/— 0.12 0/100 0/80 0/76 0/160 0/612 0/680 0/160 0/92 0/720 490/— 0.24 0/66 0/22 0/20 0/98 0/248 0/286 0/80 0/34 0/310 260/— 表 1 光照下叶绿素类二氢卟吩对金黄色葡萄球菌(ATCC 25923)和大肠杆菌(ATCC 25922)的抑制作用
Table 1. The bactericidal activities of chlorophyllous chlorins on Staphylococcus aureus (ATCC 25923) and Escherichia coli (ATCC 25922) under photoirradiation从表 1可知, 所有测试的叶绿素类二氢卟吩对金黄色葡萄球菌均表现出明显的杀灭作用, 但在相同条件下对大肠杆菌的抑制效果相对较低.以二氢卟吩醇3为例, 当其浓度为0.06 mmol/L时对金黄色葡萄球菌就可达到完全抑制的程度; 但在同等浓度下对大肠杆菌的杀灭能力相对较弱, 直到其浓度增至0.24 mmol/L, 对大肠杆菌也没有形成完全杀灭.其结果或可归因于大肠杆菌细胞膜相对致密, 其特定结构不仅限制了叶绿素类二氢卟吩与细胞膜的结合, 同时也阻断了单线态氧等活性质点对细胞膜的破坏作用.
相对青霉素钠而言, 所有叶绿素二氢卟吩均表现出更高的抗菌活性.化合物1a、7和11对金黄色葡萄球菌的杀灭能力相似, 化合物10、12和17的光动力活性相对较弱, 而在C-D环端向连有羟基的叶绿素衍生物3, 5和13对相应的菌群则具有较强的光毒损伤作用.例如, 当青霉素钠的浓度达到0.12 mmol/L的时候, 其菌落数才降至500以下; 而相同浓度的二氢卟吩醇却可以将菌落数减少为零, 完全抑制了金黄色葡萄球菌的生长.二氢卟吩醇3, 5和11在浓度为0.06 mmol/L时, 其菌落数均已降为零.二氢卟吩11和12的极性差别来自于12-位取代基的性质, 其光敏杀菌能力也与其分子极性成正比, 即二氢卟吩醛11的PDT活性远优于二乙烯基取代的二氢卟吩二氢卟吩12.这些测试结果表明, 所连接的取代基团的极性越高, 其光动力抗菌活性越强.与此同时, 对相应的二氢卟吩也进行了非光照的对照实验, 在此条件下的叶绿素降解产物对金黄色葡萄球菌只产生微弱的抑制作用, 由此充分反映出该类四吡咯大环化合物具有高光毒性和低暗毒性的特殊性质, 符合作为理想光敏剂所应具备的基本要求[8].
2 结论
利用叶绿素类二氢卟吩芳香性大环上的活性反应区域, 通过羟醛缩合和氧化反应构建含氧官能结构, 再通过Grignard反应、酸催化脱水和水解重排反应, 在周环的不同位置上引进了具有较高反应活性的甲烯基或者乙烯基, 完成了一系列未见报道的多端烯基取代的叶绿素类二氢卟吩的合成; 相应的光敏抗菌实验表明, 叶绿素类二氢卟吩具有良好的光动力生物活性.沿着N21-N23轴向建立具有端烯特征的碳碳双键, 不仅在叶绿素二氢卟吩周环上建立了新的反应位点, 同时也能够促成大环分子的其他性质产生规律性的变化, 为获取新型四吡咯大环分子以及完善其物理、化学、生物等诸多性质, 提供了有效的切入手段和必要的理论依据.
3 实验部分
3.10 3-烯丙酰基-3-去乙烯基焦脱镁叶绿酸-a甲酯(15)的合成
在25 mL的干燥二氯甲烷中溶解139 mg二氢卟吩醇14 (0.240 mmol), 在氮气保护下迅速加入20 mg N-甲基吗啉氧化物并避光搅拌15 min, 再小量分批加入30 mg高钌酸四丙基铵(TPAP), 约搅拌1.5 h后反应结束, 再加入10%的乙酸溶液搅拌反应1 h, 静置过夜后分出水层, 水层用二氯甲烷萃取(15 mL×3), 合并有机层并用无水硫酸钠干燥, 除去溶剂, 剩余物经硅胶柱层析分离[洗脱剂: V(乙酸乙酯):V(正己烷)=1:4], 得到65 mg绿色固体15 (0.113 mmol), 产率为47%. m.p. 206~219 ℃; UV-Vis (CHCl3) λmax [ε/(L•mol-1•cm-1)]: 414 (1.07×105), 514 (3.28×103), 543 (1.17×104), 610 (1.79×102), 678 (3.25×104) nm; 1H NMR (400 MHz, CDCl3) δ:-1.98 (br s, 1H, NH), 0.03 (br s, 1H, NH), 1.74 (t, J=7.6 Hz, 3H, 8-CH3), 1.84 (d, J=7.2 Hz, 3H, 18-CH3), 2.20~2.36 (m, 1H, 17a+17b-H), 2.56~2.64 (m, 2H, 17a+17b-H), 2.66~2.78 (m, 1H, 17a+17b-H), 3.25, 3.54, 3.62, 3.72 (each s, each 3H, CH3+OCH3), 3.73 (q, J=7.6 Hz, 2H, 8a-CH2), 4.38 (d, J=8.4 Hz, 1H, 17-H), 4.57 (q, J=7.2 Hz, 1H, 18-H), 5.18 (d, J=19.8 Hz, 1H, 132-H), 5.34 (d, J=19.8 Hz, 1H, 132-H), 6.35 (dd, J=10.6, 1.0 Hz, 1H, cis-3c-H), 6.54 (dd, J=17.0, 1.0 Hz, 1H, trans-3c-H), 7.47 (dd, J=17.0, 10.6 Hz, 1H, 3b-H), 8.77, 9.64, 9.65 (each s, each 1H, meso-H); IR (KBr) ν: 3419 (N—H), 2940, 2917 (C—H), 1738, 1686 (C=O), 1669 (C=C), 1526(chlorin skeleton), 1424, 1388, 1252, 1174, 999 cm-1; EI-MS m/z: 577.4 (M+H+). Anal. calcd for C35H36N4O4: C 72.90, H 6.29, N 9.72; found C 73.04, H 6.44, N 9.89.
3.1 仪器与试剂
元素分析用Perkin-Elmer 2400型元素分析仪测定; IR用Perkin-Elmer 1730型红外分光光度仪测定(KBr压片); UV-Vis用UV-160A型紫外分光光度计测定; 1H NMR用Brucker ARX-400型核磁共振仪测定, 内标为TMS.所用试剂均为分析纯或化学纯.脱镁叶绿酸-a甲酯(1a)和焦脱镁叶绿酸-a甲酯(9a)按文献[12]制备; 焦脱镁叶绿酸-b甲酯(1b)按文献[13]制备.
3.11 12a(R/S)-12-(1-羟乙基)-12-去甲基焦脱镁叶绿酸-a甲酯(16)的合成
以二氢卟吩醛9b替代MPb(1b), 按照制备化合物8的方法合成.得绿色固体16, 产率57%. m.p. 226~229 ℃; UV-Vis (CHCl3) λmax [ε/(L•mol-1•cm-1)]: 413 (1.16×105), 510 (1.27×104), 524 (8.67×102), 609 (6.11×103), 666 (5.12×104) nm; 1H NMR (400 MHz, CDCl3) δ:-1.26 (-1.27) (br s, 1H, NH), 0.70 (br s, 1H, NH), 1.65 (1.64) (t, J=7.6 Hz, 3H, 8-CH3), 1.80 (1.78) (d, J=7.2 Hz, 3H, 18-CH3), 2.14 (2.01) (d, J=6.6 Hz, 3H, 12a-CH3), 2.23~2.27 (m, 2H, 17a+17b-H), 2.51~2.73 (m, 1H, 17a+17b-H), 3.15, 3.35, 3.63 (each s, each 3H, CH3+OCH3), 3.60 (3.58) (q, J=7.6 Hz, 2H, 8a-CH2), 4.24 (d, J=7.2 Hz, 1H, 17-H), 4.42 (q, J=7.2 Hz, 1H, 18-H), 4.87 (br s, 1H, 12-OH), 6.15 (d, J=11.6 Hz, 1H, cis-12b-H), 6.24 (d, J=17.8 Hz, 1H, trans-3b-H), 6.42 (t, J=6.6 Hz, 1H, 12a-H), 7.91 (dd, J=17.8, 11.6 Hz, 1H, 3a-H), 8.45, 9.19, 9.35 (9.33) (each s, each 1H, meso-H); IR (KBr) ν: 3418 (N—H), 2846 (C—H), 1719, 1698 (C=O), 1600 (C=C), 1500 (chlorin skeleton), 1432, 1393, 1252, 1158, 1080, 893 cm-1; EI-MS m/z: 579.4 (M+H+). Anal. calcd for C35H38N4O4: C 72.64, H 6.62, N 9.68; found C 76.51, H 6.84, N 9.87.
3.12 12-乙烯基-12-去甲基焦脱镁叶绿酸-a甲酯(17)的合成
将124 mg 16 (0.214 mmol)溶解于15 mL干燥的甲苯中, 加入3 mg对甲苯磺酸, 氮气保护, 90 ℃搅拌反应0.5 h, 先后加入20 mL水和20 mL二氯甲烷, 分出有机层, 水层用二氯甲烷萃取(15 mL×3), 合并有机层并用无水硫酸钠干燥, 除去溶剂, 剩余物经硅胶柱层析分离[洗脱剂: V(乙酸乙酯):V(正己烷)=1:4], 得到82 mg绿色固体17 (0.146 mmol), 产率为68%. m.p. 186~189 ℃; UV-Vis (CHCl3) λmax [ε/(L•mol-1•cm-1)]: 404 (1.21×105), 418 (8.29×103), 556 (7.96×102), 609 (6.11×103), 682 (6.12×104) nm; 1H NMR (400 MHz, CDCl3) δ:-1.07 (br s, 1H, NH), -0.12 (br s, 1H, NH), 1.67 (t, J=7.6 Hz, 3H, 8-CH3), 1.79 (d, J=7.2 Hz, 3H, 18-CH3), 2.14 (2.01) (d, J=6.6 Hz, 3H, 12a-CH3), 2.25~2.36 (m, 2H, 17a+17b-H), 2.52~2.59 (m, 1H, 17a+17b-H), 2.64~2.71 (m, 1H, 17a+17b-H), 3.18, 3.35, 3.62 (each s, each 3H, CH3+OCH3), 3.67 (q, J=7.6 Hz, 2H, 8a-CH2), 4.23 (d, J=8.2 Hz, 1H, 17-H), 4.41 (q, J=7.2 Hz, 1H, 18-H), 5.09 (d, J=19.6 Hz, 1H, 132-H), 5.24 (d, J=19.6 Hz, 1H, 132-H), 6.16 (d, J=11.6 Hz, 2H, cis-3b+12b-H), 6.24 (d, J=17.8 Hz, 1H, trans-3b-H), 7.62 (d, J=17.2 Hz, 1H, trans-12b-H), 7.92 (dd, J=17.8, 11.6 Hz, 1H, 3a-H), 8.21 (dd, J=17.2, 11.0 Hz, 1H, 12a-H), 8.42, 9.21, 9.49 (each s, each 1H, meso-H); IR (KBr) ν: 3409 (N—H), 2935 (C—H), 1737, 1694 (C=O), 1605 (C=C), 1525 (chlorin skeleton), 1385, 1256, 1166, 1077, 892, 778 cm-1; EI-MS m/z: 561.4 (M+H+). Anal. calcd for C35H36N4O3: C 74.98, H 6.47, N 9.99; found C 75.11, H 6.64, N 10.17.
3.13 体外光动力抗菌活性的测定
待测样品和对照品:分别选择化合物1a、3、5、7、10~13和17为待测化合物, 选择临床药物青霉素钠为对照品, 将样品和对照分别溶于DMSO和水配置成10 mmol•L-1的母液待用.
菌体培养及PDT抑菌测定:将冻存菌种熔化后接入营养肉汤培养基, 37 ℃摇床培养24 h.再分别适量移接至新鲜培养基中, 37 ℃振荡培养直至对数生长后期, 该菌悬液以1:100~1:50的比例接种于100 mL LB液体培养基中, 37 ℃振荡培养至OD600=0.5, 采用分光光度计测定, 将试验菌用液体培养基稀释至所需浓度.用微量加样器分别取5 μL试验菌稀释液, 放入待测样品及对照品两个系列梯度液试管中, 一个迅速置于暗处; 另一个用BioSpec LED (670~700 nm)作为光源距20 cm照射30 min (2.0 J/cm2).用微量加样器分别从试管中取5 μL到制好的LB培养基培养基平皿中, 迅速均匀涂板, 然后倒置于(36±1) ℃培养箱中, (24±2) h后取出并进行菌落计数并绘制菌落群-样品浓度曲线.
3.2 15a-甲烯基二氢卟吩-e6-13, 17-二甲酯(3)和15a(R/S)-二氢卟吩-e6-13, 15a-ε-己内酯-1-单甲酯(4)的合成
在30 mL二氯甲烷中溶解487 mg MPa (1) (0.803 mmol), 搅拌下先后加入3 mL 40%的甲醛水溶液和150 mg碘, 室温搅拌8 h后, 再加入20 mL二氯甲烷和40 mL水, 分出有机相.水相用二氯甲烷萃取(15 mL×2), 合并有机相并浓缩至干.将所得化合物2的粗产物重新溶解于25 mL由氢氧化钠饱和的甲醇溶液, 用氮气充分保护后室温搅拌1 h.将反应混合物倒入20 mL水中, 用稀硫酸调pH至2~3, 加入70 mL二氯甲烷后分出水层.水层用二氯甲烷萃取(20 mL×3), 合并有机相, 用无水硫酸钠干燥后减压除尽溶剂, 剩余物经硅胶柱层析分离[洗脱剂: V(乙酸乙酯):V(石油醚)=1:6], 得到138 mg绿色固体3 (0.217 mmol, 27%)和21 mg绿色固体4 (0.032 mmol, 4%).
3: m.p. 234~237 ℃; UV-Vis (CH2Cl2) λmax [ε/(L• mol-1•cm-1)]: 420 (8.98×104), 518 (7.64×103), 546 (3.15×104), 632 (2.84×104), 665 (4.67×104) nm; 1H NMR (400 MHz, CDCl3) δ: -1.56 (br s, 1H, NH), 0.57 (br s, 1H, NH), 1.73 (t, J=7.6 Hz, 3H, 8-CH3), 1.87 (d, J=7.2 Hz, 3H, 18-CH3), 1.64~1.77 (m, 1H, 17a+17b-H), 1.86~1.96 (m, 1H, 17a+17b-H), 2.09~2.18 (m, 1H, 17a+17b-H), 2.25~2.35 (m, 1H, 17a+17b-H), 3.32, 3.43, 3.50, 3.68, 3.96 (each s, each 3H, CH3+OCH3), 3.78 (q, J=7.6 Hz, 2H, 8a-H), 4.21 (d, J=7.6, 2.2 Hz, 1H, 17-H), 4.47 (dd, J=17.0, 7.2 Hz, 1H, 18-H), 6.17 (d, J=11.6 Hz, 1H, cis-3b-H), 6.37 (d, J=18.0 Hz, 1H, trans-3b-H), 6.31 (s, 1H, 15a-methylene-H), 7.59 (s, 1H, 15a-methylene-H), 8.08 (dd, J=18.0, 11.6 Hz, 1H, 3a-H), 8.84, 9.64, 9.73 (each s, each 1H, meso-H); 13C NMR (400 Hz, CDCl3) δ: 192.1, 182.2, 175.5, 173.3, 167.7, 154.1, 152.4, 150.0, 145.2, 143.0, 142.8, 137.1, 137.0, 136.2, 134.7, 133.2, 131.2, 128.8, 128.5, 128.4, 127.1, 123.1, 121.6, 115.8, 103.2, 121.2, 95.3, 52.6, 51.8, 49.4, 32.2, 31.6, 23.6, 19.0, 17.0, 11.9, 10.9; IR (KBr) v: 3449 (N—H), 2924 (C—H), 1742, 1708 (C=O), 1686 (C=C), 1560 (chlorin skeleton), 1457, 1341, 1082, 1040, 971 cm-1; EI-MS m/z: 637.5 (M+H+). Anal. calcd for C37H40N4O6: C 69.79, H 6.33, N 8.80; found C 69.66, H 6.24, N 8.98.
4: m.p. 205~207 ℃; UV-Vis (CH2Cl2) λmax [ε/(L• mol-1•cm-1)]: 418 (9.13×104), 509 (7.57×103), 558 (3.11×104), 644 (1.98×104), 668 (4.24×104) nm; 1H NMR (400 MHz. CDCl3) δ: -1.62 (-1/58) (br s, 1H, NH), 0.43 (br s, 1H, NH), 1.72 (1.71) (t, J=7.6 Hz, 3H, 8-CH3), 1.97 (d, J=7.2 Hz, 3H, 18-CH3), 2.17~2.33 (m, 1H, 17a+17b-H), 2.55~2.75 (m, 2H, 17a+17b-H), 2.79~3.03 (m, 1H, 17a+17b-H), 3.26 (3.25), 3.30 (3.89), 3.60 (3.58), 3.71 (3.70) (each s, each 3H, CH3+OCH3), 3.68~3.74 (m, 2H, 8a-H), 4.47 (4.43) (q, J=7.2 Hz, 1H, 18-H), 4.47 (4.43) (dd, J=9.2, 1.8 Hz, 1H, 17-H), 4.39~4.51 (m, 2H, 15a-CH2O), 5.55 (5.45) (dd, J=10.0, 3.2 Hz, 1H, 15a-H), 6.21 (dd, J=11.6, 1.2 Hz, 1H, cis-3b-H), 6.31 (dd, J=17.8, 1.2 Hz, 1H, trans-3b-H), 8.01 (dd, J=17.8, 11.6 Hz, 1H, 3a-H), 8.60, 9.41 (9.39), 9.57 (9.55) (each s, each 1H, meso-H); IR (KBr) v: 3443 (N—H), 2832 (C—H), 1739, 1688 (C=O), 1653 (C=C), 1527 (chlorin skeleton), 1400, 1287, 1189, 793 cm-1; EI-MS m/z: 637.5 (M+H+). Anal. calcd for C37H40N4O6: C 69.79, H 6.33, N 8.80; found C 69.91, H 6.60, N 8.71.
3.3 15a-甲烯基二氢卟吩-e6-13-羟甲基酯-15, 17-二甲酯(5)、15a-甲烯基二氢卟吩-e6-13-甲酰基酯-15, 17-二甲酯(6)和15a-甲烯基二氢卟吩-e6三甲酯(7)的合成
在10 mL四氢呋喃中溶解686 mg 1a (1.131 mmol)和120 mg研细的多聚甲醛, 在氮气充分保护下, 加入30 mL由氢氧化钾饱和的甲醇溶液, 室温搅拌反应5 h; 用浓盐酸调节pH值至2~3, 先后加入200 mL水和100 mL二氯甲烷分层, 分出有机相, 水相用二氯甲烷萃取(30 mL×2), 合并有机层, 水洗两次后用无水硫酸钠干燥, 用重氮甲烷甲基化后除去溶剂, 剩余物经硅胶柱层析分离[洗脱剂: V(乙酸乙酯):V(正己烷)=1:6], 得到91 mg绿色固体5 (0.136 mmol, 12%)、60 mg绿色固体6(0.091 mmol, 8%)和191 mg绿色固体7(0.294 mmol, 26%).
5: m.p. 231~234 ℃; UV-Vis (CHCl3) λmax [ε/(L• mol-1•cm-1)]: 423 (6.43×104), 519 (4.32×103), 546 (1.98×104), 631 (6.27×103), 665 (4.54×104) nm; 1H NMR (400 MHz. CDCl3) δ: -1.56 (br s, 1H, NH), 0.61 (br s, 1H, NH), 1.73 (t, J=7.6 Hz, 3H, 8-CH3), 1.87 (d, J=7.2 Hz, 3H, 18-CH3), 1.60~1.71 (m, 1H, 17a+17b-H), 1.76~1.90 (m, 1H, 17a+17b-H), 1.96~2.08 (m, 1H, 17a+17b-H), 2.14~2.36 (m, 1H, 17a+17b-H), 3.29, 3.38, 3.47, 3.61, 3.91 (each s, each 3H, CH3+OCH3), 3.77 (q, J=7.6 Hz, 2H, 8a-H), 4.08 (dd, J=9.2, 2.4 Hz, 1H, 17-H), 4.42 (d, J=7.2 Hz, 1H, 18-H), 5.97 (d, J=6.0 Hz, 2H, 13-CO2CH2OH), 6.15 (d, J=11.2 Hz, 1H, cis-3b-H), 6.09 (s, 1H, 15a-methylene-H), 6.25 (d, J=6.0 Hz, 2H, 13-CO2CH2OH), 6.35 (d, J=18.0 Hz, 1H, trans-3b-H), 7.29 (s, 1H, 15a-methylene-H), 8.06 (dd, J=18.0, 11.2 Hz, 1H, 3a-H), 8.78, 9.60, 9.71 (each s, each 1H, meso-H); 13C NMR (400 Hz, CDCl3) δ: 195.9, 173.4, 170.2, 169.0, 154.7, 152.1, 150.3, 148.6, 144.4, 139.6, 138.8, 136.9, 134.2, 131.6, 129.8, 126.1, 106.6, 103.3, 99.0, 93.8, 52.0, 51.7, 49.6, 48.1, 31.0, 29.7, 19.9, 19.2, 17.2, 11.9, 10.8; IR (KBr) v: 3427 (N—H), 2925 (C—H), 1738, 1687 (C=O), 1612 (C=C), 1550 (chlorin skeleton), 1450, 1329, 1242, 1175, 1016, 980 cm-1; EI-MS m/z: 667.2 (M+H+). Anal. calcd for C38H42N4O7: C 68.45, H 6.35, N 8.40; found C 68.29, H 6.31, N 8.59;
6: m.p. 226~229 ℃; UV-Vis (CHCl3) λmax [ε/(L• mol-1•cm-1)]: 422 (6.65×104), 522 (4.25×103), 544 (2.07×104), 630 (6.30×103), 665 (4.52×104) nm; 1H NMR (400 MHz, CDCl3) δ: -0.61 (br s, 1H, NH), 0.60 (br s, 1H, NH), 1.70 (t, J=7.6 Hz, 3H, 8-CH3), 1.83 (d, J=6.8 Hz, 3H, 18-CH3), 1.62~1.75 (m, 1H, 17a+17b-H), 1.80~1.93 (m, 1H, 17a+17b-H), 1.96~2.15 (m, 1H, 17a+17b-H), 2.30~2.42 (m, 1H, 17a+17b-H), 3.24, 3.40, 3.48, 3.64, 3.92 (each s, each 3H, CH3+OCH3), 3.75 (q, J=7.6 Hz, 2H, 8a-H), 4.17 (d, J=7.6 Hz, 1H, 17-H), 4.44 (q, J=6.8 Hz, 1H, 18-H), 6.15 (d, J=11.2 Hz, 1H, cis-3b-H), 6.36 (d, J=17.8 Hz, 1H, trans-3b-H), 8.08 (dd, J=17.8, 11.2 Hz, 1H, 3a-H), 6.28 (s, 1H, 15a-methylene-H), 7.56 (s, 1H, 15a-methylene-H), 7.87 (s, 13-CO2CHO), 8.81, 9.63, 9.70 (each s, each 1H, meso-H); IR (KBr) v: 3434 (N—H), 2858 (C—H), 1739, 1689 (C=O), 1623 (C=C), 1562 (chlorin skeleton), 1460, 1343, 1218, 1160, 1027, 905 cm-1; EI-MS m/z: 665.4 (M+H+). Anal. calcd for C38H40N4O7: C 68.66, H 6.07, N 8.43; found C 68.79, H 6.19, N 8.58;化合物7的分析数据与文献[14]一致.
3.4 7-(1-羟乙基)-7-去甲酰基脱镁叶绿酸-b甲酯(8)的合成
将92 mg MPb (1b) (0.148 mmol)溶解于10 mL干燥的四氢呋喃中, 氮气保护下于0 ℃搅拌缓慢滴加0.3 mL浓度为1 mol/L的甲基溴化镁乙醚溶液, 搅拌反应5 min, 向反应体系加入15 mL冰水, 移去冰水浴并搅拌10 min; 加入20 mL二氯甲烷分层, 分出有机层, 水层用二氯甲烷萃取(15 mL×2), 合并有机层, 用无水硫酸钠干燥, 减压除去溶剂, 剩余物经硅胶柱层析分离[洗脱剂: V(乙酸乙酯):V(正己烷)=1:4], 得到88 mg黄绿色固体8 (0.083 mmol), 产率为56%. m.p. 251~253 ℃; UV-Vis (CHCl3) λmax [ε/(L•mol-1•cm-1)]: 405 (1.21×105), 510 (4.84×103), 541 (1.21×104), 607 (8.47×103), 664 (6.05×104) nm; 1H NMR (400 MHz, CDCl3) δ:-1.69 (br s, 1H, NH), 0.37 (br s, 1H, NH), 1.70 (1.76) (t, J=7.6 Hz, 3H, 8-CH3), 1.57 (d, J=7.2 Hz, 3H, 18-CH3), 2.17 (2.19) (d, J=6.4 Hz, 3H, 7a-CH3), 1.97~2.32 (m, 2H, 17a+17b-H), 2.44~2.65 (m, 2H, 17a+17b-H), 3.39 (3.37). 3.57 (3.56), 3.67, 3.89 (each s, each 3H, CH3+OCH3), 3.58~3.70 (m, 2H, 8a-CH2), 4.22 (d, J=8.4 Hz, 1H, 17-H), 4.45 (q, J=7.2 Hz, 1H, 18-H), 6.18 (d, J=10.8 Hz, 1H, cis-3b-H), 6.11~6.23 (m, 1H, 7a-H), 6.24 (s, 1H, 132-H), 6.32 (d, J=18.0 Hz, 1H, trans-3b-H), 7.97 (dd, J=18.0, 10.8 Hz, 1H, 3a-H), 8.81, 9.63, 9.70 (each s, each 1H, meso-H); 13C NMR (400 Hz, CDCl3)δ: 203.1, 173.5, 171.3, 161.3, 156.7, 148.9, 145.1, 141.5, 137.8, 136.0, 131.0, 129.6, 128.3, 126.4, 122.5, 109.1, 104.8, 97.2, 93.1, 56.6, 51.7, 50.9, 50.1, 39.1, 31.2, 30.0, 25.8, 23.4, 19.4, 17.4, 12.1, 11.2; IR (KBr) ν: 3409 (N—H), 2960 (C—H), 1726, 1689 (C=O), 1647 (C=C), 1550 (chlorin skeleton), 1460, 1380, 1271, 1205, 1143, 1070 cm-1; EI-MS m/z: 637.6 (M+H+). Anal. calcd for C37H40N4O6: C 69.79, H 6.33, N 8.80; found C 69.61, H 6.48, N 8.78.
3.5 132-甲烯基焦脱镁叶绿酸-a甲酯(10)的合成
以MPPa (9)替代MPa (1a), 按照制备化合物2的方法合成, 得黄色固体10, 产率38%.物理常数与分析数据与文献[10]一致.
3.6 132-甲烯基-12-甲酰基-12-去甲基焦脱镁叶绿酸-a甲酯(11)的合成
在5 mL水中溶解1.2 g LiOH, 再加入15 mL甲醇稀释, 然后倒入含有128 mg二氢卟吩烯酮10 (0.228 mmol)的25 mL四氢呋喃中, 敞口剧烈搅拌3 h后, 用25%硫酸溶液调至pH为2~3, 用二氯甲烷萃取(100 mL×3), 合并有机层后用无水硫酸钠干燥.减压除去溶剂, 重新溶解于25 mL含有5%硫酸的甲醇溶液中, 搅拌过夜, 先后加入30 mL水和45 mL二氯甲烷, 分出有机层, 水洗两次后用无水硫酸钠干燥, 减压除去溶剂, 剩余物经硅胶柱层析分离[洗脱剂: V(乙酸乙酯):V(正己烷)=1:4], 得到28 mg黄绿色固体11 (0.048 mmol), 产率21%. m.p. 229~232 ℃; UV-Vis (CHCl3) λmax [ε/(L•mol-1•cm-1)]: 412 (1.16×105), 510 (4.41×104), 544 (5.80×103), 609 (1.97×104), 698 (1.07×105) nm; 1H NMR (400 MHz, CDCl3) δ:-0.32 (br s, 1H, NH), 0.56 (br s, 1H, NH), 1.60 (t, J=7.6 Hz, 3H, 8-CH3), 1.79 (d, J=7.2 Hz, 3H, 18-CH3), 1.93~2.08 (m, 1H, 17a+17b-H), 2.36~2.44 (m, 2H, 17a+17b-H), 2.62~2.71 (m, 1H, 17a+17b-H), 3.03, 3.29, 3.69 (each s, each 3H, CH3+OCH3), 3.52 (q, J=7.6 Hz, 2H, 8a-H), 4.44 (d, J=9.4 Hz, 1H, 17-H), 4.36 (d, J=7.2 Hz, 1H, 18-H), 6.17 (d, J=11.6 Hz, 1H, cis-3b-H), 6.24 (d, J=18.0 Hz, 1H, trans-3b-H), 6.52 (s, 1H, 132-methylene-H), 6.84 (s, 1H, 132-methylene-H), 7.80 (dd, J=18.0, 11.6 Hz, 1H, 3a-H), 8.36, 8.91, 9.94 (each s, each 1H, meso-H), 11.38 (s, 1H, CHO); IR (KBr) v: 3445 (N—H), 2925 (C—H), 1742, 1700 (C=O), 1662 (C=C), 1500 (chlorin skeleton), 1347, 1259, 1093, 1021, 801 cm-1; EI-MS m/z: 575.6 (M+H+). Anal. calcd for C35H34N4O4: C 73.15, H 5.96, N 9.75; found C 73.31, H 6.02, N 9.87;
3.7 132-甲烯基-12-乙烯基-12-去甲基焦脱镁叶绿酸-a甲酯(12)的合成
将92 mg二氢卟吩醛11 (0.160 mmol)溶解于10 mL干燥的四氢呋喃中, 氮气保护下于0 ℃搅拌缓慢滴加0.3 mL浓度为1 mol/L的甲基溴化镁乙醚溶液, 搅拌反应5 min, 然后再向反应体系加入15 mL冰水和20 mL二氯甲烷分层, 分出有机层浓缩至干, 重新溶解于10 mL含有10 mg对甲苯磺酸的干燥甲苯溶液中, 50 ℃搅拌反应1 h后加入15 mL水, 分出有机相, 水相用二氯甲烷萃取(15 mL×2), 合并有机层, 用无水硫酸钠干燥, 减压除去溶剂, 剩余物经硅胶柱层析分离[洗脱剂: V(乙酸乙酯):V(正己烷)=1:6], 得到38 mg绿色固体12 (0.066 mmol), 产率为41%. m.p. 211~214 ℃; UV-Vis (CHCl3) λmax [ε/(L•mol-1•cm-1)]: 410 (1.21×105), 471 (4.84×103), 503 (1.21×104), 536 (1.09×103), 607 (8.47×103), 684 (6.05×104) nm; 1H NMR (400 MHz, CDCl3) δ:-1.38 (br s, 1H, NH), 0.56 (br s, 1H, NH), 1.67 (t, J=7.6 Hz, 3H, 8-CH3), 1.83 (d, J=7.2 Hz, 3H, 18-CH3), 2.01~2.07 (m, 1H, 17a+17b-H), 2.26~2.40 (m, 2H, 17a+17b-H), 2.62~2.69 (m, 1H, 17a+17b-H), 3.18, 3.39, 3.66 (each s, each 3H, CH3+OCH3), 3.62 (q, J=7.6 Hz, 2H, 8a-H), 4.50 (d, J=7.2 Hz, 1H, 18-H), 4.61 (d, J=9.2 Hz, 1H, 17-H), 6.18 (d, J=11.6 Hz, 1H, cis-3b-H), 6.24 (d, J=11.6 Hz, 1H, cis-12b-H), 6.28 (d, J=18.0 Hz, 1H, trans-3b-H), 6.54 (s, 1H, 132-methylene-H), 6.86 (s, 1H, 132-methylene-H), 7.78 (d, J=16.0, 11.6 Hz, 1H, 12a-H), 7.96 (dd, J=18.0, 11.6 Hz, 1H, 3a-H), 8.26 (dd, J=17.6, 11.6 Hz, 1H, 12a-H), 8.59, 9.31, 9.59 (each s, each 1H, meso-H); IR (KBr) ν: 3443 (N—H), 2951 (C—H), 1734, 1688 (C=O), 1651, 1637 (C=C), 1560 (chlorin skeleton), 1528, 1434, 1079, 904 cm-1; EI-MS m/z: 573.3 (M+H+). Anal. calcd for C36H36N4O3: C 75.50, H 6.34, N 9.78; found C 75.61, H 6.44, N 9.68.
3.8 131(R/S)-132-甲烯基-131-羟基-131-甲基-131-去氧焦脱镁叶绿酸-a甲酯(13)的合成
以二氢卟吩烯酮10替代MPb (1b), 按照制备化合物8的方法合成.得黄色固体13, 产率42%. m.p. 246~249℃; UV-Vis (CHCl3) λmax [ε/(L•mol-1•cm-1)]: 410 (1.01×105), 511 (1.27×104), 542 (1.12×103), 607 (7.39×103), 664 (5.96×104) nm; 1H NMR (400 MHz, CDCl3) δ:-2.89 (-2.74) (br s, 1H, NH), -1.45 (br s, 1H, NH), 1.73 (t, J=7.6 Hz, 3H, 8-CH3), 1.89 (d, 3H, J=7.2 Hz, 3H, 18-CH3), 1.96~2.17 (m, 1H, 17a+17b-H), 2.27~2.37 (m, 1H, 17a+17b-H), 2.60~2.83 (m, 2H, 17a+17b-H), 2.25 (2.12) (s, 3H, 131-CH3), 3.36, 3.61, 3.54 (3.53), 3.61 (each s, each 3H, CH3+OCH3), 3.80 (q, J=7.6 Hz, 8a-CH2), 4.64 (q, J=7.2 Hz, 1H, 18-H), 4.75 (d, J=8.8 Hz, 1H, 17-H), 6.18 (6.24) (s, 1H, 132-methylene-H), 6.43 (6.48) (s, 1H, 132-methylene-H), 6.15 (6.32) (d, J=11.6 Hz, 1H, cis-12b-H), 6.28 (6.33) (d, J=17.8 Hz, 1H, trans-3b-H), 8.19 (8.17) (dd, J=17.8, 11.6 Hz, 1H, 3a-H), 8.94 (8.92), 9.61 (9.63), 9.83 (9.79) (each s, each 1H, meso-H); IR (KBr) ν: 3448 (N—H), 2915 (C—H), 1732, 1686 (C=O), 1614 (C=C), 1550 (chlorin skel-eton), 1496, 1360, 1220, 1166, 1110, 977 cm-1; EI-MS m/z: 577.4 (M+H+). Anal. calcd for C36H40N4O3: C 74.97, H 6.99, N 9.71; found C 75.11, H 6.84, N 9.59.
3.9 3-(1-羟烯丙基)-3-去乙烯基焦脱镁叶绿酸-a甲酯(14)的合成
将352 mg MPPa (9a) (0.642 mmol)溶解在15 mL四氢呋喃中, 加入0.5 mL吡啶, 冷却到0 ℃, 剧烈搅拌条件下加入含有180 mg (0.678 mmol)四氧化锇的8 mL四氢呋喃溶液, 混合液在0 ℃下搅拌反应30 min, 然后室温搅拌2 h后, 加入过量的在50%甲醇水溶液中饱和的NaHSO3溶液, 继续搅拌40 min, 过滤, 先后向滤液加入40 mL二氯甲烷和40 mL水, 有机相干燥后减压浓缩.将浓缩物溶解于30 mL甲醇中; 同时将400 g (1.868 mmol) NaIO4溶解于20 mL水中, 再加入1 g硅胶.然后将两者合并, 反应体系的颜色迅速由墨绿色变为红棕色, 30 min后反应完毕, 加入150 mL水和180 mL二氯甲烷, 过滤, 分出有机层, 干燥, 减压除溶剂, 用一短硅胶层析柱分离出暗红色色带, 除去溶剂后溶解于25 mL干燥的四氢呋喃中, 氮气保护下于0 ℃搅拌缓慢滴加0.3 mL浓度为1 mol/L的烯丙基溴化镁乙醚溶液, 搅拌反应5 min后, 向反应体系加入25 mL饱和氯化铵溶液, 移去冰水浴并搅拌10 min; 再加入20 mL二氯甲烷, 分出有机层, 水相用二氯甲烷萃取(15 mL×2), 合并有机层, 用无水硫酸钠干燥, 减压除去溶剂, 剩余物经硅胶柱层析分离[洗脱剂: V(乙酸乙酯):V(正己烷)=1:6], 得到189 mg绿色固体14 (0.327 mmol), 产率为51%. m.p. 247~250 ℃; UV-Vis (CHCl3) λmax [ε/(L•mol-1• cm-1)]: 395 (1.21×105), 497 (4.84×103), 516 (1.09×103), 595 (1.21×104), 648 (3.05×104) nm; 1H NMR (400 MHz, CDCl3) δ:-3.30 (br s, 1H, NH), -1.47 (br s, 1H, NH), 1.73 (t, J=7.6 Hz, 3H, 8-CH3), 1.77 (d, J=7.2 Hz, 3H, 18-CH3), 2.02~2.39 (m, 2H, 17a+17b-H), 2.40~2.78 (m, 2H, 17a+17b-H), 3.30, 3.46, 3.52 (3.51), 3.56 (each s, each 3H, CH3+OCH3), 3.73 (q, J=7.6 Hz, 2H, 8a-CH2), 4.36~4.62 (m, 2H, 17-H+18-H), 4.96 (d, J=15.6 Hz, 1H, 132-H), 5.06 (d, J=15.6 Hz, 1H, 132-H), 5.36 (d, J=10.2 Hz, 1H, cis-3c-H), 5.64 (d, J=16.8 Hz, 1H, trans-3c-H), 6.60~6.70 (m, 1H, 3b-H), 6.71~7.79 (m, 1H, 3a-H), 8.78, 9.60, 9.95 (9.94) (each s, each 1H, meso-H); 13C NMR (400 Hz, CDCl3) δ: 198.2, 173.6, 168.4, 156.3, 153.1, 150.6, 144.2, 141.9, 138.8, 137.9, 136.2, 135.6, 135.0, 134.5, 133.2, 132.2, 130.2, 129.5, 129.3, 128.6, 128.5, 128.0, 126.9, 121.9, 110.2, 101.4, 99.9, 97.9, 93.1, 55.9, 52.9, 51.6, 51.3, 49.6, 37.4, 30.5, 28.7, 23.8, 19.5, 17.5, 12.2, 11.9, 11.3; IR (KBr) ν: 3407 (N—H), 2915, 2847 (C—H), 1736, 1696 (C=O), 1665 (=C), 1520 (chlorin skeleton), 1384, 1303, 1168, 1066, 983 cm-1; EI-MS m/z: 579.4 (M+H+). Anal. calcd for C35H38N4O4: C 72.64, H 6.62, N 9.68; found C 72.57, H 6.54, N 9.89.
-
-
[1]
Scheer, H. In Chlorophylls and Bacteriochlorophylls: Biochemistry, Biophysics, Functions and Applications, Vol. 1, Eds.: Grimm, B.; Porra, R. J.; Rüdiger, W.; Scheer, H, Springer, 2006, p. 1.
-
[2]
Tsuchiya, T.; Mizoguchi, T.; Akimoto, S.; Tomo, T.; Tamiaki, H.; Mimuro, M. Plant Cell Physiol. 2012, 53(3), 518. doi: 10.1093/pcp/pcs007
-
[3]
Hoober, J. K.; Eggink, L. L.; Chen, M. Photosynth. Res. 2007, 94, 387.
(b) Mizoguchi, T.; Shoji, A.; Kunieda, M.; Miyashita, H.; Tsuchiya, T.; Mimuro, M.; Tamiaki, H. Photochem. Photobiol. Sci. 2006, 5, 291. -
[4]
Wang, J.-J. Chin. J. Org. Chem. 2005, 25, 1353 (in Chinese).
(王进军, 有机化学, 2005, 25, 1353.)
(b) Xu, X.-S.; Yao, N-N.; Liu, Y.; Yin, J.-G.; Qi, C.-X.; Wang, J.-J. Chin. J. Org. Chem. 2014, 34, 938 (in Chinese).
(徐希森, 姚楠楠, 刘洋, 殷军港, 祁彩霞, 王进军, 有机化学, 2014, 34, 938.) -
[5]
Liu, Y.; Xu, X.-S.; Li, J.-Z.; Yin, J.-G.; Qi, C.-X.; Wang, J.-J. Chin. J. Org. Chem. 2014, 34, 552 (in Chinese).
(刘洋, 徐希森, 李家柱, 殷军港, 祁彩霞, 王进军, 有机化学, 2014, 34, 552.) -
[6]
Chen, Y. H.; Li, G. L.; Pandey, R. K. Curr. Org. Chem. 2004, 8, 1105.
(b) Morishita, H.; Tamiaki, H. Tetrahedron 2005, 61, 6097. -
[7]
(纪建业, 夏尚文, 刘洋, 殷军港, 祁彩霞, 王进军, 有机化学, 2014, 34, 1138.) doi: 10.6023/cjoc201401007Ji, J.-Y.; Xia, C.-W.; Liu, Y.; Yin, J.-G.; Qi, C.-X.; Wang, J.-J. Chin. J. Org. Chem. 2014, 34, 1138 (in Chinese). doi: 10.6023/cjoc201401007
-
[8]
Bellnier, D. A.; Greco, W. R.; Loewen, G. M.; Nava, H.; Oseroff, A. R.; Pandey, R. K.; Tsuchida, T.; Dougherty, T. J. Cancer Res. 2003, 63.
(b) Wang, J.-J.; Li, J.-Z.; Li, Y.-W.; Jakus, J.; Shim, Y.-K. J. Porphyrins Phthalocyanines 2010, 14, 859.
(c) Wang, J.-J.; Li, J.-Z.; Jakus. J.; Shim, Y. K. J. Porphyrins Phthalocyanines 2012, 16, 122 -
[9]
Ethirajan, M.; Chen, Y.-H.; Joshi, P.; Pandey, R. K. Chem. Soc. Rev. 2011, 40, 340. doi: 10.1039/B915149B
-
[10]
Kozyrev, R. K.; Chen, Y.-H.; Goswami, L. N.; Tabaczynski, W. A.; Pandey, R. K. J. Org. Chem. 2006, 71. 1949 doi: 10.1021/jo052334i
-
[11]
Li, J.-Z.; Zhang, P.; Zhang, S.-G.; Yin, J.-G.; Wang, J.-J. Org. Biol. Chem. 2015, 13, 1992. doi: 10.1039/C4OB02491E
-
[12]
Wainwringht, M.; Phoenix, D. A.; Marland, J. FEMS Immunol. Med. Microbiol. 1997, 19(1), 75.
(b) Wilson, M.; Burns, T.; Pratten, J. J. Appl. Bacteriol. 1995, 78, 569. -
[13]
Smith, K. M.; Gogg, D. A.; Simpson, D. J. J. Am. Chem. Soc. 1985, 107, 4946. doi: 10.1021/ja00303a021
-
[14]
(武进, 殷军港, 张千, 孙传民, 李付国, 裴文, 王进军, 有机化学, 2011, 31, 1653.) http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract340487.shtmlWu, J.; Yin, J.-G.; Zhang, Q.; Sun, C.-M.; Li, F.-G.; Pei, W.; Wang, J.-J. Chin. J. Org. Chem. 2011, 31, 1653 (in Chinese). http://sioc-journal.cn/Jwk_hxxb/CN/abstract/abstract340487.shtml
-
[15]
(殷军港, 王振, 杨泽, 刘超, 赵丽丽, 王进军, 有机化学, 2012, 32, 360.) doi: 10.6023/cjoc1108301Yin, J.-G.; Wang, Z.; Yang, Z.; Liu, C.; Zhao, L.-L.; Wang, J.-J. Chin. J. Org. Chem. 2012, 32, 360 (in Chinese). doi: 10.6023/cjoc1108301
-
[1]
-
表 1 光照下叶绿素类二氢卟吩对金黄色葡萄球菌(ATCC 25923)和大肠杆菌(ATCC 25922)的抑制作用
Table 1. The bactericidal activities of chlorophyllous chlorins on Staphylococcus aureus (ATCC 25923) and Escherichia coli (ATCC 25922) under photoirradiation
浓度/
(mmol•L -1)菌落数(金黄色葡萄球菌/大肠杆菌) 1a 3 5 7 10 11 12 13 17 青霉素钠 0.01 520/2810 470/2390 440/2290 525/2940 680/3632 515/2690 790/2645 465/2400 630/3780 4680/— 0.02 240/2160 190/1630 185/1550 260/2260 430/2720 225/2090 335/2040 200/1870 400/3010 4400/— 0.03 90/1080 66/860 60/729 105/1410 210/1860 82/1910 185/1410 72/1008 230/1938 2200/— 0.06 6/180 0/140 0/120 10/300 40/810 4/920 82/215 0/145 66/1005 1890/— 0.12 0/100 0/80 0/76 0/160 0/612 0/680 0/160 0/92 0/720 490/— 0.24 0/66 0/22 0/20 0/98 0/248 0/286 0/80 0/34 0/310 260/— -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 1397
- HTML全文浏览量: 165


 下载:
下载:


 下载:
下载:

