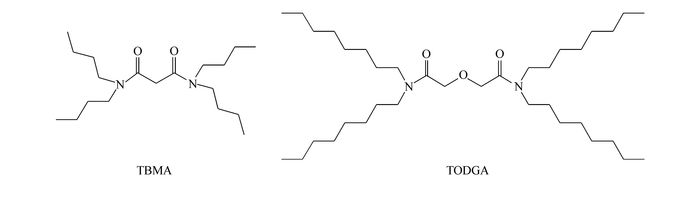
 图1
TBMA和TODGA分子结构图
Figure1.
The molecular structures of TBMA and TODGA
图1
TBMA和TODGA分子结构图
Figure1.
The molecular structures of TBMA and TODGA

Citation: SHANG Jiguang, SUN Guoxin. Extraction of Fe(Ⅲ) from Aluminum Chloride[J]. Chinese Journal of Applied Chemistry, 2018, 35(1): 75-81. doi: 10.11944/j.issn.1000-0518.2018.01.170040

氯化铝中萃取铁工艺
-
关键词:
- 高纯氯化铝
- / 提纯
- / 萃取
- / 铁
- / N, N, N', N'-四辛基-3-氧戊二酰胺
English
Extraction of Fe(Ⅲ) from Aluminum Chloride
-
高纯氯化铝在透明陶瓷、钇铝石榴石、高性能催化剂等新材料领域显示出广泛的应用前景。随着对原料氯化铝纯度的要求越来越高,发展一种新技术,将现有的工业原料氯化铝进行提纯获得高纯氯化铝显得尤为重要[1-4]。现有生产工艺中铁杂质是氯化铝中常见且不易去除的杂质。为提高氯化铝的纯度,降低氯化铝中的铁杂质含量,甚至痕量级别,许多工作者进行了研究。氯化铝纯化的方法主要有萃取法、阴离子树脂吸附法、无水氯化铝升华法、溶液重结晶法等。Mishra等[5]研究了HCl浓度和Aliquat336萃取剂浓度对萃铁萃取率的影响,用0.4 mol/L的Aliquat336萃取铁质量浓度为19 g/L、HCl浓度为9 mol/L的水相,一次萃取率为97%。Cui等[1]使用Aliquat336萃取含铝煤矿废弃物中的铁,萃取后六水氯化铝中铁质量分数低于0.005%;Zhu等[6]使用0.3 mol/L的Lix63和0.33 mol/L的Versatic10协同萃取铜离子浓度为14 g/L、铁离子浓度为4.7 g/L的水相,相比为1:2,质量分数95%的Cu和14%的Fe萃取入有机相,铁萃取率大于10%。魏存弟等[7]使用磷酸、乙酰胺等萃取剂,制备的结晶氯化铝中杂质氯化铁的质量分数在0.2%~0.3%。HCl浓度大于9 mol/L时,Cyanex 921的萃取率为99.8%,Cyanex 923的萃取率为99.9%,TBP的萃取率为99.7%[8]。Wang等[9]采用N235萃取15 g/L Fe3+、32 g/L Al3+、40 g/L Ca2+溶液中的铁,其中盐酸浓度是3 mol/L,萃取后溶液中Fe3+的质量浓度是0.0165 g/L。仲碳伯胺N1923作为萃取剂,正辛醇为改性剂,煤油为稀释剂。有机相中N1923萃取剂、正辛醇、煤油体积分数分别为25%、25%和50%,相比为1:2,pH=1.2,在含Fe3+ 2.3 g/L和含Al3+ 89.4 g/L的硫酸铝溶液中,萃取铁一次萃取率高达99.99%[10]。酰胺萃取剂N, N′-二甲基-N, N′-二丁基丙二酰胺(DMDBMA)、N, N′-二甲基-N, N′-二苯基丙二酰胺(DMDPHMA)、N, N′-二甲基-N, N′-二苯基十四烷基丙二酰胺(DMDPHTDMA),在HCl浓度高于5 mol/L时,对0.01 mol/L铁离子的萃取率大于90%[11]。30%N, N-二乙基十二酰胺(DEDA)萃取剂、30%异癸醇,萃取合成的含Fe3+ 20 g/L、含Cl- 6 mol/L的红土镍矿氯化浸出液,萃取率约为90%[12]。吕子剑等[13]使用树脂对氯化铝溶液中的铁离子进行吸附,将氯化铁浓度为1.5 g/L的氯化铝溶液通过树脂,得到含铁0.25 mg/L的氯化铝精制液。寇晓康等[14]研究树脂对氯化铝中铁杂质的吸附性能,将铁离子浓度为2.3 g/L的氯化铝溶液使用树脂吸附后,氯化铝溶液中的铁离子浓度为0.01 g/L。吸附法显示出较好的性能,但不易实现连续化操作。升华法、重结晶法等存在操作复杂、设备要求高、除铁效果不佳等问题,很难达到高纯的要求[15-16]。萃取法操作简便,易实现连续化,产品质量稳定,是比较高效的提纯方法。综上所述,萃取法是优选的方法。目前报道的萃取研究体系大多在低酸度下萃取,效果不理想,易引入其它杂质,高酸度下萃取效果相对较好,但存在高酸腐蚀以及酸难以回收等问题,使得实际应用还有困难,而且萃铁效果达不到高纯氯化铝生产工艺对铁含量的要求。
本文研究酰胺类萃取剂N, N, N′, N′-四丁基丙二酰胺(TBMA)、N, N, N′, N′-四辛基-3-氧戊二酰胺(TODGA)对氯化铝体系中铁杂质的萃取性能及影响因素,并与常用萃取剂和甲基异丁基甲酮(MIBK)[17-18]进行了分析对比,探究提纯制备高纯氯化铝的有效萃取方法。
1 实验部分
1.1 仪器和试剂
TU-1810型紫外可见分光光度计(北京普析通用仪器有限责任公司),SPECTRO ARCOS型电感耦合等离子体-原子发射光谱(ICP-AES,德国斯派克分析仪器公司)。工业无水氯化铝(99.9%,淄博纳诺工贸有限公司),邻二氮菲(分析纯,99.0%,国药集团化学试剂有限公司),盐酸羟胺(分析纯,98.5%,天津市大茂化学试剂厂),pH=4.5的乙酸-乙酸钠缓冲溶液。MIBK(分析纯,天津市科密欧化学试剂有限公司),TBMA和TODGA参照本实验室报道的方法[18-19]制备提纯,结构如图 1所示。将工业无水氯化铝升华,称量13.334 g升华的AlCl3(铁质量浓度约5 mg/L)到50 mL容量瓶中,准确加入不同量的浓盐酸和已知浓度的铁溶液,定容、摇匀,得到Al3+浓度为2.0 mol/L的氯化铝溶液。
1.2 实验方法
将配制好的水相3.0 mL置于10 mL振荡管中,加入3.0 mL配制好的对应浓度的有机相,旋紧缠有四氟带的塞子,放入设置好温度的水浴恒温振荡器中,振荡速度为280 r/min,振荡需要的时间后,离心分离两相。取一定体积的水相于容量瓶中,采用邻二氮菲分光光度法[20-22]测定氯化铝水溶液中的铁杂质含量。
2 结果与讨论
2.1 振荡时间对萃取的影响
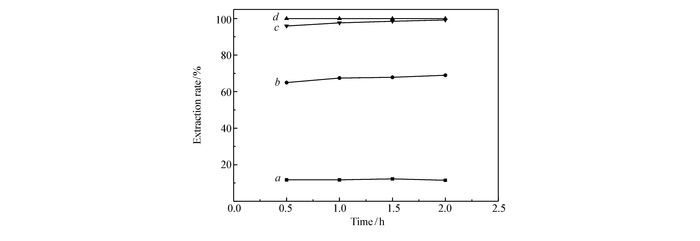
为考察TBMA、TODGA、MIBK萃取体系振荡时间对萃取率的影响,配制氯化铝水相和有机相。水相中的Al3+浓度为2.0 mol/L,Fe3+浓度为0.0036 mol/L(0.2 g/L),HCl浓度为1.2 mol/L。有机相分别为含有体积分数10%辛醇的0.20 mol/L TBMA环己烷溶液、纯MIBK有机相、0.20 mol/L TODGA环己烷溶液及0.20 mol/L TODGA正十二烷溶液。在25 ℃条件下分别振荡0.5、1.0、1.5和2.0 h,按时取出水相,分别测其铁含量。
从萃取率随着振荡时间的变化可以看出,0.5 h各体系已接近或达到萃取平衡。萃取速度较快,有利于工业生产中的应用。从图中可以看出,此条件下TODGA的萃取效果优于TBMA,并且比纯MIBK的萃取效果还要好。
2.2 酸浓度对不同萃取剂萃铁的影响
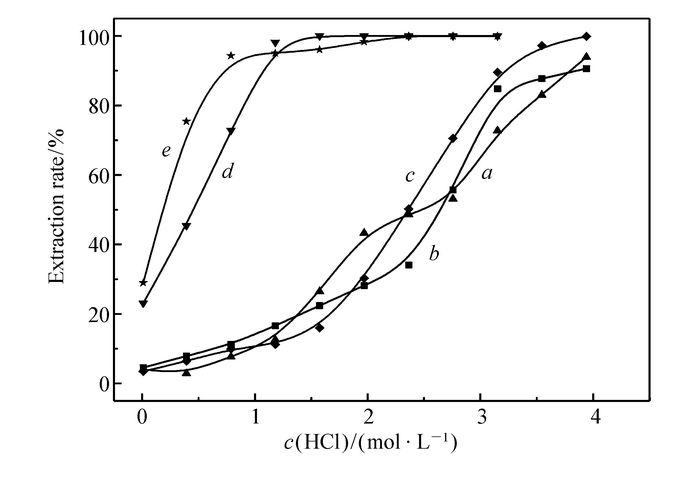
配制不同盐酸浓度的氯化铝溶液,其中Al3+浓度为2.0 mol/L,Fe3+浓度为0.0036 mol/L(0.2 g/L)。配制的有机相分别为纯MIBK有机相、0.20 mol/L TBMA的环己烷溶液、含辛醇体积分数10%的0.20 mol/L TBMA的环己烷溶液、0.20 mol/L TODGA的环己烷溶液和0.20 mol/L TODGA的正十二烷溶液。25 ℃下分别进行萃取实验,萃取时间均大于或等于60 min。考察酸浓度对不同萃取有机相萃取铁的影响。
振荡过程中,发现TBMA有机相有乳化结块现象。重复实验时,有机相中加入体积分数10%的辛醇,乳化现象基本消失。数据平行测量两次以上。
从图 3中可以看出,盐酸浓度在0~2 mol/L时,TBMA的萃取率较低,酸浓度在3.0 mol/L左右时萃取率出现突跃,达到该条件下的较好萃取水平。加入辛醇后,盐酸浓度在0~2 mol/L时,萃取率略有降低;当盐酸浓度在2~4 mol/L时,萃取率略有升高,应该是辛醇起到降低乳化的作用,对萃取有利。加入辛醇的TBMA有机相,盐酸浓度在4 mol/L时接近萃取完全。
纯甲基异丁基酮的萃取率在低酸浓度下比较低,当酸浓度达到4 mol/L时,萃取率大于90%。萃取率随酸浓度的变化趋势与TBMA差不多。同时注意到MIBK随着酸浓度的增加,萃取率有两次突跃,具体机理有待进一步分析。Zhang等[23]使用70%磷酸三丁酯(TBP)和30%的MIBK,在萃取相比为1:1的条件下,水相HCl浓度大于6 mol/L时,萃取率超过95%。当HCl浓度为5.1~5.5 mol/L、铁浓度为39 g/L时,一次萃取率为89%。但TBP容易在水相中引入P元素,MIBK易挥发、在水相中溶解度比较大,难以在提纯高纯氯化铝研究中应用。
TODGA萃取结果显示,当盐酸浓度在0~1 mol/L时,萃取率随着酸浓度的增加而快速增加[24];盐酸浓度高于1.5 mol/L时,萃取率均接近100%,水相中铁含量低于0.01 mg/L。盐酸浓度为0 mol/L时,萃取率大于20%。
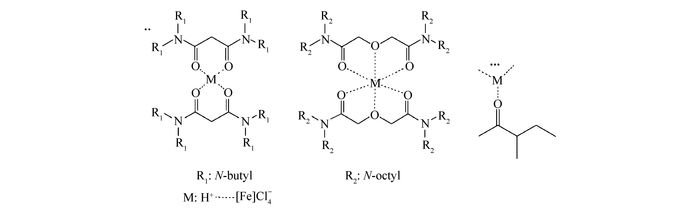
研究表明,Fe3+是以[FeCl4]-与H+结合的缔合离子形式被萃取入有机相,1个缔合离子与2个TBMA分子作用形成两个螯合环的结构被萃取进入有机相,而与2个TODGA分子作用形成4个螯合环的结构被萃取进入有机相[24-25],与MIBK分子形不成螯合环。由于体系中螯合结构的稳定性,0.20 mol/L的TBMA萃取体系与纯MIBK萃取体系的萃取效果接近,而比0.20 mol/L的TODGA萃取体系的萃取效果低很多。示意图如图 4。
2.3 萃取剂浓度对萃取的影响
配制0.10~0.60 mol/L不同浓度的萃取剂有机相,分别为加入10%体积分数辛醇的TBMA环己烷溶液、TODGA的环己烷溶液和TODGA的正十二烷溶液。萃取水相同2.1。25 ℃下分别进行萃取实验,萃取时间均大于或等于60 min。考察萃取剂浓度对萃取的影响。
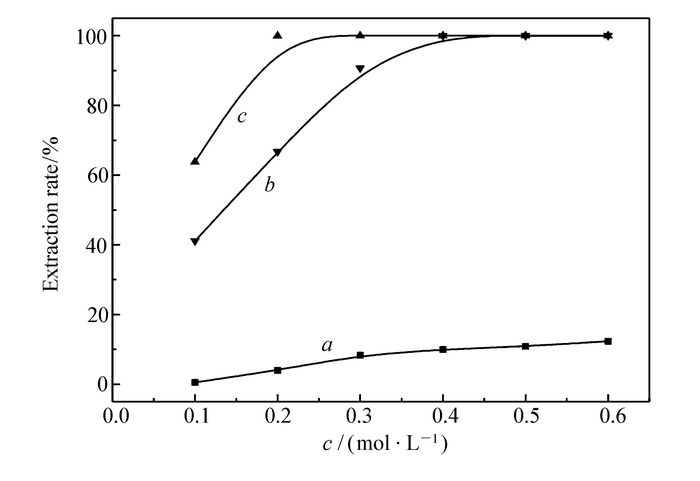
图 5中萃取剂TBMA的浓度在大于0.4 mol/L时,萃取率变化不大,并且乳化现象较严重。TODGA环己烷有机相中萃取剂浓度在0.1~0.4 mol/L时,萃取率随萃取剂浓度的增加而增加,达到0.4 mol/L时,萃铁接近萃取完全。TODGA正十二烷有机相中萃取剂浓度在0.1~0.2 mol/L时,萃取率随萃取剂浓度的增加而增加,在0.2 mol/L左右,萃取率就接近100%。
2.4 TODGA的多级萃取研究
有机相为0.20 mol/L TODGA的正十二烷有机相,水相同2.1。取15 mL水相,加入7.5 mL有机相,室温下充分搅拌30 min,转移到分液漏斗静置分离,将水相再与7.5 mL新鲜的有机相混合,重复萃取分离操作,共萃取分离3次,分别取水相,使用ICP测其铁含量,结果如表 1所示。
 表 1
TODGA多级萃取氯化铝溶液中的铁
Table 1.
Multistage extraction of iron from the aluminum chloride solution by TODGA
表 1
TODGA多级萃取氯化铝溶液中的铁
Table 1.
Multistage extraction of iron from the aluminum chloride solution by TODGA
Liquor alumini chloridi Raw water phase First extraction Second extraction Third extraction Iron concentration/(mg·L-1) 176.2 65.6 2.5 <0.01 可以看出,水相与有机相的体积比按2:1进行萃取3次,萃取效果明显,水相中萃余的铁质量浓度小于0.01 mg/L,计算出氯化铝中的铁质量浓度小于1 mg/L,能够深度除去氯化铝中的铁杂质。
2.5 TODGA萃取体系的反萃
2.5.1 反萃取溶液的选择
使用0.1 mol/L的碳酸钠溶液、去离子水[25]、1 mol/L的稀盐酸水溶液,将萃取后的TODGA有机相按1:1的相比进行摇匀反洗。发现0.1 mol/L的碳酸钠溶液反洗后乳化严重,久置不分层,加热、加盐、加酸后分层效果依旧不明显;用去离子水和稀盐酸溶液洗后很容易分层,稀盐酸溶液条件下有机相对铁有萃取,水洗反萃率比较高。
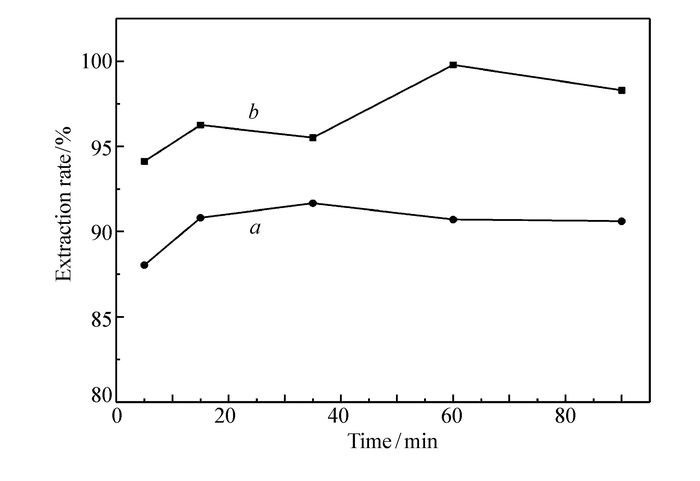
2.5.2 振荡时间对水洗反萃的影响
有机相为萃取铁后的0.20 mol/L TODGA环己烷和0.20 mol/L TODGA正十二烷的负载有机相。水相选择去离子水。取去离子水2.0 mL于10 mL振荡管中,取2.0 mL萃取后已知铁含量的有机相,振荡速度为280 r/min,25 ℃下分别进行反萃取实验,萃取时间分别为5、15、35、60和90 min。按时取出水相,分别测其铁含量。
从图 6可以看出,去离子水作为反萃剂具有很好的反萃性能,反萃取平衡时间短,5~10 min就达到了反萃取平衡。环己烷体系一次反萃率达到95%以上,正十二烷体系一次反萃取率在90%左右。反萃取后的有机相用于萃取实验,基本不影响萃取性能,依旧具有优异的萃取效果。
3 结论
N, N, N′, N′-四丁基丙二酰胺(TBMA)的萃取过程存在乳化现象,当加入体积分数10%的辛醇,0.20 mol/L TBMA的环己烷溶液在盐酸浓度比较高时,萃取效果有所提升。甲基异丁基甲酮(MIBK)虽是纯有机相作为萃取剂,其萃取效果与TBMA相近,萃取率随酸浓度的变化趋势与TBMA差不多,在比较高的盐酸浓度下,萃取率比较高。N, N, N′, N′-四辛基-3-氧戊二酰胺(TODGA)萃取剂的萃取性能优异。在水相AlCl3浓度2.0 mol/L,Fe3+浓度为0.0036 mol/L,盐酸浓度为1.2 mol/L时,0.20 mol/L的TODGA环己烷溶液,按水相有机相1:1的体积比进行萃取,一次萃取效果就接近完全萃取。同时,0.20 mol/L的TODGA正十二烷溶液,按水相有机相1:1的体积比进行多次连续萃取,萃取效果良好,萃取后水相含铁量低于0.01 mg/L,实现了深度除去氯化铝中铁杂质的目的。并且反萃取快速有效,有机相可重复再生利用。相对于环己烷体系,正十二烷体系在工业应用中更有优势,因此,在化工提纯氯化铝生产中有极大应用价值。
-
-
[1]
Cui L, Cheng F Q, Zhou J F. Preparation of High Purity AlCl3·6H2O Crystals from Coal Mining Waste Based on Iron(Ⅲ) Removal Using Undiluted Ionic Liquids[J]. Sep Purif Technol, 2016, 167: 45-54. doi: 10.1016/j.seppur.2016.04.046
-
[2]
Kim, Su Tae. Method for Simultaneously Preparing High Purity Aluminum Chloride and Zinc:WO 2014208944 A1[P]. 2014-12-31.
-
[3]
Shiroishi Akihiro, Sanuki Sumiko, Takikawa Shinichiro, et al. Method and Apparatus for Manufacturing High Purity Aluminum:JP 2004203713A[P]. 2004-07-22.
-
[4]
郭宇杰, 栾兆坤, 范彬. 高浓度高Al13含量聚合氯化铝溶液的制备[J]. 无机化学学报, 2007,23,(1): 63-69. GUO Yujie, LUAN Zhaokun, FAN Bin. Preparation Solution of Polymeric Aluminum Chloride with High Concentration of Al13[J]. Chinese J Inorg Chem, 2007, 23(1): 63-69.
-
[5]
Mishra R K, Rout P C, Sarangi K. Solvent Extraction of Fe(Ⅲ) from the Chloride Leach Liquor of Low Grade Iron ore Tailings Using Aliquat 336[J]. Hydrometallurgy, 2011, 108: 93-99. doi: 10.1016/j.hydromet.2011.03.003
-
[6]
Zhu Z, Zhang W, Cheng C Y. A Synergistic Solvent Extraction System for Separating Copper from Iron in High Chloride Concentration Solutions[J]. Hydrometallurgy, 2012, 113/114: 155-159. doi: 10.1016/j.hydromet.2011.12.016
-
[7]
魏存弟, 郭昭华, 董宏, 等. 一种氯化铝浆液萃取除铁的方法: CN 103435080B[P]. 2015-12-09.WEI Cundi, GUO Zhaohua, DONG Hong, et al. A Method for Extracting Iron from Aluminum Chloride Slurry:CN 103435080B[P]. 2015-12-09(in Chinese).
-
[8]
Mishra R K, Rout P C, Sarangi K. A Comparative Study on Extraction of Fe(Ⅲ) from Chloride Leach Liquor Using TBP, Cyanex 921 and Cyanex 923[J]. Hydrometallurgy, 2010, 104: 298-303. doi: 10.1016/j.hydromet.2010.07.003
-
[9]
Wang X Y, Ma C, Liu J. Studies of Selective Removal of Iron(Ⅲ) from the Simulated Bauxite Hydrochloric Acid Leaching Liquor by Solvent Extraction[J]. Adv Mater Res, 2013, 746: 31-33. doi: 10.4028/www.scientific.net/AMR.746
-
[10]
Li M Y, He Z M, Zhou L. Removal of Iron from Iindustrial Grade Aluminum Sulfate by Primary Amine Extraction System[J]. Hydrometallurgy, 2011, 106: 170-174. doi: 10.1016/j.hydromet.2010.12.018
-
[11]
Paiva A P, Costa M C. Application of N, N'-Tetrasubstituted Malonamides to the Recovery of Iron(Ⅲ) from Chloride Solutions[J]. Hydrometallurgy, 2005, 77: 103-108. doi: 10.1016/j.hydromet.2004.10.014
-
[12]
Zhu Z W, Karol Tulpatowicz, Yoko Pranolo. Fe(Ⅲ) Removal from a Synthetic Chloride Leach Solution of Nickel Laterite by N, N-Diethyldodecanamide[J]. Miner Eng, 2014, 61: 47-53. doi: 10.1016/j.mineng.2014.03.008
-
[13]
吕子剑, 蒋引珊, 郭昭华, 等. 一种氯化铝溶液除铁的方法: CN101838004A[P]. 2010-09-22.LV Zijian, JIANG Yinshan, GUO Zhaohua, et al. A Method for Removing Iron from Aluminum Chloride Solution:CN101838004A[P]. 2010-09-22(in Chinese).
-
[14]
寇晓康, 郭昭华, 樊文岷, 等. 含铁氯化铝溶液除铁的方法: CN105016368A[P]. 2015-11-04.KOU Xiaokang, GUO Zhaohua, FAN Wenmin, et al. Method for Removing Iron from Iron Containing Aluminum Chloride Solution:CN105016368A[P]. 2015-11-04(in Chinese).
-
[15]
吴兴科. 无水氯化铝在真空条件下的升华研究[J]. 精细化工, 1988,5,27-30. WU Xingke. Sublimation of Anhydrous Aluminum Chloride Under Vacuum Condition[J]. Fine Chem, 1988, 5: 27-30.
-
[16]
冯月斌, 戴永年, 刘永成. 无水三氯化铝及结晶三氯化铝的生产工艺和应用[J]. 真空科学与技术学报, 2008,29,(5): 336-339. FENG Yuebin, DAI Yongnian, LIU Yongcheng. The Production Process and Application of Anhydrous Aluminum Chloride and Aluminum Chloride Crystal[J]. Chinese J Vac Sci Technol, 2008, 29(5): 336-339.
-
[17]
江涛, 苏元复. 溶剂萃取法从氯化锌溶液中除铁(Ⅲ)[J]. 华东化工学院学报, 1988,14,(5): 537-543. JIANG Tao, SU Yuanfu. Removal of Iron from Zinc Chloride Solution by Solvent Extraction[J]. J East China Inst Chem Technol, 1988, 14(5): 537-543.
-
[18]
赵红丽, 琚行松, 赵立新. 甲基异丁基甲酮萃取制备高纯Fe2O3的研究[J]. 合肥工业大学学报, 2006,29,(9): 1132-1135. ZHAO Hongli, JU Xingsong, ZHAO Lixin. Preparation of High Purity Fe2O3 by Methyl Isobutyl Methanol Extraction[J]. J Hefei Univ Technol, 2006, 29(9): 1132-1135.
-
[19]
杨全宁. 丙二酰胺盐酸体系中萃取铁和稀土及动力学研究[D]. 济南: 济南大学, 2016. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D01049586YANG Quanning. Study on the Extraction of Iron and Rare Earth and Its Kinetics in Malonamide Hydrochloride[D]. Ji'nan:Ji'nan University, 2016(in Chinese). http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D01049586
-
[20]
韦兵. N, N, N', N''-四辛基-3-氧戊二酰胺/HNO3萃取稀土元素的动力学研究[D]. 济南: 济南大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10427-1016259846.htmWEI Bing. Study on Kinetics of Extraction of Rare Earth Elements by TODGA in HNO3[D]. Ji'nan:Ji'nan University, 2016(in Chinese). http://cdmd.cnki.com.cn/Article/CDMD-10427-1016259846.htm
-
[21]
黄志中, 罗六保, 张世誉. 邻二氮菲分光光度法测定铁条件选择实验的改进[J]. 化工科技, 2008,16,(6): 50-53. HANG Zhizhong, LUO Liubao, ZHANG Shiyu. Improvement on the Determination of Iron Condition by the Method of Phenanthroline[J]. Sci Technol Chem Ind, 2008, 16(6): 50-53.
-
[22]
李丝红, 郭幼红. 邻二氮菲分光光度法测定微量铁实验探讨[J]. 海峡药学, 2013,25,(8): 82-85. LI Sihong, GUO Youhong. An Experimental Study on the Determination of Trace Iron by Phenanthroline[J]. Strait Pharm J, 2013, 25(8): 82-85.
-
[23]
GB/T 3049-2006/ISO 6685: 工业用化工产品铁含量测定的通用方法[S]. 1982.GB/T 3049-2006/ISO 6685:General Method for the Determination of Iron Content of Chemical Products Industry[S].1982(in Chinese).
-
[24]
Zhang G Z, Chen D S, Wei G Y. Extraction of Iron(Ⅲ) from Chloride Leaching Liquor with High Acidity Using Tri-n-butyl Phosphate and Synergistic Extraction Combined with Methyl Isobutyl Ketone[J]. Sep Purif Technol, 2015, 150: 132-138. doi: 10.1016/j.seppur.2015.07.001
-
[25]
Cai X C, Han J X, Pang M P. Structural Effect of Diamide Extractants on the Extraction Behaviour of Fe(Ⅲ) from Hydrochloric Acid[J]. Hydrometallurgy, 2016, 164: 48-53. doi: 10.1016/j.hydromet.2016.05.009
-
[26]
蔡绪灿. 双酰胺萃取剂的合成及萃取性能研究[D]. 济南: 济南大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10427-1016257737.htmCAI Xucan. Study on the Synthesis and Extraction Performance of Bisamide Extractant[D]. Ji'nan:Ji'nan University, 2016(in Chinese). http://cdmd.cnki.com.cn/Article/CDMD-10427-1016257737.htm
-
[1]
-
图 2 不同有机相萃取率随振荡时间的变化
Figure 2 The change of extraction efficiency of different organic phases with oscillating time
a.0.20 mol/L TBMA solution of cyclohexane(10% volume fraction ofoctanol); b.pure MIBK organic phase; c.0.20 mol/L TODGA solution of n-dodecane; d.0.20 mol/L TODGA solution of cyclohexane
图 3 酸浓度对不同萃取剂萃取铁的影响
Figure 3 The effect of acid concentration on the extraction of iron from different extractants
a.pure MIBK organic phase; b.0.20 mol/L TBMA solution of cyclohexane; c.0.20 mol/L TBMA solution of cyclohexane(10% volume fraction of octanol); d.0.20 mol/L TODGA solution of cyclohexane; e.0.20 mol/L TODGA solution of n-dodecane
图 5 不同有机相中萃取剂浓度与萃取率的关系
Figure 5 The relationship between the extractant concentration and the extraction efficiency in different organic phases
a.0.20 mol/L TBMA solution of cyclohexane(10% volume fraction of octanol); b.0.20 mol/L TODGA solution of cyclohexane; c.0.20 mol/L TODGA solution of n-dodecane
表 1 TODGA多级萃取氯化铝溶液中的铁
Table 1. Multistage extraction of iron from the aluminum chloride solution by TODGA
Liquor alumini chloridi Raw water phase First extraction Second extraction Third extraction Iron concentration/(mg·L-1) 176.2 65.6 2.5 <0.01 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 1418
- HTML全文浏览量: 157


 下载:
下载:





 下载:
下载:

