 图1
4个样品的XRD衍射图
Figure1.
XRD patterns of four samples
图1
4个样品的XRD衍射图
Figure1.
XRD patterns of four samples

Citation: WAN Lu, FU Zhengbing. Preparation and Characterization of Nitrogen-doped Carbon-coated Lithium Titanate Anode for Lithium-ion Batteries[J]. Chinese Journal of Applied Chemistry, 2018, 35(1): 116-122. doi: 10.11944/j.issn.1000-0518.2018.01.170016

锂离子电池负极材料碳氮包覆钛酸锂的制备及表征
English
Preparation and Characterization of Nitrogen-doped Carbon-coated Lithium Titanate Anode for Lithium-ion Batteries
-
Key words:
- lithium titanate
- / sol-gel method
- / electrochemical performance
-
能源危机和清洁能源的开发使具有高能量存储和转换性能的电极材料成为研究热点。钛酸锂(Li4Ti5O12)以其优异的结构稳定性和电化学性能受到广泛关注[1-3]。较之石墨负极材料,钛酸锂(Li4Ti5O12)结构更稳定、锂离子扩散系数(2×10-8 cm2/s)更大、嵌锂电位更高、锂离子脱嵌时体积基本无变化。很多专家预测,在未来2~3年里钛酸锂材料很有可能将会取代碳材料成为锂离子电池新一代能源材料。然而,由于Li4Ti5O12导电性差阻碍了其推广使用[4-7]。针对这一问题,学者们进行了大量研究[8-13],归纳为以下3方面:通过设计实验方法制备不同形貌Li4Ti5O12;金属离子的掺杂(V+、Ni3+)部分取代Li+、Ti4+或O2-;对Li4Ti5O12进行表面包覆改性。其中,对Li4Ti5O12进行碳包覆可以抑制材料在烧结过程中颗粒团聚生长有利于材料纳米化并提供导电网络,有效提高颗粒间的导电能力。但是碳石墨化温度较高难以形成高导电率的碳包覆层。氮和碳的原子半径接近,在碳材料中进行氮掺杂,氮作为电子供体掺杂到六边形碳网络结构中,使其产生局部张力形成结构缺陷,进而提高碳包覆层的导电性和增加碳包覆层表面吸附金属粒子的活性位点。
氮和碳的原子半径接近,在碳材料中进行氮掺杂,氮作为电子供体掺杂到六边形碳网络结构中,使其产生局部张力形成结构缺陷,进而提高碳包覆层的导电性和增加碳包覆层表面吸附金属粒子的活性位点。本文以钛酸正四丁酯、甲酸锂、柠檬酸和脲作为主要原料,采用溶胶-凝胶法制备氮修饰碳包覆钛酸锂(Li4Ti5O12/NC)复合电极材料,考察制备工艺对产物结构和电化学性能的影响。
1 实验部分
1.1 仪器和试剂
D8 ADVANCE型X射线分析仪(XRD, 德国BRUKERAXS公司),CuKα射线,扫描速度为14°/min,扫描范围10°~80°;Nicloet 6700型红外光谱仪(美国尼高力公司);Escalab 250Xi型X射线光电子能谱仪(XPS,美国赛默飞世尔科技公司);JSM-6510F型扫描电子显微镜(SEM, 日本JEOL公司);JEM-2100HR型透射电子显微镜(TEM,日本电子株式会社);SDTQ600型热重分析仪(TG,美国TA公司);CT2001A型LAND电池测试系统(武汉蓝电电子公司),在恒温25 ℃,恒定电流1 mA,电压范围0.8~2.5 V的条件下,对装配好的模拟电池进行循环充放电性能测试。钛酸正四丁酯、甲酸锂、柠檬酸、脲和无水乙醇均为国药集团化学试剂有限公司生产的分析纯试剂。
1.2 Li4Ti5O12/NC复合材料的制备
将7 mL钛酸正丁酯(Ti(OC4H9)4)溶在35 mL无水乙醇中,搅拌的同时加入5 mmol柠檬酸充分混合得到溶液A;将17.28 mmol的甲酸锂(HCOOLi(H2O)与脲(CO(NH2)2)溶于去离子水中得到溶液B;在强烈搅拌下将溶液B逐滴滴入溶液A中,继续搅拌得到均一、透明的溶胶,然后将溶胶室温陈化12 h得到凝胶,将干燥后的凝胶体在空气中热处理2 h,然后再在N2气氛围高温煅烧,冷却后即得到Li4Ti5O12/NC复合材料。实验中脲和柠檬酸的摩尔比依次为4:3、8:3和16:3,得到的样品分别记为Li4Ti5O12/NC-1、Li4Ti5O12/NC-2、Li4Ti5O12/NC-3。在同样实验条件下,不加入柠檬酸和脲在空气中高温热处理制备纯的Li4Ti5O12。
1.3 电池的制备及电池组装
将复合材料Li4Ti5O12/NC、Super-Li(导电剂)和聚偏氟乙烯(PVDF, 粘结剂)按质量比(8:1:1)和十二甲基吡咯烷酮(分散剂)混合成糊状物,然后涂到铜箔上,真空80 ℃干燥24 h,经过压片,裁片,称量,计算活性物质质量后,取金属锂片作为锂离子电池对电极,Celgard 2400为隔膜,以1 mol/L LiPF6的碳酸乙烯酯(EC)、碳酸二乙酯(DMC)和甲基碳酸乙烯(EMC)体积比为1:1:1配置成电解液,在隔绝氧气的Ar氛围手套箱中,组装成R2016型纽扣式电池。
2 结果与讨论
2.1 样品表征
2.1.1 样品的晶型分析
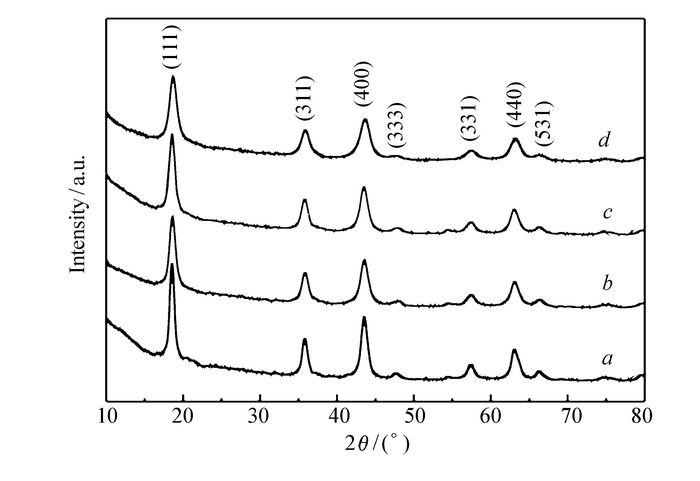
图 1是Li4Ti5O12和Li4Ti5O12/NC的XRD衍射图,4个样品均在2θ=18.37°、35.60°、43.27°、47.39°、57.23°、62.86°和66.09°出现了明显衍射峰,与标准卡片(No.49-0207)对照,这些衍射峰分别对应面心立方结构Li4Ti5O12的(111)、(311)、(400)、(333)、(331)、(440)和(531)晶面,说明制备的样品主体是Li4Ti5O12。对比Li4Ti5O12/NC-1、Li4Ti5O12/NC-2、Li4Ti5O12/NC-3和Li4Ti5O12的衍射峰发现,不管样品是否碳氮包覆,其均未出现碳的衍射峰,原因可能是柠檬酸在无氧氛围下热解生成的碳氮化合物在Li4Ti5O12中的含量较低或者碳氮化合物以非晶态的物质存在。另外,4个样品峰位基本一致,说明包覆的碳氮没有掺杂到Li4Ti5O12晶格内部导致峰位偏移,而是仅包覆在Li4Ti5O12表面,构成导电包覆层。
2.1.2 样品的TG曲线分析
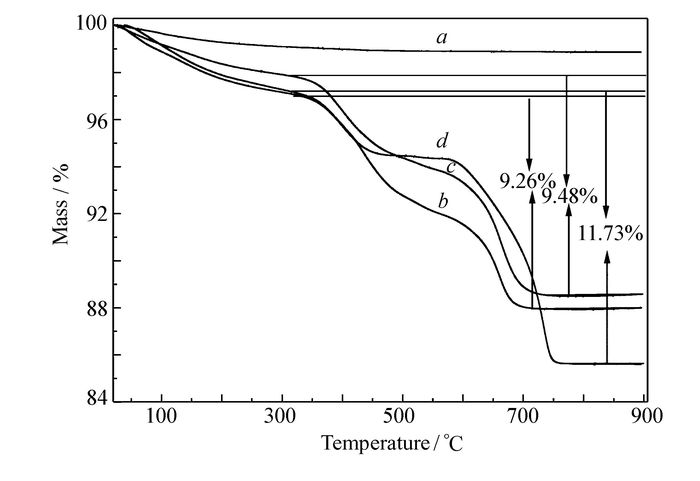
为确定Li4Ti5O12/NC样品中碳氮的含量,在空气气氛下对样品进行了热重测试。从图 2可以看出,纯Li4Ti5O12在整个测试温度范围内质量基本保持不变;Li4Ti5O12/NC-1、Li4Ti5O12/NC-2和Li4Ti5O12/NC-3这3个样品失重较为明显,且失重曲线相似:350 ℃前失重是样品中吸附水的脱附;350~750 ℃温度段是包覆在Li4Ti5O12表面的碳氮与空气中的氧反应而失重。由失重量可知,Li4Ti5O12/NC-1、Li4Ti5O12/NC-2和Li4Ti5O12/NC-3中碳氮含量分别为9.26%、9.48%和11.73%。
2.1.3 样品的IR和XPS结果分析
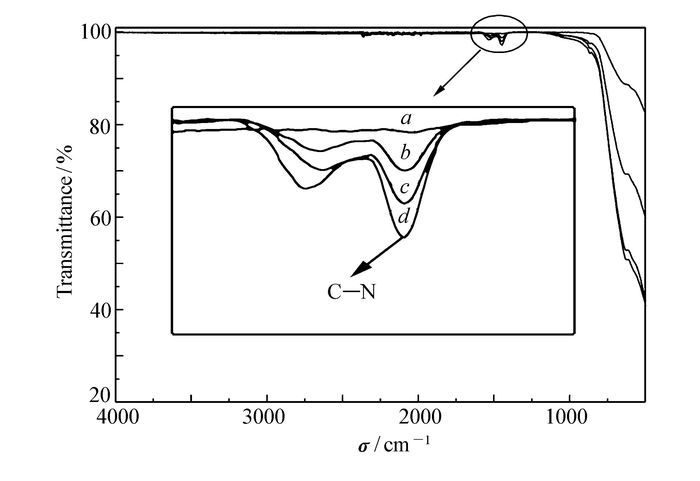
为了进一步确定样品的碳氮元素的存在,对样品进行了红外和光电子能谱测试分析。图 3为纯Li4Ti5O12和Li4Ti5O12/NC样品的红外光谱图,对比纯的Li4Ti5O12红外谱图,Li4Ti5O12/NC在1450 cm-1均有较为明显的吸收峰,对应于C—N骨架震动[14],由此说明,Li4Ti5O12/NC材料中均存在碳氮化合物,且掺杂N为结构氮,原来六边形的C网络在掺杂N的作用下产生局部张力,导致结构变形,同时N原子的孤对电子可以带给sp2杂化C骨架离域系统负电荷,从而增强材料中电子的传输特性和化学活性;此外富电子的N原子使材料的价带降低,增加费米能级上的电子密度,材料的化学稳定性增加[15-16]。
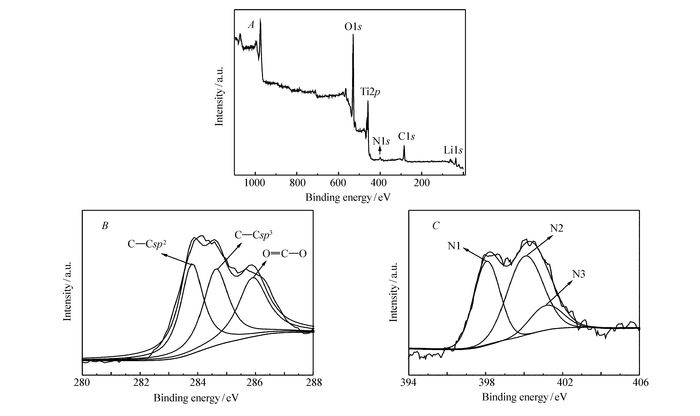
图 4A为Li4Ti5O12/NC-2样品的XPS全谱图。从图 4中可以看出,Li、Ti、O、N和C等元素的存在。对C1s进行拟合,可以得到3个特征峰分别在283.8、284.6和285.9 eV,如图 4B,其中结合能在283.8和284.6 eV的特征峰分别对应于sp2杂化石墨型碳和sp2杂化型C—N键中的碳,结合能在285.9 eV的特征峰对应于与O结合的碳(OCO),这些结构进一步表明了N掺入了C的石墨层结构中[17],验证了红外光谱的结果。对N1s进行拟合,也分别在结合能为398.1、400.0和401.2 eV位置出现了特征峰(图 4C),这是因为含氮物质了在高温下热解,N原子掺入到石墨层中并在不同的位置进行取代,398.1和400.0 eV对应于吡啶型N,结合能在401.2 eV的特征峰说明还有部分N以季氮形式存在,不管是位于石墨层结构边缘的吡啶氮还是位于石墨层结构内的四取代氮,它们存在于碳中均会使六边形的碳网络产生局部张力,致使结构变形产生缺陷,增加电极材料的化学活性[18]。
2.1.4 样品的形貌分析
对比图 5可以发现,碳氮包覆之后的Li4Ti5O12/NC-2颗粒分布较均匀,粒径缩小到800 nm左右,没有出现板结现象。由此表明,通过对Li4Ti5O12进行表面碳氮包覆提高了材料颗粒均匀度、有效缩小材料粒径并抑制了材料在烧结过程中颗粒团聚生长。同时观察到材料颗粒较小,有利于材料与电解液充分反应Li+活性位点增多,并缩短了Li+的传输路径,电化学反应速率提高,另外材料颗粒均匀度较高,材料在充放电过程较稳定且充放电速率快。
图 6A和6B是Li4Ti5O12/NC-2样品的透射电子显微镜扫描照片。从图 6A中可以清晰观察到,晶体结构完整,整个晶体均一,且具有相当明显的晶体棱角,说明晶体结晶生长结构完整。从图 6B可以看到样品晶面间距为0.48 nm,恰好对应于尖晶石型Li4Ti5O12最强衍射峰(111)晶面间距,说明Li4Ti5O12晶体生长较完整。在Li4Ti5O12晶粒边缘处还观察到2~3 nm的碳氮包覆层,表明对Li4Ti5O12进行包覆的碳氮没有掺杂到晶体中,对晶型没有影响,这与XRD测试结果一致。
2.2 样品电化学性能分析
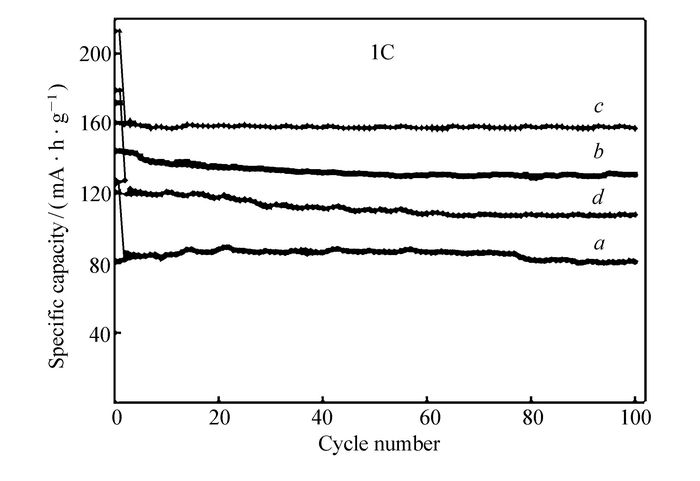
图 7为不同碳氮包覆比的Li4Ti5O12与纯Li4Ti5O12在1C倍率下电压从0.8~2.5 V充放电循环100周期的比容量图。从图 7可以看出,Li4Ti5O12、Li4Ti5O12/NC-1、Li4Ti5O12/NC-2、Li4Ti5O12/NC-3首次放电比容量分别为126.2、171.7、212.9和178.9 mA·h/g,这可能是因为柠檬酸裂解产生的无定型碳和乙炔黑中碳具有一定嵌锂功能,使其首周放电比容量较Li4Ti5O12的理论比容量高;而首次放电后,比容量急速下降这是可能是碳的不可逆嵌锂以及在负极材料与电解液之间形成了SEI膜导致比容量下降较大。然后从第2个循环周期开始稳定,放电比容量分别为143.8、160.1、127.4和86.5 mA·h/g。其中Li4Ti5O12/NC材料的比容量均明显高于纯Li4Ti5O12,且循环100周期后仍然保持稳定的高比容量。通过比较可以很明显地看出,Li4Ti5O12/NC-2样品的比容量最高说明并不是碳氮含量越高越好,分析其原因可能是当碳氮含量过高时,Li4Ti5O12/NC振实密度大幅度降低,制备出来的电极材料体积比容量下降,不利于提高整体的比容量和比能量;此外包覆层过厚也不利于锂离子的扩散,还有可能改变Li4Ti5O12的晶型结构;但是,如果Li4Ti5O12表面包覆的碳氮含量过低,对提高Li4Ti5O12的导电性效果不明显。因此,只有包覆合适的碳氮量,才能较有效地提高Li4Ti5O12的电化学性能。结合热重曲线图可以得出结论,当碳氮质量分数为9.48%时,材料比容量较高循环稳定性好。
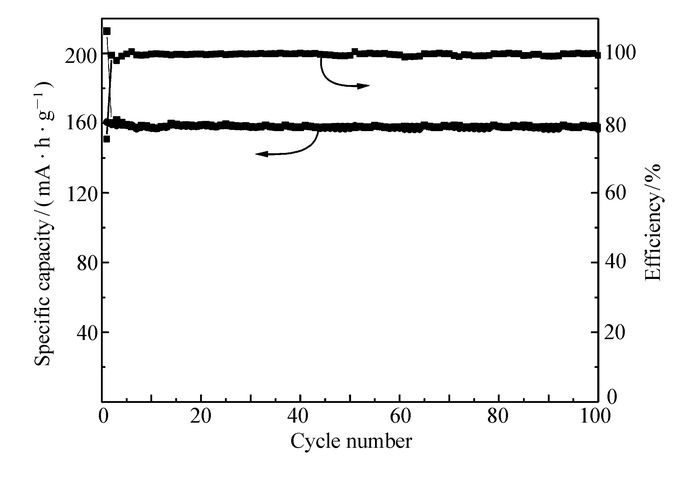
进一步计算Li4Ti5O12/NC-2样品的库伦效率,如图 8结果。发现在1C倍率下Li4Ti5O12/NC-2循环100周期里的库伦效率始终接近100%,由此表明,Li4Ti5O12/NC-2材料在充放电过程结构稳定。结合前面材料的结构表征分析,Li4Ti5O12/NC-2复合材料颗粒粒径小,与电解液接触的脱嵌锂活性位点多比容量高,掺杂从而使碳层中引入缺陷有利于加快Li+快速平稳的传输且使电化学反应速率较快,因此,Li4Ti5O12/NC-2具有高比容量和库伦效率[17]。
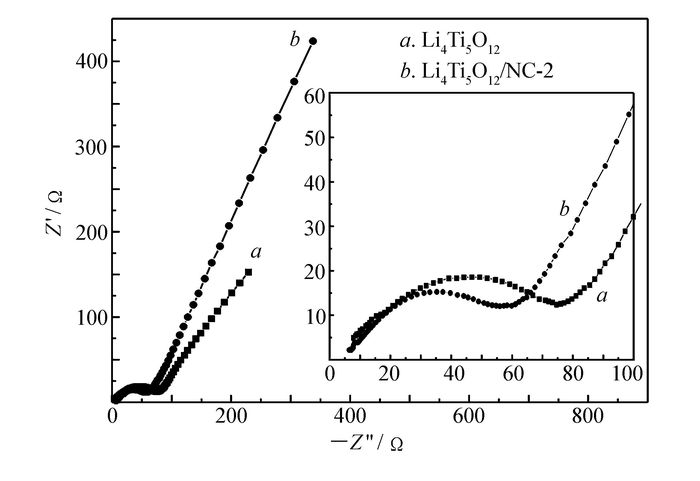
图 9所示Li4Ti5O12/NC-2和Li4Ti5O12材料的交流阻抗图谱。两种电极的交流阻抗谱图都是由3个部分组成:高频区与实轴的焦点、中频区的半圆和低频区的直线部分。高频区与实轴的交点所截取的阻值为欧姆阻抗,包括电解液阻抗和电极阻抗;中频区半圆代表电荷转移过程阻抗,即电子转移阻抗;低频区的直线代表Li+在电极材料中的扩散阻抗。从图中可以看出,Li4Ti5O12/NC-2在欧姆阻抗和电子转移阻抗以及锂离子的扩散电阻均小于纯的Li4Ti5O12说明碳氮包覆大大提高了Li4Ti5O12的导电性并使加快了Li+传输速率。结合材料结构表征,由于碳的导电性较好,柠檬酸裂解产生的碳的存在有效降低材料中晶粒及晶粒间的接触电阻,而N的引入改变了材料的能带结构降低C的费米能级,从而增强了材料传输电子的特性,并使碳包覆层形成一个完整的导电网络提高了Li4Ti5O12的导电性[15]。而N掺杂到碳网络中产生结构缺陷,有利于电极材料与电解液反应活性位点增加,有利于锂离子快速扩散运动,降低了锂离子的扩散电阻。
3 结论
实验通过溶胶-凝胶法成功制备出了碳氮包覆的尖晶石型Li4Ti5O12。研究了不同碳氮包覆量对材料电化学性能影响。当碳氮包覆量为9.48%时,Li4Ti5O12/NC在1C倍率下的首次放电比容量为212.9 mA·h/g,循环100周后的比容量仍然保持160.1 mA·h/g。由电交流阻抗测试分析,碳氮包覆不仅能够大大提高材料的比容量而且在Li4Ti5O12表面形成导电网络,增加材料的导电性。对Li4Ti5O12碳氮包覆可以提高材料颗粒均匀度,大大缩小颗粒粒径,使材料与电解液反应活性位点增多,并能有效抑制材料在烧结过程中颗粒团聚现象。
-
-
[1]
Jia P Q, Shao Z B, Liu K R. Pretreatments-assisted High Temperature Ball Milling Route to Li4Ti5O12 and Its Electrochemical Performance[J]. J Power Sources, 2014, 130(5): 71-74.
-
[2]
Belharouak I, Gary M, Koenig J. Electro Chemistry and Safety of Li4Ti5O12 and Graphite Anodes Paired with LiMn2O4 for Hybrid Electric Vehicle Li-ion Battery Applications[J]. J Power Sources, 2011, 196(23): 10344-10350. doi: 10.1016/j.jpowsour.2011.08.079
-
[3]
Scrosati B, Garche J. Lithium Batteries:Status, Prospects and Future[J]. J Power Sources, 2010, 195(9): 2419-2430. doi: 10.1016/j.jpowsour.2009.11.048
-
[4]
Shen L F, Li H G, Evan U. General Strategy for Designing Core-Shell Nanostructured Materials for High-power Lithium Ion Batteries[J]. Nano Lett, 2016, 12(11): 5673-5678.
-
[5]
Mi R J, Jung Y S, Kang Y M. Tailored Li4Ti5O12 Nanofibers with Outstanding Kinetics for Lithium Rechargeable Batteries[J]. Nanoscale, 2012, 4(21): 6870-6875. doi: 10.1039/c2nr31675g
-
[6]
Kang E, Jung Y S, Kim G H. Highly improved Rate Capability for a Lithium-ion Battery Nano-Li4Ti5O12 Negative Electrode via Carbon-Coated Mesoporous Uniform Pores with a Simple Self-assembly Method[J]. Adv Funct Mater, 2011, 21(22): 4349-4357. doi: 10.1002/adfm.201101123
-
[7]
Wang Y Q, Gu L, Guo Y G. Rutile-TiO2 Nanocoating for a High-Rate Li4Ti5O12 anode of a Lithium-Ion Battery[J]. J Am Chem Soc, 2012, 134(18): 7874-7879. doi: 10.1021/ja301266w
-
[8]
Liu J X, Wang H K, Yang S L. Single-crystalline Li4Ti5O12 Nanorods and Their Application in High Rate Capability Li4Ti5O12/LiMn2O4 Full Cells[J]. J Power Sources, 2013, 242: 222-229. doi: 10.1016/j.jpowsour.2013.04.020
-
[9]
曹绍梅, 冯欣, 张大卫. 精细化砂磨制备纳米Li4Ti5O12电极材料及其电化学性能研究[J]. 功能材料, 2014,45,(11): 11101-11104. doi: 10.3969/j.issn.1001-9731.2014.11.021CAO Shaomei, FENG Xin, ZHANG Dawei. Preparation of Li4Ti5O12 Electrode Material with Refining Sand Milling Technique and Its Electrochemical Performance Research[J]. J Funct Mater, 2014, 45(11): 11101-11104. doi: 10.3969/j.issn.1001-9731.2014.11.021
-
[10]
Li B H, Han C P, He Y B. Facile Synthesis of Li4Ti5O12/C Composite with Super Rate Performance[J]. Energy Environ Sci, 2012, 5(11): 9595-9602. doi: 10.1039/c2ee22591c
-
[11]
Hao Y J, Lai Q Y, Xu Z H. Synthesis by Sol-Gel Method and Electrochemical Properties of Li4Ti5O12 Anode Material for Lithium-Ion Battery[J]. Solid State Ionics, 2005, 176(13/14): 1201-1206.
-
[12]
Gao J, Ying J R, Jiang C Y. Preparation and Characterization of Spherical La-doped Li4Ti5O12 Anode Material for Lithium Ion Batteries[J]. Ionics, 2009, 15(5): 597-601. doi: 10.1007/s11581-008-0306-0
-
[13]
Hui Y N, Cao L Y, Xu Z W. Mesoporous Li4Ti5O12 Nanoparticles Synthesized by a Microwaveassisted Hydrothermal Method for High Rate Lithium-Ion Batteries[J]. J Electroanal Chem, 2016, 763: 45-50. doi: 10.1016/j.jelechem.2015.12.042
-
[14]
Luo H J, Shen L F, Rui K. Carbon Coated Li4Ti5O12 Nanorods as Superior Anode Material for High Rate Lithium Ion Batteries[J]. J Alloys Compd, 2013, 572(32): 37-42.
-
[15]
Ren Y R, Huang X B, Wang H Y. Li4Ti5O12/C Anode Material with High-rate Performance Using Phenanthroline as Carbon Precursor[J]. Ionics, 2015, 21(3): 629-634. doi: 10.1007/s11581-014-1235-8
-
[16]
Xu H G, Hu X L, Luo W. Electrospun Conformal Li4Ti5O12/C Fibers for High Rate Lithium-ion Batteries[J]. Chem Electro Chem, 2014, 1(3): 611-616.
-
[17]
杨承昭, 张小满, 贺先冬. 采用为负极的软包锂离子电池研究[J]. 电池工业, 2013,18,(3): 139-141. YANG Chengzhao, ZHANG Xiaoman, HE Xiandong. Study on the Soft Package Li-ion Battery Using Li4Ti5O12 as Anode Material[J]. J Chinese Battery Ind, 2013, 18(3): 139-141.
-
[18]
王磊, 刘兴江. 锂离子电池/电化学电容器用AC承载Li4Ti5O12材料[J]. 电源技术, 2009,33,(8): 662-665. WANG Lei, LIU Xingjiang. Study on Li4Ti5O12 Loaded Activated Carbon for Lithium-Ion Battery/Capacitors[J]. Power Supp Technol Appl, 2009, 33(8): 662-665.
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 10
- 文章访问数: 2307
- HTML全文浏览量: 1193




 下载:
下载:








 下载:
下载:

