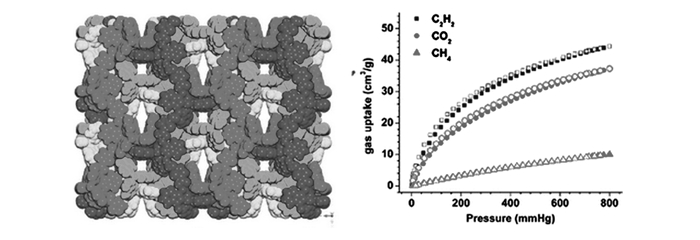
 图1
Zn5(bta)6(tda)2的四重互穿结构(左)和295 K条件下的气体吸附等温线(右)[22]
Figure1.
Left: four-fold interpenetrated framework of Zn5(bta)6(tda)2. Right: the adsorption isotherms at 295 K[22]
图1
Zn5(bta)6(tda)2的四重互穿结构(左)和295 K条件下的气体吸附等温线(右)[22]
Figure1.
Left: four-fold interpenetrated framework of Zn5(bta)6(tda)2. Right: the adsorption isotherms at 295 K[22]

Citation: LIU Kang, MA Dingxuan, SHI Zhan. Application of Metal-Organic Frameworks for Separation of Hydrocarbon Mixtures[J]. Chinese Journal of Applied Chemistry, 2017, 34(9): 1006-1016. doi: 10.11944/j.issn.1000-0518.2017.09.170185

金属有机骨架材料在轻烃分离中的应用
English
Application of Metal-Organic Frameworks for Separation of Hydrocarbon Mixtures
-
Key words:
- metal-organic frameworks
- / light hydrocarbons
- / separation
-
化石燃料也称为矿石燃料,是碳氢化合物及其衍生物的总称。碳氢化合物包括炔烃、烯烃、烷烃和芳香烃等,是生产多种生活和工业用品的重要原料。轻烃气体(甲烷、乙炔、乙烯、乙烷、丙烷和丙烯)是碳氢化合物的重要组成部分。在石化工业中,轻烃被广泛用作能源和工业原料。例如,甲烷能够代替汽油、柴油作为一种清洁型的汽车燃料;乙炔和乙烯可以作为生产乙酸、橡胶和塑料等工业产品的原材料。因此,获得高品质和高纯度的轻烃气体是保证其有效利用的关键。研究如何高效分离轻烃气体在工业生产中是很有意义的,传统轻烃分离通常采用高能耗的低温蒸馏技术,为了获得单一产物往往需要多步蒸馏且回流比很高,如何低能耗的实现轻烃分离是实际生产中急需解决的技术难题[1]。
利用多孔材料对气体进行吸附并在一定的温度和压力下进行脱附是分离气体混合物的有效办法。金属有机骨架材料(metal-organic frameworks, MOFs)是以金属或金属簇为结构基元通过配位键与有机配体相连接而形成的多孔晶体材料[2-8]。MOFs材料具有比表面积大、结构可调、易于剪裁等优点,在气体捕获和分离领域具有潜在的应用价值,对该领域的详细研究为MOFs在轻烃分离方面的功能开发提供了理论基础。本文主要从MOFs材料对轻烃气体分离的机制、发展现状和发展趋势进行综述。
1 MOFs材料对轻烃气体的分离机制
MOFs对轻烃气体的捕获能力是影响分离效果的关键因素。轻烃气体分子在MOFs孔道内部通常是物理吸附,与骨架上的原子通过范德华力相互作用。通过调节MOFs骨架与轻烃气体分子的相互作用力可以提高其捕获能力,一般方法包括向MOFs骨架中引入不饱和金属中心;在有机配体上引入特殊官能基团;骨架的多重互穿形成多孔结构等。另外,MOFs材料对轻烃气体的分离机制还包括位阻分离、平衡分离、动力学分离和“开门”效应等:1) 基于位阻机理进行分离利用的是轻烃分子筛分效应。由于轻烃气体分子尺寸不同,一些尺寸较小的轻烃可以通过孔道窗口,而另一些尺寸较大的轻烃则会被阻隔在外,从而实现分离;2) 对平衡分离来说,MOFs的孔大小允许多种轻烃分子通过,其分离性能由孔道内壁与被吸附轻烃分子的相互作用力决定,一般以吸附焓的形式表现出来;3) 动力学分离是利用不同轻烃分子的扩散特性进行分离。流动性较强的轻烃分子会快速通过孔道,扩散特性的不同可以通过固定床穿透试验进行测试;4) 所谓“开门”效应是通过轻烃气体吸附作用使得MOFs的孔道结构由密实相向多孔相发生转变,特定的临界压力控制着不同气体分子的吸附和脱附[9-13]。
2 MOFs材料在轻烃气体分离中的应用
2.1 C2s碳氢化合物/甲烷的吸附分离
C2s碳氢化合物包括乙炔、乙烯和乙烷。乙炔一般由天然气裂解制得[14],为了制备高纯乙炔(纯度>99.5%)进行有机合成反应,乙炔/甲烷分离是非常有必要的。另外,甲烷氧化偶联反应可以制得C2Hx(x=2, 4, 6),但甲烷通常不能完全转化,所以必须对混合物进行分离[15-17]。由于C2s碳氢化合物和甲烷的物理性质差别较大,故可以利用这两类气体分子尺寸的差别和与MOFs骨架的作用力不同进行分离。
MOFs的孔径尺寸对轻烃分子的分离有重要影响,若孔径与轻烃分子的动力学直径接近,则会在孔道中产生强烈的限制效应。例如,Chen等[18]通过将羟基官能团引入到孔表面,合成了一种二维微孔MOF材料Cu(bdc-OH) (H2bdc为1, 4-benzenedicarboxylic acid,1, 4-苯二羧酸),该材料具有直径为0.30 nm的一维孔道,在296 K下C2H2/CH4选择性为6.7。通过骨架互穿也能得到一些孔径在0.31~0.48 nm的MOFs材料,孔径尺寸处于这个范围的MOFs材料往往可以从CH4中分离C2H2、C2H4和C2H6。例如,UTSA-38a[19]具有二重互穿结构,其C2H2/CH4、C2H4/CH4和C2H6/CH4的亨利定律选择性分别为5.6、6.4和10.1。[Zn2(pba)2(bdc)](UTSA-36a;Hpba为4-(4-pyridyl)benzoic acid,4-(4-吡啶基)苯甲酸)同样具有二重互穿结构[20],从273 K到296 K,其C2s/CH4亨利定律选择性范围是11~25。Zn2(bba)2(CuPyen)(M′MOF-20;H2bba为biphenyl-4, 4′-dicarboxylate,二苯基-4, 4′-二羧酸)具有三重互穿结构[21],孔径大小为0.39 nm,其C2H2/CH4选择性为34.9。Zn5(bta)6(tda)2(Hbta为1, 2, 3-benzenetriazolate 1, 2, 3-苯三唑,H2tda为thiophene-2, 5-dicarboxylate,噻吩-2, 5-二羧酸)具有四重互穿结构[22](图 1),在295 K下等摩尔C2H2/CH4混合物的IAST(ideal adsorbed solution theory,理想吸附溶液理论)选择性为15.5,但其在1×105 Pa气压下的乙炔吸附容量仅为1.96 mmol/g。然而,这些材料均由于比表面积较低(<700 m2/g)而使乙炔吸附容量受到限制。
 图1
Zn5(bta)6(tda)2的四重互穿结构(左)和295 K条件下的气体吸附等温线(右)[22]
Figure1.
Left: four-fold interpenetrated framework of Zn5(bta)6(tda)2. Right: the adsorption isotherms at 295 K[22]
图1
Zn5(bta)6(tda)2的四重互穿结构(左)和295 K条件下的气体吸附等温线(右)[22]
Figure1.
Left: four-fold interpenetrated framework of Zn5(bta)6(tda)2. Right: the adsorption isotherms at 295 K[22]
Kitagawa研究组[23]对二维柔性材料[Zn(5NO2-ip)(bpy)](CID-5;ip为isophthalate,间苯二甲酸,bpy为4, 4′-bipyridine,4, 4′-联吡啶)、[Zn(5MeO-ip)(bpy)](CID-6) 及[Zn(5NO2-ip)1-x(5MeO-ip)x(bpy)(x=0.1, 0.2, 0.4)](CID-5/6) 的C2H6/CH4选择性分离性能进行了研究。由于取代基的大小和吸推电子能力的差异,CID-5与CID-6表现出不同的柔性结构,其中CID-5的整体结构柔性大于CID-6,CID-5/6的孔隙率和柔性取决于骨架中配体的相对比例。CID-5/6(x=0.1) 的晶体结构与纯相CID-5类似,能够随C2H6的吸附呈现“开门”效应。研究表明,不同的骨架柔性对双组份C2H6/CH4气体混合物展现不同的动力学气体穿透曲线,纯相CID-5或CID-6并没有气体分离性质,而CID-5/6(x=0.1) 展现了C2H6/CH4选择性分离能力(图 2)。因此,通过精细调控配体比例来调节骨架柔性可以优化气体分离效率。
MMOF-74系列,也称为M2(dobdc)(dobdc为2, 5-dioxido-1, 4-benzene-dicarboxylate,2, 5-二羟基-1, 4-苯-二羧酸)。在C2s碳氢化合物和CH4的分离研究中,MMOF-74由于其具有高比表面积和高密度不饱和金属中心成为一类“明星”材料。Long研究组[24]报道了FeMOF-74在分离CH4、C2H6、C2H4和C2H2混合物方面非凡的应用前景,通过分离几乎能得到各个组分的纯相气体。除FeMOF-74之外,MgMOF-74和CoMOF-74在常温常压下也能从等摩尔CH4/C2H2/C2H4/C2H6混合物中分离CH4[25]。MOF-505和Cu3(btc)2的结构中由于含有不饱和铜金属中心,因此对乙炔分子具有较强的亲和力(H3btc为benzene-1, 3, 5-tricarboxylic acid,苯-1, 3, 5-三羧酸)。Hu等[26]通过向bptc配体中引入CC键合成了一种新型的微孔MOF材料Cu2(ebtc)(H4bptc为3, 3′, 5, 5′-biphenyltetracarboxylate,3, 3′, 5, 5′-二苯基四羧酸,H4ebtc为1, 1′-acetylenebenzene-3, 3′, 5, 5′-tetracarboxylate,1, 1′-炔基苯-3, 3′, 5, 5′-四羧酸)。该MOF材料的结构与MOF-505类似,均属于Nbo拓扑并具有较高的比表面积和不饱和铜金属中心。293 K温度下乙炔吸附量达到252 cm3/g,是同等条件下甲烷吸附量的10倍。乙炔分子在该材料中的吸附强度显著高于MOF-505和Cu3(btc)2,这种现象可以归结于开放性金属中心与C≡C键和乙炔分子的协同作用。
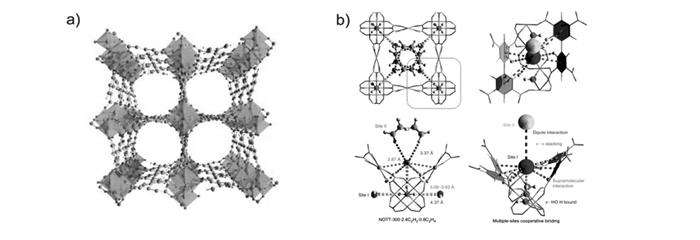
不饱和金属中心和路易斯碱位的同时引入会大幅度提升C2s/CH4分离效果。我们小组[27]利用六羧酸配体H6TDPAH与轮桨型铜次级结构基元,合成出具有rht拓扑的MOF材料[Cu3(TDPAH)(H2O)3]·13H2O·8DMA(Cu-TDPAH; H6TDPAH为2, 5, 8-tris(3, 5-dicarboxylphenylamino)-s-heptazine,2, 5, 8-三(3, 5-二羧基苯胺)-均草怕津)。该材料同时具有rht拓扑结构中密度最高的路易斯碱位(5.4 nm-3)和高密度不饱和金属中心,对C2s具有优越的吸附性能,在273 K条件下,C2H2吸附量为202 cm3/g,并具有最高的C2H6吸附焓(33 kJ/mol)。该材料对CH4具有很强的分离能力,通过对气体的分离能力进行计算,该材料的C2H2/CH4亨利选择性为81,显著高于当时的保持最高选择性68的MOFs材料Cu6(PDC)6·2.6H2O(UTSA-50;PDC为3, 5-pyridine-dicarboxylate 3, 5-吡啶-二羧酸),证明了该策略的合理性。同时,它也表现出了很好的水汽稳定性和热稳定性,在天然气纯化领域具有很好的应用前景(图 3a)。同年,我们小组[28]通过理论计算与实验相结合的研究手段对MOF材料Cu3(TDPAT)(H2O)3·10H2O·5DMA(Cu-TDPAT; H6TDPAT为2, 4, 6-tris(3, 5-dicarboxylphenyl amino)-1, 3, 5-triazine,2, 4, 6-三(3, 5-二羧基苯胺)-1, 3, 5-三嗪)的C2s吸附性能及对CH4的分离性能进行了详细研究。理论计算说明不饱和金属中心及路易斯碱位对C2s分子具有很强作用力,这是首次在分子层面对C2s分子和路易斯碱位的相互作用进行研究。因为不饱和金属中心和路易斯碱位对气体分子的协同作用,Cu-TDPAT表现出很强的C2s碳氢化合物吸附能力。值得注意的是,该材料还具有MOFs材料中最高的C2H4吸附焓(49.5 kJ/mol)。另外,Cu-TDPAT展现了优异的C2s/CH4分离能力,在298 K条件下C2H2/CH4选择性最高(分离比为127)。吸附床实验表明Cu-TDPAT在气体流动状态下也可以从混合气中吸附分离C2s,具有较好的应用前景(图 3b)。
2.2 乙炔/乙烯的吸附分离
乙烯是聚合物生产的重要化学原料,而原料的纯度往往成为决定产品质量的先决条件。乙炔是乙烷裂解制乙烯的主要副产品,它也是在轻油裂解装置上生产乙烯的杂质之一(体积分数约为1%)。另外在乙烯聚合反应中乙炔的含量需要严格限制,因为超过40 mg/L的乙炔就会使催化剂中毒失活。因此,从乙烯中除去乙炔是至关重要的。由于分子大小、分子特性和挥发性相近,C2H2/C2H4分离是非常具有挑战性的。传统的乙炔分离办法要用到液体吸附剂N, N′-二甲基甲酰胺,但吸附过程非常耗能,而MOFs作为一种低能耗固体吸附剂已经在C2H2/C2H4分离方面展现出良好的应用前景。
Xiang等[29]首次报道了具有C2H2/C2H4分离效果的MOFs材料Zn3(BDC)3[Cu(SalPycy)](M′MOF-2) 和Zn3(CDC)3[Cu(SalPycy)](M′MOF-3;H2CDC为1, 4-cyclohexanedicarboxylate,1, 4-环己烷二羧酸)。M′MOF-2和M′MOF-3是同构的三维骨架,其中Zn3(COO)6次级结构单元通过CDC2-或BDC2-阴离子相连接形成Zn3(CDC)3或Zn3(BDC)3二维层,通过手性金属配体Cu(SalPyCy)柱撑得到三维结构。195 K下M′MOF-2可同时吸附C2H2和C2H4,Henry选择性为1.6。然而,由于M′MOF-3具有更小的孔结构,其C2H2/C2H4选择性为25.5。C2H2的分子大小为(0.332 nm×0.334 nm×0.570 nm),C2H4的分子大小为(0.328 nm×0.418 nm×0.484 nm),相比较而言C2H2更容易进入M′MOF-3的微孔结构,而C2H4由于分子尺寸或动力学因素被被阻隔在外。另外,295 K下M′MOF-3的C2H2/C2H4选择性为5.3,使该材料具有一定的实际应用价值。
Schröder研究组[30]于2015年报道了一例羟基功能化的多孔MOF材料NOTT-300,该材料同时展现了高C2H2/C2H4选择性和吸附能力。NOTT-300结构中的孔道由共顶八面体[AlO4(OH)2]桥连四羧酸配体L4-构成(H4L为biphenyl-3, 3′, 5, 5′-tetracarboxylic acid,二苯基-3, 3′, 5, 5′-四羧酸)。在293 K,1×105 Pa大气压条件下,NOTT-300可以分别吸收6.34 mmol/g的C2H2和4.28 mmol/g的C2H4,吸附量差值为2.06 mmol/g。基于常温常压下纯组分吸附曲线计算C2H2/C2H4等摩尔混合物的IAST选择性为2.30。通过对NOTT-300中两种分子间的竞争吸附进行密度泛函理论(DFT)计算和非弹性中子散射(INS)研究,结果表明,超分子共同作用(例如π…HO氢键、π…π堆积、C…H超分子相互作用和乙炔分子间的偶极相互作用)导致NOTT-300与乙炔的键合能(30~32 kJ/mol)强于乙烯(16~28 kJ/mol)。这种作用主要产生于孔腔的中心位置,通过静电偶极相互作用固定乙炔分子(图 4)。吸附床实验进一步证实了NOTT-300的C2H2/C2H4选择性,出口气体C2H4纯度达99.5%。不饱和金属中心和这两类气体中的π电子发生π配合作用(一般吸附热值可达40~60 kJ/mol)。
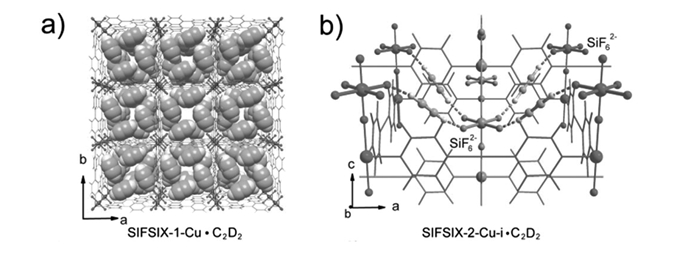
Cui等[31]于2016年报道了一系列包含SiF62-阴离子(SIFSIX; SiF22-为hexafluorosilicate六氟硅酸根)的MOFs材料,该系列材料展现了卓越的C2H2/C2H4分离能力。SIFSIX系列材料的孔壁由SiF62-构成,孔大小可以通过改变有机配体的长度进行调节。IAST计算表明SIFSIX-2-Cu-i(2为4, 4′-dipyridylacetylene,4, 4′-二吡啶基乙炔, i为interpenetrated,互穿)展现了目前MOFs材料中最高的C2H2/C2H4分离比(39.7~44.8)。在298 K,2.5×103 Pa条件下,SIFSIX-2-Cu-i表现出极高的C2H2吸附量(2.1 mmol/g),使得SIFSIX-2-Cu-i成为最适合进行C2H2/C2H4 (1/99) 分离的材料。SIFSIX-1-Cu(1为4, 4′-bipridine,4, 4′-联吡啶)在C2H2/C2H4(体积比50/50) 混合物分离方面性能最好,298 K,1×105 Pa条件下C2H2/C2H4分离比达到7.1~10.6,C2H2吸附量为8.5 mmol/g。DFT计算和中子衍射实验表明SIFSIX-1-Cu晶体结构中的每个单胞包含4个C2H2分子,通过C—H…F氢键主客体相互作用固定在结构中。在SIFSIX-2-Cu-i中,每个C2H2分子均被两个F原子限制在孔道中(图 5)。通过吸附床实验模拟实际工业上的气体混合物并进行分离,进一步证明了SIFSIX系列材料对C2H2分子良好的选择性吸附作用。
2.3 烯烃/烷烃的吸附分离
在石化工业中,大规模地烯烃/烷烃分离属于能源密集型分离。由于烯烃和烷烃分子大小相似、相对挥发度相近,其分离手段最为困难和昂贵(如乙烯和乙烷沸点相差15 K,相对挥发度约为1.2;丙烯和丙烷沸点相差5.3 K,相对挥发度约为1.14)。工业上分离乙烯/乙烷的条件为248 K和2.3×106 Pa,分离丙烯/丙烷的条件为243 K和3.0×106 Pa,均需通过耗能较高的分馏手段进行分离[32]。
MOFs材料中最有效的烯烃/烷烃分离手段是热力学平衡分离,这类分离中不饱和金属中心具有重要作用。Cu3(btc)2是首例进行C2H4/C2H6分离且包含不饱和金属中心的MOF材料。通过对材料进行活化,Cu金属中心失去配位水,形成不饱和金属铜位点。由吸附曲线可以看出,Cu3(btc)2优先吸附C2H4,这种现象可以归结于C2H4分子中碳碳双键与不饱和金属中心的作用[33-34]。Bhatia等[35]通过量子力学计算对Cu3(btc)2的骨架与C2H4/C2H6的相互作用做了详细研究,结果表明,C2H4与O原子形成更强的氢键作用,并一定程度上与Cu原子具有静电相互作用。巨正则蒙特卡洛(GCMC)计算表明低压区吸附热为22~30 kJ/mol,与实际吸附热约差3 kJ/mol,在298 K下等摩尔C2H4/C2H6理论选择性仅为2[36-37]。与C2H4/C2H6分离类似,Cu3(btc)2也能对C3H6/C3H8进行分离(C3H6吸附热-41.8 kJ/mol, C3H8吸附热-28.5 kJ/mol)。Rodrigues等[38]从实验和理论两方面论证了Cu3(btc)2对C3H6/C3H8分离的可行性。GCMC和DFT计算说明Cu3(btc)2对C3H6的吸附作用更强,这是因为C3H6分子的π键轨道与Cu原子空的s轨道相互作用,而C3H8则优先吸附于骨架的八面体空腔中,通过紫外可见光谱发生红移也可以证明C3H6分子与不饱和铜位点进行配位[39-41]。研究人员利用双组分吸附床进一步证明Cu3(btc)2的分离能力,结果表明,313 K C2H4/C2H6分离比为3.3,升温至353 K分离比为5.5[42]。由于在烯烃/烷烃分离效果显著,多种不同形貌的Cu3(btc)2材料被合成出来(包括球状、块状和片状材料等),这些材料被广泛用于变压吸附(PSA)、真空变压吸附(VSA)或模拟移动床吸附的研究当中。
MMOF-74系列是另一类典型的具有高密度不饱和金属中心(7.13~7.58 mmol/cm3)的MOF材料[43-44]。Bao等[34]报道了应用于C2H4/C2H6和C3H6/C3H8分离的首例该类型材料MgMOF-74。在给定温度下,该材料对C2H4/C2H6或C3H6/C3H8的饱和吸附量大体相等,但其烯烃的吸附热远大于对应的烷烃。C2H4/C2H6和C3H6/C3H8的吸附选择性分别为~15和~19。GCMC模拟表明所有小分子均吸附于Mg2+开放位点周围,每个金属位点附近被一个气体分子占据。随后,Snurr课题组[45]系统地研究了一系列MMOF-74(M=Co, Mn, Mg)同构材料的C3H6/C3H8选择性。与MnMOF-74(~24) 和MgMOF-74(~4.5) 相比,CoMOF-74(~46) 显现出更高的选择性,这是由于C3H6与开放Co金属中心键和作用更强,吸附床穿透实验同样证明了CoMOF-74的优越分离性能。与其它MMOF-74同构物相比,FeMOF-74中Fe中心具有更软的(软硬酸碱理论)金属特性,因而具有更强的C2H4/C2H6和C3H6/C3H8分离能力。Long研究组[24]证明FeMOF-74在318 K条件下具有极好的C2H4/C2H6和C3H6/C3H8分离性能,等摩尔C2H4/C2H6选择性可达13~18,大幅高于NaX型分子筛(9~14) 或同构材料MgMOF-74(4~7)。另外,在1 (105Pa条件下每个Fe2+中心都吸附一个气体分子,这几种气体都接近预期的化学计量吸附量(图 6)。吸附床实验证明这种材料在318 K, 1×105 Pa条件下可以分离等摩尔C2H4/C2H6混合物,最后分别得到99%和99.5%的纯相气体;就C3H6/C3H8分离来说,可以得到纯度超过99%的C3H6和100%的C3H8。另外,吸附床模拟表明FeMOF-74的C2H4/C2H6分离能力几乎是NaX型分子筛和MgMOF-74的2倍,而与其它材料(NaX、ITQ-12、Cu3(btc)2和MIL-100(Fe))相比,318 K条件下C3H6/C3H8分离中C3H8的生产量至少提高20%。中子衍射实验说明Fe2+不饱和金属中心附近是首选吸附位点,不饱和轻烃乙炔、乙烯和丙烯通过预期的侧面吸附模式与金属位点作用,Fe—C键长为0.242~0.260 nm,而乙烷和丙烷与金属位点作用力较弱,Fe—C键长为~0.3 nm。在之后的研究中,该研究组对不同不饱和金属中心的烯烃/烷烃分离效果进行了比较,结果表明,MMOF-74系列材料的C3H6/C3H8选择性均高于C2H4/C2H6选择性,其中FeMOF-74的C2H4/C2H6分离比最高,而MnMOF-74的C3H6/C3H8分离性质最强,Mg和Zn金属同构材料与气体分子作用力最弱,分离性质最差[46]。
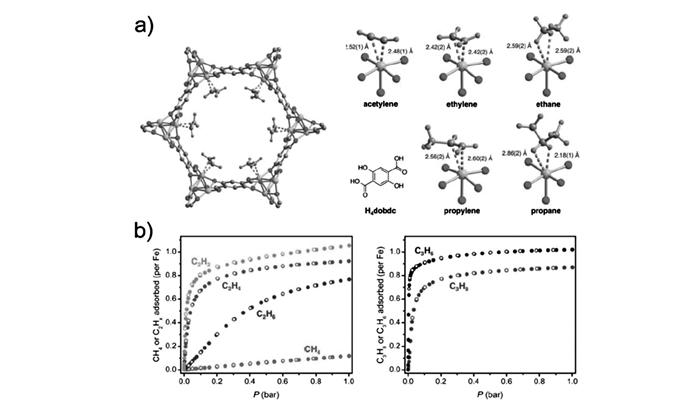 图6
中子粉末衍射数据分析测得部分Fe2(dobdc)·2C2D4结构图(左)和铁中心与不同气体分子的第一球形配位结构(右)(a);318 K条件下Fe2(dobdc)的气体吸附曲线(b)[24]
Figure6.
A portion of the solid-state structure of Fe2(dobdc)·2C2D4 as determined by the analysis of neutron powder diffraction data (Left); the first coordination spheres for the iron centers with varieties of gases(Right)(a); gas adsorption isotherms in Fe2(dobdc) at 318 K(b)[24]
图6
中子粉末衍射数据分析测得部分Fe2(dobdc)·2C2D4结构图(左)和铁中心与不同气体分子的第一球形配位结构(右)(a);318 K条件下Fe2(dobdc)的气体吸附曲线(b)[24]
Figure6.
A portion of the solid-state structure of Fe2(dobdc)·2C2D4 as determined by the analysis of neutron powder diffraction data (Left); the first coordination spheres for the iron centers with varieties of gases(Right)(a); gas adsorption isotherms in Fe2(dobdc) at 318 K(b)[24]
研究表明,某些过渡金属例如Cu(Ⅰ)和Ag(Ⅰ)离子会与烯烃分子的C=C键形成π配合物,进而达到烯烃和烷烃分离的目的[47-49]。Bao研究组[50]将Ag(Ⅰ)离子引入富含磺酸基的MOF材料(Cr)-MIL-101-SO3H中,显著提高了其室温C2H4/C2H6和C3H6/C3H8选择性。在303 K、100 kPa条件下,(Cr)-MIL-101-SO3Ag的等摩尔C2H4/C2H6分离比为16,高于大多数已报道的沸石和MOF材料。Ma研究组[51]也于同期报道了(Cr)-MIL-101-SO3Ag材料的高C2H4/C2H6选择性,在318 K、100 kPa条件下可达9.7。另外,向微孔MOFs材料内部负载过渡金属离子也是提高烯烃/烷烃选择性的有效手段。Chang等[52]通过将CuCl纳米粒子分散到MIL-101孔道中形成一种复合材料,这种材料能显著提高C2H4/C2H6分离效率。负载质量分数40%CuCl的MIL-101材料较原始MIL-101相比,C2H4/C2H6分离选择性从1.6提高到14.0。这可能是由于Cu+的引入导致与乙烯中C=C双键的π配合作用。
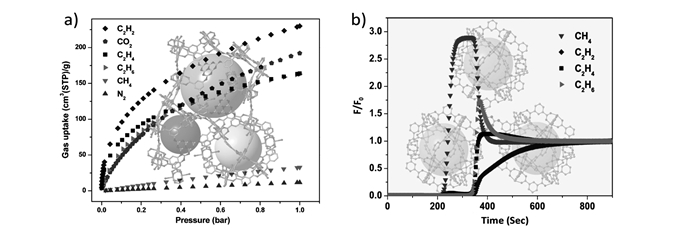
就大多数MOFs材料而言,烯烃更容易和骨架中的金属离子进行作用,这使得获得烯烃纯相气体必须经过气体脱附阶段。Liao等[53]报道了多孔MOF材料Zn(batz)(MAF-49;H2batz为bis(5-amino-1H-1, 2, 4-triazol-3-yl)methane,双(5-氨基-1H-1, 2, 4-三唑-3-基)甲烷)的卓越C2H6/C2H4分离能力。MAF-49具有1D锯齿状超微孔结构(0.33 nm×0.30 nm),这种大小的孔道正与乙烯和乙烷分子的动力学直径相匹配。孔壁上富含来自三唑配体的负电性氮原子,这些位点均可作为氢键受体提高气体分子作用力。单晶结构和GCMC模拟表明,C2H6/C2H4的高选择性是因为孔道中适当分布着多种负电性和正电性的官能团,这些官能团的存在使得乙烷分子可以形成许多氢键,但对乙烯分子的相互作用较弱,使乙烯气体脱附更为容易。在313 K、1×105 Pa条件下对MAF-49进行吸附床穿透实验,起始气体为典型的裂解气混合物(V(乙烯):V(乙烷)=15:1),通过一定体积的MAF-49样品管后可以直接产出56倍于样品管体积的乙烯气体,纯度达99.95%,可直接用于聚合物生产,这一结果大幅超过其他的乙烷选择性吸附材料,如MAF-3、MAF-4和IRMOF-8(图 7)。
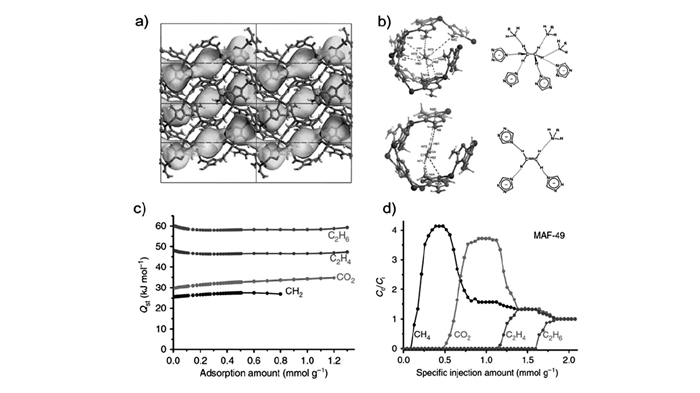 图7
MAF-49的晶体结构(a); 计算模拟MAF-49中乙烷和乙烯的最佳吸附位点(b); MAF-49的吸附焓(c); MAF-49的四组分等摩尔气体混合物(CH4/CO2/C2H4/C2H6)吸附床分离曲线(d)[53]
Figure7.
Crystal structure of MAF-49(a), Preferential adsorption sites for ethane and ethylene in MAF-49 revealed by computational simulations(b), The adsorption enthalpy of MAF-49(c), Breakthrough curves of four-component equimolar gas mixture(CH4/CO2/C2H4/C2H6) separation on MAF-49(d)[53]
图7
MAF-49的晶体结构(a); 计算模拟MAF-49中乙烷和乙烯的最佳吸附位点(b); MAF-49的吸附焓(c); MAF-49的四组分等摩尔气体混合物(CH4/CO2/C2H4/C2H6)吸附床分离曲线(d)[53]
Figure7.
Crystal structure of MAF-49(a), Preferential adsorption sites for ethane and ethylene in MAF-49 revealed by computational simulations(b), The adsorption enthalpy of MAF-49(c), Breakthrough curves of four-component equimolar gas mixture(CH4/CO2/C2H4/C2H6) separation on MAF-49(d)[53]
3 结论与展望
MOFs材料具有可调节孔维度、独特的孔形状和功能化的孔表面,在轻烃分离方面具有非常大的应用潜力。自从十几年前MOFs材料被应用于轻烃气体分离领域,如何提高分离效率成为这一领域的研究重点。为了这一目标,化学工作者对轻烃气体的分离机理进行研究,如今成熟的分离机理包括平衡分离、位阻分离、动力学分离和“开门”效应等。通过不断地对机理进行完善,合成了众多具有优异分离性能的MOFs材料,例如FeMOF-74、SIFSIX-1-Cu、Cu-TDPAT等,这些材料在重要的轻烃分离,如C2s碳氢化合物/甲烷、乙炔/乙烯和烯烃/烷烃的吸附分离等方面具有潜在的应用价值。综合来看,MOFs材料中不饱和金属中心密度、特殊官能团密度和孔道结构大小是影响轻烃吸附分离能力重要因素。
MOFs材料的应用受到众多因素的影响,其在轻烃分离中存在许多挑战:1) 在石化工业的实际应用中,气体分离条件往往较为苛刻,这使得MOFs材料需要具备水、热和一定程度的酸碱稳定性;2) 虽然MOFs材料在气体分离的过程中可以重复使用,但MOFs材料的制造成本也需要仔细考量;3) 由于较多的金属盐和接近无限的有机配体可供选择,距今为止已经报道了超过20000种MOFs材料。为了更加合理和系统地合成MOFs材料,需要利用先进的分子模拟方法建立大数据库对材料的结构进行预测,这可以使实验工作更便捷和高效;4) 实际应用过程中需要添加粘合剂制备复合材料,以便在进行吸附床穿透实验时使样品具有足够的机械强度,并在气体通过样品管时减小压降。可以预见,随着新颖多孔MOFs材料的不断涌现,一些有轻烃分离应用前景的MOFs材料一定将会在不远的将来投入到实际工业应用当中。
-
-
[1]
Eldridge R B. Olefin/Paraffin Separation Technology:A Review[J]. Ind Eng Chem Res, 1993, 32(10): 2208-2212. doi: 10.1021/ie00022a002
-
[2]
Yaghi O M, Li G M, Li H L. Selective Binding and Removal of Guests in a Microporous Metal-Organic Framework[J]. Nature, 1995, 378(6558): 703-706. doi: 10.1038/378703a0
-
[3]
韩易潼, 刘民, 李克艳. 高稳定性金属有机骨架UIO-66的合成与应用[J]. 应用化学, 2016,33,(4): 367-378. doi: 10.11944/j.issn.1000-0518.2016.04.150439HAN Yitong, LIU Min, LI Keyan. Preparation and Application of High Stability Metal-Organic Framework UIO-66[J]. Chinese J Appl Chem, 2016, 33(4): 367-378. doi: 10.11944/j.issn.1000-0518.2016.04.150439
-
[4]
Rowsell J L C, Spencer E C, Eckert J. Gas Adsorption Sites in a Large-Pore Metal-Organic Framework[J]. Science, 2005, 309(5739): 1350-1354. doi: 10.1126/science.1113247
-
[5]
Han Y, Zheng H, Liu K. In-Situ Ligand Formation-Driven Preparation of a Heterometallic Metal Organic Framework for Highly Selective Separation of Light Hydrocarbons and Efficient Mercury Adsorption[J]. ACS Appl Mater Interfaces, 2016, 8(35): 23331-23337. doi: 10.1021/acsami.6b08397
-
[6]
Liu K, Hu H, Sun J. pH Value-Controlled Assembly of Photoluminescent Zinc Coordination Polymers in the Mixed-Ligand System[J]. J Mol Struct, 2017, 1134: 174-179. doi: 10.1016/j.molstruc.2016.12.075
-
[7]
Liu K, Sun Y, Hu H. Hydrothermal Syntheses and Characterization of a New Metal-Organic Framework of Gadolinium(Ⅲ) with 2, 4, 6-Tris(3, 5-dicarboxylphenyl-amino)-1, 3, 5-triazine[J]. Polyhedron, 2017, 131: 8-12. doi: 10.1016/j.poly.2017.04.009
-
[8]
龚文朋, 柯晓芬, 李志鹏. 磷钼钨杂多酸修饰金属有机骨架MOF-5复合材料吸附亚甲基蓝[J]. 应用化学, 2016,33,(9): 1047-1055. GONG Wenpeng, KE Xiaofen, LI Zhipeng. Adsorption of Methylene Blue by Phosphomolybdiumtungstic Acid Decorated Metal Organic Framework MOF-5[J]. Chinese J Appl Chem, 2016, 33(9): 1047-1055.
-
[9]
Herm Z R, Bloch E D, Long J R. Hydrocarbon Separations in Metal-Organic Frameworks[J]. Chem Mater, 2014, 26(1): 323-338. doi: 10.1021/cm402897c
-
[10]
Banerjee D, Liu J, Thallapally P K. Separation of C2 Hydrocarbons by Porous Materials:Metal Organic Frameworks as Platform[J]. Comments Inorg Chem, 2015, 35(1): 18-38. doi: 10.1080/02603594.2014.976704
-
[11]
Li J R, Sculley J, Zhou H C. Metal-Organic Frameworks for Separations[J]. Chem Rev, 2012, 112(2): 869-932. doi: 10.1021/cr200190s
-
[12]
Wu H H, Gong Q H, Olson D H. Commensurate Adsorption of Hydrocarbons and Alcohols in Microporous Metal Organic Frameworks[J]. Chem Rev, 2012, 112(2): 836-868. doi: 10.1021/cr200216x
-
[13]
Yang R T. Gas Separation by Adsorption Processes[M]. Butterworths, Boston, 1987.
-
[14]
Czaja A U, Trukhan N, Muller U. Industrial Applications of Metal-Organic Frameworks[J]. Chem Soc Rev, 2009, 38(5): 1284-1293. doi: 10.1039/b804680h
-
[15]
Arakawa H, Aresta M, Armor J N. Catalysis Research of Relevance to Carbon Management:Progress, Challenges, and Opportunities[J]. Chem Rev, 2001, 101(4): 953-996. doi: 10.1021/cr000018s
-
[16]
Guo X G, Fang G Z, Li G. Direct, Nonoxidative Conversion of Methane to Ethylene, Aromatics, and Hydrogen[J]. Science, 2014, 344(6184): 616-619. doi: 10.1126/science.1253150
-
[17]
Zhou S D, Li J L, Wu X N. Efficient Room-Temperature, Au+-Mediated Coupling of a Carbene Ligand with Methane To Generate C2H x(x=4, 6)[J]. Angew Chem Int Ed, 2016, 55(1): 441-444. doi: 10.1002/anie.201509320
-
[18]
Chen Z X, Xiang S C, Arman H D. A Microporous Metal-Organic Framework with Immobilized -OH Functional Groups within the Pore Surfaces for Selective Gas Sorption[J]. Eur J Inorg Chem, 2010, 2010(24): 3745-3749. doi: 10.1002/ejic.201000349
-
[19]
Das M C, Xu H, Wang Z. A Zn4O-Containing Doubly Interpenetrated Porous Metal-Organic Framework for Photocatalytic Decomposition of Methyl Orange[J]. Chem Commun, 2011, 47(42): 11715-11717. doi: 10.1039/c1cc12802g
-
[20]
Das M C, Xu H, Xiang S C. A New Approach to Construct a Doubly Interpenetrated Microporous Metal-Organic Framework of Primitive Cubic Net for Highly Selective Sorption of Small Hydrocarbon Molecules[J]. Chem Eur J, 2011, 17(28): 7817-7822. doi: 10.1002/chem.201100350
-
[21]
Zhang Z J, Xiang S C, Hong K L. Triple Framework Interpenetration and Immobilization of Open Metal Sites within a Microporous Mixed Metal-Organic Framework for Highly Selective Gas Adsorption[J]. Inorg Chem, 2012, 51(9): 4947-4953. doi: 10.1021/ic2021275
-
[22]
Zhang Z, Xiang S, Chen Y. A Robust Highly Interpenetrated Metal-Organic Framework Constructed from Pentanuclear Clusters for Selective Sorption of Gas Molecules[J]. Inorg Chem, 2010, 49(18): 8444-8448. doi: 10.1021/ic1010083
-
[23]
Horike S, Inubushi Y, Hori T. A Solid Solution Approach to 2D Coordination Polymers for CH4/CO2 and CH4/C2H6 Gas Separation:Equilibrium and Kinetic Studies[J]. Chem Sci, 2012, 3(1): 116-120. doi: 10.1039/C1SC00591J
-
[24]
Bloch E D, Queen W L, Krishna R. Hydrocarbon Separations in a Metal-Organic Framework with Open Iron(Ⅱ) Coordination Sites[J]. Science, 2012, 335(6076): 1606-1610. doi: 10.1126/science.1217544
-
[25]
He Y, Krishna R, Chen B. Metal-Organic Frameworks with Potential for Energy-Efficient Adsorptive Separation of Light Hydrocarbons[J]. Energy Environ Sci, 2012, 5(10): 9107-9120. doi: 10.1039/c2ee22858k
-
[26]
Hu Y X, Xiang S C, Zhang W W. A New MOF-505 Analog Exhibiting High Acetylene Storage[J]. Chem Commun, 2009, (48): 7551-7553. doi: 10.1039/b917046d
-
[27]
Liu K, Li B, Li Y. An N-Rich Metal-Organic Framework with a rht Topology:High CO2 and C2 Hydrocarbons Uptake and Selective Capture from CH4[J]. Chem Commun, 2014, 50(39): 5031-5033. doi: 10.1039/c4cc00375f
-
[28]
Liu K, Ma D, Li B. High Storage Capacity and Separation Selectivity for C2 Hydrocarbons over Methane in the Metal-Organic Framework Cu-TDPAT[J]. J Mater Chem A, 2014, 2(38): 15823-15828. doi: 10.1039/C4TA03656E
-
[29]
Xiang S, Zhang Z, Zhao C. Rationally Tuned Micropores within Enantiopure Metal Organic Frameworks for Highly Selective Separation of Acetylene and Ethylene[J]. Nat Commun, 2011, 2: 204. doi: 10.1038/ncomms1206
-
[30]
Yang S H, Ramirez-Cuesta A J, Newby R. Supramolecular Binding and Separation of Hydrocarbons within a Functionalized Porous Metal-Organic Framework[J]. Nat Chem, 2015, 7(2): 121-129.
-
[31]
Cui X L, Chen K J, Xing H B. Pore Chemistry and Size Control in Hybrid Porous Materials for Acetylene Capture from Ethylene[J]. Science, 2016, 353(6295): 141-144. doi: 10.1126/science.aaf2458
-
[32]
Bao Z, Alnemrat S, Yu L. Adsorption of Ethane, Ethylene, Propane, and Propylene on a Magnesium-Based Metal-Organic Framework[J]. Langmuir, 2011, 27(22): 13554-13562. doi: 10.1021/la2030473
-
[33]
Wang Q M, Shen D M, Bulow M. Metallo-Organic Molecular Sieve for Gas Separation and Purification[J]. Micropor Mesopor Mater, 2002, 55(2): 217-230. doi: 10.1016/S1387-1811(02)00405-5
-
[34]
Ploegmakers J, Japip S, Nijmeijer K. Mixed Matrix Membranes Containing MOFs for Ethylene/Ethane Separation-Part B:Effect of Cu3BTC2 on Membrane Transport Properties[J]. J Membr Sci, 2013, 428: 331-340. doi: 10.1016/j.memsci.2012.11.013
-
[35]
Nicholson T M, Bhatia S K. Electrostatically Mediated Specific Adsorption of Small Molecules in Metallo-Organic Frameworks[J]. J Phys Chem B, 2006, 110(49): 24834-24836. doi: 10.1021/jp065102b
-
[36]
Nicholson T M, Bhatia S K. Role of Electrostatic Effects in the Pure Component and Binary Adsorption of Ethylene and Ethane in Cu-Tricarboxylate Metal-Organic Frameworks[J]. Adsorpt Sci Technol, 2007, 25(8): 607-619. doi: 10.1260/0263-6174.25.8.607
-
[37]
Wang S, Yang Q, Zhong C. Adsorption and Separation of Binary Mixtures in a Metal-Organic Framework Cu-BTC:A Computational Study[J]. Sep Purif Technol, 2008, 60(1): 30-35. doi: 10.1016/j.seppur.2007.07.050
-
[38]
Lamia N, Jorge M, Granato M A. Adsorption of Propane, Propylene and Isobutane on a Metal-Organic Framework:Molecular Simulation and Experiment[J]. Chem Eng Sci, 2009, 64(14): 3246-3259. doi: 10.1016/j.ces.2009.04.010
-
[39]
Jorge M, Lamia N, Rodrigues A E. Molecular Simulation of Propane/Propylene Separation on the Metal-Organic Framework CuBTC[J]. Colloids Surf A, 2010, 357(1/2/3): 27-34.
-
[40]
Rubes M, Wiersum A D, Llewellyn P L. Adsorption of Propane and Propylene on CuBTC Metal-Organic Framework:Combined Theoretical and Experimental Investigation[J]. J Phys Chem C, 2013, 117(21): 11159-11167. doi: 10.1021/jp401600v
-
[41]
Fischer M, Gomes J R B, Froeba M. Modeling Adsorption in Metal Organic Frameworks with Open Metal Sites:Propane/Propylene Separations[J]. Langmuir, 2012, 28(22): 8537-8549. doi: 10.1021/la301215y
-
[42]
Yoon J W, Jang I T, Lee K Y. Adsorptive Separation of Propylene and Propane on a Porous Metal-Organic Framework, Copper Trimesate[J]. Bull Korean Chem Soc, 2010, 31(1): 220-223. doi: 10.5012/bkcs.2010.31.01.220
-
[43]
Wu X F, Bao Z B, Yuan B. Microwave Synthesis and Characterization of MOF-74(M=Ni, Mg) for Gas Separation[J]. Micropor Mesopor Mater, 2013, 180: 114-122. doi: 10.1016/j.micromeso.2013.06.023
-
[44]
Bohme U, Barth B, Paula C. Ethene/Ethane and Propene/Propane Separation via the Olefin and Paraffin Selective Metal Organic Framework Adsorbents CPO-27 and ZIF-8[J]. Langmuir, 2013, 29(27): 8592-8600. doi: 10.1021/la401471g
-
[45]
Bae Y S, Lee C Y, Kim K C. High Propene/Propane Selectivity in Isostructural Metal Organic Frameworks with High Densities of Open Metal Sites[J]. Angew Chem Int Ed, 2012, 51(8): 1857-1860. doi: 10.1002/anie.v51.8
-
[46]
Geier S J, Mason J A, Bloch E D. Selective Adsorption of Ethylene over Ethane and Propylene over Propane in the Metal-Organic Frameworks M2(dobdc) (M=Mg, Mn, Fe, Co, Ni, Zn)[J]. Chem Sci, 2013, 4(5): 2054-2061. doi: 10.1039/c3sc00032j
-
[47]
Yang R T, Kikkinides E S. New Sorbents for Olefin/Paraffin Separations by Adsorption via π-Complexation[J]. AIChE J, 1995, 41(3): 509-517. doi: 10.1002/(ISSN)1547-5905
-
[48]
Jiang W J, Yin Y, Liu X Q. Fabrication of Supported Cuprous Sites at Low Temperatures:An Efficient, Controllable Strategy Using Vapor-Induced Reduction[J]. J Am Chem Soc, 2013, 135(22): 8137-8140. doi: 10.1021/ja4030269
-
[49]
Qin J X, Wang Z M, Liu X Q. Low-Temperature Fabrication of Cu(Ⅰ) Sites in Zeolites by Using a Vapor-Induced Reduction Strategy[J]. J Mater Chem A, 2015, 3(23): 12247-12251. doi: 10.1039/C5TA02569A
-
[50]
Chang G G, Huang M H, Su Y. Immobilization of Ag(Ⅰ) into a Metal-Organic Framework with -SO3H Sites for Highly Selective Olefin-Paraffin Separation at Room Temperature[J]. Chem Commun, 2015, 51(14): 2859-2862. doi: 10.1039/C4CC09679G
-
[51]
Zhang Y M, Li B Y, Krishna R. Highly Selective Adsorption of Ethylene over Ethane in a MOF Featuring the Combination of Open Metal Site and π-Complexation[J]. Chem Commun, 2015, 51(13): 2714-2717. doi: 10.1039/C4CC09774B
-
[52]
Chang G G, Bao Z B, Ren Q L. Fabrication of Cuprous Nanoparticles in MIL-101:An Efficient Adsorbent for the Separation of Olefin-Paraffin Mixtures[J]. RSC Adv, 2014, 4(39): 20230-20233. doi: 10.1039/C4RA02125H
-
[53]
Liao P Q, Zhang W X, Zhang J P. Efficient Purification of Ethene by an Ethane-Trapping Metal-Organic Framework[J]. Nat Commun, 2015, 6: 8697. doi: 10.1038/ncomms9697
-
[1]
-
图 6 中子粉末衍射数据分析测得部分Fe2(dobdc)·2C2D4结构图(左)和铁中心与不同气体分子的第一球形配位结构(右)(a);318 K条件下Fe2(dobdc)的气体吸附曲线(b)[24]
Figure 6 A portion of the solid-state structure of Fe2(dobdc)·2C2D4 as determined by the analysis of neutron powder diffraction data (Left); the first coordination spheres for the iron centers with varieties of gases(Right)(a); gas adsorption isotherms in Fe2(dobdc) at 318 K(b)[24]
图 7 MAF-49的晶体结构(a); 计算模拟MAF-49中乙烷和乙烯的最佳吸附位点(b); MAF-49的吸附焓(c); MAF-49的四组分等摩尔气体混合物(CH4/CO2/C2H4/C2H6)吸附床分离曲线(d)[53]
Figure 7 Crystal structure of MAF-49(a), Preferential adsorption sites for ethane and ethylene in MAF-49 revealed by computational simulations(b), The adsorption enthalpy of MAF-49(c), Breakthrough curves of four-component equimolar gas mixture(CH4/CO2/C2H4/C2H6) separation on MAF-49(d)[53]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 816
- HTML全文浏览量: 129


 下载:
下载:






 下载:
下载:

