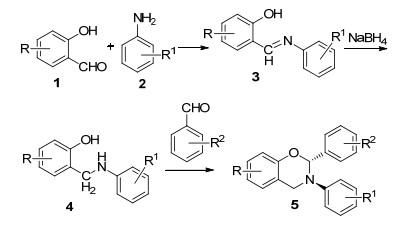
 图 图式1
2, 3, 6(8)-三取代-1, 3-苯并噁嗪类化合物5的合成
Figure 图式1.
Synthesis of 2, 3, 6(8)-trisubstituted-1, 3-benzoxazines
图 图式1
2, 3, 6(8)-三取代-1, 3-苯并噁嗪类化合物5的合成
Figure 图式1.
Synthesis of 2, 3, 6(8)-trisubstituted-1, 3-benzoxazines

Citation: Tang Zilong, Xia Zanwen, Li Xinxing. Stereoselective Synthesis, Crystal Structure and Fungicidal Activity of trans-2, 3, 6(8)-Trisubstituted-1, 3-benzoxazines[J]. Chinese Journal of Organic Chemistry, 2016, 36(3): 590-595. doi: 10.6023/cjoc201508019

反-2, 3, 6(8)-三取代-1, 3-苯并噁嗪类化合物的立体选择性合成、晶体结构与杀菌活性
-
关键词:
- 2, 3, 6(8)-三取代-1, 3-苯并噁嗪
- / 合成
- / 立体选择性
- / 杀菌活性
English
Stereoselective Synthesis, Crystal Structure and Fungicidal Activity of trans-2, 3, 6(8)-Trisubstituted-1, 3-benzoxazines
-
1, 3-苯并噁嗪衍生物是一类重要的含氮杂环化合物, 具有抗癌[1~3]、抗血小板聚集[4]、抗细菌和真菌活性[5, 6]、抗结核病活性[7, 8]等广泛的生物活性[1~11].此外, 2-位无取代1, 3-苯并噁嗪衍生物还是制备酚醛树脂的重要原料[12, 13].最近, 文献报道一些1, 3-苯并噁嗪衍生物具有光致变色活性[14, 15].因此, 对合成1, 3-苯并噁嗪类化合物的新方法和新型1, 3-苯并噁嗪类化合物的研究日益引起化学家们的极大兴趣.伯胺、甲醛和苯酚之间的曼尼希反应是合成1, 3-苯并噁嗪的一种既简单又重要的方法[16~18].然而, 这种方法只局限于合成2-位无取代1, 3-苯并噁嗪类化合物.利用伯胺和含氧二卤代化合物的反应可以生成1, 3-苯并噁嗪衍生物[19], 且反应条件温和.但是原料含氧二卤代化合物不易制备. 2-氨甲基苯酚与醛或酮在催化剂的作用下反应生成1, 3-苯并噁嗪衍生物, 为该类化合物提供了一个较普适的合成方法[20, 21].最近, Richers等[22]报道了一种有效的合成方法, 即用氧化还原中性法对胺的α-位进行氧化, 然后与2-羟基苯甲醛反应来制备苯并噁嗪衍生物.本课题组[23, 24]曾报道采用SnCl4或(CH3)3SiCl (TMSCl)作为催化剂, 催化2-氨基甲基苯酚与芳醛的N, O-缩醛反应来制备取代1, 3-苯并噁嗪类化合物.最近, 我们[25]还报道了一种利用相转移催化2-(1, 3, 4-噻二唑基-2-氨基甲基)苯酚与CH2Cl2反应来合成1, 3, 4-噻二唑基取代1, 3-苯并噁嗪类化合物.所合成的大部分1, 3-苯并噁嗪类化合物具有良好的杀菌活性.因此, 为了寻找具有生物活性的新型苯并噁嗪杂环类化合物, 本文利用TMSCl为催化剂, 通过2-芳氨基甲基苯酚与芳醛反应合成了一系列新型2, 3, 6(8)-三取代-1, 3-苯并噁嗪类化合物5 (Scheme 1), 并且发现反应具有高度的反式选择性, 目标化合物也具有良好的杀菌活性.
 图 图式1
2, 3, 6(8)-三取代-1, 3-苯并噁嗪类化合物5的合成
Figure 图式1.
Synthesis of 2, 3, 6(8)-trisubstituted-1, 3-benzoxazines
图 图式1
2, 3, 6(8)-三取代-1, 3-苯并噁嗪类化合物5的合成
Figure 图式1.
Synthesis of 2, 3, 6(8)-trisubstituted-1, 3-benzoxazines
1 结果与讨论
1.1 合成
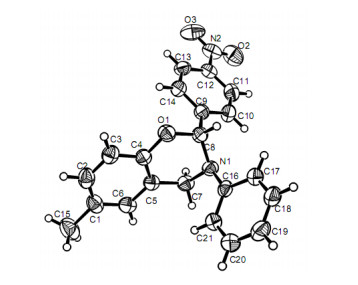
根据合成路线1, 采用“一锅法”, 芳胺与取代水杨醛在对甲苯磺酸的催化作用下反应生成席夫碱3, 然后, 在无水乙醇中经硼氢化钠还原生成2-芳氨基甲基苯酚4 [18, 26], 总产率为67%~90%.以TMSCl为催化剂, 2-芳氨基甲基苯酚(4)与取代苯甲醛在加热条件下反应生成目标化合物5a~5k, 产率为38%~80%(表 1).由表 1可知: (1) 4-氯苯甲醛的反应产率低于硝基苯甲醛, 不论硝基处于邻位、间位或对位.这主要是因为硝基电负性较大, 使硝基苯甲醛羰基碳的亲电性增大, 从而使其反应活性增大. (2)与氮原子相连的苯环上带有供电子基团的产率比带有吸电子基团的要高(5b vs. 5c; 5h vs. 5j vs. 5k).因为供电子基团可以增加氮原子的电荷密度, 从而增强其亲核性. (3)苯并噁嗪环的苯环上含有供电子基团如CH3基比含有吸电子基团如Br、Cl的产率要高(5b vs. 5d, 5j), 因为供电子基团可以增大氧原子的电子密度, 从而增大其亲核性. (4)特别要指出的是所有反应都只得到一种顺反异构体, 其苯并噁嗪环上的3-芳基和2-芳基呈反式关系, 如化合物5c的晶体结构所示(图 1, CCDC: 942186), 这可能是由于3-芳基和2-芳基处于反式, 它们之间的排斥力小, 降低分子内能, 化合物更加稳定.这些实验结果表明该反应具有高度的反式选择性.
Compd. R R 1 R 2 Yield b /% 5a 6-CH3 4'-OCH3 2'-NO2 80 5b 6-CH3 4'-OCH3 4'-NO2 80 5c 6-CH3 H 4'-NO2 65 5d 6-Br 4'-OCH3 4'-NO2 58 5e 6-Br 3'-Cl 2'-NO2 49 5f 6-Br 3'-Cl 4'-Cl 38 5g 6-Br 3'-Cl 3'-NO2 42 5h 8-Cl 4'-CH3 4'-NO2 58 5i 8-Cl H 2'-NO2 49 5j 8-Cl H 4'-NO2 55 5k 8-Cl 4'-Cl 4'-NO2 49 a反应条件:反应物的量之比, n(2-芳氨基甲基苯酚4):n(芳醛)=1:1.3.催化剂: TMSCl (20 mol%, 基于2-芳氨基甲基苯酚4的量).溶剂: CHCl3/C6H12(环己烷)=1:4 (V:V).反应时间: 5 h.反应温度: 85 ℃. b分离产率. 表 1 化合物5a~5k的合成结果a
Table 1. Results of the preparation of compound 5a~5k1.2 目标化合物的波谱特征
化合物5a~5k的结构用1H NMR, 13C NMR, IR和元素分析等进行表征, 表现出了相应的特征峰(见实验部分), 这可用化合物5c为例予以说明.在其IR谱中, 3072 cm-1处的吸收峰为苯环的C—H键的伸缩振动峰, 1608 cm-1处的吸收峰是由苯环C=C键的伸缩振动造成的, 1357 cm-1处的吸收峰表示NO2基团的存在.在1H NMR中, 化学位移δ2.21处有一个单峰, 对应于CH3的质子峰; δ6.61处的单峰为苯并噁嗪环内OCHN的质子峰, 此质子峰移向低场是由于氮和氧原子的强电负性造成的.苯并噁嗪环内NCH2的两个质子分裂为两个双峰, 不再是一个单峰, 化学位移为δ4.23和4.36, 表明两个质子是化学不等价的, 这是苯并噁嗪环形成的一个重要标志.在13C NMR中, CH3基碳的化学位移为δ20.65, CH2N基碳的化学位移为δ46.80, OCHN基碳的化学位移为δ87.21.化合物5c的质谱(ESI-MS)显示出347的离子峰, 此为化合物[M+H]+的离子峰.此外, 化合物5c的结构进一步由X射线晶体分析所证实(图 1, CCDC: 942186), 图 1清楚地展示了化合物5c的结构, 噁嗪环的构象呈半椅式, 3-芳基和2-芳基处于反式关系, 且3-芳基处于直立键, 2-芳基处于平伏键, 其扭转角为151.3(2)°.从图 1还可以清楚地看到苯并噁嗪环中N(1)原子与C(16)形成的C—N键和由N(1)原子与C(7)、C(8)形成的另外两个C—N键不在一个平面内, 这说明N(1)原子采用sp3杂化.
1.3 抑菌活性
采用离体法测定了目标化合物5a~5k对油菜菌核病菌(Sclerotonia sclerotiorum)、辣椒疫霉病菌(Phyto-phythora capsici)、黄瓜灰霉病菌(Botrytis cinerea)、水稻纹枯病菌(Rhizoctorzia solani)、烟草赤星病菌(Alternaria alterna)和稻瘟病菌(Magnaporthe oryzae)的抑制活性.对于稻瘟病菌, 测试化合物的浓度为50 mg/mL, 对于其余病菌, 测试化合物的浓度为25 mg/mL, 具体操作见实验部分.测试结果见表 2, 抑菌活性用抑制率表示.总的来说, 大部分化合物对所测试病菌具有中等至良好的抑菌活性, 其中对稻瘟病菌的抑制活性最好, 如化合物5e、5g的抑制活性均为78.6%.其次, 化合物对油菜菌核病菌也显示出良好的抑制活性, 如化合物5f的抑制活性为76.9%, 化合物5e的抑制活性为69.2%.特别是化合物5g对稻瘟病菌、灰霉病菌、疫霉病菌和菌核病菌等都表现出较好的抑菌活性, 具有广谱活性.此外, 化合物的活性与结构没有明显的关系, 但在大多数情况下, 与N原子相连的苯环上带有取代基(OCH3, CH3或Cl)的活性比未带取代基的要高(Entry 2 vs. Entry 3; Entries 8, 11 vs. Entry 10).
Entry 化合物 菌核病菌 疫霉病菌 灰霉病菌 纹枯病菌 赤星病菌 稻瘟病菌 1 5a 0 0 0 0 18.3 0 2 5b 13.1 7.6 0 0 41.2 0 3 5c 0 10.3 0 0 34.5 0 4 5d 0 44.4 35.3 50.0 43.8 21.4 5 5e 69.2 51.9 38.2 52.4 0 78.6 6 5f 76.9 44.4 44.1 64.3 0 50.0 7 5g 53.8 55.6 61.8 57.1 0 78.6 8 5h 30.8 40.7 23.5 52.4 37.5 28.6 9 5i 57.7 55.6 61.8 54.8 0 42.9 10 5j 36.5 13.1 13.6 0 12.3 0 11 5k 0 30.9 41.2 0 46.0 0 a 杀菌活性等级: A, 抑制率≥90%; B, 70%≤抑制率<90%; C, 50%≤抑制率<70%; D, 抑制率<50%. 表 2 化合物5a~5k的杀菌活性(抑制率/%)a
Table 2. Fungicidal activity (inhibitory rate/%) of products 5a~5k2 结论
本文提供了一个具有高度反式选择性合成多取代1, 3-苯并噁嗪类化合物的简单有效方法.在TMSCl的催化作用下, 2-芳基氨基甲基酚与取代苯甲醛经N, O-缩醛反应生成了一系列反-2, 3, 6(8)-三取代-1, 3-苯并噁嗪类化合物5a~5k.测定了化合物5c的单晶结构, 证实了苯并噁嗪环上的2-和3-位两个取代基处于反式.测试了化合物的抑菌活性, 其中大部分显示中等至良好的活性.
3 实验部分
3.1 仪器与试剂
熔点用WRS-1B数字熔点仪测定; 红外(IR)用Nicolet 6700 FT-IR测定; NMR用Bruker AVANCE-500 MHz核磁共振仪测定; 质谱用Bruker Esquire 2000质谱仪测定; 元素分析用PE 2400 II元素分析仪测定; 用Bruker Smart CCD Apex II单晶衍射分析仪测定化合物单晶结构.所有溶剂均用常规法进行干燥, 所用试剂为分析纯或化学纯; 取代水杨醛由实验室根据文献[27]合成, 2-芳基氨基甲基苯酚(4)根据文献[18]合成.
3.2 实验方法
3.2.1 反-2, 3, 6(8)-三取代-1, 3-苯并噁嗪(5)的合成
向装有分水器的100 mL三颈圆底烧瓶中加入2-芳氨基甲基苯酚4(4 mmol), 取代苯甲醛(5.2 mmol), 氯仿和环己烷的混合溶剂50 mL (V:V=1:4), 然后加入TMSCl (0.8 mmol, 20%), 通入氮气, 将该溶液加热至85 ℃, 5 h后停止反应(TLC检测).冷却, 加入三乙胺, 使溶液的pH=8, 随后加入乙酸乙酯(40 mL).将混合物依次用水(40 mL×2)和饱和盐水(40 mL×2)洗涤.将有机相用无水硫酸钠干燥, 抽滤, 减压脱除去溶剂得到粗产物, 用乙酸乙酯-石油醚重结晶, 或经快速柱层析法(乙酸乙酯-石油醚为展开剂)分离得到化合物5.
6-甲基-3-(4-甲氧基苯基)-2-(2-硝基苯基)-3, 4-二氢-2H-[1, 3]苯并噁(5a):黄色固体, 收率80%. m.p. 135.5~137.3 ℃; 1H NMR (CDCl3, 500 MHz) δ: 7.71~7.73 (m, 1H), 7.61~7.63 (m, 1H), 7.43~7.45 (m, 2H), 7.07 (d, J=9.0 Hz, 2H), 7.00 (d, J=8.0 Hz, 1H), 6.91 (d, J=8.5 Hz, 1H), 6.88 (s, 1H), 6.75 (d, J=9.0 Hz, 2H), 6.66 (s, 1H), 4.11 (d, J=17.0 Hz, 1H), 3.96 (d, J=17.5 Hz, 1H), 3.72 (s, 3H, OCH3), 2.22 (s, 3H, CH3); 13C NMR (CDCl3, 125 MHz) δ: 155.94, 150.39, 149.04, 142.66, 132.96, 131.76, 130.34, 129.04, 128.93, 128.69, 126.97, 124.27, 123.24 (2C), 120.03, 116.35, 114.22 (2C), 85.89, 55.35, 47.83, 20.59; IR (KBr) ν: 3010, 2932, 1618, 1522, 1446, 1364, 1247, 1177, 1043, 808, 777 cm-1. Anal. calcd for C22H20-N2O4: C 70.20, H 5.36, N 7.44; found C 70.50, H 5.34, N 7.41.
6-甲基-3-(4-甲氧基苯基)-2-(4-硝基苯基)-3, 4-二氢-2H-苯并[1, 3]噁嗪(5b):黄色固体, 收率80%. m.p. 128.9~129.7 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.19 (d, J=9.0 Hz, 2H), 7.75 (d, J=8.0 Hz, 2H), 7.12 (d, J=9.0 Hz, 2H), 6.99 (dd, J=8.0, 1.0 Hz, 1H), 6.91 (d, J=8.5 Hz, 1H), 6.79 (d, J=9.0 Hz, 2H), 6.69 (s, 1H), 6.42 (s, 1H), 4.28 (d, J=17.0 Hz, 1H), 4.19 (d, J=17.0 Hz, 1H), 3.74 (s, 3H, OCH3), 2.22 (s, 3H, CH3);13C NMR (CDCl3, 125 MHz) δ: 155.76, 150.28, 147.65, 146.44, 142.77, 130.41, 128.86, 127.97 (2C), 126.93, 123.69 (2C), 123.22 (2C), 119.75, 116.62, 114.36(2C), 88.32, 55.40, 48.06, 20.55; IR (KBr) ν: 3020, 1606, 1512, 1463, 1445, 1347, 1241, 1172, 1033, 978, 851, 751 cm-1. Anal. calcd for C22H20N2O4: C 70.20, H 5.36, N 7.44; found C 69.89, H 5.33, N 7.42.
6-甲基-2-(4-硝基苯基)-3-苯基-3, 4-二氢-2H-苯并[1, 3]噁嗪(5c):黄色固体, 收率65%. m.p. 118.2~120.1 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.20 (d, J=8.5 Hz, 2H), 7.75 (d, J=8.5 Hz, 2H), 7.27~7.31 (m, 2H), 7.20 (d, J=7.5 Hz, 2H), 6.97~7.02 (m, 2H), 6.91 (d, J=8.0 Hz, 1H), 6.69 (s, 1H), 6.61 (s, 1H, OCHN), 4.36 (d, J=17.0 Hz, 1H), 4.23 (d, J=17.0 Hz, 1H), 2.21 (s, 3H, CH3);13C NMR (125 MHz, CDCl3) δ: 150.02, 149.43, 147.74, 146.55, 130.54, 129.43 (2C), 129.04, 127.98 (2C), 126.99, 123.91 (2C), 122.70, 120.35 (2C), 119.65, 116.78, 87.21, 46.80, 20.65; IR (KBr) ν: 3072, 1608, 1533, 1500, 1489, 1456, 1357, 1236, 1219, 1141, 974, 957, 751 cm-1; MS (ESI) m/z: 347 [M+H]+. Anal. calcd for C21H18N2O3: C 72.82, H 5.24, N 8.09; found C 72.51, H 5.22, N 8.07.
6-溴-3-(4-甲氧基苯基)-2-(4-硝基苯基)-3, 4-二氢-2H-苯并[1, 3]噁嗪(5d):黄色固体, 收率58%. m.p. 156.3~157.4 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.20 (d, J=9.0 Hz, 2H), 7.73 (d, J=8.5 Hz, 2H), 7.11 (dd, J=9.0, 2.5 Hz, 1H), 7.10 (dd, J=7.0, 2.0 Hz, 1H), 7.02 (d, J=2.0 Hz, 1H), 6.80~6.81 (m, 2H), 6.45 (s, 1H), 4.29 (d, J=17.0 Hz, 1H), 4.19 (d, J=17.5 Hz, 1H), 3.75 (s, 3H, OCH3); 13C NMR (CDCl3, 125 MHz) δ: 156.09, 151.74, 147.84, 145.75, 142.20, 131.25, 129.37, 127.89 (2C), 123.82 (2C), 123.37 (2C), 122.14, 118.74, 114.48 (2C), 113.21, 88.75, 55.44, 47.91; IR (KBr) ν: 3068, 1602, 1508, 1478, 1341, 1248, 1229, 1040, 950, 843, 822 cm-1. Anal. calcd for C21H17BrN2O4: C 57.16, H 3.88, N 6.35; found C 57.42, H 3.86, N 6.32.
6-溴-2-(2-硝基苯基)-3-(3-氯苯基)-3, 4-二氢-2H-苯并[1, 3]噁嗪(5e):黄色固体, 收率49%. m.p. 156.2~158.5 ℃; 1H NMR (CDCl3, 500 MHz) δ: 7.77~7.78 (m, 2H), 7.49~7.51 (m, 2H), 7.26~7.27 (m, 2H), 7.17~7.18 (m, 1H), 7.13 (t, J=1.5 Hz, 1H), 7.07 (s, 1H), 7.00~7.02 (m, 2H), 6.92 (d, J=9.0 Hz, 1H), 4.20 (d, J=17.0 Hz, 1H), 3.99 (d, J=17.5 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 157.11, 132.13, 131.69, 131.60, 130.36, 129.81, 129.69, 129.34, 128.52, 126.81, 124.77, 124.66, 123.46, 121.42, 120.54, 119.50, 118.67, 118.47, 84.95, 46.55; IR (KBr) ν: 3074, 1593, 1570, 1523, 1485, 1363, 1346, 1226, 989, 822 cm-1. Anal. calcd for C20H14BrClN2O3: C 53.90, H 3.17, N 6.29; found C 53.65, H 3.16, N 6.26.
6-溴-2-(4-氯苯基)-3-(3-氯苯基)-3, 4-二氢-2H-苯并[1, 3]噁嗪(5f):黄色固体, 收率38%. m.p. 158.1~160.4 ℃; 1H NMR (CDCl3, 500 MHz) δ: 7.49 (d, J=8.5 Hz, 2H), 7.39 (d, J=8.5 Hz, 2H), 7.28~7.32 (m, 3H), 7.13~7.16 (m, 2H), 7.08 (d, J=2.5 Hz, 1H), 6.93 (d, J=9.0 Hz, 1H), 6.56 (s, 1H), 4.32 (s, 2H); 13C NMR (CDCl3, 125 MHz) δ: 151.18, 147.29, 136.31, 133.90, 130.82, 128.84 (2C), 128.79, 128.49 (2C), 127.56 (2C), 127.49, 121.45 (2C), 121.38, 118.32, 112.55, 87.45, 46.07; IR (KBr) ν: 3016, 2977, 1609, 1494, 1374, 1226, 1177, 1137, 1008, 978, 815 cm-1. Anal. calcd for C20H14BrCl2NO: C 55.20, H 3.24, N 3.22; found C 55.45, H 3.23, N 3.23.
6-溴-2-(3-硝基苯基)-3-(3-氯苯基)-3, 4-二氢-2H-苯并[1, 3]噁嗪(5g):黄色固体, 收率42%. m.p. 152.1~154.9 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.39 (s, 1H), 8.18 (d, J=8.0 Hz, 1H), 7.86 (d, J=7.5 Hz, 1H), 7.55 (t, J=8.0 Hz, 1H), 7.26~7.30 (m, 1H), 7.20~7.23 (m, 2H), 7.08 (d, J=8.0 Hz, 1H), 7.00~7.02 (m, 2H), 6.95 (d, J=8.5 Hz, 1H), 6.60 (s, 1H), 4.36 (d, J=17.5 Hz, 1H), 4.26 (d, J=17.0 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 151.14, 150.18, 148.73, 140.55, 135.06, 132.86, 131.60, 130.53, 130.04, 129.38, 123.62, 123.12, 122.01, 121.58, 120.57, 119.08, 118.46, 113.54, 86.83, 46.56; IR (KBr) ν: 3016, 1609, 1568, 1550, 1497, 1359, 1267, 1230, 971, 861 cm-1. Anal. calcd for C20H14BrClN2O3: C 53.90, H 3.17, N 6.29; found C 53.63, H 3.18, N 6.27.
8-氯-2-(4-硝基苯基)-3-(4-甲基苯基)-3, 4-二氢-2H-苯并[1, 3]噁嗪(5h):黄色固体, 收率58%. m.p. 140.7~142.6 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.22 (d, J=8.5 Hz, 2H), 7.76 (d, J=8.5 Hz, 2H), 7.27 (s, 1H), 7.10 (s, 4H), 6.78~6.82 (m, 2H), 6.70 (s, 1H), 4.38 (d, J=17.0 Hz, 1H), 4.26 (d, J=17.0 Hz, 1H), 2.28 (s, 3H, CH3); 13C NMR (CDCl3, 125 MHz) δ: 148.09, 147.90, 146.47, 145.52, 132.80, 130.41, 129.90 (2C), 128.71, 127.68 (2C), 124.92, 123.92 (2C), 121.72, 121.17, 120.75 (2C), 88.63, 47.05, 20.55; IR (KBr) ν: 3098, 1648, 1601, 1524, 1490, 1357, 1244, 1229, 1185, 967, 860, 768 cm-1. Anal. calcd for C21H17ClN2O3: C 66.23, H 4.50, N 7.36; found C 66.54, H 4.48, N 7.33.
8-氯-2-(2-硝基苯基)-3-苯基-3, 4-二氢-2H-苯并[1, 3]噁嗪(5i):黄色固体, 收率49%. m.p. 153.3~154.9 ℃; 1H NMR (CDCl3, 500 MHz) δ: 7.96 (d, J=8.0 Hz, 1H), 7.70 (t, J=7.5 Hz, 1H), 7.65 (t, J=7.5 Hz, 1H), 7.43 (d, J=8.0 Hz, 1H), 7.35~7.37 (m, 2H), 7.29 (t, J=8.0 Hz, 2H), 7.14 (d, J=8.0 Hz, 2H), 6.99~7.01 (m, 2H), 6.90 (t, J=8.0 Hz, 1H), 4.55 (d, J=17.5 Hz, 1H), 3.85 (d, J=17.5 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 148.82, 148.56, 148.12, 132.01, 131.98, 129.45, 129.23 (2C), 128.89, 128.38, 124.93, 124.49, 123.46, 121.91, 121.44, 121.17, 120.70 (2C), 86.22, 46.85; IR (KBr) ν: 3036, 1596, 1530, 1495, 1458, 1326, 1232, 1134, 963, 781 cm-1. Anal. calcd for C20H15ClN2O3: C 65.49, H 4.12, N 7.64; found C 65.18, H 4.10, N 7.61.
8-氯-2-(4-硝基苯基)-3-苯基-3, 4-二氢-2H-苯并[1, 3]噁嗪(5j):黄色固体, 收率55%. m.p. 138.7~139.6 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.22 (d, J=8.5 Hz, 2H), 7.75 (d, J=8.5 Hz, 2H), 7.30 (t, J=7.5 Hz, 3H), 7.20 (d, J=8.0 Hz, 2H), 7.03 (t, J=7.5 Hz, 1H), 6.81 (d, J=5.0 Hz, 2H), 6.76 (s, 1H), 4.43 (d, J=17.0 Hz, 1H), 4.29 (d, J=17.0 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 148.98, 148.09, 148.05, 145.55, 129.51 (2C), 128.87, 127.75 (2C), 124.98, 124.07 (2C), 123.15, 121.90, 121.73, 121.35, 120.47 (2C), 88.33, 46.75; IR (KBr) ν: 3066, 2999, 1606, 1509, 1464, 1360, 1254, 1243, 1228, 934, 831, 772 cm-1. Anal. calcd for C20H15ClN2O3: C 65.49, H 4.12, N 7.64; found C 65.16, H 4.14, N 7.67.
8-氯-2-(4-硝基苯基)-3-(4-氯苯基)-3, 4-二氢-2H-苯并[1, 3]噁嗪(5k):黄色固体, 收率49%. m.p. 146.7~148.6 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.40 (d, J=8.5 Hz, 1H), 8.23 (d, J=8.5 Hz, 2H), 8.08 (d, J=8.5 Hz, 1H), 7.74 (d, J=9.0 Hz, 2H), 7.24 (s, 1H), 7.14 (d, J=8.5 Hz, 2H), 6.78~6.87 (m, 2H), 6.69 (s, 1H), 4.38 (d, J=17.0 Hz, 1H), 4.29 (d, J=17.0 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 148.04, 147.89, 147.47, 144.99, 130.49, 129.43 (2C), 129.01, 128.38, 127.67, 124.98, 124.31, 124.10, 121.99 (2C), 121.91, 121.53, 121.29, 88.22, 47.14; IR (KBr) ν: 3107, 1654, 1608, 1518, 1492, 1346, 1243, 1231, 1197, 952, 854, 837, 767 cm-1; MS (ESI) m/z: 401 [M+H]+. Anal. calcd for C20H14Cl2N2O3: C 59.87, H 3.52, N 6.98; found C 59.58, H 3.50, N 6.95.
3.2.2 化合物5c单晶结构的测定
化合物5c的单晶培养采用溶液结晶法, 于室温下在乙酸乙酯和石油醚中进行, 其单晶结构用Bruker Smart CCD Apex II单晶衍射分析仪测定.单晶选用尺寸为0.46 mm×0.32 mm×0.30 mm, 在291(2) K下, 利用经石墨单色化的Mo Kα射线(μ=0.089, λ=0.71073 )为辐射光源, 以ω/2θ扫描方式在0.46 mm×0.32 mm×0.30 mm, 2.89°<θ<26.37°范围内, 共收集数据6885个, 其中独立衍射点3540个(Rint=0.0356), 有2336个I≥2σ(I)的可观察点.全部强度数据用经验法校正, 晶体结构由直接法(SHELX-97)解出.化合物5c的分子式为C21H18N2O3, Mr=346.37, 斜方晶系, P212121空间群, 晶胞参数a=8.8272(6) , b=10.1322(8) , c=19.5627(14) , α=90.00°, β=90.00°, γ=90.00°, 晶胞体积V=1749.7(2) 3, Dc=1.315 mg/mm3, Z=4, F(000)=728, 拟合优度=1.013.化合物5c结构的晶体数据存于英国剑桥晶体数据中心, CCDC号为942186.
3.2.3 抑菌活性的测定
根据NY/T1156.5-2006标准方法, 采用含药培养基法测试了目标化合物对油菜菌核病菌、辣椒疫霉病菌、黄瓜灰霉病菌、水稻纹枯病菌、烟草赤星病菌和稻瘟病菌的离体抑制活性.将供试药剂溶解在丙酮内, 然后用200 mg/mL sorporl-144乳化剂稀释成500 mg/mL药液.在无菌操作条件下, 用移液枪吸取1 mL的化合物溶液加入已灭菌的平皿中, 再用移液管加入9 mL的灭菌PDA培养基于平皿中, 混匀, 制成相应浓度的含药平板.将培养好的病原菌, 在无菌条件下用直径为4 mm的灭菌打孔器, 自菌落边缘切取菌饼, 待培养基凝固后, 用接种器将菌饼接种于含药平板中央, 置于适宜温度的培养箱中培养.以不加药剂做空白对照.将各处理于(24±1) ℃培养箱内培养, 72 h后观察并量取菌落直径, 每个菌落用十字交叉法垂直量取直径各一次, 取其平均值.对稻瘟病菌, 测试化合物的浓度为50 mg/mL, 对其余病菌, 测试化合物的浓度为25 mg/mL.结果见表 2.
式中“4”为接入菌饼的直径, 单位为mm.
辅助材料(Supporting Information)化合物的核磁共振氢谱、核磁共振碳谱.这些材料可以免费从本刊网站http://sioc-journal.cn/上下载.
-
-
[1]
Wang, S.; Li, Y.; Liu, Y.; Lu, A.; You, Q. Bioorg. Med. Chem. 2008, 18, 4095. doi: 10.1016/j.bmcl.2008.05.103
-
[2]
Chen, S.; Li, X.; Wan, S.; Jiang, T. Synth. Commun. 2012, 42, 2937. doi: 10.1080/00397911.2011.573169
-
[3]
Benameur, L.; Bouaziz, Z.; Nebois, P.; Bartoli, M.; Boltard, M.; Fillion, H. Chem. Pharm. Bull. 1996, 44, 605. doi: 10.1248/cpb.44.605
-
[4]
Ihmaid, S. K.; Ai-Rawi, J. M. A.; Bradley, C. J.; Angove, M. J.; Robertson, M. N. Eur. J. Med. Chem. 2012, 57, 85. doi: 10.1016/j.ejmech.2012.08.035
-
[5]
Tang, Z.; Xia, Z.; Chang, S.; Wang, Z. Bioorg. Med. Chem. Lett. 2015, 25, 3378. doi: 10.1016/j.bmcl.2015.05.010
-
[6]
Konda, S.; Raparthi, S.; Bhaskar, K.; Munaganti, R. K.; Guguloth, V.; Nagarapu, L.; Akkewar, D. M. Bioorg. Med. Chem. Lett. 2015, 25, 1643. doi: 10.1016/j.bmcl.2015.01.026
-
[7]
Nemecek, P.; Mocak, J.; Lehotay, J.; Waisser, K. Chem. Papers 2013, 67, 305.
-
[8]
Waisser, K.; Petrlikova, E.; Perina, M.; Klimesova, V.; Kunes, J.; Jr, K. P.; Kaustova, J.; Dahse, H. M.; Mollmann, U. Eur. J. Med. Chem. 2010, 45, 2715.
-
[9]
Pastemak, A.; Goble, S. D.; Struters, M.; Vicario, P. P.; Ayala, J. M.; Salvo, J. D.; Kilbum, R.; Wisniewski, T.; Demartino, J. A.; Mills, S. G.; Yang, L. ACS Med. Chem. Lett. 2010, 1, 14. doi: 10.1021/ml900009d
-
[10]
Garg, V.; Kumar, A.; Chaudhary, A.; Agrawal, S.; Tomar, P.; Sreenivasan, K. K. Med. Chem. Res. 2013, 22, 5256. doi: 10.1007/s00044-013-0534-3
-
[11]
Cobum, C. A.; Meinke, P. T.; Chang, W.; Fandozzi, C. M.; Graham, D. J.; Hu, B.; Huang, Q.; Kargmam, S.; Kozlowski, J.; Liu, R.; Mccauley, J. A.; Nomeir, A. A.; Soll, R. M.; Vacca, J. P.; Wang, D.; Wu, H.; Zhong, B.; Olsen, D. B.; Ludmere, S. W. ChemMedChem 2013, 8, 1930. doi: 10.1002/cmdc.v8.12
-
[12]
Baqar, M.; Agag, T.; Huang, R.; Maia, J.; Qutubuddin, S.; Ishida, H. Macromolecules 2012, 45, 8119. doi: 10.1021/ma301963d
-
[13]
Kawaguchi, A. W.; Sudo, A.; Endo, T. ACS Macro Lett. 2013, 2, 1. doi: 10.1021/mz3005296
-
[14]
Deniz, E.; Tomasulo, M.; Sortino, S.; Rayno, F. M. J. Phys. Chem. C 2009, 113, 8491. doi: 10.1021/jp901494c
-
[15]
Voiciuk, V.; Redeckas, K.; Martynaitis, V.; Steponaviciute, R. A.; Šackus, A.; Vengris, M. J. Photochem. Photobiol. A: Chem. 2014, 278, 60. doi: 10.1016/j.jphotochem.2013.12.022
-
[16]
Burke, W. J.; Murdock, K. C.; Ec, G. J. Am. Chem. Soc. 1954, 76, 1677. doi: 10.1021/ja01635a065
-
[17]
Mathew, B. P.; Nath, M. J. Heterocycl. Chem. 2009, 46, 1003. doi: 10.1002/jhet.v46:5
-
[18]
(唐子龙, 夏赞稳, 马红伟, 刘汉文, 欧晓明, 应用化学, 2013, 30, 993.)Tang, Z.; Xia, Z.; Ma, H.; Liu, H.; Ou, X. Chin. J. Appl. Chem. 2013, 30, 993 (in Chinese).
-
[19]
Colin, J. L.; Loubinoux, B. Tetrahedron Lett. 1982, 23, 4245. doi: 10.1016/S0040-4039(00)88715-8
-
[20]
Neuvonen, K.; Pihlaja, K. J. Chem. Soc., Perkin Trans. 2 1988, 461.
-
[21]
Mangion, K.; Chen, C.; Li, H.; Maligres, P.; Chen, Y.; Christensen, M.; Cohen, R.; Jeon, I.; Klapars, A.; Krska, S.; Nguyen, H.; Reamer, R. A.; Sherry, B. D.; Zavialov, I. Org. Lett. 2014, 16, 2310. doi: 10.1021/ol500971c
-
[22]
Richers, M. T.; Breugst, M.; Platonova, A. Y.; Ullrich, A.; Dieckmann, A.; Houk, K. N.; Seidel, D. J. Am. Chem. Soc. 2014, 136, 6123. doi: 10.1021/ja501988b
-
[23]
Tang, Z.; Chen, W.; Zhu, Z.; Liu, H. Synth. Commun. 2012, 42, 1372. doi: 10.1080/00397911.2010.540691
-
[24]
Tang, Z.; Zhu, Z.; Yan, L.; Chang, S.; Liu, H. J. Heterocycl. Chem. 2013, 50, 1116.
-
[25]
(唐子龙, 常书红, 颜林, 崔美艳, 刘汉文, 有机化学, 2012, 32, 1241.) doi: 10.6023/cjoc201203011Tang, Z.; Chang, S.; Yan, L.; Cui, M.; Liu, H. Chin. J. Org. Chem. 2012, 32, 1241 (in Chinese). doi: 10.6023/cjoc201203011
-
[26]
Xiao, Z.; Shi, W.; Wang, P.; Wei, W.; Zeng, X.; Zhang, J.; Zhu, N.; Peng, M.; Peng, B.; Lin, X.; Hui, O.; Peng, X.; Wang, G. Bioorg. Med. Chem. 2015, 23, 4508. doi: 10.1016/j.bmc.2015.06.014
-
[27]
Casiraghi, G.; Casnati, G.; Puglia, G.; Sartori, G.; Terenghi, G. J. Chem. Soc., Perkin Trans. 1 1980, 1862.
-
[1]
-
表 1 化合物5a~5k的合成结果a
Table 1. Results of the preparation of compound 5a~5k
Compd. R R 1 R 2 Yield b /% 5a 6-CH3 4'-OCH3 2'-NO2 80 5b 6-CH3 4'-OCH3 4'-NO2 80 5c 6-CH3 H 4'-NO2 65 5d 6-Br 4'-OCH3 4'-NO2 58 5e 6-Br 3'-Cl 2'-NO2 49 5f 6-Br 3'-Cl 4'-Cl 38 5g 6-Br 3'-Cl 3'-NO2 42 5h 8-Cl 4'-CH3 4'-NO2 58 5i 8-Cl H 2'-NO2 49 5j 8-Cl H 4'-NO2 55 5k 8-Cl 4'-Cl 4'-NO2 49 a反应条件:反应物的量之比, n(2-芳氨基甲基苯酚4):n(芳醛)=1:1.3.催化剂: TMSCl (20 mol%, 基于2-芳氨基甲基苯酚4的量).溶剂: CHCl3/C6H12(环己烷)=1:4 (V:V).反应时间: 5 h.反应温度: 85 ℃. b分离产率. 表 2 化合物5a~5k的杀菌活性(抑制率/%)a
Table 2. Fungicidal activity (inhibitory rate/%) of products 5a~5k
Entry 化合物 菌核病菌 疫霉病菌 灰霉病菌 纹枯病菌 赤星病菌 稻瘟病菌 1 5a 0 0 0 0 18.3 0 2 5b 13.1 7.6 0 0 41.2 0 3 5c 0 10.3 0 0 34.5 0 4 5d 0 44.4 35.3 50.0 43.8 21.4 5 5e 69.2 51.9 38.2 52.4 0 78.6 6 5f 76.9 44.4 44.1 64.3 0 50.0 7 5g 53.8 55.6 61.8 57.1 0 78.6 8 5h 30.8 40.7 23.5 52.4 37.5 28.6 9 5i 57.7 55.6 61.8 54.8 0 42.9 10 5j 36.5 13.1 13.6 0 12.3 0 11 5k 0 30.9 41.2 0 46.0 0 a 杀菌活性等级: A, 抑制率≥90%; B, 70%≤抑制率<90%; C, 50%≤抑制率<70%; D, 抑制率<50%. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 1196
- HTML全文浏览量: 148


 下载:
下载:

 下载:
下载:

