
Citation: Wang Yonggang, Liu Renrong, Gao Jianrong, Jia Yixia. Palladium-Catalyzed Dearomative Decarboxylative Alkynylation of Indoles with Acetylenecarboxylic Acids[J]. Chinese Journal of Organic Chemistry, 2017, 37(3): 691-697. doi: 10.6023/cjoc201608027

钯催化吲哚与丙炔酸的去芳构化脱羧炔基化反应
English
Palladium-Catalyzed Dearomative Decarboxylative Alkynylation of Indoles with Acetylenecarboxylic Acids
-
Key words:
- homogenous catalysis
- / palladium
- / indole
- / dearomatization
- / alkynylation
-
吲哚啉结构单元广泛存在于具有生物活性天然产物以及药物活性分子中, 且作为有机合成中的重要砌块在复杂天然产物合成中得到广泛应用, 近年来一直受到化学家们的广泛关注[1].目前已有大量关于吲哚啉结构的合成研究报道, 然而2, 3-位具有连续手性中心的双取代吲哚啉的合成仍具有一定的挑战性[2], 多数已报道的方法往往需要多步合成才能得以实现.因此, 发展高效、快速构建2, 3-二取代吲哚啉的合成方法具有重要意义.
最近, 过渡金属催化的吲哚化合物的去芳构化反应已成为一类重要的有机合成策略[3], 通过吲哚的去芳构化过程可以一步高效构筑吲哚啉化合物[4].相对于铜、铑等过渡金属催化剂, 钯催化剂可以通过对卤化物氧化加成活得有机钯中间体, 在吲哚的去芳构化反应中具有独特的优势而受到广泛关注. 2012年, You课题组[5a]报道了钯催化分子内含自由N—H键吲哚的去芳香化芳基化反应, 高效实现3-位具有季碳中心螺环吲哚啉化合物的构建; 同年, Yao和Wu课题组[5b]发展了一种新的吲哚去芳香化策略, 采用N-酰基保护的2, 3-二甲基吲哚为底物, 通过去芳构化反应形成苄基钯中间体, 随后经过β-H消除反应实现2-位具有季碳中心、3-位具有环外双键的取代吲哚啉化合物的合成. 2015年, 我们课题组[6]利用中断C—H键活化策略研究钯催化吲哚不对称芳基化反应, 以负氢捕获苄基钯中间体, 实现了吲哚环内双键的不对称还原Heck型反应, 高对映选择性地获得2-位含季碳手性中心的取代吲哚啉类化合物.然而, 上述反应只能合成2-位或3-位具有取代基的吲哚啉结构, 并不能实现2, 3-位双取代吲哚啉化合物. 2015年, Lautens小组[7a]利用氰基化试剂对吲哚芳基化反应的苄基钯中间体进行捕获, 首次实现了2, 3-二取代吲哚啉结构的高效合成构建.随后, 该小组[7b]又进一步以芳基硼试剂对苄基钯中间体进行捕获, 以优异的非对映选择性地完成了吲哚去芳构化/Suzuki串联偶联反应.最近, 我们小组[8]则利用Heck/Sonagashira串联策略, 实现了吲哚环内双键的芳基化/炔基化反应并构建2, 3-位双取代吲哚啉类化合物.
脱羧偶联利用羧酸为原料, 可快速高效构建碳-碳键或碳-杂原子键, 近年来引起化学家们的广泛关注[9]. 2002年, Myers课题组[10]首次实现钯催化的芳基羧酸与苯乙烯衍生物的脱羧Heck偶联反应.紧接着, Goo en课题组[11]实现了在Pd/Cu共催化下, 芳基羧酸和卤代芳烃的脱羧偶联反应, 得到了联芳基化合物. Lee小组[12]报道了芳基丙炔酸类化合物与芳基溴化物在钯催化下的脱羧sp-sp2偶联反应, 获得一系列二芳基炔类化合物.基于这些研究结果, 我们设想通过吲哚环内双键的Heck芳基化反应产生的苄基钯物种与丙炔酸的脱羧sp-sp3偶联反应, 实现含有炔烃结构的2, 3-二取代吲哚啉类化合物的合成.在此, 我们报道钯催化的2-取代吲哚与丙炔酸化合物的去芳构化脱羧偶联反应, 以Pd (dba)2为催化剂, PCy3为配体, 二甲基亚砜 (DMSO) 为溶剂, 在较温和的条件下以中等到良好的收率、优异的非对映选择性合成了一系列2, 3-位具有连续季碳和叔碳中心的双取代吲哚啉化合物[13].
1 结果与讨论
1.1 反应条件优化
我们首先采用吲哚1a和苯炔酸 (2a) 为模型底物研究去芳构化脱羧炔基化反应, 实验结果见表 1.首先, 以5 mol%的醋酸钯为催化剂, 三苯基膦为配体, 碳酸铯为碱, 在N, N-二甲基甲酰胺 (DMF) 溶剂中90 ℃下反应12 h后, 可以得到具有单一构型的少量目标产物3a(表 1, Entry 1).受此鼓舞, 我们首先对反应条件中的碱进行优化.当以三乙胺为碱时, 产物收率显著提高至48%(表 1, Entry 2).以1, 4-二氮杂二环[2.2.2]辛烷 (DABCO) 作为碱也能以31%的收率获得目标产物 (表 1, Entry 5), 然而以K2CO3或1, 8-二氮杂二环十一碳-7-烯 (DBU) 为碱时几乎不能获得目标产物 (表 1, Entries 3~4).因此, 在以三乙胺为碱的条件下, 我们对反应溶剂进行了优化.研究表明溶剂效应非常明显.当采用极性溶剂时, 反应均可获得相对较高的收率 (表 1, Entries 6~8), 其中以DMSO为溶剂产物收率最高可达51%(表 1, Entry 6).其他溶剂如乙腈、乙醚、甲苯、四氢呋喃及二氯甲烷等, 目标产物的收率非常低.进一步, 我们对催化剂前体进行了简单筛选.发现改变钯催化剂前体, 反应产率可明显改变 (表 1, Entries 14~16), 以Pd (dba)2为催化剂时, 反应收率最高达到59%.随后我们对配体进行了考察, 发现富电性烷基膦配体的使用可显著提高反应收率, 尤其以PCy3为配体时, 反应收率达到69%(表 1, Entries 17~18).此外, 通过升高反应温度或提高苯炔酸的用量, 目标产物的收率均可以得到少量提高 (表 1, Entries 19~20).因此, 确定的较优反应条件为:吲哚1a和苯炔酸 (2a) 的物质的量比为1:2, 5 mol%的Pd (dba)2为催化剂, PCy3为配体, 2.0 equiv.的Et3N为碱, 甲苯为溶剂, 100 ℃条件下反应.

Entry [Pd] Ligand Base Solvent Yieldb/% 1 Pd (OAc)2 PPh3 Cs2CO3 DMF 10 2 Pd (OAc)2 PPh3 Et3N DMF 48 3 Pd (OAc)2 PPh3 K2CO3 DMF Trace 4 Pd (OAc)2 PPh3 DBU DMF Trace 5 Pd (OAc)2 PPh3 DABCO DMF 31 6 Pd (OAc)2 PPh3 Et3N DMSO 51 7 Pd (OAc)2 PPh3 Et3N DMA 38 8 Pd (OAc)2 PPh3 Et3N NMP 40 9 Pd (OAc)2 PPh3 Et3N CH3CN 5 10 Pd (OAc)2 PPh3 Et3N Et2O 8 11 Pd (OAc)2 PPh3 Et3N Toluene 10 12 Pd (OAc)2 PPh3 Et3N THF 7 13 Pd (OAc)2 PPh3 Et3N CH2Cl2 8 14 Pd (CH3CN)2Cl2 PPh3 Et3N DMSO 57 15 Pd (PPh3)2Cl2 PPh3 Et3N DMSO 55 16 Pd (dba)2 PPh3 Et3N DMSO 59 17 Pd (dba)2 PCy3•HBF4 Et3N DMSO 69 18 Pd (dba)2 P (tBu)3•HBF4 Et3N DMSO 67 19c Pd (dba)2 PCy3•HBF4 Et3N DMSO 71 20c, d Pd (dba)2 PCy3•HBF4 Et3N DMSO 73 aReactions were carried out with 1a (0.2 mmol), 2a (0.3 mmol), [Pd] (5 mol%), ligand (10 mol%), base (2.0 equiv.), solvent (2.0 mL), 90 ℃, 12 h. bIsolated yields, d.r.>20:1. cAt 100 ℃. d 0.4 mmol 2awas used. 表 1 反应条件的优化a
Table 1. Optimization of reaction conditions1.2 去芳构化脱羧炔基化底物范围拓展
在上述最优反应条件下, 对反应的底物范围进行了考察, 结果如表 2所示.首先对吲哚底物1进行了考察, 改变溴原子所在苯环上的取代基 (R1) 时, 反应能够以中等到良好的收率得到去吲哚啉目标产物.总体来讲, 反应的位阻效应并不明显, 无论是对位、间位还是邻位取代基都能以中等收率获得吲哚啉化合物3b~3d.相对于缺电子取代基, 含有给电子基团的底物在反应中获得更高的收率 (3b, 3c, 3e vs 3f~3h).此外, 当吲哚C2位取代基R2为苯基或杂芳基时, 反应同样可以取得中等到良好的收率 (3i~3j).随后, 对苯炔酸底物2的取代基进行了考察, 发现不论苯炔酸芳基上带有给电子基团还是吸电子基团, 反应都能顺利发生获得目标化合物3.苯环上含有供电子基 (如甲基3k~3l、甲氧基3m) 时, 收率比带有吸电子基 (如氯, 3n~3o) 的反应稍高.
1.3 反应机理
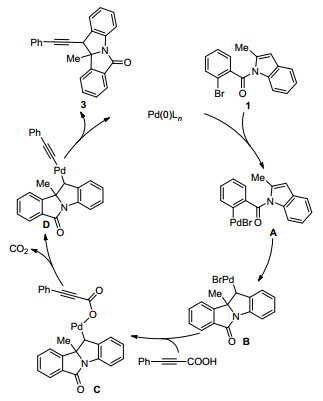
基于文献结果, 我们提出了如下反应机理 (Scheme 1):首先, 原位生成的零价钯催化剂对底物1氧化加成得到活性中间体A.随后, 两价钯中间体对吲哚2, 3-双键发生顺式插入反应获得苄基钯中间体B.中间体B和芳基丙炔酸通过阴离子交换得到中间体C.随后, C脱去一分子二氧化碳得到炔基钯中间体D. D经过还原消除得到目标吲哚啉产物3, 并再生零价钯催化剂, 完成催化循环过程.
2 结论
以钯为催化剂, 通过分子内Heck/脱羧炔基化过程, 成功实现了吲哚与芳基丙炔酸的去芳构化脱羧炔基化反应, 高非对映选择性地合成了一系列含有连续季碳和叔碳中心的2, 3-二取代吲哚啉化合物.反应条件简单, 底物适用范围较好, 为吲哚的去芳构化双官能化反应提供了新的思路.
3 实验部分
3.1 仪器与试剂
实验所用溶剂使用前均按照处理溶剂的标准方法进行. 1H NMR, 13C NMR均在Bruker AVANCE Ⅲ 500 MHz型核磁共振仪上测定, 溶剂CDCl3, 内标TMS; 柱层析使用200~300目硅胶, 展开剂为石油醚 (60~90 ℃) 和乙酸乙酯.所有实验药品均为市售分析纯试剂.取代吲哚底物1[6]和芳基炔酸2[14]的合成均采用文献报道的方法.
3.2 实验方法
反应的通用方法:在安培管中依次加入0.2 mmol的取代吲哚1、0.4 mmol的苯炔酸2、5 mol% Pd (dba)2和10 mmol% PCy3•HBF4, 氮气置换三次后, 用注射器加入0.4 mmol的三乙胺和2 mL的新蒸馏的DMSO溶剂, 在100 ℃下反应12 h.反应结束后粗产品用层析柱分离得到目标产物3a~3o[淋洗液: V(乙酸乙酯):V(石油醚, 60~90 ℃)=1:10].
10b-甲基-11-(苯基乙炔基)-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3a):白色固体, 产率73%. m.p. 146~149 ℃; 1H NMR (500 MHz, CDCl3)δ: 7.93 (d, J=7.5 Hz, 1H), 7.76 (d, J=8.0 Hz, 1H), 7.67 (td, J=7.5, 1.0 Hz, 1H), 7.61 (d, J=7.5 Hz, 1H), 7.54 (td, J=7.5, 1.0 Hz, 1H), 7.48 (d, J=7.5 Hz, 1H), 7.41 (td, J=7.5, 1.0 Hz, 1H), 7.20 (td, J=7.5, 1.0 Hz, 1H), 7.14~7.17 (m, 1H), 7.08~7.11 (m, 2H), 6.78~6.80 (m, 2H), 4.25 (s, 1H), 1.72 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 168.6, 149.1, 138.7, 135.7, 132.8, 132.5, 131.1, 129.1, 128.8, 127.89, 127.87, 126.0, 125.0, 124.6, 123.1, 122.4, 117.6, 87.0, 86.6, 75.3, 43.1, 26.7. HRMS (ESI+) calcd for C24H17NO [M+H]+: 336.1388; found 336.1414.
9, 10b-二甲基-11-(苯基乙炔基)-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3b):白色固体, 产率60%. m.p. 164~167 ℃; 1H NMR (500 MHz, CDCl3)δ: 7.80 (d, J=8.0 Hz, 1H), 7.74 (d, J=8.0 Hz, 1H), 7.47 (d, J=7.5 Hz, 1H), 7.38~7.41 (m, 2H), 7.35 (d, J=8.0 Hz, 1H), 7.15~7.20 (m, 2H), 7.11 (t, J=7.5 Hz, 2H), 6.80~6.82 (m, 2H), 4.23 (s, 1H), 2.51 (s, 3H), 1.71 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 168.8, 149.5, 143.3, 138.9, 135.5, 131.1, 130.2, 129.7, 129.0, 127.9, 126.0, 124.8, 124.4, 123.6, 122.6, 117.6, 86.9, 86.8, 75.0, 43.1, 26.8, 22.0. HRMS (ESI+) calcd for C25H19NO ([M+H]+): 350.1545; found 350.1566.
8, 10b-二甲基-11-(苯基乙炔基)-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3c):白色固体, 产率60%. m.p. 165~168 ℃; 1H NMR (500 MHz, CDCl3)δ: 7.80 (d, J=7.5 Hz, 1H), 7.74 (d, J=7.5 Hz, 1H), 7.47 (d, J=7.5 Hz, 1H), 7.38~7.41 (m, 2H), 7.35 (d, J=8.0 Hz, 1H), 7.15~7.20 (m, 2H), 7.09~7.12 (m, 2H), 6.80~6.82 (m, 2H), 4.23 (s, 1H), 2.51 (s, 3H), 1.71 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 168.8, 149.5, 143.3, 138.9, 135.6, 131.2, 130.3, 129.8, 129.0, 127.87, 127.86, 126.0, 124.8, 124.5, 123.6, 122.6, 117.6, 86.9, 86.8, 75.0, 43.2, 26.8, 22.0. HRMS (ESI+) calcd for C25H19NO ([M+H]+): 350.1545; found 350.1549.
10, 10b-二甲基-11-(苯基乙炔基)-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3d):白色固体, 产率58%. m.p. 135~138 ℃; 1H NMR (500 MHz, CDCl3)δ: 7.76~7.77 (m, 2H), 7.46~7.49 (m, 1H), 7.3~7.45 (m, 3H), 7.15~7.21 (m, 2H), 7.10 (t, J=7.5 Hz, 2H), 6.79~6.81 (m, 2H), 4.32 (s, 1H), 2.61 (s, 3H), 1.75 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 167.9, 147.0, 138.1, 135.5, 134.3, 133.4, 133.2, 131.2, 129.1, 129.0, 127.9, 126.0, 124.9, 122.5, 122.3, 117.3, 86.2, 86.1, 75.6, 42.3, 24.8, 18.8. HRMS (ESI+) calcd for C25H19NO ([M+H]+): 350.1545; found 350.1524.
8-甲氧基-10b-甲基-11-(苯基乙炔基)-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3e):白色固体, 产率62%. m.p. 100~103 ℃; 1H NMR (500 MHz, CDCl3)δ: 7.74 (d, J=8.0 Hz, 1H), 7.46~7.50 (m, 2H), 7.38~7.42 (m, 2H), 7.10~7.23 (m, 5H), 6.86 (d, J=7.5 Hz, 2H), 4.22 (s, 1H), 3.89 (s, 3H), 1.69 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 168.5, 160.5, 141.5, 138.7, 135.9, 134.2, 131.2, 129.0, 127.9, 126.0, 124.9, 124.0, 122.5, 120.8, 117.6, 107.1, 86.9, 86.7, 74.9, 55.7, 43.2, 26.8. HRMS (ESI+) calcd for C25H19NO2 ([M+H]+): 366.1494; found 366.1461.
9-氟-10b-甲基-11-(苯基乙炔基)-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3f):白色固体, 产率53%. m.p. 153~155 ℃ (lit.[13] 168~170 ℃); 1H NMR (500 MHz, CDCl3)δ: 7.90 (dd, J=8.5, 5.0 Hz, 1H), 7.73 (d, J=8.0 Hz, 1H), 7.47 (d, J=7.5 Hz, 1H), 7.41 (t, J=7.0 Hz, 1H), 7.30 (d, J=8.0 Hz, 1H), 7.25~7.11 (m, 5H), 6.87 (d, J=7.0 Hz, 2H), 4.24 (s, 1H), 1.72 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 167.6, 166.8, 164.8, 151.7 (d, J=9.9 Hz), 138.7, 135.4, 131.2, 129.2, 128.9, 128.1 (d, J=12.6 Hz), 126.8 (d, J=9.9 Hz), 126.1, 125.2, 122.3, 117.6, 116.7, 116.6, 110.7, 110.5, 87.3, 86.2, 74.9, 43.2, 26.7.
8-氟-10b-甲基-11-(苯基乙炔基)-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3g):白色固体, 产率50%. m.p. 155~157 ℃ (lit.[13] 158~160 ℃); 1H NMR (500 MHz, CDCl3)δ: 7.74 (d, J=7.8 Hz, 1H), 7.61~7.55 (m, 2H), 7.47 (d, J=7.6 Hz, 1H), 7.41 (d, J=1.0 Hz, 1H), 7.36 (d, J=2.3 Hz, 1H), 7.23~7.19 (m, 1H), 7.19~7.16 (m, 1H), 7.16~7.10 (m, 2H), 6.89~6.82 (m, 2H), 4.24 (s, 1H), 1.71 (s, 3H).
8-氯-10b-甲基-11-(苯基乙炔基)-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3h):白色固体, 产率41%. m.p. 107~109 ℃ (lit.[8] 108~110 ℃); 1H NMR (500 MHz, CDCl3)δ: 7.89 (d, J=1.5 Hz, 1H), 7.74 (d, J=8.0 Hz, 1H), 7.63 (dd, J=8.0, 2.0 Hz, 1H), 7.54 (d, J=8.0 Hz, 1H), 7.48 (d, J=7.5 Hz, 1H), 7.41 (td, J=7.5, 1.0 Hz, 1H), 7.17~7.23 (m, 2H), 7.12~7.15 (m, 2H), 6.84~6.86 (m, 2H), 4.24 (s, 1H), 1.71 (s, 3H).
3-甲氧基-10b-苯基-11-苯基乙炔基-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3i):白色固体, 产率62%. m.p. 73~75 ℃; 1H NMR (500 MHz, CDCl3)δ: 7.91 (d, J=7.5 Hz, 1H), 7.70~7.76 (m, 3H), 7.60 (t, J=7.0 Hz, 1H), 7.46~7.51 (m, 2H), 7.35 (t, J=7.5 Hz, 2H), 7.25~7.29 (m, 2H), 7.11~7.20 (m, 3H), 6.85 (d, J=7.0 Hz, 2H), 6.69 (dd, J=8.5, 2.5 Hz, 1H), 4.81 (s, 1H), 3.90 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 169.0, 160.7, 148.6, 142.3, 140.4, 132.7, 132.2, 131.2, 128.9, 128.8, 128.2, 128.0, 127.9, 127.1, 126.0, 125.0, 124.6, 124.1, 122.5, 111.5, 103.2, 87.5, 87.0, 81.2, 55.7, 44.7. HRMS (ESI+) calcd for C30H21NO2 ([M+H]+): 428.1651; found 428.1637.
10b-(呋喃-2-基)-11-苯基乙炔基-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3j):白色固体, 产率41%. m.p. 71~73 ℃; 1H NMR (500 MHz, CDCl3)δ: 7.94 (d, J=7.5 Hz, 1H), 7.81 (t, J=8.0 Hz, 2H), 7.67 (td, J=7.5, 1.0 Hz, 1H), 7.56 (t, J=7.5 Hz, 1H), 7.39~7.46 (m, 3H), 7.16~7.21 (m, 2H), 7.12 (t, J=7.5 Hz, 2H), 6.83~6.85 (m, 2H), 6.25~6.26 (m, 2H), 4.91 (s, 1H); 13C NMR (125 MHz, CDCl3)δ: 169.1, 153.2, 146.0, 143.2, 139.4, 135.5, 132.7, 132.4, 131.2, 129.2, 129.1, 128.0, 127.9, 125.8, 125.3, 124.6, 122.3, 117.5, 110.3, 106.7, 87.7, 85.9, 76.3, 42.2. HRMS (ESI+) calcd for C27H17NO2 ([M+H]+): 388.1338; found 388.1331.
10b-甲基-11-(4-甲基苯基) 乙炔基-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3k):白色固体, 产率64%. m.p. 117~119 ℃; 1H NMR (500 MHz, CDCl3)δ: 7.91 (d, J=7.5 Hz, 1H), 7.75 (d, J=8.0 Hz, 1H), 7.64~7.67 (m, 1H), 7.60 (d, J=7.5 Hz, 1H), 7.52~7.55 (m, 1H), 7.47 (d, J=7.5 Hz, 1H), 7.40 (t, J=7.5 Hz, 1H), 7.19 (td, J=7.5, 0.5 Hz, 1H), 6.90 (d, J=7.5 Hz, 2H), 6.69 (d, J=8.0 Hz, 2H), 4.24 (s, 1H), 2.23 (s, 3H), 1.72 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 168.6, 149.1, 138.7, 138.0, 135.8, 132.8, 132.4, 131.0, 129.0, 128.7, 128.6, 126.0, 124.9, 124.5, 123.1, 119.4, 117.6, 87.1, 85.9, 75.3, 43.2, 26.7, 21.3. HRMS (ESI+) calcd for C25H19NO ([M+H]+): 350.1545; found 350.1558.
10b-甲基-11-(2-甲基苯基) 乙炔基-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3l):白色固体, 产率62%. m.p. 116~119 ℃; 1H NMR (500 MHz, CDCl3)δ: 7.91 (d, J=6.5 Hz, 1H), 7.76 (d, J=6.5 Hz, 1H), 7.41~7.65 (m, 5H), 6.87~7.20 (m, 5H), 4.30 (s, 1H), 1.74 (s, 3H), 1.72 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 168.3, 149.0, 139.8, 138.5, 136.2, 133.0, 132.6, 131.6, 129.04, 129.02, 128.8, 127.9, 125.9, 125.1, 125.0, 124.7, 123.2, 122.2, 117.6, 90.3, 85.9, 75.1, 43.3, 26.8, 19.9. HRMS (ESI+) calcd for C25H19NO ([M+H]+): 350.1545; found 350.1550.
11-(4-甲氧基苯基) 乙炔基-甲基-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3m):白色固体, 产率67%. m.p. 182~185 ℃ (lit.[13] 196~198 ℃); 1H NMR (500 MHz, CDCl3)δ: 7.91 (d, J=7.5 Hz, 1H), 7.74 (d, J=7.5 Hz, 1H), 7.66 (t, J=7.0 Hz, 1H), 7.60 (d, J=7.5 Hz, 1H), 7.54 (t, J=7.5 Hz, 1H), 7.46 (d, J=7.5 Hz, 1H), 7.40 (t, J=7.5 Hz, 1H), 7.19 (t, J=7.5 Hz, 1H), 6.72 (d, J=9.0 Hz, 2H), 6.62 (d, J=9.0 Hz, 2H), 4.22 (s, 1H), 3.72 (s, 3H), 1.71 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 168.7, 159.3, 149.2, 138.7, 135.9, 132.9, 132.6, 132.4, 129.0, 128.8, 126.1, 125.0, 124.6, 123.2, 117.7, 114.7, 113.6, 86.9, 85.2, 75.4, 55.2, 43.3, 26.7.
11-[(4-氯苯基) 乙炔基]-甲基-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3n):白色固体, 产率48%. m.p. 126~129 ℃; 1H NMR (500 MHz, CDCl3)δ: 7.92 (d, J=7.5 Hz, 1H), 7.75 (d, J=8.0 Hz, 1H), 7.66 (td, J=7.5, 1.0 Hz, 1H), 7.59 (d, J=7.5 Hz, 1H), 7.54 (td, J=7.5, 0.5 Hz, 1H), 7.46 (d, J=7.5 Hz, 1H), 7.41 (td, J=7.5, 1.0 Hz, 1H), 7.20 (td, J=7.5, 1.0 Hz, 1H), 7.05~7.08 (m, 2H), 6.68~6.71 (m, 2H), 4.22 (s, 1H), 1.72 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 168.6, 149.0, 138.7, 135.4, 134.0, 132.8, 132.5, 132.4, 129.2, 128.8, 128.3, 126.0, 125.0, 124.6, 123.1, 120.9, 117.7, 87.6, 85.9, 75.3, 43.1, 26.6. HRMS (ESI+) calcd for C24H16ClNO ([M+H]+): 370.0999; found 370.0988.
11-[(3-氯苯基) 乙炔基]-甲基-10b, 11-二氢-6H-异吲哚并[2, 1-a]吲哚-6-酮 (3o):白色固体, 产率43%. m.p. 114~118 ℃; 1H NMR (500 MHz, CDCl3)δ: 7.93 (d, J=7.0 Hz, 1H), 7.67~7.76 (m, 2H), 7.57~7.61 (m, 2H), 7.41~7.46 (m, 2H), 7.02~7.21 (m, 3H), 6.64~6.74 (m, 2H), 4.23 (s, 1H), 1.73 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 168.5, 148.9, 138.8, 135.3, 133.7, 132.8, 132.5, 131.1, 129.24, 129.23, 129.1, 128.9, 128.2, 126.0, 125.1, 124.7, 124.1, 123.1, 117.8, 88.0, 85.7, 75.3, 43.1, 26.6. HRMS (ESI+) calcd for C24H16ClNO ([M+H]+): 370.0999; found 370.0983.
辅助材料 (Supporting Information)化合物3a~3o的1H NMR和13C NMR原始谱图.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
-
-
[1]
For selected reviews, see: (a) Ruiz-Sanchis, P. ; Savina, S. A. ; Albericio, F. ; Álvarez, M. Chem. Eur. J. 2011, 17, 1388.
(b) Dalpozzo, R. ; Bartoli, G. ; Bencivenni, G. Chem. Soc. Rev. 2012, 41, 7247.
(c) Zhao, J. ; Zhang, Q. Acta Chim. Sinica2015, 73, 1235 (in Chinese).
(赵金钵, 张前, 化学学报, 2015, 73, 1235. ) -
[2]
For examples, see: (a) Gallagher, T. ; Magnus, P. J. Am. Chem. Soc. 1983, 105, 2186.
(b) Magnus, P. ; Gallagher, T. ; Brown P. ; Huffman, J. C. J. Am. Chem. Soc. 1984, 106, 2105.
(c) Magnus, P. ; Brown, P. J. Chem. Soc. , Chem. Commun. 1985, 184.
(d) Kuehne, M. E. ; Seaton, P. J. J. Org. Chem. 1985, 50, 4790.
(e) Shinohara, C. ; Hasumi, K. ; Takei, Y. ; Endo, A. J. Antibiot. 1994, 47, 163.
(f) Wang, T. ; Xu, Q. -G. ; Yu, P. ; Liu, X. -X. ; Cook, J. M. Org. lett. 2001, 3, 345.
(g) Iyengar, R. ; Schildknegt, K. ; Morton, M. ; Jeffrey A. J. Org. Chem. 2005, 70, 10645.
(h) Zhang, H. -J. ; Boonsombat, J. ; Padwa, A. Org. lett. 2007, 9, 279.
(i) Lim, K. H. ; Hiraku, O. ; Komiyama, K. ; Koyano, T. ; Hayashi, M. ; Kam, T. -S. J. Nat. Prod. 2007, 70, 1302.
(j) Bui, T. ; Syed, S. , Barbas Ⅲ, C. F. J. Am. Chem. Soc. 2009, 131, 8758.
(k) Liu, D. -Y. ; Zhao, G. -W. ; Xiang, L. Eur. J. Org. Chem. 2010, 3975.
(l) Duan, D. ; Yin, Q. ; Wang, S. ; Gu, Q. ; You, S. -L. Acta Chim. Sinica 2014, 72, 1001 (in Chinese).
(段德河, 殷勤, 王守国, 顾庆, 游书力, 化学学报, 2014, 72, 1001. )
(m) Takamatsu, K. ; Hirano, K. ; Satoh, T. ; Miura, M. J. Org. Chem. 2015, 80, 3242. -
[3]
(a) Pape, A. R.; Kaliappan, K. P.; Kündig, E. P. Chem. Rev. 2000, 100, 2917.
(b) Wang, D.-S.; Chen, Q.-A.; Li, W.; Yu, C.-B.; Zhou, Y.-G.; Zhang, X. J. Am. Chem. Soc. 2010, 132, 8909.
(c) Wang, D.-S.; Chen, Q.-A.; Lu, S.-M.; Zhou, Y.-G. Chem. Rev. 2012, 112, 2557.
(d) Zhuo, C.-X.; Zhang, W.; You, S.-L. Angew. Chem., Int. Ed. 2012, 51, 12662.
(e) Zhuo, C.-X.; Zheng, C.; You, S.-L. Acc. Chem. Res. 2014, 47, 2558.
(f) Gao, R.-D.; Liu, C.; Dai, L.-X.; Zhang, W.; You, S.-L. Org. Lett. 2014, 16, 3919.
(g) Du, K.; Guo, P.; Chen, Y.; Cao, Z.; Wang, Z.; Tang, W. Angew. Chem., Int. Ed. 2015, 54, 3033.
(h) Roche, S. P.; Youte Tendoung, J.-J.; Treguier, B. Tetrahedron 2015, 3549.
(i) Zhang, H.; Hu, R.-B.; Liu, N.; Li, S.-X.; Yang, S. Org. Lett. 2016, 18, 28.
(j) Wu, W.-T.; Zhang, L.; You, S.-L. Chem. Soc. Rev. 2016, 45, 1570. -
[4]
(a) Zhang, X.; Yang, Z.-P.; Liu, C.; You, S.-L. Chem. Sci. 2013, 4, 3239.
(b) Zhang, X.; Liu, W.-B.; Wu, Q.-F.; You, S.-L. Org. Lett. 2013, 15, 3746.
(c) Spangler, J. E.; Davies, H. M. L. J. Am. Chem. Soc. 2013, 135, 6802.
(d) Xiong. H.; Xu, H.; Liao, S.; Xie, Z.; Tang, Y. J. Am. Chem. Soc. 2013, 135, 7851.
(e) Zhang, X.; Han, L.; You, S.-L. Chem. Sci. 2014, 5, 1059.
(f) Tong, M.-C.; Chen, X.; Li, J.; Huang, R.; Tao, H.-Y.; Wang, C.-J. Angew.Chem., Int. Ed. 2014, 53, 4680.
(g) Zhang, X.; Liu, W.-B.; Tu, H.-F.; You, S.-L. Chem. Sci. 2015, 6, 4525. -
[5]
(a) Wu, K.-J.; Dai, L.-X.; You, S.-L. Org. Lett. 2012, 14, 3772.
(b) Zhao, L.; Li, Z.; Chang, L.; Xu, J.; Yao, H.; Wu, X. Org. Lett. 2012, 14, 2066. -
[6]
Shen, C.; Liu, R.-R.; Fan, R.-J.; Li, Y.-L.; Xu, T.-F.; Gao, J.-R.; Jia, Y.-X. J. Am. Chem. Soc. 2015, 137, 4936. doi: 10.1021/jacs.5b01705
-
[7]
(a) Petrone, D. A.; Yen, A.; Zeidan, N.; Lautens, M. Org. Lett. 2015, 17, 4838.
(b) Petrone, D. A.; Kondo, M.; Zeidan, N.; Lautens, M. Chem. Eur. J. 2016, 22, 5684. -
[8]
Liu, R.-R.; Xu, T.-F.; Wang, Y.-G.; Xiang, B.; Gao, J.; Jia, Y.-X. Chem. Commun. 2016, 52, 13664. doi: 10.1039/C6CC06262H
-
[9]
(a) Goossen, L. J.; Rodríguez, N.; Melzer, B.; Linder, C.; Deng, G.; Levy, L. M. J. Am. Chem. Soc. 2007, 129, 4824.
(b) Gooß en, L. J.; Rudolphi, F.; Oppel, C.; Rodriguez, N. Angew. Chem., Int. Ed. 2008, 47, 3043.
(c) Kima, H.; Lee, P. H. Adv. Synth. Catcal. 2009, 351, 2827.
(d) Xie, K.; Yang, Z.; Zhou, X.; Li, X.; Wang, S.; Tan, Z.; An, X.; Guo, C.-C. Org. Lett. 2010, 12, 1564.
(e) Zhao, D.; Gao, C.; Su, X.; He, Y.; You, J.; Xue, Y. Chem. Commun. 2010, 46, 9049.
(f) Park, A.; Park, K.; Kim, Y.; Lee, S. Org. Lett. 2011, 52, 944.
(g) Hu, P.; Zhang, M.; Jie, X.; Su, W. Angew. Chem., Int. Ed. 2012, 51, 227.
(h) Song, B.; Knauber, T.; Gooß en, L. J. Angew. Chem., Int. Ed. 2013, 52, 2954.
(i) Fromm, A.; Vanllen Wullen, C.; Hackenberger, D.; Gooß en, L. J. J. Am. Chem. Soc. 2014, 136, 10007. -
[10]
Myers, A. G.; Tanaka, D.; Mannion, M. R. J. Am. Chem. Soc. 2002, 124, 11250. doi: 10.1021/ja027523m
-
[11]
Gooßen, L. J.; Deng, G.; Levy, L. M. Science 2006, 313, 662. doi: 10.1126/science.1128684
-
[12]
(a) Moon, J.; Jeong, M.; Nam, H.; Ju, J.; Moon, J. H.; Jung, H. M.; Lee, S. Org. Lett. 2008, 10, 945.
(b) Moon, J.; Jang, M.; Lee, S. J. Org. Chem. 2009, 74, 1403.
(c) Park, A.; Park, K.; Kim, Y.; Lee, S. Org. Lett. 2011, 52, 944. -
[13]
During our submission of this manuscript, Liang and co-workers reported a similar work, see:Che, S.; Wu, X.-X.; Wang, J.; Hao, X.-H.; Xia, Y.; Shen, Y.; Jing, H.; Liang, Y.-M. Org. Lett. 2016, 18, 4016. doi: 10.1021/acs.orglett.6b01711
-
[14]
Cai, S.; Yang, K; Wang, D. Z. Org. Lett. 2014, 16, 2606. doi: 10.1021/ol501071k
-
[1]
-
表 1 反应条件的优化a
Table 1. Optimization of reaction conditions

Entry [Pd] Ligand Base Solvent Yieldb/% 1 Pd (OAc)2 PPh3 Cs2CO3 DMF 10 2 Pd (OAc)2 PPh3 Et3N DMF 48 3 Pd (OAc)2 PPh3 K2CO3 DMF Trace 4 Pd (OAc)2 PPh3 DBU DMF Trace 5 Pd (OAc)2 PPh3 DABCO DMF 31 6 Pd (OAc)2 PPh3 Et3N DMSO 51 7 Pd (OAc)2 PPh3 Et3N DMA 38 8 Pd (OAc)2 PPh3 Et3N NMP 40 9 Pd (OAc)2 PPh3 Et3N CH3CN 5 10 Pd (OAc)2 PPh3 Et3N Et2O 8 11 Pd (OAc)2 PPh3 Et3N Toluene 10 12 Pd (OAc)2 PPh3 Et3N THF 7 13 Pd (OAc)2 PPh3 Et3N CH2Cl2 8 14 Pd (CH3CN)2Cl2 PPh3 Et3N DMSO 57 15 Pd (PPh3)2Cl2 PPh3 Et3N DMSO 55 16 Pd (dba)2 PPh3 Et3N DMSO 59 17 Pd (dba)2 PCy3•HBF4 Et3N DMSO 69 18 Pd (dba)2 P (tBu)3•HBF4 Et3N DMSO 67 19c Pd (dba)2 PCy3•HBF4 Et3N DMSO 71 20c, d Pd (dba)2 PCy3•HBF4 Et3N DMSO 73 aReactions were carried out with 1a (0.2 mmol), 2a (0.3 mmol), [Pd] (5 mol%), ligand (10 mol%), base (2.0 equiv.), solvent (2.0 mL), 90 ℃, 12 h. bIsolated yields, d.r.>20:1. cAt 100 ℃. d 0.4 mmol 2awas used. 表 2 底物拓展a
Table 2. Scope of the substrates

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 7
- 文章访问数: 1733
- HTML全文浏览量: 207


 下载:
下载:
 下载:
下载:

