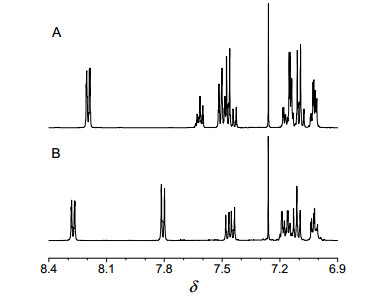
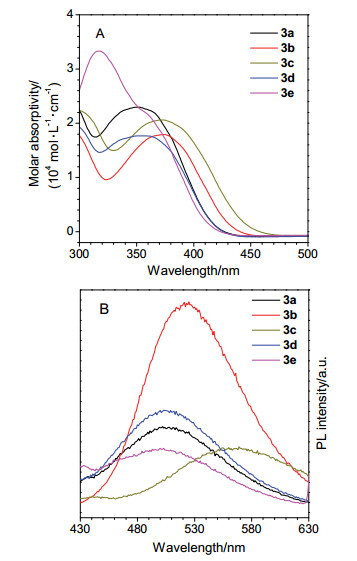
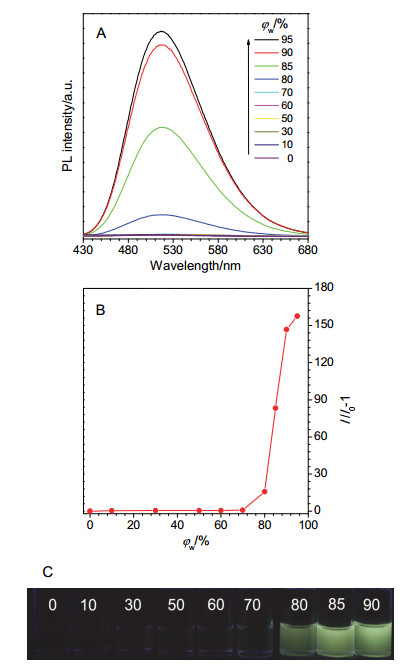
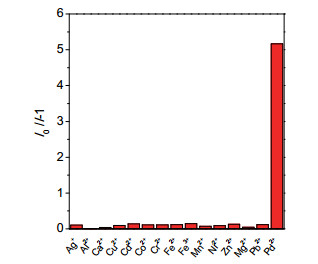
-
[1]
Chen, H. C.; Ching, K. C.; Fang, M. H.; Ching, F. S.; Pi, T. C.; Chin, H. L. Adv. Funct. Mater. 2009, 19, 560. (b) You, S.; Cai, Q.; Zheng, Y.; He, B.; Shen, J.; Yang, W.; Yin, M. ACS Appl. Mater. Interfaces 2014, 6, 16327.
-
[2]
Jenekhe, S. A.; Osaheni, J. A. Science 1994, 265, 765. (b) Chen, C. T. Chem. Mater. 2004, 16, 4389.
-
[3]
Hong, Y.; Lam, J. W. Y.; Tang, B. Z. Chem. Commun. 2009, 4332.
-
[4]
Luo, J. D.; Xie, Z. L.; Lam, J. W. Y.; Cheng, L.; Chen, H. Y.; Qiu, C. F.; Kwok, H. S.; Zhan, X. W.; Liu, Y. Q.; Zhu, D. B.; Tang, B. Z. Chem. Commun. 2001, 1740.
-
[5]
Mei, J.; Leung, N. L. C.; Kwok, R. T. K.; Lam, J. W. Y.; Tang, B. Z. Chem. Rev. 2015, 115, 11718.
doi: 10.1021/acs.chemrev.5b00263
-
[6]
Li, S.; Langenegger, S. M.; Häner, R. Chem. Commun. 2013, 49, 5835.
doi: 10.1039/c3cc42706d
-
[7]
Singh, A.; Lim, C. K.; Lee, Y. D.; Maeng, J. H.; Lee, S.; Koh, J.; Kim, S. ACS Appl. Mater. Interfaces 2013, 5, 8881. (b) Xi, W.; Gong, Y.; Mei, B.; Zhang, X.; Zhang, Y.; Chen, B.; Wu, J.; Tian, Y.; Zhou, H. Sensors and Actuators B 2014, 205, 158.
-
[8]
Sun, J. B.; Zhang, G. H.; Jia, X. Y.; Xue, P. C.; Lu, R. Acta Chim. Sinica 2016, 74, 165. (孙静波, 张恭贺, 贾小宇, 薛鹏冲, 贾俊辉, 卢然, 化学学报, 2016, 74, 165.) (b) Jackson, S. L.; Rananaware, A.; Rix, C.; Bhosale, S. V.; Latham, K. Cryst. Growth Des. 2016, 16, 3067.
-
[9]
Aldred, M. P.; Li, C.; Zhang, G. F.; Gong, W. L.; Li, A. D.; Dai, Y.; Ma, D.; Zhu, M. Q. J. Mater. Chem. 2012, 22, 7515.
doi: 10.1039/c2jm30261f
-
[10]
Grabowski, Z. R.; Rotkiewicz, K.; Rettig, W. Chem. Rev. 2003, 103, 3899. (b) Wu, P. T.; Kim, F. S.; Jenekhe, S. A. Chem. Mater. 2011, 23, 4618. (c) Ahmed, E.; Subramaniyan, S.; Kim, F. S.; Xin, H.; Jenekhe, S. A. Macromolecules 2011, 44, 7207. (d) Ahmed, E.; Ren, G.; Kim, F. S.; Hollenbeck, E. C.; Jenekhe, S. A. Chem. Mater. 2011, 23, 4563.
-
[11]
Kim, E.; Park, S. B. Chem. Asian J. 2009, 4, 1646. (b) Tao, S.; Li, L.; Yu, J.; Jiang, Y.; Zhou, Y.; Lee, C. S.; Lee, S. T.; Zhang, X.; Kwon, O. Chem. Mater. 2009, 21, 1284. (c) Xia, Z. Q.; Shao, A. D.; Li, Q.; Zhu, S. Q.; Zhu, W. H. Acta Chim. Sinica 2016, 74, 351. (夏志清, 邵安东, 李强, 朱世琴, 朱为宏, 化学学报, 2016, 74, 351.)
-
[12]
Zhao, Q.; Zhang, X. A.; Wei, Q.; Wang, J.; Shen, X. Y.; Qin, A.; Sun, J. Z.; Tang, B. Z. Chem. Commun. 2012, 48, 11671. (b) Yu, W.; Wu, Y.; Chen, J.; Duan, X.; Jiang, X. F.; Qiu, X.; Li, Y. RSC Adv. 2016, 6, 51257.
-
[13]
Cho, D. G.; Sessler, J. L. Chem. Soc. Rev. 2009, 38, 1647. (b) Kielhorn, J.; Melber, C.; Keller, D.; Mangelsdorf, I. Int. J. Hyg. Environ. Health 2002, 205, 417.
-
[14]
Kim, J. S.; Quang, D. T. Chem. Rev. 2007, 107, 3780. (b) Yang, Y.; Zhao, Q.; Feng, W.; Li, F. Chem. Rev. 2013, 113, 192.
-
[15]
Chen, X.; Li, H.; Jin, L.; Yin, B. Tetrahedron Lett. 2014, 55, 2537. (b) Cui, H.; Chen, H.; Pan, Y.; Lin, W. A. Sensors and Actuators B 2015, 219, 232.
-
[16]
Wang, Z.; Lu, X. Chem. Commun. 1996, 535.
-
[17]
Yuan, W. Z.; Yu, Z. Q.; Tang, Y.; Lam, J. W.; Xie, N.; Lu, P.; Chen, E. Q.; Tang, B. Z. Macromolecules 2011, 44, 9618.
doi: 10.1021/ma2021979
-
[18]
Liu, J.; Zhong, Y.; Lu, P.; Hong, Y.; Hong, Y.; Lam, J. W.; Faisal, M.; Yu, Y.; Wong, K. S.; Tang, B. Z. Polym. Chem. 2010, 1, 426.
doi: 10.1039/c0py00046a

 Login In
Login In






 DownLoad:
DownLoad: