 图1
烟气模拟装置示意图
Figure1.
Schematic of flue gas simulator
图1
烟气模拟装置示意图
Figure1.
Schematic of flue gas simulator

Citation: YANG Jian-guo, YANG Wei-ying, ZHENG Fang-dong, ZHAO Hong. Effects of NH3 and SO3 on the generation of ammonium bisulfate and ammonium sulfate[J]. Journal of Fuel Chemistry and Technology, 2018, 46(1): 92-98.

NH3和SO3对硫酸氢铵和硫酸铵生成的影响
English
Effects of NH3 and SO3 on the generation of ammonium bisulfate and ammonium sulfate
-
Key words:
- ammonium bisulfate
- / ammonium sulfate
- / NH3
- / SO3
- / concentration
- / formation rate
- / formation speed
-
氮氧化物是燃煤电厂的主要大气污染物之一,对人体健康和环境有多重危害。中国国标GB13223—2011中氮氧化物排放质量浓度最高限制为100 mg/m3[1],2014年进一步提出了燃煤锅炉超低排放的要求,其中,氮氧化物排放浓度不超过50 mg/m3[2]。为了实现高效脱硝,目前,中国火电燃煤机组主要采用选择性催化还原技术(SCR)[3],即通过向烟道中喷入NH3并在催化剂的作用下还原烟气中的NOx。在SCR脱硝过程中,NH3一般无法完全参与反应,少量未反应的NH3离开SCR后形成氨逃逸。逃逸的NH3会与烟气中的水蒸气和SO3反应生成硫酸氢铵(NH4HSO4)和硫酸铵((NH4)2SO4),具体反应方程式如式(1)和(2)[4]。
硫酸铵熔点为280 ℃,因此,在空气预热器的运行温度范围内为干燥固体粉末[5]。而硫酸氢铵的熔点为147 ℃,熔化后具有极强的黏性,并具有一定的酸性和吸湿性[6]。文献[7-9]指出,约30%的气态硫酸氢铵会黏附飞灰沉积在空气预热器内并腐蚀换热元件表面。积灰会引起空气预热器堵塞、影响受热面的换热、增加锅炉引风机电耗等问题[10, 11]。因此,电厂一般设计氨逃逸率在3 μL/L以下[12, 13],而实际运行中受运行工况变化、催化剂寿命等因素的影响,实际氨逃逸率存在一定的差异,空气预热器严重积灰甚至堵塞的问题时有发生[14, 15]。超低排放的实施,不仅需要增加喷氨量,还需要增加催化剂量,以进一步提高脱硝效率,这不仅可能会增加氨逃逸率,还会增加烟气中SO3浓度[16, 17]。在实际运行过程中,硫酸氢铵形成速率明显高于硫酸铵,硫酸氢铵的生成量明显高于硫酸铵[18]。文献[8, 19]指出,在NH3过量的情况下,才会生成硫酸铵。而硫酸氢铵的生成受很多因素的影响,如NH3浓度、SO3浓度、飞灰浓度等,实际运行中也存在许多不确定因素,硫酸氢铵的生成温度无法确定[4, 20],因此, 成为许多学者研究的重点。Menasha等[21]、Matsuda等[22]采用模拟实际烟气的方法并结合化学平衡计算,研究NH3和SO3的反应,研究结果显示硫酸氢铵的生成反应是气相反应,随着温度降低冷凝在换热器表面,指出硫酸氢铵的生成温度则在220-320 ℃。Burke等[18]、Sarunac[23]则通过观察硫酸氢铵出现在空气预热器中的位置,结合烟温分布,指出硫酸氢铵的生成温度在150-200 ℃。Radian Corp则运用热力学和动力学模型来估算硫酸氢铵的形成,推出的Radian公式指出硫酸氢铵的形成与温度、反应物的浓度呈正相关,可用以预见空气预热器的堵塞情况[18]。马双忱等[24]根据前人的研究成果,在实验室平台研究温度和反应物体积分数对硫酸氢铵形成机理的影响,结果表明,硫酸氢铵的生成是温度和反应物体积分数的函数,氨和雾化的硫酸的浓度积越大,硫酸氢铵的形成温度越高。总之,虽然硫酸氢铵的生成是目前普遍关心的问题,但针对硫酸氢铵生成机理的研究一般仅基于定性研究或者仅是对起始生成温度的定量研究。本研究采用模拟烟气同步研究SO3和NH3浓度及其物质的量比对硫酸氢铵和硫酸铵生成进度的影响,即硫酸氢铵和硫酸铵在不同温度下的生成率和不同温度区间的生成份额。
1 实验部分
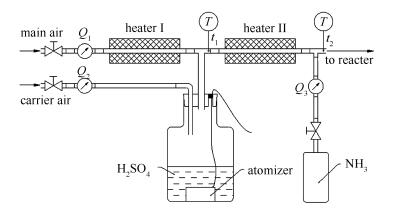
1.1 烟气模拟装置
实际脱硝烟气的成分复杂,除含有NH3和SO3以外,还包含O2、H2O、NOx、SO2等气体,不过硫酸氢铵和硫酸铵的生成主要受烟气中NH3、SO3和H2O和温度的直接影响,其他气体组分无明显影响[4, 5, 21]。因此,在实验室模拟烟气时,仅模拟烟气成分中的SO3、NH3和H2O三种组分。
目前,实验室制备SO3主要通过催化氧化SO2、纯SO3蒸发和加热稀硫酸的方法。前两种方法存在催化效率不精确、计量不准确、操作复杂等问题,而加热稀硫酸操作简单安全,且可同时提供SO3和H2O,符合模拟烟气成分的要求,但存在稀硫酸不能完全蒸发的问题[25-27]。
本研究采用两级加热器蒸发雾化稀硫酸得到SO3和H2O,以确保SO3浓度的准确性和稳定性。烟气模拟装置示意图见图 1。利用雾化器将稀硫酸雾化,由雾化载气携带与来自一级加热器的高温主空气混合,混合后稀硫酸液雾迅速蒸发,产生SO3和H2O。
由于烟气中SO3的露点温度可高达140 ℃[28, 29],为防止SO3冷凝,控制混合后的混合气温度t1在170 ℃以上。混合后的含SO3和H2O的空气经过二级加热与一定浓度的氨气混合,为防止提前反应,二级混合气的温度t2控制在300 ℃以上,最终形成实验所需的模拟烟气。其中,SO3和H2O的浓度可通过雾化载气流量Q2和稀硫酸浓度来调节,而NH3浓度可通过NH3标准气流量Q3调节,总模拟烟气流量由主空气流量Q1来协调。本实验控制模拟烟气中的水蒸气体积分数恒定为10%。
模拟烟气的NH3浓度φNH3和SO3浓度φSO3计算见式(3)和(4)。
式中,φ0NH3为气瓶NH3浓度(μL/L),Q1为主空气流量(L/min),Q2为雾化载气流量(L/min),Q3为气瓶NH3流量(L/min),m1、m2为雾化装置初始质量和最终质量(g),t为总雾化时间(min),c为稀硫酸浓度(mol/L),ρ为稀硫酸密度(g/mL),x为SO3转化率(%)。
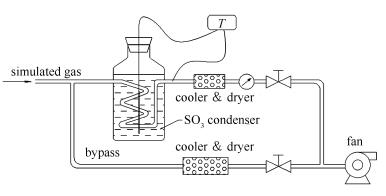
1.2 SO3浓度校验
为保证实验的准确性,对雾化硫酸生成的SO3浓度进行校验。SO3采用控制冷凝法进行采样,装置示意图见图 2。油浴温度控制在85 ℃,使模拟烟气中的SO3冷凝在盘管内壁,再用水洗收集,然后用钍试剂分光光度法[30]分析SO42-浓度。
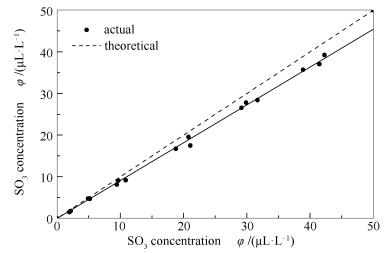
在理论SO3浓度为2-40 μL/L对模拟烟气进行多次测试,测试的结果见图 3。
由图 3可知,实测值呈线性分布,将数据进行0截距拟合,结果如式(5)所示,SO3转化率x可达90.8%,相关系数达到0.9992,表明模拟烟气中SO3浓度稳定,符合实验所需。实验中的SO3浓度均以此进行修正。
式中,φ'SO3为修正SO3浓度(μL/L)。
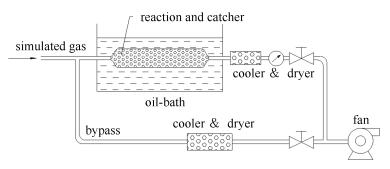
1.3 反应器与反应产物捕集器
NH3和SO3反应器与反应产物捕集器设计为一体化装置,其示意图见图 4。为增加模拟烟气流量与组分的稳定性和准确性,反应器设置了旁路,以增加模拟烟气的总流量。本实验控制进口烟温在320 ℃,防止硫酸氢铵或硫酸铵在反应器前生成并凝结。控制反应器入口空腔流量为15 m/s。玻璃管(反应器)置于恒温油浴,管内填充直径4 mm的玻璃珠作为反应物捕集器。油浴温度可以在120-260 ℃调节,反应器长度可以保证各温度下反应器末端烟温和恒温油浴的温度达到一致,并有一定的恒温停留时间。
实验后用去离子水清洗反应器内的凝结产物,得到的清洗液分别采用钍试剂分光光度法和靛酚蓝分光光度法分析SO42-和NH4+离子的浓度。钍试剂分光光度法采用与SO42-反应后剩余的Ba2+与钍试剂结合成钍-钡橙色络合物,通过测定络合物的吸光度,可以间接计算出SO42-的浓度[30]。靛酚蓝分光光度法通过测定氨与水杨酸生成蓝绿色络合物的吸光度,比色定量NH4+含量[31]。分光光度法具有很好的精确度和准确度,测试前均进行标准曲线制定,线性相关性好,且此法可排除溶液中可能存在的杂质离子Ca2+、Mg2+、Fe3+、Al3+、K+、CO32-、Cl-等对测定结果的影响[30]。根据NH4+与SO42-之间的数量关系,计算产物中硫酸氢铵和硫酸铵的量。
1.4 数据处理方法
NH3和SO3反应产物可能是硫酸氢铵、硫酸铵或两者的混合物。实验中均采用分光光度法分析清洗液中SO42-和NH4+离子的浓度,以提高数据的相对准确度。其中,清洗液中的SO42-离子分别来自SO3的凝结和SO3与NH3的反应产物,实验前,首先单独通SO3,分析清洗液中的SO42-离子,从而对不同温度下的SO3的凝结率进行标定。实验后,根据已知的SO3初始浓度、SO42-离子总量和SO3冷凝率对反应产物的SO42-离子量进行修正。
根据分析得到的反应产物中的SO42-和NH4+离子量的关系,计算反应产物中硫酸氢铵和硫酸铵的量。根据文献[4, 5],当NH3/SO3物质的量比大于2时,主要形成硫酸铵,当NH3/SO3物质的量比小于1时,则主要形成硫酸氢铵。因此, 若测出的NH4+离子浓度小于SO42-离子浓度,产物只有硫酸氢铵,且浓度为NH4+离子浓度,如式(6)所示;若测出的NH4+离子浓度大于两倍的SO42-离子浓度,产物只有硫酸铵,且浓度为SO42-离子浓度,如式(7)所示;若NH4+离子浓度和SO42-离子浓度的关系介于两者之间,则可根据式(1)和式(2)的关系算出硫酸氢铵与硫酸铵的量,具体见式(8)。
式中,a为某温度下SO3和NH3反应产物清洗液中的SO42-离子量(mol),b为某温度下SO3和NH3反应产物清洗液中的NH4+离子量(mol),M为生成硫酸氢铵的量(mol),N为生成硫酸铵的量(mol)。为便于后续的分析,本研究统一采用生成率来表示NH3与SO3反应产物硫酸氢铵、硫酸铵的生成量,其中,生成率为某反应产物的生成量与其单纯完全生成硫酸氢铵或硫酸铵的理论值的比例,见式(9)和(10)。
式中,wM、wN为硫酸氢铵、硫酸铵生成率(%),M0、N0为硫酸氢铵、硫酸铵理论生成最大量(mol)。
2 结果与讨论
2.1 反应物浓度对生成率的影响
2.1.1 对硫酸氢铵生成率的影响
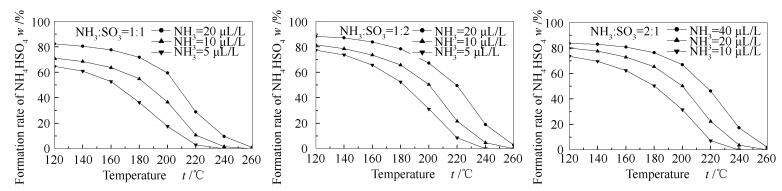
在相同NH3/SO3物质的量比下,不同反应物浓度对硫酸氢铵生成率的影响见图 5。
由图 5可知,随着反应物浓度的增加,硫酸氢铵的生成温度逐渐升高。对比同一浓度下,当NH3/SO3偏离1:1时,硫酸氢铵的生成温度有升高的趋势。实验浓度为5-40 μL/L,硫酸氢铵的生成温度为230-270 ℃。
当反应物NH3/SO3物质的量比为1:1时,随着反应物浓度的增加,硫酸氢铵的生成率相应提高,NH3浓度从5 μL/L增加到20 μL/L,硫酸氢铵120 ℃的生成率从64.6%上升到82.4%。当反应物NH3/SO3物质的量比为1:2和2:1时,反应物浓度变化对硫酸氢铵生成率的影响基本趋势与NH3/SO3物质的量比为1:1一致。
对比不同的物质的量比对硫酸氢铵生成率的影响,同一温度下,当NH3/SO3物质的量比偏离1:1时,即提高了反应物NH3或SO3比例,均出现硫酸氢铵生成率上升的变化趋势。以NH3/SO3物质的量比为1:1时作基础分析,当反应温度为120 ℃,NH3或SO3最低浓度为20 μL/L时,硫酸氢铵的生成率为82.4%,当反应物NH3/SO3物质的量比为1:2和2:1时,硫酸氢铵的生成率分别上升到88.3%和83.6%。可见当SO3浓度增加时,硫酸氢铵的生成率的增幅略大于NH3增加相同浓度时的增幅,且增加的幅度随着反应温度的降低而有所提高,表明SO3较NH3更能促进硫酸氢铵的生成。这是由于式(1)和式(2)的反应物NH3和SO3物质的量比分别为1:1和2:1,SO3的增加更有利于反应式(1)的进行。
2.1.2 对硫酸铵生成率的影响
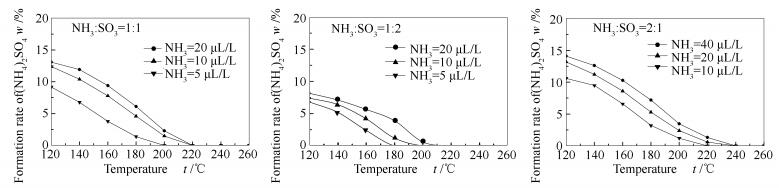
反应物浓度变化对硫酸铵生成率的影响见图 6。由图 6可知,随着反应物浓度的增加,硫酸铵的生成温度逐渐升高。当NH3/SO3物质的量比为1:1时,硫酸铵的生成温度为200-220 ℃。和硫酸氢铵生成规律不同,当NH3/SO3物质的量比为1:2时,即增加SO3的比例,硫酸铵的生成温度却有降低的趋势;当NH3/SO3物质的量比为2:1时,即增加NH3的比例,硫酸铵的生成温度会随之升高。整体上,在实验浓度5-40 μL/L,硫酸铵的生成温度为180-240 ℃,比硫酸氢铵生成温度低40 ℃左右。
硫酸铵生成率随温度的变化趋势与硫酸氢铵相似,增加反应物浓度,硫酸铵生成率会相应提高。在NH3/SO3物质的量比为1:1的工况下,NH3浓度从5 μL/L增加到20 μL/L导致硫酸铵在120 ℃下的生成率从9.2%上升到13.1%。
对比不同的NH3/SO3物质的量比对硫酸铵生成率的影响,以NH3/SO3物质的量比为1:1为基础分析,当反应温度为120 ℃,NH3浓度为20 μL/L时,硫酸铵的生成率为13.1%,当反应物NH3/SO3物质的量比为1:2和2:1时,硫酸铵的生成率分别为8.15%和14.13%,NH3浓度的增加有利于硫酸铵的生成,而SO3浓度的增加则不利于硫酸铵的生成。和硫酸氢铵的生成机理不同,NH3当量的增加更有利于反应式(2)的进行。
2.2 反应物浓度对反应进度的影响
反应物浓度对NH3和SO3反应进度可用在不同温度区间硫酸氢铵或硫酸铵的生成份额表示,相当于生成速率,计算见式(11)。
式中,P为某温度区间硫酸氢铵或硫酸铵生成率占其在120 ℃下生成率的份额(%),P1、P2为同一工况下相邻两温度点的硫酸氢铵或硫酸铵生成率(%),P120 ℃为120 ℃下硫酸氢铵或硫酸铵生成率(%)。
2.2.1 对硫酸氢铵生成进度的影响
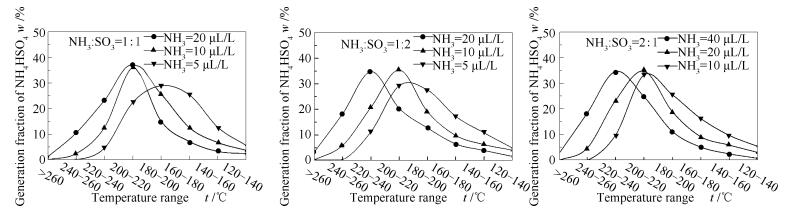
在不同温度区间硫酸氢铵生成份额的变化见图 7。
由图 7可知,硫酸氢铵的生成份额随温度的变化呈现单峰状。随着反应物初始浓度的降低,硫酸氢铵开始出现的温度区间逐渐降低,且硫酸氢铵最大生成份额即峰值所在的温度区间逐步降低。对比同一浓度下,当NH3/SO3物质的量比偏离1:1时,硫酸氢铵的峰值温度均有升高的趋势。在实验浓度5-40 μL/L下,硫酸氢铵的峰值温度为180-240 ℃。表明初始反应物浓度的提高会加快NH3和SO3的反应进程,提高了硫酸氢铵的生成温度,在空气预热器中可能沉积的量更多。根据文献[11]关于空气预热器的模拟,在空气预热器中低温段,当烟温降至220 ℃以下,此区域平均积灰强度为高温段普通积灰区的7.3倍,且在此区域颗粒的积灰概率高达90%左右,明显大于普通积灰区,因此,实验结果与实际较为符合。
2.2.2 对硫酸铵生成进度的影响
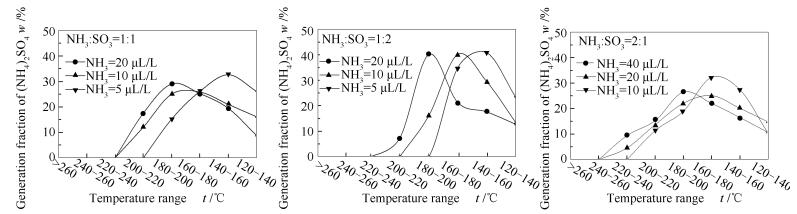
在不同温度区间硫酸铵生成份额的变化,具体见图 8。由图 8可知,硫酸铵在不同温度区间内生成份额的变化趋势与硫酸氢铵一致,呈现单峰状。反应物初始浓度越高,硫酸铵出现的温度逐渐升高,硫酸铵生成初期的生成份额上升越快,且硫酸铵最大生成份额所在的温度区间越高。对比同一浓度下,当NH3/SO3物质的量比偏离1:1时,硫酸铵的峰值温度无太大变化。在实验浓度5-40 μL/L,硫酸铵的峰值温度为140-200 ℃。总体上,硫酸铵的峰值温度比硫酸氢铵的峰值温度低40 ℃左右。当条件相同时,硫酸铵开始出现的温度区间较硫酸氢铵低,表明NH3和SO3反应更容易生成硫酸氢铵。
3 结论
在实验浓度范围内,硫酸氢铵的开始生成温度为230-270 ℃,峰值温度为180-240 ℃,硫酸铵开始生成温度及峰值温度总体上比硫酸氢铵低40 ℃左右。
在相同反应物物质的量比和温度的情况下,随着反应物浓度的增加,硫酸氢铵和硫酸铵的生成率逐渐增加。
硫酸氢铵的生成率明显高于硫酸铵,根据NH3和SO3浓度与物质的量比不同,烟温到120 ℃时,硫酸氢铵的生成率为64%-90%,硫酸铵的生成率为6%-15%,硫酸氢铵的生成率为硫酸铵的6-10倍。
以NH3/SO3物质的量比为1:1为基准分析,同一反应温度下,SO3浓度增加时,硫酸氢铵的生成率的增幅略大于NH3增加相同浓度时的增幅,表明SO3较NH3更能促进硫酸氢铵的生成。当NH3浓度增加时,硫酸铵的生成率逐渐上升;而当SO3浓度增加时,硫酸铵的生成率则下降。表明NH3浓度的增加有利于硫酸铵的生成,而SO3浓度的增加则不利于硫酸铵的生成。
硫酸氢铵/硫酸铵在各个温度区间的生成份额随温度的变化呈现单峰状,随着反应物浓度的增加,硫酸氢铵/硫酸铵生成的温度区间及峰值温度逐渐升高。这是由于硫酸氢铵/硫酸铵的生成和分解是双向平衡反应,反应物浓度增加有利于生成反应的进行。
-
-
[1]
GB13223-2011, 火电厂大气污染物排放标准[S].GB13223-2011, Emission standard of air pollutants for thermal power plants[S].
-
[2]
中华人民共和国国家发展和改革委员会. 煤电节能减排升级改造行动计划[EB/OL]. http://bgt.ndrc.gov.cn/zcfb/201409/t20140919_626242.html, 2014-09-12.
-
[3]
陈进生.电厂烟气脱硝技术——选择性催化还原法[M].北京:中国电力出版社, 2008.CHEN Jin-sheng. Flue Gas Denitrification Technology in Power Plant-Selective Catalytic Reduction[M]. Beijing:China Electric Power Press, 2008.
-
[4]
李俊华, 杨恂, 常化振.烟气催化脱硝关键技术研发及应用[M].北京:科学出版社, 2015.LI Jun-hua, YANG Xun, CHANG Hua-zhen. Development and Application of Key Technologies for Catalytic Denitrification of Flue Gas[M]. Beijing:Science Press, 2015.
-
[5]
马双忱, 金鑫, 孙云雪, 崔基伟. SCR烟气脱硝过程硫酸氢铵的生成机理与控制[J]. 热力发电, 2010,39,(8): 12-17. MA Shuang-chen, JIN Xin, SUN Yun-xue, CUI Ji-wei. The formation mechanism of ammonium bisulfate in SCR flue gas denitrification progress and control thereof[J]. Therm Power Gener, 2010, 39(8): 12-17.
-
[6]
WILBURN R T, WRIGHT T L. SCR ammonia slip distribution in coal plant effluents and dependence upon SO3[J]. Powerplant Chem, 2004, 6(5): 295-304.
-
[7]
蔡明坤. 装有脱硝系统锅炉用回转式预热器设计存在问题和对策[J]. 锅炉技术, 2005,36,(4): 8-12, 77. CAI Ming-kun. The problem and solution in air preheater design for boilers with de NOx equipments[J]. Bolier Technol, 2005, 36(4): 8-12, 77.
-
[8]
FARTHING W E, WALSH P M. Identification of (and responses to) potential effects of SCR and wet scrubbers on submicron particulate emissions and plum characteristics[R]. Alabama: Southern Research Institute, 2004.
-
[9]
梁登科. 脱硝过程伴生硫酸氢氨对于烟气灰颗粒性质影响的实验研究[D]. 济南: 山东大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10422-1014309904.htmLIANG Deng-ke. Experimental research on the effects to flue ash particles characteristics of NH4HSO4 generating during the denitrification process[D]. Jinan: Shandong University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10422-1014309904.htm
-
[10]
陆建伟, 曹志勇, 李辉. 燃煤机组烟气脱硝设施建设和运行情况及存在问题浅析[J]. 电力科技与环保, 2013,29,(5): 4-7. LU Jian-wei, CAO Zhi-yong, LI Hui. Problems analysis in construction and operation of coal-fired units flue gas denitrification facilities[J]. Electric Power Technol and Environ Prot, 2013, 29(5): 4-7.
-
[11]
罗闽, 赵伶玲, 李偲宇. 空气预热器硫酸氢铵积灰的数值研究[J]. 动力工程学报, 2016,36,(11): 883-888. doi: 10.3969/j.issn.1674-7607.2016.11.005LUO Min, ZHAO Ling-ling, LI Si-yu. Numerical simulation of ash deposition with adhesion of NH4HSO4 in an air preheater[J]. Chin J Power Eng, 2016, 36(11): 883-888. doi: 10.3969/j.issn.1674-7607.2016.11.005
-
[12]
Schreifels J J, WANG S X, HAO J M. Design and operational considerations for selective catalytic reduction technologies at coal-fired boilers[J]. Front Energy, 2012, 06(1): 98-105. doi: 10.1007/s11708-012-0171-4
-
[13]
赵宗让. 电厂锅炉SCR烟气脱硝系统设计优化[J]. 中国电力, 2005,38,(11): 69-74. ZHAO Zong-rang. Design optimization of SCR system for coal-fired boilers[J]. Electric Power, 2005, 38(11): 69-74.
-
[14]
ZHAO Y, HU J, HUA L. Ammonia storage and slip in a urea selective catalytic reduction catalyst under steady and transient conditions[J]. Ind Eng Chem Res, 2011, 50(21): 11863-11871. doi: 10.1021/ie201045w
-
[15]
LEI Z G, WEN C P, CHEN B H. Optimization of internals for selective catalytic reduction (SCR) for no removal[J]. Environ Sci Technol, 2011, 45(8): 3437-3444. doi: 10.1021/es104156j
-
[16]
朱崇兵, 金保升, 李锋, 翟俊霞. SO2氧化对SCR法烟气脱硝的影响[J]. 锅炉技术, 2008,39,(3): 68-72. ZHU Chong-bing, JIN Bao-sheng, LI Feng, ZHAI Jun-xia. Effect of SO2 oxidation on SCR-DeNOx[J]. Bolier Technol, 2008, 39(3): 68-72.
-
[17]
王杭州. SCR对脱硝效率及SO2转化影响分析[J]. 电力科学与工程, 2008,24,(5): 17-21. WANG Hang-zhou. The influence of SCR on denitrification efficiency and SO2 conversion[J]. Electric Power Sci Eng, 2008, 24(5): 17-21.
-
[18]
BURKE J M, JOHNSON K L. Ammonium sulfate and bisulfate formation in air preheaters[J]. Bmj British Med J, 1982, 329(7463): 446.
-
[19]
Ando J. NOx abatement for stationary sources in Japan[R]. USEPA, 1976.
-
[20]
CHOTHANI C, MOREY R. Ammonium bisulfate (ABS) measurement for SCR NOx control and air heater protection[C]//Baltimore, MD: 2008.
-
[21]
MENASHA J, DUNN-RANKIN D, MUZIO L, STALLINGS J. Ammonium bisulfate formation temperature in a bench-scale single-channel air preheater[J]. Fuel, 2011, 90(7): 2445-2453. doi: 10.1016/j.fuel.2011.03.006
-
[22]
MATSUDA S, KAMO T, KATO A. Deposition of ammonium bisulfate in the selective catalytic reduction of nitrogen oxides with ammonia[J]. Ind Eng Chem Prod Res Dev, 1982, 21(1): 1888-1900.
-
[23]
Sarunac N. Improving the performance of boiler auxiliaries[J]. Coal Power, 2011, (2): 1-35.
-
[24]
马双忱, 邓悦, 吴文龙, 张立男, 马京香, 张小霓. SCR脱硝过程中硫酸氢铵形成特性实验研究[J]. 动力工程学报, 2016,36,(2): 143-150. MA Shuang-chen, DENG Yue, WU Wen-long, ZHANG Li-nan, MA Jing-xiang, ZHANG Xiao-ni. Experimental research on ABS formation characteristics in SCR denitrification process[J]. Chin J Power Eng, 2016, 36(2): 143-150.
-
[25]
刘少武.硫酸工作手册[M].南京:东南大学出版社, 2001.LIU Shao-wu. Sulfuric Acid Workbook[M]. Nanjing:Southeast University Press, 2001.
-
[26]
陈晓露, 赵钦新, 鲍颖群, 王云刚, 李钰鑫. SO3脱除技术实验研究[J]. 动力工程学报, 2014,34,(12): 966-971. CHEN Xiao-lu, ZHAO Qin-xin, BAO Ying-qun, WANG Yun-gang, LI Yu-xin. Experimental research on SO3 removal[J]. Chin J Power Eng, 2014, 34(12): 966-971.
-
[27]
常景彩, 董勇, 王志强, 闫君, 陈朋, 马春元. 燃煤烟气中SO3转换吸收特性模拟实验[J]. 煤炭学报, 2010,35,(10): 1717-1720. CHANG Jing-cai, DONG Yong, WANG Zhi-qiang, YAN Jun, CHEN Peng, MA Chun-yuan. Simulation experiment of SO3 transfer and absorption characteristics in coal fired flue gas[J]. J China Coal Soc, 2010, 35(10): 1717-1720.
-
[28]
张基标, 郝卫, 赵之军, 胡兴胜, 殷国强. 锅炉烟气低温腐蚀的理论研究和工程实践[J]. 动力工程学报, 2011,31,(10): 730-733, 738. ZHANG Ji-biao, HAO Wei, ZHAO Zhi-jun, HU Xing-sheng, YIN Guo-qiang. Theoretical and practical research on mechanism of low-temperature corrosion caused by boiler flue gas[J]. Chin J Power Eng, 2011, 31(10): 730-733, 738.
-
[29]
向柏祥, 赵从振, 丁艳军, 马润田, 吕俊复. 烟气酸露点的测量和预测模型分析[J]. 清华大学学报(自然科学版), 2015,55,(10): 1117-1124. XIANG Bai-xiang, ZHAO Chong-zhen, DING Yan-jun, MA Run-tian, LU Jun-fu. Measurement and prediction model for the acid dew point in flue gases[J]. J Tsinghua Univ (Sci Technol), 2015, 55(10): 1117-1124.
-
[30]
李婕, 贾斌, 羌宁. 钍试剂分光光度法测定固定源烟气中SO3[J]. 环境污染与防治, 2008,30,(10): 63-66. doi: 10.3969/j.issn.1001-3865.2008.10.018LI Jie, JIA Bin, QIANG Ning. Thorin colorimetric method for sulfur trioxide determination from stationary sources[J]. Environ Pollut Ctrl, 2008, 30(10): 63-66. doi: 10.3969/j.issn.1001-3865.2008.10.018
-
[31]
GBT18204. 25-2000, 公共场所空气中氨测定方法[S].GBT18204. 25-2000, Method for determination of ammonia in the air of public places[S].
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 136
- 文章访问数: 10659
- HTML全文浏览量: 3288


 下载:
下载:







 下载:
下载:

