 图1
首例具有CPL性质的有机小分子1和2 [12, 13]
Figure1.
The first reported organic small molecules 1 and 2 with CPL properties [12, 13]
图1
首例具有CPL性质的有机小分子1和2 [12, 13]
Figure1.
The first reported organic small molecules 1 and 2 with CPL properties [12, 13]

Citation: Li Meng, Lin Wei-Bin, Fang Lei, Chen Chuan-Feng. Recent Progress on Circularly Polarized Luminescence of Chiral Organic Small Molecules[J]. Acta Chimica Sinica, 2017, 75(12): 1150-1163. doi: 10.6023/A17090440

手性有机小分子圆偏振发光的研究进展
English
Recent Progress on Circularly Polarized Luminescence of Chiral Organic Small Molecules
-
Key words:
- circularly polarized luminescence
- / chirality
- / helicene
- / organic small molecule
-
1 引言
单个光子是不带电也无质量的玻色子, 它存在左圆偏振和右圆偏振两种偏振态. 当一束圆偏振光照射过来时, 相应的电磁矢量如果是顺时针螺旋, 则这束光为右圆偏振光, 如果是逆时针螺旋, 则这束光为左圆偏振光, 这种左或右的圆偏振赋予了光的手性特征 [1] . 当有机小分子、聚合物、金属络合物或超分子组装体等非外消旋的发光体系发射出具有差异的左旋和右旋圆偏振光时则被称为圆偏振发光(CPL). 相对于用以研究基态手性结构信息的圆二色光谱(CD), CPL光谱不仅能直观地反映手性发光体系的激发态结构信息, 也能为研究手性的产生、传递、放大等机制提供检测方法 [2] , 而且在3D显示 [3] 、自旋信息通讯 [4] 、信息存储与处理 [5] 、CPL激光 [6] 、生物检测与探针 [7] 等领域具有广泛的应用前景. 因此, 近年来CPL材料与应用引起了人们越来越多的兴趣与关注, 成为有机发光功能材料领域一个新的研究热点.
CPL光谱中, 不对称因子(glum)是一个重要指标. 虽然CPL光谱可以测量左圆偏振光(IL)与右圆偏振光(IR)的发光强度(△I)之差, 但由于难以测量绝对发射强度, 所以通常会根据发光不对称因子来定量研究CPL光谱的不对称度 [8] . 如下式所示, 不对称因子表示为发光强度差与平均总发光强度的比率.
由上式所得的CPL光谱的不对称因子glum处于-2到+2之间, 不对称因子glum=0表示非偏振光, glum= ±2表示完全的圆偏振光(负值为右旋, 正值为左旋).目前为止, 具有高不对称因子的CPL发光分子体系主要来自手性镧系配合物, 其中最高值可达1.38 [9] .
关于圆偏振发光材料的早期研究主要集中在手性镧系配合物方面 [10] , 这主要归因于镧系元素磁性允许的内部构型的f-f跃迁极大地增加了分子圆偏振发光的不对称因子, 但是由于重原子的存在导致分子体系的发光效率普遍较低, 甚至难以检测到相应的发光性质, 这极大地限制这类圆偏振发光材料的应用. 另一类研究较多圆偏振发光材料是基于手性聚合物 [11] , 主要策略包括: (1)在手性母体材料中嵌入发色团, 通常是把聚合物发光团嵌入玻璃态手性向列型液晶基体中, 使其产生圆偏振光; (2)通过在常规的发光聚合物主链上引入手性侧链, 通过手性侧链诱导聚合物产生圆偏振光; (3)通过使用手性溶剂对聚合物进行诱导产生圆偏振光. 虽然这类材料通常具有较大的圆偏振发光不对称因子和较高的发光效率, 但是手性性质不稳定, 难以精确研究其构效关系, 以及手性单体种类有限, 这些不利因素使得基于聚合物的圆偏振发光材料进展缓慢.
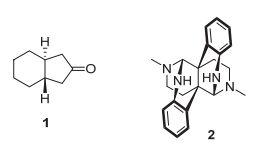
手性有机发光小分子不仅具有简单明确的分子结构, 较高的发光效率, 而且种类繁多、易于衍生化, 这些优势使其成为最有前景的一类圆偏振发光材料. 如图 1所示, 早在1967年, Emeis等 [12] 就报道了首例具有CPL性质的简单有机小分子(+)-(S, S)-trans-β-氢化茚酮1, 该手性酮在异辛烷溶液中具有显著的CPL性质, 不对称因子glum=+0.035. 但光量子产率较低, 这可能是由于这类分子上羰基所发生的是n→π*跃迁. 所以导致其发光量子产率较低. 1979年Barnett等 [13] 报道了第一例具有芳香结构的圆偏振发光有机小分子2 (glum=+8×10-3), 虽然发光效率没有质的提高, 但是开启了基于手性π体系的圆偏振发光的研究.
 图1
首例具有CPL性质的有机小分子1和2 [12, 13]
Figure1.
The first reported organic small molecules 1 and 2 with CPL properties [12, 13]
图1
首例具有CPL性质的有机小分子1和2 [12, 13]
Figure1.
The first reported organic small molecules 1 and 2 with CPL properties [12, 13]
近年来, 基于手性有机小分子的研究取得了长足的发展 [8] . 手性有机小分子及其组装体虽然不对称因子普遍处于10-5~10-2, 但具有较高的发光效率, 如果进一步优化其分子结构, 则有望得到同时具有高不对称因子和高发光效率的手性发光体系. 目前最优的有机小分子体系可同时实现88%的发光效率和3×10-3的不对称因子 [14] . 本文综述近年来基于手性有机小分子 [8, 15] 圆偏振发光的研究工作, 主要围绕具有中心手性、轴手性、面手性和螺旋手性的圆偏振发光有机小分子展开介绍.
2 具有CPL性质的中心手性有机小分子
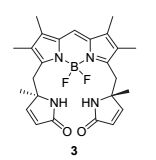
基于sp3杂化的中心手性分子是最常见的一类手性分子, 也是圆偏振发光材料中研究最早的一类. 这类手性分子最主要的特点是在已知的发光团上引入中心手性, 进而诱导发光团使其具有圆偏振发光性质. 如图 2所示, 在氟硼荧染料(BODIPY)上通过非共轭形式引入中心手性片段得到化合物3[16], 亚甲基桥联的非共价的碳中心手性可以有效地传递到发色团上, 所以该分子表现出良好的圆偏振发光性质(glum=1×10-3, Φ=0.48). 利用这种策略可以方便、高效地设计合成具有不同骨架结构类型的圆偏振有机发光分子.
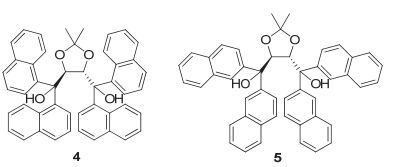
通过在手性中心的适当位置上引入发光片段是获得CPL性质最方便有效的办法. 如图 3所示, 当萘片段引入到手性酒石酸衍生物的骨架上时, 可得到具有圆二色(CD)性质和CPL性质的手性发光分子4和5 [17] . 有趣的是, 在手性骨架上引入萘片段后所得到的分子4和5具有正负号相反的CD和CPL信号. 结果不仅表明sp3杂化的手性碳中心可以对生色团整体结构产生手性扰动进而产生CPL性质, 而且通过构效关系的微调还可以实现CPL信号的翻转, 为实现CPL信号的精准调控提供了重要的参考价值.
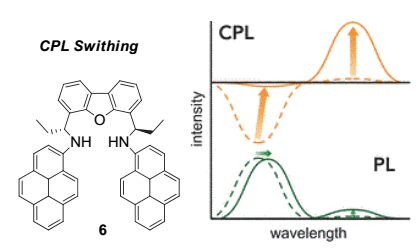
如图 4所示, 两个芘基团通过手性胺片段引入到二苯并呋喃骨架后可得到具有CPL性质的手性发光分子6 [18] . 手性胺的中心手性对芘的手性扰动使得分子6在溶液中呈现出CPL性质, 并且随着样品6浓度的增加, 分子逐渐形成的聚集态结构在长波长处的CPL信号不仅得到了增强(|glum|=3~4×10-3)而且发生了信号的翻转, 这一现象的产生归因于二聚芘周围所表现出有效的手性协同环境.
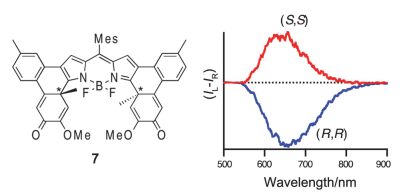
在具有π共轭骨架的芳香体系中引入中心手性, 可以实现分子骨架整体呈现出扭曲的空间结构, 进而表现出显著的CPL性质. 如图 5所示, 碳中心手性的引入使得BODIPY骨架具有手性, 所得到的手性分子7 [19] 在红光区的量子产率高达0.73, 而且还具有显著的康顿相应 (λmax=614 nm, Δε=60 L•mol-1•cm-1)和CPL性质(|glum|=6×10-4). 这种由中心手性导致的空间扭曲的分子骨架非常有利于使共轭π共轭体系产生CPL性质.
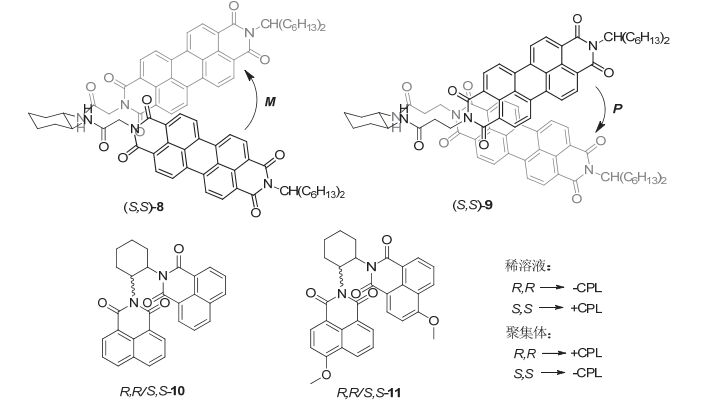
环己二胺作为一类中心手性分子, 将其引入发光团后同样可构筑具有CPL性质的手性发光分子. 如图 6所示, 当环己二胺通过不同长度柔性链引入两个苝酰亚胺后, 可得到具有不同构型的化合物8和9 [20] . 在稀溶液中, 单体分子8或9的CPL信号处于540 nm, 不对称因子glum(6×10-4)较低; 当浓度增大使8或9分子逐渐聚集后, 其聚集态的CPL信号处于630 nm, 且CPL信号反转, 不对称因子更高(glum=8×10-3). 基于类似的策略, 将1, 8-萘二甲酰亚胺引入到手性环己二胺骨架上可得到手性有机发光分子R, R/S, S-10和11 [21] . 由于这类分子具有相对刚性的骨架, 所以呈现出较高的发光效率和显著的圆偏振发光性质(R, R-2: glum=-10-2; S, S-2: glum=+10-2). 当此手性分子从稀溶液变成聚集体后, 其CPL信号发生了翻转(R, R-2: glum=+10-2; S, S-2: glum=-10-2), 这种由于分子聚集形态不同而导致CPL信号改变可应用于响应性CPL材料的研究.
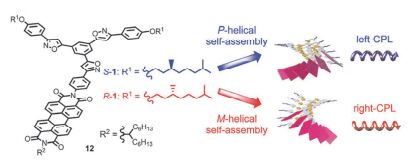
通过在发光团上引入中心手性不仅能够诱导有机小分子产生CPL信号, 而且可使相应的手性组装体保持CPL信号. 更进一步地, 所得到的手性组装体还可能实现手性信号的协同放大, 这也是构筑具有高效CPL有机发光材料的一个有效方法 [22] . 如图 7所示, Haino课题组 [23] 在2012年报道了一类由含有苝酰亚胺荧光团的手性单体12组装形成具有螺旋堆积结构的组装体, 发现这类自组装体表现出强的CD和CPL信号, 并且其手性信号可对溶剂、温度及浓度等外部刺激产生响应. 其中具有S构型侧链的单体分子所得到的自组装体呈现P型螺旋结构, 其荧光最大发射波长在650 nm (Φ=0.07), CPL光谱显示出左旋信号(glum=0.007). 同样地, 当侧链为R构型时可得到具有右旋CPL性质的M构型螺旋组装体.
手性有机小分子在组装形态下需要有效避免因分子聚集而发生荧光猝灭才可能保持良好的CPL性质. 因此, 如何实现分子聚集态具有高发光效率是设计合成高效CPL有机小分子的一个关键, 而聚集诱导发光(AIE)效应可以很好地解决这一难题. 在聚集诱导荧光增强(AIE)材料上引入手性基团, 是构筑高效CPL材料分子的有效手段.
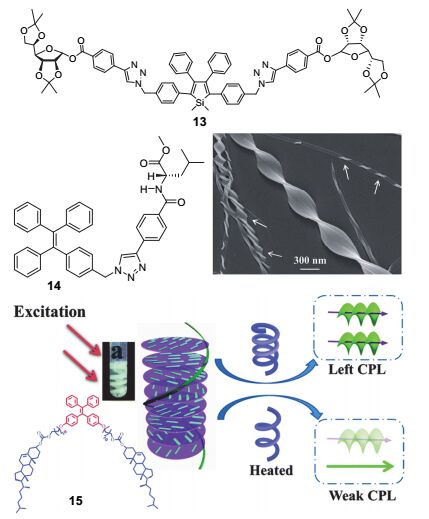
如图 8所示, 2012年唐本忠课题组 [24] 报道了一种在聚集态中构建具有显著CPL性质的手性分子13. 13在稀溶液中不具有荧光和CD信号, 但当分子聚集后, 表现出聚集诱导CD和CPL性质. 这一现象产生的原因主要是由于分子聚集时倾向于自组装形成右手螺旋纳米结构, 该自组装体表现出右旋CPL性质. 化合物13在聚集态下CPL的|glum|为0.08~0.32, 比常见的手性有机小分子发光材料高两个数量级, 这为构建同时具有高荧光量子产率和高不对称因子的CPL有机小分子提供了新的思路.
类似地, 由四苯乙烯上引入L-亮氨酸甲酯片段得到的手性分子14 [25] 在稀溶液中没有荧光和CD信号, 但当14聚集后表现出显著的荧光发射和CD性质. 当溶液蒸发后, 14容易自组装形成螺旋微/纳米纤维, 这些组装纤维表现出显著的聚集诱导圆偏振发光性质, 其不对称因子在0.02~0.07之间.
更进一步地, 把四苯乙烯与胆固醇通过十一烷基链相连, 可得到一种在胆固醇液晶相中具有固体状态、高温度范围(24~86 ℃)及高量子产率(42%)的新型CPL分子15 [26] , 其中胆固醇片段的中心手性成功地诱导四苯乙烯片段产生手性, 其CD和CPL可以通过温度变化改变其液晶相的螺旋间距来进行微调. 这种热调节的CPL材料可以在诸如手性识别和基于液晶的光电显示器中得到应用.
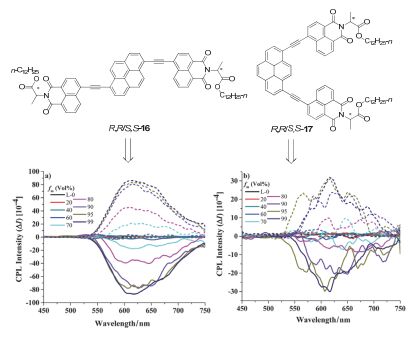
具有聚集诱导增强性质的CPL材料伴随着浓度增大、荧光增强而逐渐表现出CPL性质, 同时可实现荧光发射波长的改变和CPL信号有无的调控. 如图 9所示, 两对含有D/L-丙氨酸基元和芘荧光团的手性1, 8-萘酰亚胺异构体R, R/S, S-16和R, R/S, S-17 [27] 在良溶剂中均呈现出亮黄色荧光, 但不具有CPL性质; 当加入不良溶剂的比例逐渐增加到99%时, 其聚集体不仅显示红色荧光, 而且在红光波长区域呈现出明显的CPL信号. 这是由于聚集态下分子间π-π相互作用有利于形成规则且有序的自组装纳米结构, 进而表现出CPL性质, 其不对称因子高达0.013. 因此, 通过分子间的自组装, 能够实现CPL性质从无到有的调控.
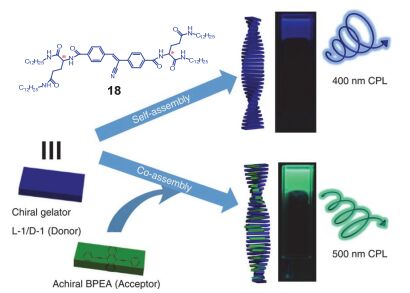
有机小分子凝胶是有机小分子凝胶因子通过氢键、π-π相互作用等弱作用在一定条件下互相连接形成空间网状结构, 结构空隙中充满了分散介质的分散体系. 如果在其凝胶因子中引入中心手性, 就可能会实现其规整的手性组装. 若这类凝胶因子中还含有发光团, 那就有可能实现具有CPL性质的有机小分子凝胶的构筑. 如图 10所示, 段鹏飞和刘鸣华等 [28] 通过超分子自组装的方法, 利用手性π凝胶因子18和非手性的π受体分子形成的复合纳米螺旋结构, 实现了给体分子和受体分子在手性和能量两方面的传递. 结果表明, 单独的手性π凝胶因子可以自组装形成纳米螺旋纤维结构, 呈现相对弱的蓝色CPL性质. 在非手性的受体分子共存的情况下, 两者仍然可以通过共组装形成复合的纳米螺旋体, 其中非手性的受体分子可以同时捕获给体的手性和能量, 同时表现出超分子手性和能量转移放大的圆偏振发光性质.
如前文所述, 中心手性的引入并不能够诱导任意结构的非手性发光团在单分子状态下产生圆偏振发光, 只有在相对刚性的分子骨架上的中心手性才能有效地诱导非手性的发光团产生手性. 更多情况下, 具有相对柔性的手性分子在聚集状态才能表现出手性特点, 这主要是由于相对柔性的手性骨架并不能为发光团制造手性环境, 只有当分子发生聚集时, 分子间产生的有序堆积才利于手性环境的产生, 进而诱导非手性的发光团产生手性. 具有CPL性质的单分子不仅自身可用于手性应用的研究, 其组装体甚至会表现出增强或翻转的CPL信号. 因此, 为了得到更多种单分子状态下具有CPL性质的有机小分子, 设计合成具有手性π骨架的芳香体系将是一条有效途径.
3 具有CPL性质的轴手性有机小分子
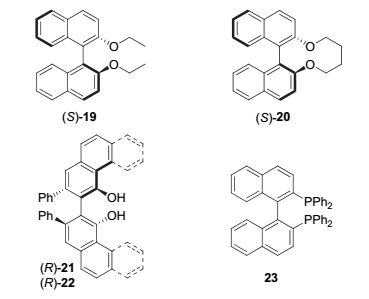
不同于中心手性, 轴手性是由多个基团围绕轴排布, 其排布方式使得分子无法与其镜像重合而产生手性. 最经典的轴手性分子是联二芳基骨架(如: 联二萘酚), 这类联芳基衍生物由于同时具有轴手性和富电子π共轭骨架, 因此分子本身具有CPL性质. 当在联芳基骨架上引入光电性质更为特殊的发光团时, 还可以进一步设计合成性能更优异的手性发光分子. 如图 11所示, 手性联萘酚衍生物(S)-19和(S)-20自身就有CPL性质, 通过控制(S)-19和(S)-20两者二面角的大小还可实现两者CPL信号的反转 [29] . 联芳基单元的π-延展也会影响分子的CPL性质 [30] , 其中(R)-21芳环相对(R)-22少, 结果(R)-21无CPL性质, 而(R)-22则可检测到CPL信号. 这些联芳基有机小分子一般都是经短波长(小于420 nm)的光进行激发产生CPL, |glum|范围为8×10-4~1.5×10-3(最大激发波长: 350~420 nm), 量子产率为15%~25%. 最近, Imai课题组 [31] 报道了具有CPL性质的BINAP (23), 通过将其掺杂入PMMA有机聚合物中使其产生CPL性质, 其量子产率为0.03, |glum|为8.3×10-4.
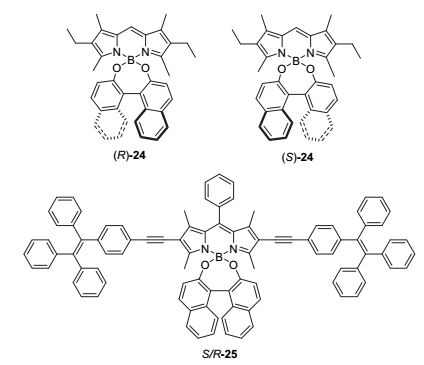
当在联二芳基衍生物骨架上引入其他发色团后, 轴手性同样可以诱导发色团产生圆偏振发光性质. 如图 12所示, de la Moya等 [32] 报道了一对基于非π-共轭氟硼荧(BODIPY)的手性有机小分子(R)-24和(S)-24. 虽然BODIPY没有手性, 但通过氧桥联的联萘酚的轴手性造成激发态的非手性BODIPY产生了手性扰动, 进而表现出CPL性质(glum=0.001, Φ=46%). 因此, 基于手性扰动设计合成简单手性非π-共轭荧光团是获得同时具有高量子产率和CPL性质有机小分子的有效策略. 基于同样的策略, 成义祥课题组 [33] 通过引入具有AIE活性的四苯乙烯设计合成了两个具有AIE活性的手性BODIPY(25), 该手性分子在630 nm (Φ=58.2%)处表现出明显的红色CPL性质(|glum|=0.002).
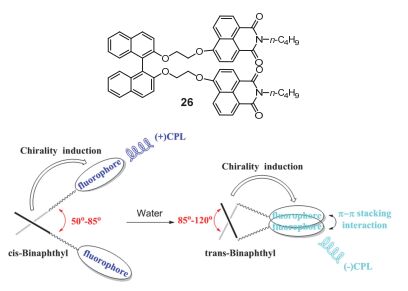
由联二萘酚的轴手性所构筑的手性分子不仅在溶液中呈现出圆偏振发光性质, 此类分子的聚集态同样具有圆偏振发光性质, 甚至还可以实现CPL信号有无、强弱以及信号反转的调控. 如图 13所示, 成义祥课题 组 [34] 合成了一个基于联萘基的手性萘酰亚胺衍生物26, 并发现其也具有聚集诱导发光性质, 并且它从稀溶液(R-26: -6.1×10-3; S-26: 5.5×10-3)到聚集态(R-26: 2.8×10-3; S-26: -2.2×10-3)显示出正负相反的CPL信号. 这是由于分子26从THF稀溶液中的顺式构象转变为在THF/水混合溶液中的反式构象导致联萘单元的二面角不同所产生的.
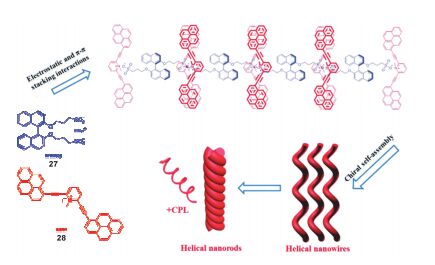
联二萘酚不仅可以使通过共价键相连的发光团产生手性, 还可以通过与发色团之间的超分子相互作用产生CPL信号. 如图 14所示, 手性联二萘磺酸盐阴离子27和非手性的二芘基吡啶鎓阳离子发色团28之间通过静电相互作用进行超分子自组装 [35] , 其中联二萘酚的轴手性通过非共价键使得相邻的两个芘片段发生有序π-π堆叠进而产生手性, 从电镜数据可发现, 这种手性超分子自组装体宏观上表现出螺烯缠绕的形态, 光谱数据显示其表现出强烈的CD和CPL信号, 而且组装体的手性得到了放大, 其不对称因子可以达到0.079.
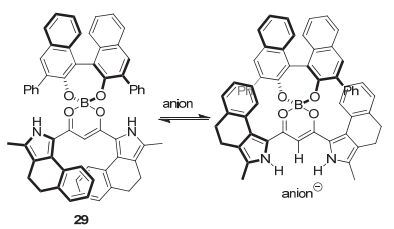
Maeda课题组 [36] 于2011年报道了首例CPL信号的化学刺激响应. 如图 15所示, 他们将BINOL单体引入二吡咯二酮得到阴离子响应的π共轭分子29, 其中阴离子与29相互作用导致两个吡咯环的反转, 引起的构象改变可以调控阴离子捕获器的光手性性质. 化合物29本身检测不到明显的CPL信号, 但当29与氯离子或乙酸根离子络合后, 表现出明显的CPL信号, 其glum可达2×10-3. 通过阴离子的刺激可诱导增强其CPL信号, 此策略为CPL的强度调控提供了一种新的方案.
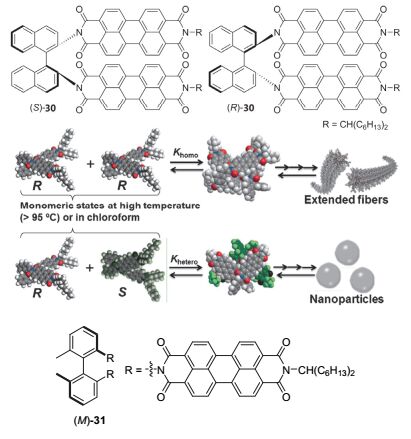
不仅联二萘酚有CPL性质, 如果在联二芳基的2, 2'位引入大位阻的荧光基团, 也可以得到具有CPL性质的手性有机分子. 如图 16所示, 通过连接两个苝酰亚胺基团到手性联二萘骨架上可得到具有显著CPL性质的手性有机发光分子30. 在氯仿溶液中其量子产率高达88%, |glum|在550 nm为0.003. 30也是目前同时具有高荧光量子产率和高不对称因子的一个最优CPL有机小分子 [14] . 该分子不仅在稀溶液中具有显著的CPL性质, 其聚集组装体同样具有CPL性质. 该分子组装形成的一维纳米纤维的不对称因子为0.02, 远高于其在氯仿溶液中的结果. 而且聚集体的形貌对圆偏振发光的程度起关键作用. 随着对映体过量的不同, 一维纳米线的长度逐渐减小, 直至最后其外消旋体组装形成规整的零维纳米球, 相应的CPL信号随着纳米线长度的减小而不断减弱 [37] . 类似地, 在联二苯基上引入苝酰亚胺同样可以诱导产生CPL性质, 因此, Langhals等 [38] 基于二氨基联苯与苝酰亚胺合成了一个含双发色团手性荧光染料(M)-31, 发现该分子同时具有高量子产率和显著的CPL性质.
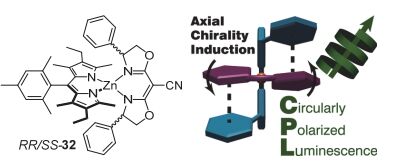
除了联二芳基的轴手性, 如图 17所示, 使用非手性的双吡咯和手性双(恶唑啉)配体合成的轴手性锌络合物32 [39] 不仅具有高的量子产率(70%), 也表现出由于手性双(恶唑啉)配体与双吡咯发生分子内π-π堆积而产生显著的CPL性质.
上述结果表明轴手性可以有效地用于合成具有CPL性质的手性有机分子. 但是这类手性分子在稀溶液中普遍存在不对称因子偏小(10-3~10-5)的问题, 其原因可能是由于轴手性的摆动在一定程度上降低了手性分子在激发态的刚性, 从而影响了分子的圆偏振发光强度. 因此, 设计相对刚性的手性骨架有利于获得具有较高不对称因子的手性有机发光分子.
4 具有CPL性质的面手性有机小分子
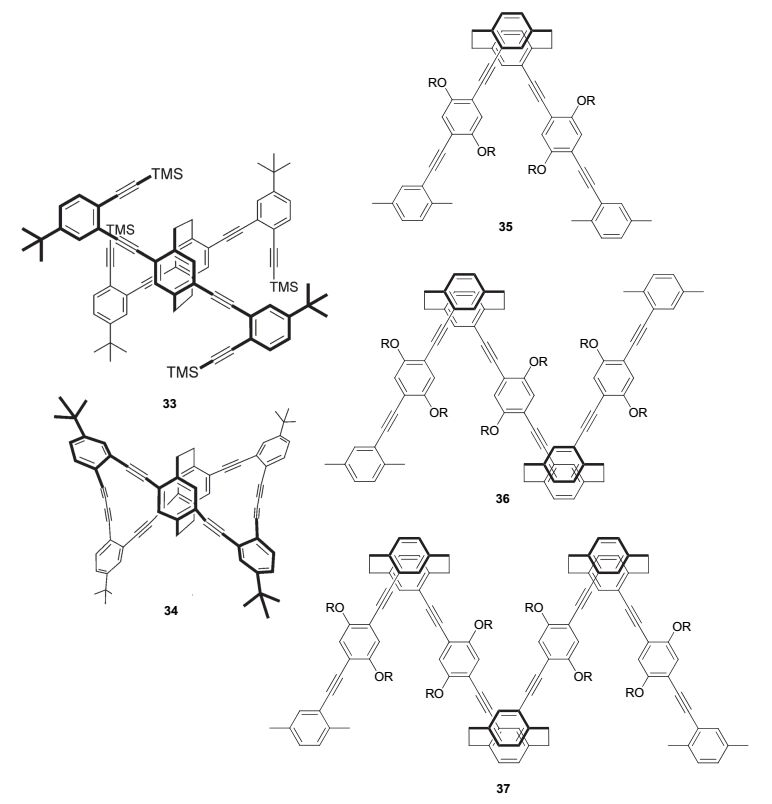
相对于中心手性与轴手性分子, 面手性有机分子结构更为刚性, 由其形成的具有CPL性质的手性有机小分子可能显示更大的不对称因子. 如图 18所示, Morisaki等 [40] 合成了基于D2对称的 [2, 2] 对环芳烷的CPL有机小分子33和34. 螺旋桨式的结构使得 [2, 2] 对环芳烷34不仅具有良好的不对称因子(glum=-0.011), 也具有高的量子产率(Φ=45%). 有趣的是, 34的glum值是其前体33 (glum=+0.0011)的10倍. 化合物34良好的CPL性质源自于其独特的结构, 其中存在一个内在的D2对称性, 并且具有十字交叉状高度离域的荧光团. 因此, 尽管π共轭荧光团平面被扭曲, 可能会导致其量子产率降低, 但是 [2, 2] 对环芳烷中心允许一种有效的贯穿空间的电子作用, 使得电子离域于整个分子, 这种额外的电子作用补偿了π共轭基团扭曲的影响, 从整体上提高了量子产率. 此外, 基于面手性[2.2]对环烷基骨架组成的光学活性寡聚体35~37 [41] , 其基态下低聚物的手性性质相似性归因于两个相邻发色团的等同取向; 而在激发态下, 通过光激发将低聚物折叠成类似于单手螺旋的形态, 使得这类分子在溶液中表现出强烈的圆偏振发光信号, 且具有相对大的不对称因子(10-2).
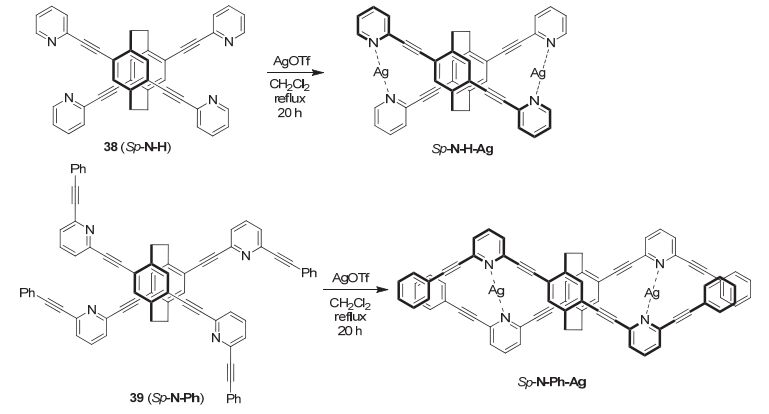
面手性分子33~37中的手性[2.2]对环烷基骨架分子自身具有CPL性质. 若固定分子结构使其变得更为刚性, 则其CPL性质会得到进一步改善. 固定方式不仅限于共价键, 通过配位键同样可以实现这类分子的手性放大. 如图 19所示, 分子38 (Sp-N-H, Φ=0.59; glum= -2.8×10-3)和39 (Sp-N-Ph, Φ=0.56; glum=-1.2×10-3)自身具有优异的发光效率和圆偏振发光性质 [42] . 当银离子加入后, 通过金属配位得到的结构呈现出双螺旋形态, 这使得分子体系的CD性质明显地增强. 但其量子产率和圆偏振发光的不对称因子不高, 这可能是由于银离子的加入虽然固定了分子的构象但是干扰了其辐射跃迁过程, 从而表现出CD信号增强, 但CPL性质变弱的现象. 该报道对于进一步设计面手性发光分子及开展手性传感检测等应用研究具有借鉴意义.
5 具有CPL性质的螺旋手性有机小分子
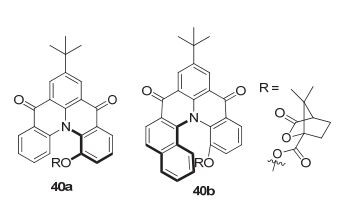
螺烯及其衍生物是一类由芳香环或其他非芳香环通过邻位稠合而得到的一类具有螺旋结构的芳香化合物 [43] . 这类芳香化合物末端芳环之间的空间位阻使分子骨架发生了扭曲从而不能处在同一个平面上. 这类分子既没有手性中心也没有对称面和S4反轴等对称元素, 扭曲的分子结构呈现出特殊的螺旋手性. 螺烯及其衍生物不仅呈现螺旋手性, 而且具有延展的π-共轭结构, 是一类优异的CPL分子体系. 如图 20所示, 2003年Venkataraman等 [44] 首次通过在外消旋的螺烯衍生物上引入手性辅助基团形成非对映异构体, 进而拆分得到具有CD和CPL性质的手性螺烯衍生物40a (glum=0.0011, λem=453 nm)和40b (glum=0.0007, λem=478 nm).
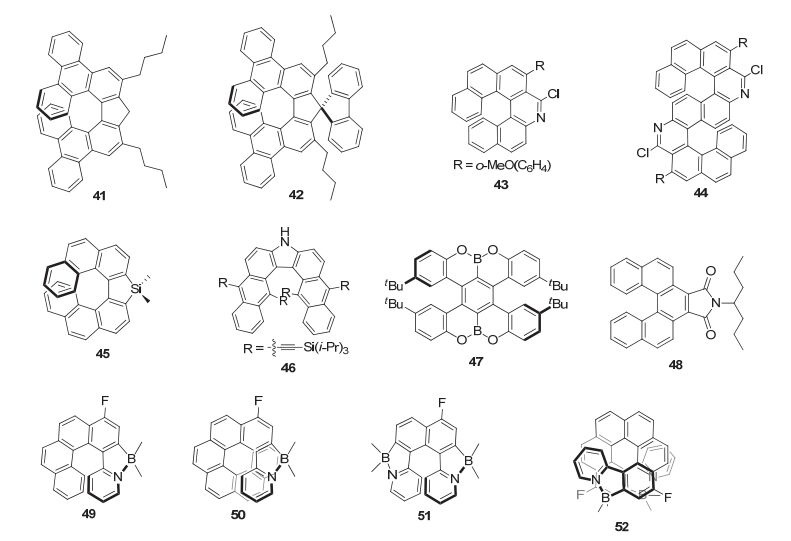
随后, 具有CPL性质的螺烯类衍生物被陆续报道, 结果表明它们是一类具有较高不对称因子的有机小分子. 如图 21所示, Tanaka等 [45] 合成得到了一系列结构复杂的螺烯类衍生物41~44, 这些分子不仅具有高的量子产率, 其不对称因子也都很高. 其中, [7] 螺烯衍生物41和42的|glum|均大于3×10-2.与此同时, S-型氮杂双 [6] 螺烯44的|glum|可达1.1×10-2, 而其单一 [6] 螺烯的|glum|小于10-3, 这可能是由于相对刚性的双螺烯在手性结构上起到了相互协同的作用, 进而表现出不对称因子的增大现象 [46] . 杂环类螺烯衍生物同样表现出优异的CPL性质, 其中, 手性硅杂 [7] 螺烯45 [47] 固态量子产率可达17%, 且表现出较好的CPL性质, 其|glum|为3× 10-3. 含氨基的螺烯类似物46 [48] 由于1, 1'位引入大位阻基团, 增大了分子的消旋能垒使其具有稳定的手性性质, 这类手性分子同样具有明显的CPL性质, 其不对称因子为3×10-3. 除了单杂螺烯衍生物, 2016年, Hatakeyama等 [49] 首次报道了硼氧杂双螺烯47, 结果表明其不对称因子为1.7×10-3, 荧光量子产率为0.65. 这表明没有完全芳构化的螺烯类衍生物不仅可以极大地提高荧光量子产率, 而且同样具有良好的CPL性质. 螺烯作为π共轭稠环骨架, 虽然不会发生明显的聚集荧光猝灭, 但是碳螺烯普遍存在发光效率偏低等问题. 在常规的碳螺烯骨架上引入具有优异光电性质的取代基后, 可明显地改善其发光效率和CPL性质. 如48 [50] , 当简单的 [5] 螺烯骨架上引入内酰亚胺后, 其荧光量子产率从0.03显著地升高到0.37, 拆分得到的手性分子表现出良好的CPL性质, 其|glum|可达2.4×10-3.
与碳碳双键相比, 硼氮双键具有一定的极性, 同样可以用来构筑具有CPL性质的螺烯类衍生物. 2017年, Crassous等 [51] 报道了四种硼氮杂[6]、[8]、[10]螺烯49~52, 分子中硼氮杂原子的引入使它们具有高的荧光量子产率(Φ=50%), 同时这类分子的对映异构体表现出显著的CD和CPL性质. 硼氮杂原子的引入可有效地改变这类杂螺烯分子的能级, 这可能使其成为良好的手性有机光电材料.
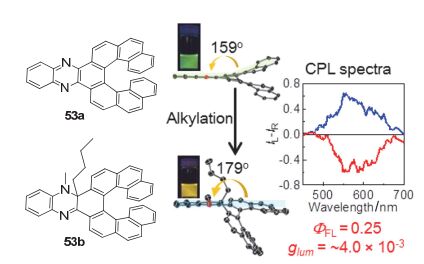
螺烯及其衍生物不仅具有良好的CPL性质, 而且通过骨架的改变及外部刺激响应等可以实现CPL性质的调控, 其中通过骨架的改变来调控手性螺烯衍生物的CPL性质是最直接的方法. 如图 22所示 [52] , 53a中喹喔啉片段与[7]螺烯片段之间的扭转角为159o, 其相应的绿色荧光的量子产率为0.05. 当53a烷基化后得到53b, 则喹喔啉片段与[7]螺烯几乎共平面. 由于部分去芳构化使得其发射黄色荧光, 量子产率增加到0.25. 更重要的是, 手性分子53b还表现出显著的圆偏振发光性质, 其不对称因子为4.0×10-3. 因此, 通过改变螺烯分子的骨架可便捷地实现手性发光性质的改变.
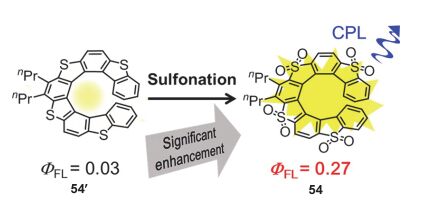
如图 23所示 [53] , 当量子产率极低(Φ=0.03)的硫杂[9]螺烯54'中四个硫被氧化成砜后, 可得到四砜[9]螺烯54. 该分子具有明显增大的荧光量子产率(Φ=0.27), 这主要是由于氧化后四砜 [9]螺烯54的辐射跃迁速率增大, 并且系间穿越速率减小. 此外, 四砜 [9]螺烯54还表现出显著的CPL性质(glum=8.3×10-4). 这一策略为进一步实现响应型圆偏振发光材料提供了新的视角.
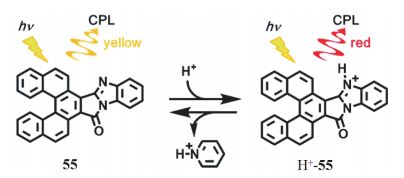
螺烯衍生物除了可以实现CPL性质从无到有的调控, 还可以实现不同发光颜色的调控. 如图 24所示 [54] , [5]螺烯并咪唑衍生物55自身呈现黄色CPL性质, 当质子加入后改变了分子内电荷转移程度, 进而显示出红色CPL性质. 当加入吡啶剥离质子后, 又可以回到原来的具有黄色CPL性质的分子, 从而方便地实现了CPL性质的可逆调控.
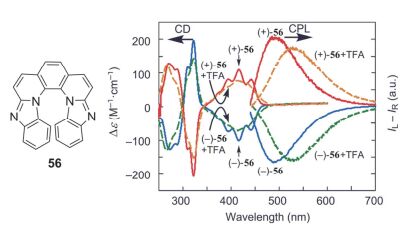
2017年Otani等 [55] 通过两步高效地得到了多氮杂[7]螺烯56(图 25), 发现56不仅具有高的消旋能垒, 其荧光量子产率在二氯甲烷中高达80%, 而且该分子的CPL不对称因子可达0.9×10-2.由于56中氮原子的存在, 所以当质子加入后, 通过氮原子的质子化-去质子化作用可以实现CD和CPL性质的可逆调控. 这种可逆响应性圆偏振发光分子, 为实现基于手性发光材料的刺激响应性识别、传感等应用研究提供了基础.
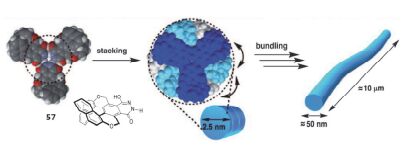
由于螺烯类衍生物是非平面的分子, 分子在聚集状态下不会因为分子间π-π堆积而发生荧光淬灭. 因此, 手性螺烯类衍生物不仅可以在溶液相呈现出显著的CPL性质, 其组装体甚至还可以增强其相应的CPL性质, 表现为组装体的不对称因子要比螺烯单体高一到两个数量级. 如图 26所示 [56] , 具有多氢键官能团化的螺烯衍生物57在甲苯、氯仿等非极性溶剂中可形成螺旋状纤维结构, M和P构型的单体所得纤维状自组装体呈现镜像对称CPL信号, 其|glum|在最大发射峰处为0.035. 该类手性组装体可用于高不对称因子的手性材料的构筑, 甚至可以媲美镧系配合物.
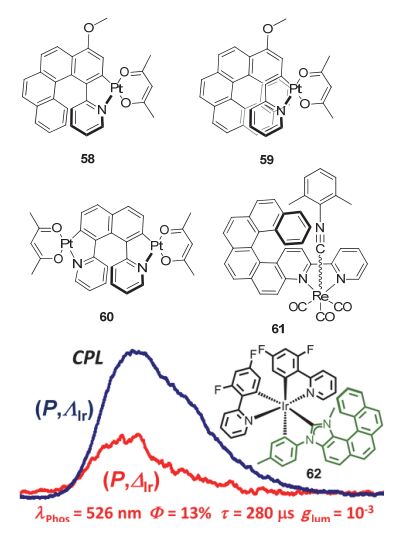
手性螺烯不仅可以实现常规的基于荧光发射的CPL, 还可用以构筑具有CPL性质的手性磷光分子体系. 所以当手性螺烯骨架上引入过渡金属铂(Pt), 铼(Re), 铱(Ir)等过渡金属, 可以很方便地得到具有圆偏振磷光性质的螺烯类衍生物. 如图 27所示, 手性螺烯骨架上引入过渡金属铂和铼后得到的手性分子58~61 [57] 不仅具有显著的磷光性质, 还具有CPL性质. 通过这种策略, 可以很方便地得到具有圆偏振磷光性质的螺烯类衍生物.
除了在骨架上引入过渡金属, 以手性螺烯作为金属配体可以诱导整个金属配合物产生圆偏振发光. 基于螺烯的氮杂卡宾配体可以使62 [58] 不仅表现出13%的磷光量子产率, 还表现出显著的CPL性质, 不对称因子为 10-3.因此, 基于螺烯骨架可以方便地得到具有圆偏振磷光性质的手性分子.
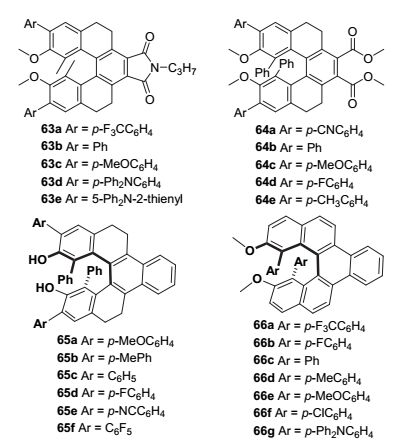
螺烯衍生物虽然可以方便地制得具有CPL性质的手性分子, 但是螺烯衍生物通常存在简单螺烯易于消旋、高级螺烯制备困难、以及发光效率偏低等问题. 为了解决这些问题, 如图 28所示, 最近我们课题组 [59] 通过在氢化[5]螺烯的1, 1'位引入两个甲基, 可以方便地得到不易消旋的手性螺旋骨架, 再通过引入内酰亚胺基团得到了一系列多官能团化的手性氢化[5]螺烯衍生物63a~63e. 由于这类分子具有显著的分子内推拉电子效应, 因此利用所引入芳基(Ar)的推拉电子能力不同, 成功地得到了一类具有全色CPL性质的手性分子 [60] . 随后, 我们把内酰亚胺换成吸电子能力较弱的酯基, 同时在1, 1'位引入更大位阻的苯基, 得到几乎不会消旋的分子64, 发现这类手性分子表现出优异的蓝光CPL性 质 [61] . 当吸电子片段换成苯基时, 我们得到的氢化螺烯衍生物65a~65f [62] , 不仅具有显著CPL性质, 其羟基的存在还可以实现对手性色氨酸甲酯的手性识别. 通过进一步芳构化我们还得到了1, 1'位含有不同大位阻基团的螺烯衍生物66a~66g [63] , 并发现其同样具有高的消旋能垒和显著CPL性质.
6 结论与展望
综上所述, 圆偏振发光手性有机小分子具有分子结构简单、发光效率高、种类多、易于衍生化等优点. 这类分子的手性类型可以为中心手性、轴手性、平面手性和螺旋手性. 在具有不同类型的手性小分子体系中, 基于联芳基骨架和螺烯衍生物的手性有机小分子显示出更为优异的圆偏振发光性质, 并且通过阴离子、质子等还可以实现其圆偏振发光性质的调控. 进一步地, 由手性有机小分子通过氢键、π-π等分子间相互作用自组装能够构筑具有大不对称因子的圆偏振发光手性组装体.
尽管圆偏振发光有诸多应用前景, 但目前受困于高效圆偏振发光材料的不足, 这很大程度上限制了该领域的发展. 现阶段圆偏振发光领域的研究主要集中在手性分子材料的构筑、调控以及组装研究. 手性有机小分子作为最有前景的圆偏振发光材料, 其相关报道日益增多, 但同时具有高效发光效率和高不对称因子的有机小分子依然少有报道. 而基于有机小分子的组装体虽然可有效地解决不对称因子低的不足, 但目前依然存在体系少、结构复杂、构效关系研究不足等问题. 因此, 我们认为基于手性有机小分子构筑圆偏振发光的研究在如下几个方面将是未来该领域发展的重点和难点: (1)具有高量子产率和高不对称因子的新型手性有机小分子体系的发展; (2)基于圆偏振发光的调控研究, 以及基于此在识别传感、生物探针等领域应用研究; (3)基于有机小分子构筑的具有圆偏振发光性质的纳米纤维、凝胶等组装体的研究; (4)基于圆偏振发光性质在3D显示、自旋信息通讯、信息存储与处理、CPL激光等光电材料以及在生物的3D成像等领域的应用研究. 因此, 挑战与机遇并存, 可以预期, 基于有机小分子及其组装体的圆偏振发光性质的探索具有重要的意义和广阔的应用前景.
-
-
[1]
(a) Brittain, H. G. Chirality 1996, 8, 357;(b) Riehl, J. P.; Richardson, F. S. Chem. Rev. 1986, 86, 1.
-
[2]
Muller, G. Luminescence of Lanthanide Ions in Coordination Compounds and Nanomaterials, Ed.: de Bettencourt-Dias, A., Wiley, Hoboken, 2014, pp. 77~124.
-
[3]
Yang, Y.; da Costa, R. C.; Smilgies, D.-M.; Campbell, A. J.; Fuchter, M. J. Adv. Mater. 2013, 25, 2624. doi: 10.1002/adma.201204961
-
[4]
Farshchi, R.; Ramsteiner, M.; Herfort, J.; Tahraoui, A.; Grahn, H. T. Appl. Phys. Lett. 2011, 98, 162508. doi: 10.1063/1.3582917
-
[5]
Yang, Y.; da Costa, R. C.; Fuchter, M. J.; Campbell, A. J. Nat. Photon. 2013, 7, 634. doi: 10.1038/nphoton.2013.176
-
[6]
Jiménez, J.; Cerdán, L.; Moreno, F.; Maroto, B. L.; García-Moreno, I.; Lunkley, J. L.; Muller, G.; de la Moya, S. J. Phys. Chem. C 2017, 121, 5287. doi: 10.1021/acs.jpcc.7b00654
-
[7]
(a) Muller, G. Dalton Trans. 2009, 9692;(b) Hassey, R.; Swain, E. J.; Hammer, N. I.; Venkataraman, D.; Barnes, M. D. Science 2006, 314, 1437.
-
[8]
Sanchez-Carnerero, E. M.; Agarrabeitia, A. R.; Moreno, F.; Maroto, B. L.; Muller, G.; Ortiz, M. J.; de la Moya, S. Chem. Eur. J. 2015, 21, 13488. doi: 10.1002/chem.v21.39
-
[9]
Lunkley, J. L.; Shirotani, D.; Yamanari, K.; Kaizaki, S.; Muller, G. J. Am. Chem. Soc. 2008, 130, 13814. doi: 10.1021/ja805681w
-
[10]
(a) Carr, R.; Evans, N. H.; Parker, D. Chem. Soc. Rev. 2012, 41, 7673;(b) Aspinall, H. C. Chem. Rev. 2002, 102, 1807;(c) Bunzli, J. C. G.; Piguet, C. Chem. Rev. 2002, 102, 1897;(d) Heffern, M. C.; Matosziuk, L. M.; Meade, T. J. Chem. Rev. 2014, 114, 4496.
-
[11]
(a) Yashima, E.; Ousaka, N.; Taura, D.; Shimomura, K.; Ikai, T.; Maeda, K. Chem. Rev. 2016, 116, 13752;(b) Watanabe, K.; Akagi, K. Sci. Technol. Adv. Mater. 2014, 15, 044203.
-
[12]
Emeis, C. A.; Oosterhoff, L. J. Chem. Phys. Lett. 1967, 1, 129. doi: 10.1016/0009-2614(67)85007-3
-
[13]
Barnett, C. J.; Drake, A. F.; Mason, S. F. Bull. Soc. Chim. Belg. 1979, 88, 853.
-
[14]
Kawai, T.; Kawamura, K.; Tsumatori, H.; Ishikawa, M.; Naito, M.; Fujiki, M.; Nakashima, T. ChemPhysChem 2007, 8, 1465. doi: 10.1002/(ISSN)1439-7641
-
[15]
Kumar, J.; Nakashima, T.; Kawai, T. J. Phys. Chem. Lett. 2015, 6, 3445. doi: 10.1021/acs.jpclett.5b01452
-
[16]
Gossauer, A.; Fehr, F.; Nydegger, F.; Stöckli-Evans, H. J. Am. Chem. Soc. 1997, 119, 1599. doi: 10.1021/ja961883q
-
[17]
Amako, T.; Nakabayashi, K.; Mori, T.; Inoue, Y.; Fujiki, M.; Imai, Y. Chem. Commun. 2014, 50, 12836. doi: 10.1039/C4CC04228J
-
[18]
Ito, S.; Ikeda, K.; Nakanishi, S.; Imai, Y.; Asami, M. Chem. Commun. 2017, 53, 6323. doi: 10.1039/C7CC01351E
-
[19]
Gobo, Y.; Yamamura, M.; Nakamura, T.; Nabeshima, T. Org. Lett. 2016, 18, 2719. doi: 10.1021/acs.orglett.6b01237
-
[20]
(a) Kumar, J.; Nakashima, T.; Tsumatori, H.; Mori, M.; Naito, M.; Kawai, T. Chem. Eur. J. 2013, 19, 14090;(b) Kumar, J.; Nakashima, T.; Kawai, T. Langmuir 2014, 30, 6030.
-
[21]
Sheng, Y.; Ma, J.; Liu, S.; Wang, Y.; Zhu, C.; Cheng, Y. Chem. Eur. J. 2016, 22, 9519. doi: 10.1002/chem.201600891
-
[22]
(a) Liu, M.; Zhang, L.; Wang, T. Chem. Rev. 2015, 115, 7304;(b) Zhang, L.; Wang, T.; Shen, Z.; Liu, M. Adv. Mater. 2016, 28, 1044.
-
[23]
Ikeda, T.; Masuda, T.; Hirao, T.; Yuasa, J.; Tsumatori, H.; Kawai, T.; Haino, T. Chem. Commun. 2012, 48, 6025. doi: 10.1039/c2cc31512b
-
[24]
Liu, J.; Su, H.; Meng, L.; Zhao, Y.; Deng, C.; Ng, J. C. Y.; Lu, P.; Faisal, M.; Lam, J. W. Y.; Huang, X.; Wu, H.; Wong, K. S.; Tang, B. Z. Chem. Sci. 2012, 3, 2737. doi: 10.1039/c2sc20382k
-
[25]
Li, H.; Cheng, J.; Deng, H.; Zhao, E.; Shen, B.; Lam, J. W. Y.; Wong, K. S.; Wu, H.; Li, B. S.; Tang, B. Z. J. Mater. Chem. C 2015, 3, 2399.
-
[26]
Ye, Q.; Zhu, D.; Zhang, H.; Lu, X.; Lu, Q. J. Mater. Chem. C 2015, 3, 6997. doi: 10.1039/C5TC00987A
-
[27]
Liu, S.; Li, F.; Wang, Y.; Li, X.; Zhu, C.; Cheng, Y. J. Mater. Chem. C 2017, 5, 6030. doi: 10.1039/C7TC01371J
-
[28]
Yang, D.; Duan, P.; Zhang, L.; Liu, M. Nat. Commun. 2017, 8, 15727. doi: 10.1038/ncomms15727
-
[29]
Kimoto, T.; Tajima, N.; Fujiki, M.; Imai, Y. Chem. Asian J. 2012, 7, 2836. doi: 10.1002/asia.201200725
-
[30]
(a) Kitayama, Y.; Nakabayashi, K.; Wakabayashi, T.; Tajima, N.; Fujiki, M.; Imai, Y. RSC Adv. 2015, 5, 410;(b) Kitayama, Y.; Amako, T.; Suzuki, N.; Fujiki, M.; Imai, Y. Org. Biomol. Chem. 2014, 12, 4342.
-
[31]
Kono, Y.; Nakabayashi, K.; Kitamura, S.; Kuroda, R.; Fujiki, M.; Imai, Y. Tetrahedron 2015, 71, 3985. doi: 10.1016/j.tet.2015.04.048
-
[32]
Sanchez-Carnerero, E. M.; Moreno, F.; Maroto, B. L.; Agarrabeitia, A. R.; Ortiz, M. J.; Vo, B. G.; Muller, G.; de la Moya, S. J. Am. Chem. Soc. 2014, 136, 3346. doi: 10.1021/ja412294s
-
[33]
Zhang, S.; Wang, Y.; Meng, F.; Dai, C.; Cheng, Y.; Zhu, C. Chem. Commun. 2015, 51, 9014. doi: 10.1039/C5CC01994J
-
[34]
Sheng, Y.; Shen, D.; Zhang, W.; Zhang, H.; Zhu, C.; Cheng, Y. Chem. Eur. J. 2015, 21, 13196. doi: 10.1002/chem.201502193
-
[35]
Wang, Y.; Li, X.; Li, F.; Sun, W.-Y.; Zhu, C.; Cheng, Y. Chem. Commun. 2017, 53, 7505. doi: 10.1039/C7CC04363E
-
[36]
Maeda, H.; Bando, Y.; Shimomura, K.; Yamada, I.; Naito, M.; Nobusawa, K.; Tsumatori, H.; Kawai, T. J. Am. Chem. Soc. 2011, 133, 9266. doi: 10.1021/ja203206g
-
[37]
(a) Tsumatori, H.; Nakashima, T.; Kawai, T. Org. Lett. 2010, 12, 2362;(b) Kumar, J.; Tsumatori, H.; Yuasa, J.; Kawai, T.; Nakashima, T. Angew. Chem. Int. Ed. 2015, 54, 5943.
-
[38]
Langhals, H.; Hofer, A.; Bernhard, S.; Siegel, J. S.; Mayer, P. J. Org. Chem. 2011, 76, 990. doi: 10.1021/jo102254a
-
[39]
Kogel, J. F.; Kusaka, S.; Sakamoto, R.; Iwashima, T.; Tsuchiya, M.; Toyoda, R.; Matsuoka, R.; Tsukamoto, T.; Yuasa, J.; Kitagawa, Y.; Kawai, T.; Nishihara, H. Angew. Chem. Int. Ed. 2016, 55, 1377. doi: 10.1002/anie.201509411
-
[40]
(a) Morisaki, Y.; Gon, M.; Sasamori, T.; Tokitoh, N.; Chujo, Y. J. Am. Chem. Soc. 2014, 136, 3350;(b) Gon, M.; Morisaki, Y.; Chujo, Y. J. Mater. Chem. C 2015, 3, 521.
-
[41]
Morisaki, Y.; Inoshita, K.; Chujo, Y. Chem. Eur. J. 2014, 20, 8386. doi: 10.1002/chem.201402930
-
[42]
Gon, M.; Morisaki, Y.; Chujo, Y. Chem. Commun. 2017, 53, 8304. doi: 10.1039/C7CC03615A
-
[43]
Shen, Y.; Chen, C.-F. Chem. Rev. 2012, 112, 1463. doi: 10.1021/cr200087r
-
[44]
Field, J. E.; Muller, G.; Riehl, J. P.; Venkataraman, D. J. Am. Chem. Soc. 2003, 125, 11808. doi: 10.1021/ja035626e
-
[45]
Sawada, Y.; Furumi, S.; Takai, A.; Takeuchi, M.; Noguchi, K.; Tanaka, K. J. Am. Chem. Soc. 2012, 134, 4080. doi: 10.1021/ja300278e
-
[46]
Nakamura, K.; Furumi, S.; Takeuchi, M.; Shibuya, T.; Tanaka, K. J. Am. Chem. Soc. 2014, 136, 5555. doi: 10.1021/ja500841f
-
[47]
Oyama, H.; Nakano, K.; Harada, T.; Kuroda, R.; Naito, M.; Nobusawa, K.; Nozaki, K. Org. Lett. 2013, 15, 2104. doi: 10.1021/ol4005036
-
[48]
Goto, K.; Yamaguchi, R.; Hiroto, S.; Ueno, H.; Kawai, T.; Shinokubo, H. Angew. Chem. Int. Ed. 2012, 51, 10333 doi: 10.1002/anie.201204863
-
[49]
Katayama, T.; Nakatsuka, S.; Hirai, H.; Yasuda, N.; Kumar, J.; Kawai, T.; Hatakeyama, T. J. Am. Chem. Soc. 2016, 138, 5210. doi: 10.1021/jacs.6b01674
-
[50]
Sakai, H.; Kubota, T.; Yuasa, J.; Araki, Y.; Sakanoue, T.; Takenobu, T.; Wada, T.; Kawai, T.; Hasobe, T. J. Phys. Chem. C 2016, 120, 7860. doi: 10.1021/acs.jpcc.6b01344
-
[51]
Shen, C.; Srebro-Hooper, M.; Jean, M.; Vanthuyne, N.; Toupet, L.; Williams, J. A. G.; Torres, A. R.; Riives, A. J.; Muller, G.; Autschbach, J.; Crassous, J. Chem. Eur. J. 2017, 23, 407. doi: 10.1002/chem.v23.2
-
[52]
Sakai, H.; Shinto, S.; Kumar, J.; Araki, Y.; Sakanoue, T.; Takenobu, T.; Wada, T.; Kawai, T.; Hasobe, T. J. Phys. Chem. C 2015, 119, 13937. doi: 10.1021/acs.jpcc.5b03386
-
[53]
Yamamoto, Y.; Sakai, H.; Yuasa, J.; Araki, Y.; Wada, T.; Sakanoue, T.; Takenobu, T.; Kawai, T.; Hasobe, T. J. Phys. Chem. C 2016, 120, 7421. doi: 10.1021/acs.jpcc.6b01123
-
[54]
Sakai, H.; Kubota, T.; Yuasa, J.; Araki, Y.; Sakanoue, T.; Takenobu, T.; Wada, T.; Kawai, T.; Hasobe, T. Org. Biomol. Chem. 2016, 14, 6738. doi: 10.1039/C6OB00937A
-
[55]
Otani, T.; Tsuyuki, A.; Iwachi, T.; Someya, S.; Tateno, K.; Kawai, H.; Saito, T.; Kanyiva, K. S.; Shibata, T. Angew. Chem. Int. Ed. 2017, 56, 3906 doi: 10.1002/anie.201700507
-
[56]
Kaseyama, T.; Furumi, S.; Zhang, X.; Tanaka, K.; Takeuchi, M. Angew. Chem. Int. Ed. 2011, 50, 3684. doi: 10.1002/anie.v50.16
-
[57]
(a) Shen, C.; Anger, E.; Srebro, M.; Vanthuyne, N.; Deol, K. K.; Jefferson, T. D., Jr.; Muller, G.; Williams, J. A. G.; Toupet, L.; Roussel, C.; Autschbach, J.; Reau, R.; Crassous, J. Chem. Sci. 2014, 5, 1915;(b) Saleh, N.; Srebro, M.; Reynaldo, T.; Vanthuyne, N.; Toupet, L.; Chang, V. Y.; Muller, G.; Williams, J. A. G.; Roussel, C.; Autschbach, J.; Crassous, J. Chem.Commun. 2015, 51, 3754.
-
[58]
Hellou, N.; Srebro-Hooper, M.; Favereau, L.; Zinna, F.; Caytan, E.; Toupet, L.; Dorcet, V.; Jean, M.; Vanthuyne, N.; Williams, J. A. G.; Di Bari, L.; Autschbach, J.; Crassous, J. Angew. Chem. Int. Ed. 2017, 56, 8236. doi: 10.1002/anie.v56.28
-
[59]
Shen, Y.; Lu, H.-Y.; Chen, C.-F. Angew. Chem. Int. Ed. 2014, 53, 4648. doi: 10.1002/anie.201400486
-
[60]
Li, M.; Lu, H.-Y.; Zhang, C.; Shi, L.; Tang, Z.; Chen, C.-F. Chem. Commun. 2016, 52, 9921. doi: 10.1039/C6CC04674F
-
[61]
He, D.-Q.; Lu, H.-Y.; Li, M.; Chen, C.-F. Chem. Commun. 2017, 53, 6093. doi: 10.1039/C7CC01882G
-
[62]
Fang, L.; Li, M.; Lin, W.-B.; Shen, Y.; Chen, C.-F. J. Org. Chem. 2017, 82, 7402. doi: 10.1021/acs.joc.7b01087
-
[63]
Lin, W.-B.; Li, M.; Fang, L.; Shen, Y.; Chen, C.-F. Chem. Asian J. 2017, 12, 86. doi: 10.1002/asia.v12.1
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 874
- 文章访问数: 19058
- HTML全文浏览量: 6778


 下载:
下载:



























 下载:
下载:

