 图式1
手性酰亚胺的合成路线
Scheme1.
Synthetic method of chiral maleimide
图式1
手性酰亚胺的合成路线
Scheme1.
Synthetic method of chiral maleimide

Citation: Fu Liyan, Ji Baoming, Du Chenxia. Synthesis of a New Class of Chiral Maleimide Derivatives with C2-Symmetry[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2685-2689. doi: 10.6023/cjoc201703001

一类具有C2对称性的轴手性马来酰亚胺类化合物的合成
English
Synthesis of a New Class of Chiral Maleimide Derivatives with C2-Symmetry
-
Key words:
- imide
- / BINOL
- / organic synthesis
- / chirality
-
手性1, 1'-联二萘酚(简称BINOL)及其衍生物是一类具有C2对称性的轴手性化合物, 因其独特的立体化学性质, 可同时作为手性配体或有机小分子催化剂广泛应用于不对称催化和手性识别研究[1].例如不对称Diels-Alder反应、杂Diels-Alder反应、不对称烷基化反应、不对称羟醛缩合反应等.以具有C2对称性的BINOL作为手性源, 对其酚羟基进行修饰或取代, 并在其萘环上2, 2'和3, 3'位引入官能团是一种制作新型手性有机小分子催化剂的经典方法[2].例如近十年受到广泛关注的手性磷酸类有机小分子催化剂[3~6], 就是利用联萘基团提供手性源并连接催化活性基团.
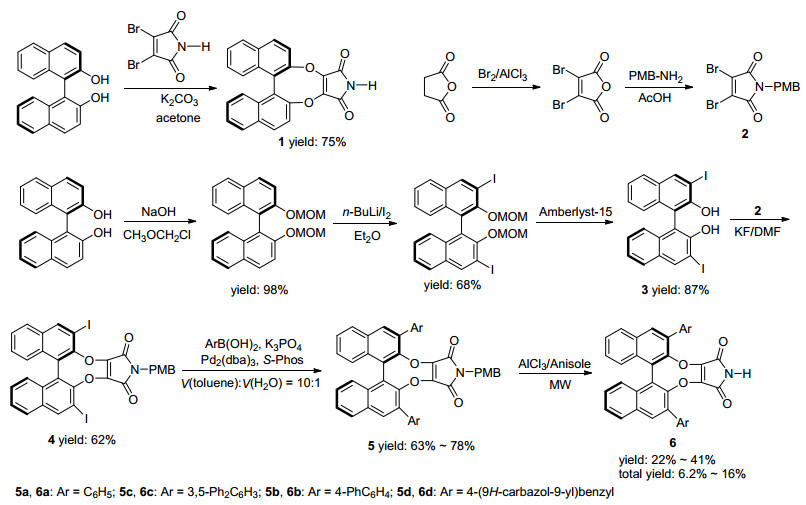
马来酰亚胺, 即顺丁烯二酰亚胺, 含有两个羰基和一个N-H键结构, 其衍生物因其生物活性[7]广泛应用于抗癌[8~12]、心血管疾病[13]、糖尿病[14, 15]等医药领域, 具有手性时还可作为手性催化剂[16]和手性助剂[17]应用于不对称催化. Brenet等[16, 18]首次将BINOL作为手性源与马来酰亚胺结构相结合, 合成了一系列具有C2对称性的轴手性酰亚胺化合物, 并将其应用于催化不对称反应.在其报道中仅有化合物1 (Scheme 1), 具有N—H结构, 而在BINOL萘环上进行修饰的酰亚胺类化合物至今未见文献报道.因此, 制备这一类新的C2对称性的轴手性酰亚胺化合物并探究其催化活性具有重要的理论和现实意义.本文以廉价易得的(R)-BINOL和顺丁烯二酸酐为起始原料, 经过Williamson醚合成法、Suzuki偶联反应、脱保护基等6步反应合成了一系列具有C2对称性的轴手性酰亚胺类化合物6a, 6b, 6c和6d, 合成路线见Scheme 1.
1 结果与讨论
1.1 路线设计与中间体的合成
在Brenet等[18]的报道中, 化合物1直接使用(R)-BINOL与3, 4-二溴马来酰亚胺反应, 在N, N-二甲基甲酰胺(DMF)中, 以Na2CO3作碱, 通过Williamson醚合成法, 收率仅有16%.而我们直接使用(R)-BINOL与3, 4-二溴马来酰亚胺反应, 在无水丙酮中, 以K2CO3作碱, 化合物1的收率可以提高到75%. 图 1为其分子晶体结构(CCDC号1546521).然而我们在参照1的合成方法利用BINOL衍生物3与3, 4-二溴马来酰亚胺反应制备6的衍生物时, 发现3, 4-二溴马来酰亚胺会发生分解, 此现象和文献报道[18]的结果相吻合.无论是用无水丙酮、DMF或乙腈作溶剂, K2CO3、KF或三乙胺作碱都无法得到目标产物.
因此, 我们改变了合成路线, 以顺丁烯二酸酐为原料制备了带有N-PMB保护基的3, 4-二溴马来酰亚胺衍生物2[19], 通过Williamson醚合成法, 2与化合物3反应, 用无水DMF作溶剂, KF作碱, 以62%的收率成功制备了中间体化合物4, 进一步利用各种各样的芳基硼酸与化合物4进行的Suzuki偶联反应得到了中间体5a~5d.当芳基为2-蒽基、3-菲基、1-芘基芳基硼酸时没有得到相应的化合物5, 推测原因可能是芳基硼酸的芳基基团空间位阻过大所致.
1.2 保护基的脱除
尽管PMB是常用的酰胺保护基之一[20], 化合物5a在Anisole/AlCl3[21]、Anisole/TFA[12, 22]、TFA[22, 23]、CAN[24]、甲磺酸[13]、HCl/1, 4-二氧六环[20]、n-BuLi/ O2[10, 25]、Pd(OH)2/H2[11]等多种反应体系中, 均无法脱除PMB保护基.最终我们在Anisole/AlCl3体系中, 微波作用下成功地脱除了化合物5的PMB保护基[12], 制得化合物6a(表 1).
Compd. Yield a/% Total yield b/% 6a 41 9.3 6b 30 7.0 6e 61 16 6f 22 6.2 aIsolated yield; b(R)-BINOL as the starting compound. 在得到最终产物后, 我们尝试将其作为有机小分子催化剂应用于环氧化物的不对称开环[26, 27]反应和环状酮的不对称Baeyer-Villiger氧化反应[5, 6]中, 遗憾的是所得产物均接近外消旋体.
2 结论
以顺丁烯二酸酐和(R)-BINOL为起始原料, 制备了一系列具有C2对称性的轴手性酰亚胺类化合物, 该类化合物结构较为新颖, 有作为手性配体和有机小分子催化剂的发展前景.本文中经过大量实验筛选出的反应体系, 为合成手性酰亚胺类化合物提供了一种有效、稳定的新途径.
3 实验部分
3.1 仪器与试剂
瑞士BRUKER公司AVANCE 400 MHz核磁共振仪; 美国CEM公司DISCOVER SP单模微波合成仪; 美国Agilent公司1290-6540 Q-Tof超高效液相-高分辨质谱联用仪, ESI为离子源; 日本岛津SHIMADZU公司IRAffinity-1S傅立叶变换红外光谱仪(KBr压片法测定); 美国Perkin Elmer股份有限公司341号旋光仪; 北京福凯仪器有限公司X-6A精密显微熔点仪.所用试剂均为市售化学纯或分析纯, 所用无水试剂均经实验室再次除水后使用.
3.2 实验方法
3.2.1 3, 4-[(R)-(1, 1'-联萘)-2, 2'-二氧基]-马来酰亚胺(1)的合成
在氮气氛下, 将0.858 g (3.0 mmol) (R)-BINOL和0.828 g (6.0 mmol) K2CO3置于100 mL圆底烧瓶中, 然后加入60 mL无水丙酮, 搅拌回流状态下滴入溶有0.765 g (3.0 mmol) 3, 4-二溴马来酰亚胺的20 mL丙酮溶液, 搅拌回流5 h后再补加0.153 g (0.6 mmol) 3, 4-二溴马来酰亚胺, 继续反应3 h, 薄层色谱(TLC)检测反应完毕, 冷却至室温.减压除去溶剂丙酮, 向残余物中加入适量蒸馏水(约30 mL), 然后用二氯甲烷萃取(25 mL×4), 合并有机相, 饱和食盐水洗涤, 无水Na2SO4干燥, 柱色谱分离[V(乙酸乙酯):V(石油醚)=1:6]得白色固体0.853 g, 产率75%. m.p.>290 ℃(文献值[18] m.p.>350 ℃); [α]D12+313.9 (c 0.60, CDCl3); 1H NMR (400 MHz, CDCl3) δ: 8.06 (d, J=8.8 Hz, 2H), 7.96 (d, J=8.2 Hz, 2H), 7.54~7.49 (m, 4H), 7.31 (t, J=7.6 Hz, 2H), 7.12 (d, J=8.5 Hz, 2H), 6.84 (bs, 1H).
3.2.2 部分中间体的合成
N-PMB保护的3, 4-二溴马来酰亚胺(2)和(R)-BINOL衍生物3参照文献[4, 15, 28]的方法合成.
3.2.3 N-对甲氧基苄基-3, 4-[(R)-3, 3'-二碘-1, 1'-联萘-2, 2'-二氧基]-马来酰亚胺(4)的合成
在氮气氛下, 将0.375 g (1.0 mmol) N-对甲氧基苄基-3, 4-二溴马来酰亚胺(2)、0.592 g (1.1 mmol) (R)-3, 3'-二碘-2, 2'-二羟基-1, 1'-联萘(3)和0.581 g (10.0 mmol)氟化钾置于25 mL圆底烧瓶中, 加入10 mL无水DMF, 油浴加热至75 ℃, 搅拌反应24 h, 冷至室温, 向体系中加入20 mL蒸馏水, 用乙酸乙酯萃取(15 mL×4), 合并有机相, 用饱和食盐水充分洗涤, 无水Na2SO4干燥, 柱色谱分离[V(乙酸乙酯):V(石油醚)=1:25]得黄色固体0.466 g, 产率62%. m.p. 183~185 ℃; [α]D12+255.7 (c 0.60, CDCl3); 1H NMR (400 MHz, CDCl3) δ: 8.59 (s, 2H), 7.83 (d, J=8.2 Hz, 2H), 7.53~7.47 (m, 2H), 7.35~7.27 (m, 4H), 7.01 (d, J=8.4 Hz, 2H), 6.86~6.81 (m, 2H), 4.72~4.58 (m, 2H), 3.78 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 163.5, 159.4, 149.3, 141.8, 137.1, 133.3, 132.7, 130.0, 128.4, 128.0, 127.3, 127.3, 126.6, 124.6, 114.2, 87.9, 55.4, 41.0; IR (KBr) ν: 3033, 1727, 1506, 1396, 1230, 975, 754 cm-1. HRMS (ESI+) calcd for C32H20I2NO5 [M+H]+ 751.9425; found 751.9427.
3.2.4 偶联产物5a~5d的合成
在氮气氛下, 将N-对甲氧基苄基-3, 4-[(R)-3, 3'-二碘-1, 1'-联萘-2, 2'-二氧基]-马来酰亚胺(4) (1.0 mmol)、有机硼酸(3.0 mmol)、Pd2(dba)3 (55 mg, 0.05 mmol)、S-Phos (50 mg, 0.1 mmol)和磷酸钾(1.3 g, 6.0 mmol)置于25 mL圆底烧瓶中, 加入10 mL甲苯和1 mL水, 加热至50 ℃, 搅拌反应5 h, TLC检测反应完毕, 冷至室温, 减压除去部分溶剂, 向残余物中加入20 mL水, 用二氯甲烷萃取(15 mL×4), 合并有机相, 饱和食盐水洗涤, 无水Na2SO4干燥, 柱色谱分离[V(乙酸乙酯):V(石油醚)=1:20] (5a~5c)及[V(二氯甲烷):V(石油醚)=1:4] (5d)得目标产物.
N-对甲氧基苄基-3, 4-[(R)-3, 3'-二苯基-1, 1'-联萘-2, 2'-二氧基]-马来酰亚胺(5a):黄色固体, 产率63%. m.p. 216~217 ℃; [α]D12+261.1 (c 0.60, CDCl3); 1H NMR (400 MHz, CDCl3) δ: 8.04 (s, 2H), 7.97 (d, J=8.2 Hz, 2H), 7.56~7.51 (m, 6H), 7.43~7.42 (m, 6H), 7.36 (t, J=7.5 Hz, 2H), 7.29~7.25 (m, 2H), 6.91 (d, J=8.5 Hz, 2H), 6.73 (d, J=8.6 Hz, 2H), 4.25 (d, J=14.8 Hz, 1H), 4.19(d, J=14.8 Hz, 1H), 3.77 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 163.2, 159.2, 148.7, 138.0, 136.2, 134.4, 132.5, 132.1, 132.0, 130.2, 129.7, 128.7, 128.4, 128.3, 128.1, 127.3, 126.8, 126.7, 125.0, 113.9, 55.4, 40.2; IR (KBr) ν: 3044, 1717, 1672, 1506, 1396, 1233, 743 cm-1. HRMS (ESI+) calcd for C44H30NO5 [M+H]+ 652.2119, found 652.2120.
N-对甲氧基苄基-3, 4-[(R)-3, 3'-二(4-苯基苯基)-1, 1'-联萘-2, 2'-二氧基]-马来酰亚胺(5b):浅黄色固体, 产率65%. m.p. 198~200 ℃; [α]D12+35.9 (c 0.60, CDCl3); 1H NMR (400 MHz, CDCl3) δ: 8.12 (s, 2H), 8.00 (d, J=8.2 Hz, 2H), 7.71~7.68 (m, 4H), 7.66 (d, J=3.8 Hz, 8H), 7.58~7.53 (m, 2H), 7.48 (t, J=7.6 Hz, 4H), 7.38 (ddd, J=7.4, 2.5, 1.3 Hz, 4H), 7.31 (d, J=8.4 Hz, 2H), 6.87 (d, J=8.7 Hz, 2H), 6.63~6.57 (m, 2H), 4.19 (s, 2H), 3.67 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 163.1, 159.1, 148.8, 141.0, 140.8, 138.1, 135.1, 133.9, 132.5, 132.1, 130.6, 129.7, 128.9, 128.7, 128.5, 127.5, 127.4, 127.0, 126.8, 126.7, 125.2, 113.8, 55.3, 40.3; IR (KBr) ν: 3022, 1717, 1672, 1506, 1385, 1241, 754 cm-1, HRMS (ESI+) calcd for C56H38NO5 [M+H]+ 804.2745, found 804.2743.
N-对甲氧基苄基-3, 4-[(R)-3, 3'-二(3, 5-二苯基苯基)-1, 1'-联萘-2, 2'-二氧基]-马来酰亚胺(5c):白色固体, 产率75%. m.p. 209~211 ℃; [α]D12+65.7 (c 0.60, CDCl3); 1H NMR (400 MHz, CDCl3) δ: 8.21 (s, 2H), 8.03 (d, J=8.2 Hz, 2H), 7.90 (t, J=1.6 Hz, 2H), 7.84 (d, J=1.6 Hz, 4H), 7.79 (d, J=1.3 Hz, 4H), 7.77 (s, 4H), 7.60~7.55 (m, 2H), 7.48 (s, 2H), 7.46 (s, 4H), 7.44 (s, 2H), 7.40 (d, J=1.1 Hz, 1H), 7.38 (d, J=1.3 Hz, 2H), 7.36 (d, J=2.2 Hz, 3H), 7.35 (d, J=1.1 Hz, 1H), 7.34 (s, 1H), 6.63 (d, J=8.6 Hz, 2H), 6.23 (d, J=8.7 Hz, 2H), 4.17 (d, J=14.9 Hz, 1H), 3.43 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 163.0, 158.8, 148.7, 141.8, 141.3, 138.1, 136.9, 134.2, 132.5, 132.2, 132.1, 129.2, 128.9, 128.5, 128.3, 128.2, 127.6, 127.6, 127.5, 126.9, 126.7, 125.8, 125.3, 113.7, 55.1, 39.9; IR (KBr) ν: 3033, 1717, 1661, 1506, 1385, 1218, 754 cm-1. HRMS (ESI+) calcd for C68H46NO5 [M+H]+ 956.3371, found 956.3369.
N-对甲氧基苄基-3, 4-{(R)-3, 3'-二[4-(9H-咔唑-9-基)苯基]-1, 1'-联萘-2, 2'-二氧基}-马来酰亚胺(5d):白色片状固体, 产率78%. m.p. 247~249 ℃; [α]D12+58.6 (c 0.60, CDCl3); 1H NMR (400 MHz, CDCl3) δ: 8.24~8.19 (m, 6H), 8.09 (d, J=7.6 Hz, 2H), 7.80 (d, J=6.4 Hz, 4H), 7.70~7.59 (m, 10H), 7.52~7.46 (m, 8H), 7.36~7.28 (m, 4H), 6.91 (d, J=6.8 Hz, 2H), 6.32 (d, J=6.8 Hz, 2H), 4.32 (d, J=14.0 Hz, 1H), 4.22 (d, J=14.8 Hz, 1H), 3.27 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 162.9, 159.0, 148.8, 141.1, 138.3, 137.6, 135.1, 133.7, 132.6, 132.0, 131.9, 131.7, 129.8, 128.6, 128.3, 127.6, 127.1, 127.0, 126.8, 126.1, 125.2, 123.5, 120.4, 120.1, 113.7, 110.3, 54.8, 40.5; IR (KBr) ν: 3056, 1727, 1528, 1440, 1318, 1230, 743 cm-1; HRMS (ESI+) calcd for C68H44N3O5 [M+H]+ 982.3275, found 982.3276.
3.2.3 手性马来酰亚胺衍生物6a~6d的合成
分别将偶联产物5a~5d (1.0 mmol)和无水AlCl3 (5.0 mmol)置于15 mL微波反应瓶中, 加入10 mL苯甲醚, 10 min加热至145 ℃反应40 min, 功率200 Hz, 冷至室温, 然后向体系中加入20 mL乙酸乙酯和20 mL水, 分出有机相, 水相用乙酸乙酯萃取(15 mL×4), 合并有机相, 用饱和食盐水洗涤, 无水硫酸钠干燥, 柱色谱分离[V(乙酸乙酯):V(石油醚)=1:20] (6a~6c)及[V(二氯甲烷):V(石油醚)=1:4](6d), 得目标化合物6a~6d.
3, 4-[(R)-3, 3'-二苯基-1, 1'-联萘-2, 2'-二氧基]-马来酰亚胺(6a):浅黄色固体, 产率41%. m.p. 249~250 ℃; [α]D12+313.9 (c 0.60, CDCl3); 1H NMR (400 MHz, CDCl3) δ: 8.11 (s, 2H), 8.03 (d, J=8.0 Hz, 2H), 7.63 (d, J=8.0 Hz, 4H), 7.58 (t, J=7.4 Hz, 2H), 7.50~7.39 (m, 8H), 7.33 (d, J=8.4 Hz, 2H), 6.53 (s, 1H); 13C NMR (100 MHz, CDCl3) δ: 162.5, 148.5, 138.4, 136.1, 134.3, 132.5, 132.2, 132.1, 130.2, 128.5, 128.4, 128.2, 127.4, 126.8, 126.7, 125.0; IR (KBr) ν: 3052, 1732, 1683, 1506, 1418, 1312, 1201, 758, 687 cm-1; HRMS (ESI+) calcd for C36H22NO4 [M+H]+ 532.1543, found 532.1545.
3, 4-[(R)-3, 3'-二(4-苯基苯基)-1, 1'-联萘-2, 2'-二氧基]-马来酰亚胺(6b):浅黄色固体, 产率30%. m.p. 245~247 ℃; [α]D12-24.7 (c 0.60, CDCl3); 1H NMR (400 MHz, CDCl3) δ: 8.16 (s, 2H), 8.16 (s, 2H), 8.03 (d, J=8.2 Hz, 2H), 8.03 (d, J=8.2 Hz, 2H), 7.88~7.63 (m, 13H), 7.75~7.66 (m, 12H), 7.60~7.54 (m, 2H), 7.62~7.51 (m, 2H), 7.45 (t, J=7.6 Hz, 4H), 7.51~7.25 (m, 12H), 7.41~7.29 (m, 6H), 6.38 (s, 1H), 6.38 (s, 1H); 13C NMR (100 MHz, CDCl3) δ: 162.5, 148.6, 140.9, 140.8, 138.4, 135.0, 133.8, 132.6, 132.2, 132.1, 130.7, 128.9, 128.5, 127.5, 127.4, 127.3, 127.1, 126.9, 126.7, 125.2; IR (KBr) ν: 3052, 1744, 1661, 1489, 1330, 1201, 754 cm-1. HRMS (ESI+) calcd for C48H30NO4 [M+H]+ 684.2169, found 684.2171.
3, 4-[(R)-3, 3'-二(3, 5-二苯基苯基)-1, 1'-联萘-2, 2'-二氧基]-马来酰亚胺(6c):白色固体, 产率61%. m.p. 253~255 ℃; [α]D12-47.9 (c 0.60, CDCl3); 1H NMR (400 MHz, CDCl3) δ: 8.27 (s, 2H), 8.08 (d, J=8.4 Hz, 2H), 7.89~7.88 (m, 6H), 7.79~7.77 (m, 8H), 7.62 (d, J=6.8 Hz, 1H), 7.60 (d, J=6.8 Hz, 1H), 7.47~7.42 (m, 11H), 7.39~7.34 (m, 5H), 6.42 (s, 1H); 13C NMR (100 MHz, CDCl3) δ: 171.3, 162.5, 148.6, 141.9, 141.2, 138.5, 136.7, 134.1, 132.6, 132.3, 132.2, 128.9, 128.6, 128.2, 127.6, 127.0, 126.7, 125.9, 125.3; IR (KBr) ν: 3033, 1738, 1506, 1318, 1207, 842, 743 cm-1. HRMS (ESI+) calcd for C60H38NO4 [M+H]+ 836.2795, found 836.2793.
3, 4-{(R)-3, 3'-二[4-(9H-咔唑-9-基)苯基]-1, 1'-联萘-2, 2'-二氧基}-马来酰亚胺(6d):白色固体, 产率22%. m.p. 284~286 ℃; [α]D12-26.6 (c 0.60, CDCl3); 1H NMR (400 MHz, CDCl3) δ: 8.25 (s, 2H), 8.16 (d, J=7.7 Hz, 4H), 8.09 (d, J=8.2 Hz, 2H), 7.88 (d, J=8.4 Hz, 4H), 7.69 (d, J=8.4 Hz, 4H), 7.65~7.57 (m, 6H), 7.45 (dd, J=11.4, 4.1 Hz, 6H), 7.38 (d, J=8.4 Hz, 2H), 7.30 (dd, J=11.0, 3.9 Hz, 4H), 6.48 (s, 1H); 13C NMR (100 MHz, CDCl3) δ: 162.4, 148.5, 141.1, 138.6, 137.7, 135.0, 133.5, 132.7, 132.1, 131.8, 128.6, 127.7, 127.1, 126.8, 126.2, 125.2, 123.6, 120.4, 120.1, 110.1; IR (KBr) ν: 3056, 1750, 1518, 1440, 1318, 1218, 743 cm-1, HRMS (ESI+) calcd for C60H36N3O4 [M+H]+ 862.2700, found 862.2702.
辅助材料(Supporting Information)新化合物的1H NMR和13C NMR谱图, 化合物1的晶体结构数据.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
胡跃飞, 现代有机合成试剂, 第四卷, 化学工业出版社, 北京, 2011, p. 97.Hu, Y.-F. In Modern Organic Synthesis Reagents, Vol. 4, Chemical Industry Press, Beijing, 2011, p. 97 (in Chinese).
-
[2]
Pu, L. Chem. Rev. 1998, 98, 2405. doi: 10.1021/cr970463w
-
[3]
高勇军, 杨丽华, 宋双居, 马晶军, 唐然肖, 边瑞环, 刘海燕, 吴秋华, 王春, 有机化学, 2008, 28, 8. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract330956.shtmlGao, Y.-J.; Yang, L.-H.; Song, S.-J.; Ma, J.-J.; Tang, R.-X.; Bian, R.-H.; Liu, H.-Y.; Wu, Q.-H.; Wang, C. Chin. J. Org. Chem. 2008, 28, 8(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract330956.shtml
-
[4]
Chen, Y. Y.; Jiang, Y. J.; Fan, Y. S.; Sha, D.; Wang, Q. F.; Zhang, G.; Zheng, L.; Zhang, S. Tetrahedron:Asymmetry 2012, 23, 904. doi: 10.1016/j.tetasy.2012.06.008
-
[5]
Xu, S.; Wang, Z.; Zhang, X.; Ding, K. Eur. J. Org. Chem. 2011, 110.
-
[6]
Xu, S.; Wang, Z.; Li, Y.; Zhang, X.; Wang, H.; Ding, K. Chem.-Eur. J. 2010, 16, 3021. doi: 10.1002/chem.v16:10
-
[7]
Sengoku, T.; Murata, Y.; Aso. Y.; Kawakami, A.; Inuzuka, T.; Sakamoto, M.; Takahashi, M.; Yoda, H. Org. Lett. 2015, 17, 5846. doi: 10.1021/acs.orglett.5b03021
-
[8]
Marminon, C.; Pierre, A.; Pfeiffer, B.; Perez, V.; Leonce, S.; Renard, P.; Prudhomme, M. Bioorg. Med. Chem. 2003, 11, 679. doi: 10.1016/S0968-0896(02)00532-1
-
[9]
Wang, K.; Yan, Z.; Wang, N.; Liu, Z. Z. Chin. Chem. Lett. 2012, 23, 462. doi: 10.1016/j.cclet.2012.01.033
-
[10]
Rigby, J. H.; Mateo, M. E. J. Am. Chem. Soc. 1997, 119, 12655. doi: 10.1021/ja972950z
-
[11]
Rigby, J. H.; Maharoof, U. S. M.; Meteo, M. E. J. Am. Chem. Soc. 2000, 122, 6624. doi: 10.1021/ja000930i
-
[12]
Awuah, E.; Capretta, A. J. Org. Chem. 2011, 76, 3122. doi: 10.1021/jo1025805
-
[13]
Chung, J. Y. L.; Cai, C.; McMilliams, J. C.; Reamer, B. A.; Peter, G. D.; Cvetovich, R. J. J. Org. Chem. 2005, 70, 10342. doi: 10.1021/jo0514927
-
[14]
Bartlett, S.; Nelson, A.; Org. Biomol. Chem. 2004, 2, 2874. doi: 10.1039/b405010j
-
[15]
Shen, L.; Prouty, C.; Conway, B. R.; Westover, L.; Xu, J. Z.; Look, R. A.; Chen, X.; Beavers, M. P.; Roberts, J.; Murray, W. V.; Demarest, K. T.; Kuo, H. Bioorg. Med. Chem. 2004, 12, 1239. doi: 10.1016/j.bmc.2003.09.047
-
[16]
Brenet, S.; Berthiol, F.; Einhorn, J. Eur. J. Org. Chem. 2013, 8094.
-
[17]
Paik, S.; Lee, J. Y. Tetrahedron Lett. 2006, 47, 1813. doi: 10.1016/j.tetlet.2006.01.019
-
[18]
Brenet, S.; Baptiste, B.; Philouze, C.; Berthiol, F.; Einhorn, J. Eur. J. Org. Chem. 2013, 1041.
-
[19]
Dubernet, M.; Caubert, V.; Guillard, J.; Claude, M.; Massuard, V. Tetrahedron. 2005, 61, 4585. doi: 10.1016/j.tet.2005.03.016
-
[20]
Wuts. P. G. M.; Greene, T. W. Greene's Protective Groups in Organic Synthesis, John Wiley & Sons, New Jersey, 2007, p. 905.
-
[21]
Akiyama, T.; Takesue, Y.; Kumegawa, M.; Nishimoto, H.; Ozaki, S. Bull. Chem. Soc. Jpn. 1991, 64, 2266. doi: 10.1246/bcsj.64.2266
-
[22]
Banwell, M. G.; Hamel, E.; Hockless, D. C. R.; Verdier-Pinard, P.; Willis, A. C.; Wong, D. J. Bioorg. Med. Chem. 2006, 14, 4627. doi: 10.1016/j.bmc.2006.02.018
-
[23]
Subramanyam, C. Synth. Commun. 1995, 25, 761. doi: 10.1080/00397919508011414
-
[24]
Zhou, X.; Liu, W. J.; Ye, J. L.; Huang, P. Q. Tetrahedron 2007, 63, 6346. doi: 10.1016/j.tet.2007.02.087
-
[25]
Williams, R. M.; Glinka, T.; Kwast. E.; Coffman, H.; Stille, J. K. J. Am. Chem. Soc. 1990, 112, 808. doi: 10.1021/ja00158a048
-
[26]
Kumar, M.; Kukhsana, I. K.; Saravanan, S.; Verma, S.; Jakhar, A.; Khan, N. H.; Abdi, S. H.; Bajaj, H. C. Org. Lett. 2014, 16, 2798. doi: 10.1021/ol500699c
-
[27]
Roy, S.; Bhanja, P.; Islam, S. S.; Bhaumik, A.; Islam, S. M. Chem. Commun. 2016, 52, 1871. doi: 10.1039/C5CC08675B
-
[28]
Goldys, A.; McErlean, C. S. P. Tetrahedron Lett. 2009, 50, 3985. doi: 10.1016/j.tetlet.2009.04.092
-
[1]
-
表 1 化合物6的产率
Table 1. Yield of compound 6
Compd. Yield a/% Total yield b/% 6a 41 9.3 6b 30 7.0 6e 61 16 6f 22 6.2 aIsolated yield; b(R)-BINOL as the starting compound. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 10
- 文章访问数: 2516
- HTML全文浏览量: 172



 下载:
下载:

 下载:
下载:

