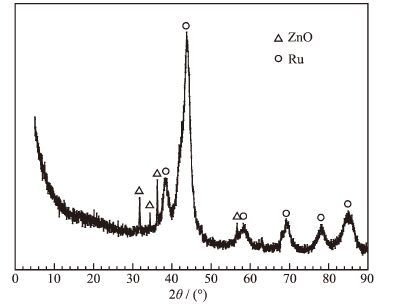
 图 1
Ru-Zn催化剂的XRD图
Figure 1.
XRD pattern of the Ru-Zn catalyst
图 1
Ru-Zn催化剂的XRD图
Figure 1.
XRD pattern of the Ru-Zn catalyst

Citation: SUN Hai-Jie, QIN Hui-An, HUANG Zhen-Xu, SU Man-Fei, LI Yong-Yu, LIU Zhong-Yi, LIU Shou-Chang. Effect of Reaction Modifier ZnSO4 and Pretreatment on Performance of Ru-Zn Catalyst for Selective Hydrogenation of Benzene to Cyclohexene[J]. Chinese Journal of Inorganic Chemistry, 2017, 33(1): 73-80. doi: 10.11862/CJIC.2016.283

反应修饰剂ZnSO4和预处理对苯选择加氢制环己烯Ru-Zn催化剂性能的影响
English
Effect of Reaction Modifier ZnSO4 and Pretreatment on Performance of Ru-Zn Catalyst for Selective Hydrogenation of Benzene to Cyclohexene
-
Key words:
- benzene
- / selective hydrogenation
- / cyclohexene
- / Ru
- / Zn
- / reaction modifier
- / pretreatment
-
己内酰胺和己二酸是尼龙-6和尼龙-66的单体,广泛应用纺织、汽车、电子等行业,是现代化学工业的基本原料[1-2]。从苯选择加氢制环己烯出发制备己内酰胺和己二酸具有安全、节能、环保、碳原子利用率高等优点,引起人们的广泛关注[3]。然而,热力学上苯加氢反应更倾向于生成环己烷[4]。因此,只能从动力学解决这一挑战,即开发高活性高选择的苯选择加氢制环己烯催化剂。
反应修饰剂是提高苯选择加氢制环己烯Ru基催化剂环己烯选择性的主要途径之一。苯选择加氢制环己烯Ru催化剂的反应修饰剂主要包括无机盐(如ZnSO4[5]、FeSO4或CdSO4[6])、无机碱(如NaOH[4, 7])、胺类(如乙二胺或二乙醇胺[8])和醇类(如聚乙二醇[8-9])等。其中,ZnSO4作反应修饰剂Ru催化剂上环己烯收率最高。Sun等利用ZnSO4作反应修饰剂分别在Ru-Mn催化剂[10]、Ru-Co-B/ZrO2催化剂[11]和Ru-Zn催化剂[12]上分别获得了61.3%、62.8%和59.6%的环己烯收率。然而关于反应修饰剂ZnSO4的作用机理至今没有相关文献报道。
预处理也是提高苯选择加氢制环己烯Ru基催化剂环己烯选择性的途径之一。预处理是将催化剂在反应修饰剂ZnSO4溶液中于反应条件下保持1 h或更长的时间,工业运行为22 h[13].Sun等[9]在反应修饰剂ZnSO4溶液中对Ru-Zn催化剂预处理了22 h获得了64.5%的环己烯收率。然而关于预处理在提高Ru基催化剂环己烯选择性所起的作用也没有文献报道。
本文正是在此基础上,用共沉淀法制备了Ru-Zn催化剂,考察了反应修饰剂ZnSO4和预处理对苯选择加氢制环己烯Ru-Zn催化剂性能的影响,探讨了反应修饰ZnSO4的作用机理和预处理的作用。
1 实验部分
1.1 实验试剂
水合三氯化钌(AR)购自昆明贵研铂业股份有限公司;七水合硫酸锌(AR)购自天津福晨化学试剂厂;氢氧化钠(GR)、苯(AR)均购自天津市科密欧化学试剂有限公司。
1.2 催化剂制备
Ru-Zn催化剂的制备采用共沉淀法制备,具体方法如下:取20.0 g RuCl3·3H2O和4.5 g ZnSO4·7H2O配成200 mL混合溶液,将该混合加热至80 ℃左右。然后在搅拌下快速向该溶液中倒入5%的NaOH溶液200 mL,在80 ℃左右继续搅拌30 min。将上述浆液倒入1 L的哈氏合金高压反应釜中,密封。用N2气置换3次空气后,再用H2气置换3次空气,将H2压力调节至5 MPa,温度控制在150 ℃,搅拌800 r·min-1,还原3 h。将所得黑色固体用蒸馏水洗涤至滤液至中性,真空干燥,即得Ru-Zn催化剂。
1.3 催化表征
催化剂物相分析在荷兰PAN Nalytical公司的X′Pert PRO型X射线衍射(XRD)仪上进行。Ni滤光片,滤除Kβ线,Cu Kα射线(λ=0.154 18 nm),管电压40 kV,管电流40 mA,扫描范围5°~90°,扫描步长0.03°。催化剂中各元素含量分析在德国Bruker公司的S4 Pioneer型X射线荧光仪(XRF)上进行。催化剂形貌在日本电子公司的JEOL JEM 2100型透射电子显微镜(TEM)上观察。X射线光电子能谱(XPS)在ESCALAB 250型电子能谱仪(Thermo-VG Scientific)上进行,以Al Kα的X射线为激发光源,测定催化剂表面物种中Ru3p、ZN2p、C1s和O1s电子结合能(Eb)及Zn LMM俄歇电子能谱,以表面污染碳的C1s电子结合能(284.6 eV)校正电子结合能数据。DFT理论计算采用Gaussian 09程序包中的M06-2X方法,6-31G(d,p)基组。
1.4 催化剂评价
催化剂评价在1 L哈氏合金高压反应釜中进行,具体步骤如下:取2 g上述制备的Ru-Zn催化剂,46 g ZnSO4·7H2O和280 mL水,密封于1 L的高压反应釜内。用N2气置换3次空气后,再用H2气置换3次N2气,将H2压力调节至5 MPa,搅拌800 r·min-1。升温至150 ℃后,将搅拌转速调节至1 400 r·min-1,加入140 mL苯,反应开始计时,每隔5 min取样。在杭州科晓GC-1690型气相色谱仪上分析产物组成,计算苯转化率,环己烯选择性和收率。色谱柱为AT·SE-30(30 m×0.32 mm×0.25 μm),柱箱温度为70 ℃,进样温度和检测器温度均为210 ℃,柱前压为0.1 MPa。催化剂预处理即升温至150 ℃后,继续搅拌一定时间,然后将搅拌转速调节至1 400 r·min-1,加入140 mL苯,加氢条件同上。
2 结果与讨论
图 1给出了Ru-Zn催化剂的XRD图。可以看出,Ru-Zn催化剂上出现了金属Ru和ZnO的特征衍射峰,说明Ru-Zn催化剂中Ru和Zn分别主要以金属Ru和ZnO存在。Wang等[2]和Sun等[14]也认为Ru-Zn催化剂中Ru-Zn分别以金属Ru和ZnO存在。根据Scherrer公式计算出催化剂粒径为4.2 nm.
图 2给出了Ru-Zn催化剂的TEM照片和粒径分布图。可以看出,Ru-Zn催化剂为圆形或椭圆形的,粒径主要集中分布在4.3 nm左右,与XRD计算结果一致。
图 3给出了不同浓度反应修饰剂ZnSO4中苯加氢后Ru-Zn催化剂的XRD图。所有样品上都出现了金属Ru的特征衍射峰。根据Scherrer公式计算出催化剂粒径为4.3 nm左右(见表 1),与催化剂粒径一致。随反应修饰剂ZnSO4浓度增加,催化剂上ZnO的特征衍射峰消失,逐渐出现了(Zn(OH)2)3(ZnSO4)(H2O)盐的特征衍射峰,且衍射峰的强度逐渐增加。这说明Ru催化剂中ZnO与反应修饰剂ZnSO4反应生成了(Zn(OH)2)3(ZnSO4)(H2O)盐,且随ZnSO4浓度增加生成的(Zn(OH)2)3(ZnSO4)(H2O)盐量增加。然而当ZnSO4浓度高于0.41 mol·L-1后,继续增加ZnSO4浓度,(Zn(OH)2)3(ZnSO4)(H2O)盐的衍射峰又消失了,说明该盐量减少。
 表 1
不同浓度反应修饰剂ZnSO4中苯加氢后Ru-Zn催化剂的组成、粒径及浆液pH值
Table 1.
Composition and particle size of the Ru-Zn catalyst in the presence of the different concentration of the modifier ZnSO4 as well as pH value of the slurry after hydrogenation a Measured by pH meter at room temperature; b Measured by XRD; c Measured by XRF; d Blank: in distilled water.
表 1
不同浓度反应修饰剂ZnSO4中苯加氢后Ru-Zn催化剂的组成、粒径及浆液pH值
Table 1.
Composition and particle size of the Ru-Zn catalyst in the presence of the different concentration of the modifier ZnSO4 as well as pH value of the slurry after hydrogenation a Measured by pH meter at room temperature; b Measured by XRD; c Measured by XRF; d Blank: in distilled water.
 表 1 不同浓度反应修饰剂ZnSO4中苯加氢后Ru-Zn催化剂的组成、粒径及浆液pH值
表 1 不同浓度反应修饰剂ZnSO4中苯加氢后Ru-Zn催化剂的组成、粒径及浆液pH值
Table 1. Composition and particle size of the Ru-Zn catalyst in the presence of the different concentration of the modifier ZnSO4 as well as pH value of the slurry after hydrogenation a Measured by pH meter at room temperature; b Measured by XRD; c Measured by XRF; d Blank: in distilled water.表 1给出了不同浓度反应修饰剂ZnSO4中加氢后Ru-Zn催化剂的组成及pH值。可以看出,随ZnSO4浓度增加,催化剂上nZn / nRu和nS / nRu原子比逐渐增加,与XRD结果(Zn(OH)2)3(ZnSO4)(H2O)盐量增加一致。然而当ZnSO4浓度高于0.41 mol·L-1后,再增加ZnSO4浓度,催化剂上nZn / nRu和nS / nRu原子比却逐渐减小,与XRD结果(Zn(OH)2)3(ZnSO4)(H2O)盐量减少一致。随ZnSO4浓度增加,室温下pH值逐渐减小,说明ZnSO4水解程度增加,酸性增加。一般情况下,升温有利于水解。这意味着0.57 mol·L-1和0.63 mol·L-1 ZnSO4浆液在加氢温度150 ℃下有更强的酸性,可以溶解部分生成的(Zn(OH)2)3(ZnSO4)(H2O)盐,因此nZn / nRu和nS / nRu原子比逐渐减小。
图 5(a)、(b)和(c)给出了蒸馏水中苯加氢后Ru-Zn催化剂的Ru3p3/2、ZN2p XPS谱和Zn LMM AES谱。可以看出,位于461.6 eV 处的谱峰可以归属为金属Ru03p3/2,说明催化剂表面Ru主要以金属态存在,与XRD结果一致。由ZN2p3/2的电子结合能为1 022.9 eV和Zn LMM电子动能为986.5 eV,催化剂中Zn以Zn2+存在,与XRD结果Zn主要以ZnO存在一致。图 5(d)、(e)和(f)给出了0.63 mol·L-1 ZnSO4中苯加氢后Ru-Zn催化剂的Ru3p3/2、ZN2p XPS谱和Zn LMM AES谱。可以看出,位于462.2 eV处的谱峰可以归属为金属Ru03p3/2,比蒸馏水中加氢后Ru-Zn催化剂的Ru3p3/2高0.6 eV。由ZN2p3/2的电子结合能为1 021.9 eV和Zn LMM电子动能为987.8 eV,催化剂中Zn以Zn2+存在,与XRD结果Zn主要以(Zn(OH)2)3(ZnSO4)(H2O)盐存在一致。且ZN2p3/2的电子结合能比蒸馏水中加氢后Ru-Zn催化剂的低1.0 eV,Zn LMM电子动能高1.3 eV,说明金属Ru0将部分电子转移给了(Zn(OH)2)3(ZnSO4)(H2O)盐的Zn2+.
图 6给出了15 min不同浓度反应修饰剂ZnSO4中Ru-Zn催化剂上苯转化率、环己烯选择性和收率。可以看出,随ZnSO4浓度增加,催化剂活性逐渐降低,环己烯选择性逐渐升高。当ZnSO4浓度高于0.41 mol·L-1后,再增加ZnSO4浓度,催化剂活性升高,环己烯选择性略微降低。当ZnSO4最佳浓度为0.63 mol·L-1时,15 min苯转化率为58.6%,环己烯选择性和收率分别为77.4%和45.3%。该浓度是工业Ru-Zn催化剂正常运行浓度。再增加ZnSO4浓度,浆液酸性会更强,对装置的腐蚀性就增加。
结合以上表征,ZnSO4浓度影响催化剂上生成的(Zn(OH)2)3(ZnSO4)(H2O)盐量、浆液中的Zn2+浓度和pH值,进而影响Ru-Zn催化剂的苯选择加氢制环己烯性能。当ZnSO4浓度低于0.41 mol·L-1时,随ZnSO4浓度增加,生成的(Zn(OH)2)3(ZnSO4)(H2O)盐量逐渐增加,增加的Zn2+可以转移更多Ru电子,生成更多的Ruδ+物种。Mazzieri等[15]发现缺电子的Ruδ+物种越多,环己烯在催化剂上的吸附能力越弱,越易从催化剂表面逸出,避免它进一步加氢生成环己烷,环己烯选择性逐渐升高。同时增加的Zn2+会优先吸附在较强的Ru活性位上,苯和环己烯只能吸附在剩下吸附能力弱的Ru活性位。这也抑制了环己烯进一步加氢生成环己烷,但降低了催化剂活性。因此,当ZnSO4浓度低于0.41 mol·L-1,随ZnSO4浓度增加,催化剂活性逐渐降低,环己烯选择性逐渐升高。当ZnSO4浓度高于0.41 mol·L-1后,随ZnSO4浓度增加,浆液酸性太强,会溶解部分生成(Zn(OH)2)3(ZnSO4)(H2O)盐,(Zn(OH)2)3(ZnSO4)(H2O)盐量逐渐减小,催化剂活性又逐渐升高,环己烯选择性降低。但环己烯选择性却略有降低,这是由于随ZnSO4浓度增加浆液中Zn2+可以与环己烯形成配合物,图 7给出了Zn2+与环己烯形成配合物的优势构型。利用DFT方法计算出Zn2+分别与1个环己烯分子和2个环己烯分子形成配合物的能量为-618.7和-1 075.6 kJ·mol-1,这说明环己烯可以与Zn2+形成配合物,稳定液相中的环己烯,避免了环己烯再吸附到催化剂表面并加氢生成环己烷。
图 8给出了不同预处理时间苯加氢后Ru-Zn催化剂的XRD图。可以看出,不同预处理时间苯加氢后Ru-Zn催化剂上都出现了金属Ru的特征衍射峰。根据Scherrer公式计算出催化剂粒径为4.3 nm左右(表 2),说明预处理不影响催化剂粒径。随预处理时间增加,催化剂上逐渐出现了(Zn(OH)2)3(ZnSO4)(H2O)盐。这可能是由于催化剂中ZnO逐渐与浆液中ZnSO4反应生成了(Zn(OH)2)3(ZnSO4)(H2O)盐。
 表 2
不同预处理时间苯加氢后Ru-Zn催化剂的组成
Table 2.
Composition of the Ru-Zn catalyst under the different pretreatment time after hydrogenation
表 2
不同预处理时间苯加氢后Ru-Zn催化剂的组成
Table 2.
Composition of the Ru-Zn catalyst under the different pretreatment time after hydrogenation
 表 2 不同预处理时间苯加氢后Ru-Zn催化剂的组成
表 2 不同预处理时间苯加氢后Ru-Zn催化剂的组成
Table 2. Composition of the Ru-Zn catalyst under the different pretreatment time after hydrogenation表 2给出了不同预处理时间苯加氢后Ru-Zn催化剂的组成。可以看出,随预处理时间增加,催化剂中nZn / nRu和nS / nRu逐渐增加,与XRD图上逐渐出现(Zn(OH)2)3(ZnSO4)(H2O)盐的特征峰一致。这说明催化剂中ZnO逐渐与浆液中ZnSO4反应生成了(Zn(OH)2)3(ZnSO4)(H2O)盐。然而预处理15 h后,再增加预处理时间,nZn / nRu和nS / nRu原子比不变,说明催化剂中ZnO已经完全与浆液中ZnSO4反应生成了(Zn(OH)2)3(ZnSO4)(H2O)盐。
图 10给出了不同预处理时间Ru-Zn催化剂的苯选择加氢制环己烯性能。可以看出,随预处理时间增加,催化剂活性逐渐降低,环己烯选择性逐渐升高。然而预处理15 h后,再增加预处理时间,催化剂活性和环己烯选择性几乎不变,说明预处理的最佳时间为15 h。预处理15 h,25 min苯转化率为68.2%,环己烯选择性和收率分别为80.2%和54.7%。因为苯、环己烯和环己烷的沸点接近,工业用溶剂萃取的方法分离它们。环己烯选择性越高,分离就越容易,成本也越低,因此工业要求环己烯的选择性不低于80%。显然,预处理15 h,Ru-Zn催化剂满足了这一要求,而且获得了54.7%的环己烯收率。这超过目前工业Ru-Zn催化剂运行水平:苯转化40%时环己烯选择性和收率分别为80%和32%。
结合表征,预处理的主要作用是使催化剂中ZnO与反应修饰剂ZnSO4充分反应生成(Zn(OH)2)3(ZnSO4)(H2O)盐。预处理时间增加,生成的 (Zn(OH)2)3(ZnSO4)(H2O)盐量增加,Ruδ+物种增加,催化剂活性降低,环己烯选择性升高。我们课题组还在相同条件下对Ru-La-B/ZrO2催化剂进行了预处理,认为预处理还可以使催化剂的结构稳定化,延长催化剂的使用寿命[16].
图 11给出了预处理后Ru-Zn催化剂的重复使用性能。可以看出,预处理15 h后,Ru-Zn催化剂重复使用6次中,苯转化率稳定66.4%以上,环己烯选择性和收率稳定79.3%和53.8%以上。这说明Ru-Zn催化剂具有良好的重复使用性和稳定性,具有良好的应用前景。
3 结论
反应修饰剂ZnSO4可以与Ru-Zn催化剂中助剂ZnO反应生成(Zn(OH)2)3(ZnSO4)(H2O)盐。该盐中的Zn2+可以使Ru变为有利环己烯生成的缺电子的Ruδ+物种,而且还可以占据不适宜环己烯生成的强Ru活性位。因此,反应修饰剂ZnSO4浓度增加,(Zn(OH)2)3(ZnSO4)(H2O)盐量的逐渐增加,Ruδ+物种量增加,催化剂活性逐渐降低,环己烯选择性逐渐升高。但当反应修饰剂ZnSO4浓度高于0.41 mol·L-1后,继续增加ZnSO4浓度,由于Zn2+水解浆液酸性太强,可以溶解部分(Zn(OH)2)3(ZnSO4)(H2O)盐,Ru-Zn催化剂活性升高,环己烯选择性降低。环己烯选择性略有降低,是由于ZnSO4溶液中大量的Zn2+可以与生成的环己烯形成配合物,稳定生成的环己烯,抑制环己烯再吸附到催化剂表面并加氢生成环己烷。在ZnSO4最佳浓度0.61 mol·L-1下对Ru-Zn催化剂预处理15 h,Ru-Zn催化剂中助剂ZnO可以与ZnSO4完全反应生成(Zn(OH)2)3(ZnSO4)(H2O)盐,在该催化剂上25 min 苯转化68.2%时环己烯选择性和收率分别为80.2%和54.7%。而且该催化剂具有良好的稳定性和重复使用性能。
-
-
[1]
Liao H G, Ouyang D H, Zhang J, et al. Chem. Eng. J., 2014, 243:207-216 doi: 10.1016/j.cej.2014.01.014
-
[2]
王正宝,张琪,路晓飞,等.催化学报, 2015,36(3):400-407 doi: 10.1016/S1872-2067(14)60231-XWANG Zheng-Bao, ZHANG Qi, LU Xiao-Fei , et al. Chin. J. Catal., 2015,36(3):400-407 doi: 10.1016/S1872-2067(14)60231-X
-
[3]
Yan X H, Zhang Q, Zhu M Q, et al. J. Mol. Catal. A:Chem., 2016,413:85-93 doi: 10.1016/j.molcata.2015.12.013
-
[4]
Zhang P, Wu T B, Jiang T, et al. Green Chem., 2013,15:152-159 doi: 10.1039/C2GC36596K
-
[5]
Nagahara H, Ono M, Konishi M. et al. Appl. Surf. Sci., 1997, 121/122:448-451 doi: 10.1016/S0169-4332(97)00325-5
-
[6]
Struijk J, Moene R, van der Kamp T, et al. Appl. Catal. A: Gen., 1992,89:77-102 doi: 10.1016/0926-860X(92)80079-R
-
[7]
Liu H Z, Liang S G, Wang W T, et al. J. Mol. Catal. A:Chem., 2011,341:35-41 doi: 10.1016/j.molcata.2011.03.021
-
[8]
Fan G Y, Li R X, Li X J, et al. Catal. Commun., 2008,9: 1394-1397 doi: 10.1016/j.catcom.2007.11.039
-
[9]
Sun H J, Jiang H B, Li S H, et al. Chem. Eng. J., 2013,218: 415-424 doi: 10.1016/j.cej.2012.12.041
-
[10]
孙海杰,江厚兵,李帅辉,等.催化学报, 2013,34(4):684-694 doi: 10.1016/S1872-2067(11)60489-0SUN Hai-Jie, JIANG Hou-bin, LI Shuai-Hui, et al. Chin. J. Catal., 2013,34(4):684-694 doi: 10.1016/S1872-2067(11)60489-0
-
[11]
孙海杰,李帅辉,张元馨,等.催化学报, 2013,34(8):1482-1488 doi: 10.1016/S1872-2067(12)60637-8SUN Hai-Jie, LI Shuai-Hui, ZHANG Yuan-Xin, et al. Chin. J. Catal., 2013,34(8):1482-1488 doi: 10.1016/S1872-2067(12)60637-8
-
[12]
孙海杰,陈建军,黄振旭,等.无机化学学报, 2016,32(2):202-210 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20160202&journal_id=wjhxxbcnSUN Hai-Jie, CHEN Jian-Jun, HUANG Zhen-Xu, et al. Chinese J. Inorg. Chem., 2016,32(2):202-210 http://www.wjhxxb.cn/wjhxxbcn/ch/reader/view_abstract.aspx?flag=1&file_no=20160202&journal_id=wjhxxbcn
-
[13]
孙海杰,郭伟,周小莉,等.催化学报, 2011,32(1):1-16SUN Hai-Jie, GUO Wei, ZHOU Xiao-Li, et al. Chin. J. Catal., 2011,32(1):1-16
-
[14]
Sun H J, Wang H X, Jiang H B, et al. Appl. Catal. A:Gen., 2013,450:160-168 doi: 10.1016/j.apcata.2012.10.016
-
[15]
Mazzieri V A, L'Argentire P C, Coloma-Pascual F. Ind. Eng. Chem. Res., 2003,42(11):2269-2272 doi: 10.1021/ie0209428
-
[16]
王辉,刘仲毅,师瑞娟,等.催化学报, 2005,26(5):407-411WANG Hui, LIU Zhong-Yi, SHI Rui-Juan, et al. Chin. J. Catal., 2005,26(5):407-411
-
[1]
-
表 1 不同浓度反应修饰剂ZnSO4中苯加氢后Ru-Zn催化剂的组成、粒径及浆液pH值
Table 1. Composition and particle size of the Ru-Zn catalyst in the presence of the different concentration of the modifier ZnSO4 as well as pH value of the slurry after hydrogenation a Measured by pH meter at room temperature; b Measured by XRD; c Measured by XRF; d Blank: in distilled water.

表 2 不同预处理时间苯加氢后Ru-Zn催化剂的组成
Table 2. Composition of the Ru-Zn catalyst under the different pretreatment time after hydrogenation

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 366
- HTML全文浏览量: 82










 下载:
下载:








 下载:
下载:

