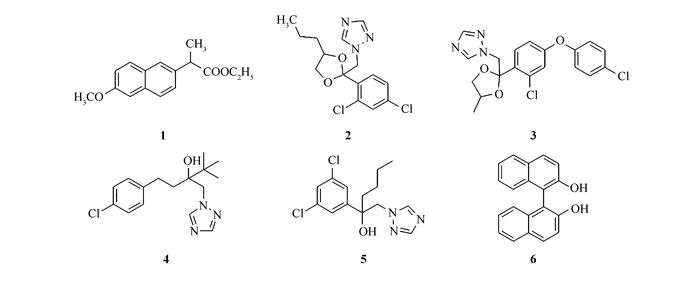
 Scheme1.
Structures of the six racemates
Scheme1.
Structures of the six racemates

Citation: HAN Xiaoqian, LIN Yunyun, LI Zhen, LIU Wenhua, SHI Ningning, WANG Nong. Preparation and Application of Novel Bonded L-Valine and L-Alanine Derived Chiral Stationary Phases[J]. Chinese Journal of Applied Chemistry, 2018, 35(1): 68-74. doi: 10.11944/j.issn.1000-0518.2018.01.170030

新型氨基酸衍生物手性固定相的制备及应用
-
关键词:
- 氨基酸衍生物
- / 手性固定相
- / 手性拆分
- / Gaussian 09
English
Preparation and Application of Novel Bonded L-Valine and L-Alanine Derived Chiral Stationary Phases
-
Key words:
- amino acid derivatives
- / chiral stationary phases
- / chiral separation
- / Gaussian 09
-
高效液相色谱手性固定相法是分离和获取单一对映体最直接、最简便、最有效的方法之一,研制新的手性固定相(CSP)是其核心和热点[1-4]。氨基酸是手性小分子,能与被分析化合物形成很好的π-π作用、氢键作用和偶极-偶极作用,由其作为原料制备的手性固定相(CSP)具有原料便宜易得,柱容量高等优点,常用来拆分氨基酸及其衍生物,此类CSP属于“刷型”CSPs,这类CSPs的手性选择子的选择和固定化方法,对开发新的“刷型”CSPs具有实际应用价值[5-8]。近年来,三聚氰氯逐渐使用在色谱填料的制备中,因其上3个氯原子非常活泼,可以与—OH和—NH2等发生反应,并且通过控制温度可以分步取代三聚氰氯上的氯原子,从而制得不同的衍生物,进而制得色谱填料,用于手性拆分或用于拆分碱性化合物[9-11]。
本文分别以L-缬氨酸、L-丙氨酸、三聚氰氯和对甲基苯甲酰氯为原料,制备了8种氨基酸三嗪衍生物手性固定相(CSP-1~CSP-8)和2种对甲基苯甲酰氨基酸手性固定相(CSP-9~CSP-10),在正相条件下对6种外消旋手性样品进行了手性拆分,同时还将所合成的CSPs用于对硝基苯酚的3种位置异构体的分离。
1 实验部分
1.1 仪器和试剂
LC-10A型高效液相色谱仪(日本岛津公司)。样品溶解在流动相中,色谱分离实验在室温下进行,检测波长254 nm,流速为0.5 mL/min,灵敏度0.02 A.U.F.S(absorbance unit full scale)。
L-缬氨酸(天津市远航化学品有限公司),L-丙氨酸(天津市光复精细化工研究所),对甲基苯甲酰氯、2-乙氧基-1-乙氧碳酰基-1,2-二氢喹啉(EEDQ)、三聚氰氯(阿拉丁化学有限公司),以上试剂均为分析纯;球形硅胶自制,平均粒径5 μm,比表面积140 m2/g,平均孔径12 nm;碳酸氢钠、盐酸、乙酸乙酯、三乙胺、吡啶等均为分析纯试剂(山东禹王实业有限公司化工分公司);所用流动相均经超声波脱气后使用。用于评价固定相手性识别能力的6种外消旋手性样品为:萘普生乙酯(1)、丙环唑(2)、苯醚甲环唑(3)、戊唑醇(4)、己唑醇(5)和联萘酚(6),结构如Scheme 1所示。
1.2 色谱计算及结合能计算
死时间(t0)用1,3,5-三叔丁基苯测定测定。保留因子(k′)、分离因子(α)、分离度(Rs)按照文献[12]方法计算。
1.3 氨基酸衍生物及其手性固定相的制备
1.3.1 氨基酸三嗪衍生物及其手性固定相的制备
参照文献[10]制备氨基酸三嗪衍生物,略有修改。称取三聚氰氯(CC)7.74 g,在0~5 ℃下溶于100 mL丙酮中,再称取L-缬氨酸5.91 g在5~10 ℃下悬浮于约30 mL水中。将L-缬氨酸悬浮液加入CC溶液中,用缚酸剂NaHCO3缓慢调pH=8,并在5~10 ℃下反应2 h。产物用HCl调pH=2,并用乙酸乙酯萃取,旋蒸得黄色固体Ⅰ8.35 g,产率75%。在此基础上用类似的方法合成L-缬氨酸二、三取代CC衍生物Ⅱ、Ⅲ。同理制得L-丙氨酸一、二、三取代CC衍生物Ⅳ、Ⅴ、Ⅵ,合成路线如Scheme 2所示。
称取产物Ⅰ3.18 g溶于35 mL丙酮中,L-丙氨酸1.25 g的悬浮液添加到丙酮溶液中,用缚酸剂NaHCO3缓慢地调pH=8,并在25 ℃下反应3 h。产物用HCl调pH=2,并用乙酸乙酯萃取,旋蒸得黄色固体Ⅶ 2.85 g。mp 182~185 ℃,产率75%,得到先L-缬氨酸后L-丙氨酸的氨基酸混合取代三嗪衍生物,同理制得先L-丙氨酸后L-缬氨酸的氨基酸混合取代三嗪衍生物Ⅷ。
分别称取衍生物Ⅰ~Ⅷ 2.2 g溶于约50 mL吡啶中,各加氨丙基硅胶2.5 g,三乙胺6 mL,在80 ℃下反应24 h,过滤,依次用吡啶,丙酮,乙醚洗涤,真空60 ℃干燥,得CSP-1~CSP-8,采用匀浆法装柱(150 mm×4.6 mm ID)。
1.3.2 对甲基苯甲酰氨基酸CSPs的制备
参照文献[11]方法,制备对甲基苯甲酰氨基酸CSPs,略有修改。称取L-缬氨酸1.47 g,溶于30 mL冰NaOH溶液中,加入约3 mL对甲基苯甲酰氯,在冰浴中反应36 h。然后加乙醚,除去醚层,用HCl调pH=2,用乙酸乙酯萃取,旋蒸有机相,得白色固体Ⅸ 2.65 g;称取L-丙氨酸1.25 g,同样反应方式,得白色固体Ⅹ 2.64 g。衍生物Ⅸ和Ⅹ的熔点分别为:98~101 ℃和151~154 ℃,产率90%和91%。合成路线如Scheme 3所示。
分别称取产物Ⅸ和Ⅹ 2.2 g溶于约50 mL干燥的THF中,分别加氨丙基硅胶2.5 g,EEDQ 2.5 g,在25 ℃下反应24 h,过滤,依次用THF,丙酮,乙醚洗涤,在真空60 ℃下干燥,得CSP-9和CSP-10。匀浆法装柱(150 mm×4.6 mm ID)。
1.3.3 结构表征
Ⅰ:IR, σ/cm-1:3236、3044(b)、1726、2972、640分别对应于NH、OH、CO、CH3、CCl;1H NMR, δ:1.08(CH3),2.24(CH),3.54(CH),4.50(NH,11.04(COOH)。
Ⅱ:IR, σ/cm-1:3236、3052(b)、1746、2981、649分别对应于NH、OH、CO、CH3、CCl;1H NMR, δ:1.10(CH3),2.20(CH),3.46(CH),4.50(NH,11.04(COOH)。
Ⅲ:IR, σ/cm-1:3216、3091(b)、1750、2966分别对应于NH、OH、CO、CH3;1H NMR, δ:1.07(CH3),2.18(CH),3.48(CH),4.27(NH),11.08(COOH)。
Ⅳ:IR, σ/cm-1:3212、3052(b)、1774、2986、692分别对应于NH、OH、CO、CH3、CCl;1H NMR, δ:1.24(CH3),3.50(CH),4.43(NH),11.11(COOH)。
Ⅴ:IR, σ/cm-1:3212、3081(b)、1774、2896、695分别对应于NH、OH、CO、CH3、CCl;1H NMR, δ:1.36(CH3),3.52(CH),4.50(NH),11.04(COOH)。
Ⅵ:IR, σ/cm-1:3210、3045(b)、1756、2880分别对应于NH、OH、CO、CH3;1H NMR, δ:1.38(CH3),3.80(CH),4.54(NH),11.14(COOH)。
Ⅶ:IR, σ/cm-1:3213、3083(b)、1714、2970分别对应于NH、OH、CO、CH3;1H NMR, δ:1.10(CH3),1.32(CH3),2.28(CH),3.66(CH),3.70(CH),4.51(NH),11.14(COOH)。
Ⅷ:IR, σ/cm-1:3201、3076(b)、1744、2973分别对应于NH、OH、CO、CH3;1H NMR, δ:1.13(CH3),1.33(CH3),2.31(CH),3.68(CH),3.73(CH),4.53(NH),11.12(COOH)。
Ⅸ:IR, σ/cm-1:3400、2950(b)、1710、1678分别对应于NH、OH、CO、CONH;1H NMR, δ:1.13(CH3),2.33 (phCH3),2.78(CH),4.58(CH),6.88~7.73(phH),6.53(NH),11.12(COOH)。
Ⅹ:IR, σ/cm-1:3401、2953(b)、1713、1679分别对应于NH、OH、CO、CONH;1H NMR, δ:1.41(CH3),2.35(phCH3),4.64(CH),6.88~7.73(phH),6.53(NH),11.12(COOH)。
2 结果与讨论
2.1 CSP-1~CSP-10对硝基苯酚位置异构体的分离
硝基苯酚的3种同分异构体,均有很大的毒性,低浓度会引起慢性的中毒,高浓度会导致死亡[13-14],在CSP-1~CSP-10上对邻(o)、间(m)和对(p)硝基苯酚进行了分离,结果见表 1。CSP-5、CSP-9和CSP-10对硝基苯酚无分离能力,CSP-4上硝基苯酚未被洗脱下来,在CSP-2上只分离了邻和间硝基苯酚,在CSP-8上的分离结果最好,如图 1所示。
 表 1
邻、间和对硝基苯酚在CSP-1~3、6~8上的分离结果
Table 1.
Separations of the regioisomers of o-, m-, p-nitrophenol on CSP-1~3, 6~8
表 1
邻、间和对硝基苯酚在CSP-1~3、6~8上的分离结果
Table 1.
Separations of the regioisomers of o-, m-, p-nitrophenol on CSP-1~3, 6~8
CSP1 CSP2 CSP3 CSP-6 CSP-7 CSP-8 to 6.62 14.8 5.63 9.72 7.33 5.08 tm 18.6 28.4 13.1 17.8 14.3 16.9 tp 30.1 - 15.7 21.2 24.8 24.2 Ro, m 1.52 1.34 2.68 2.87 1.74 3.20 Rm, p 0.81 - 0.68 1.06 1.11 1.17 Ro, p 1.94 - 2.53 4.24 2.08 4.11 *V(n-hexane):V(isopropyl alcohol)=95:5. 2.2 CSP-1~CSP-10对外消旋样品1~6的拆分
以体积比95:5的正己烷/异丙醇为流动相,在CSP-1~CSP-10上,对外消旋样品1~6进行了拆分,结果见表 2。随着固定相上取代基和取代基数目的不同,键合方式的不同,CSP-1~CSP-10对样品的分离能力表现出差异。L-缬氨酸三嗪衍生物CSP的分离能力为CSP-2>CSP-1>CSP-3,L-丙氨酸三嗪衍生物CSP的分离能力为CSP-4>CSP-6>CSP-5,L-缬氨酸与L-丙氨酸混合取代的三嗪衍生物CSP的分离能力为CSP-7>CSP-8,但从总的分离效果来看,L-丙氨酸三嗪衍生物CSP-4和CSP-6的分离效果更好一些;CSP-9和CSP-10的分离能力为CSP-10>CSP-9,由此可见,空间位阻稍小的丙氨酸制得的CSP表现出较好的识别能力。
CSP 1 2 3 4 5 6 k1′ α k1′ α k1′ α k1′ α k1′ α k1′ α CSP-1 0.79 1.23 0.77 1.09 1.27 1.00 1.18 1.00 1.26 1.00 13.4 1.00 CSP-2 0.69 1.19 0.86 1.22 1.41 1.08 1.66 1.00 1.63 1.00 13.3 1.06 CSP-3 0.85 1.00 1.27 1.18 2.35 1.10 2.19 1.00 2.49 1.00 3.38 1.00 CSP-4 0.86 1.25 0.82 1.15 1.42 1.04 2.11 1.00 1.70 1.11 - - CSP-5 1.18 1.06 1.12 1.13 1.96 1.00 2.09 1.00 2.09 1.00 13.2 1.00 CSP-6 1.03 1.26 1.00 1.12 1.62 1.04 2.16 1.00 2.02 1.00 11.2 1.00 CSP-7 0.57 1.18 0.63 1.08 0.95 1.00 1.03 1.00 0.93 1.00 8.52 1.09 CSP-8 0.56 1.00 0.53 1.00 1.00 1.00 1.14 1.05 0.84 1.00 3.42 1.08 CSP-9 0.73 1.14 0.65 1.14 - - 0.96 1.00 - - - - CSP-10 1.40 1.36 0.81 1.10 - - 1.30 1.05 - - - -* Mobile phase:V(n-hexane):V(isopropanol)=95:5; detection wavelength:254 nm; *-:no elution; flow rate:0.5 mL/min. 为能更好地理解样品与固定相之间的相互作用,初步尝试利用化学软件Gaussian 09[15]分别计算了L-丙氨酸三取代三嗪衍生物Ⅵ(衍生物Ⅵ)与外消旋样品1的R或S异构体的结合能(EL-R=52.51 kJ/mol;EL-S=133.9 kJ/mol)和构型(如图 2所示)。由图 2可见,外消旋样品1的R和S异构体与衍生物Ⅵ的羧基之间有明显的氢键作用,且从结合位点可以看到,S构型与衍生物Ⅵ之间的相互作用强于R构型与衍生物Ⅵ之间的相互作用,从计算出的L-S的结合能大于L-R的结合能也说明了形成的非对映配合物的稳定性不同,L-S稳定性大于L-R,因而外消旋样品1在CSP-6上获得拆分。
因氢键作用是主要的手性识别作用力,所以当改变流动相中异丙醇的比例和结构时,样品在所合成CSPs上的的保留随醇含量的减小、随醇的碳链增长而增加,但分离因子和分离度均有不同程度的变化,图 3给出了样品1在CSP-1、CSP-2、CSP-4~CSP-7、CSP-9和CSP-10上的色谱图。但要获得更好的分离结果还需进一步探索CSP-1~CSP-10适用的流动相组成、正反相模式、温度等分离条件。
3 结论
在制备的10种新型氨基酸衍生物“刷型”手性固定相(CSP-1~CSP-10)上,正相条件下,6种外消旋样品萘普生乙酯(1)、丙环唑(2)、苯醚甲环唑(3)、戊唑醇(4)、己唑醇(5)和联萘酚(6)分别获得了不同程度的拆分,(邻、间、对)硝基苯酚3种位置异构体也获得了较好的分离结果。使用Gaussian 09软件计算出衍生物Ⅵ与外消旋样品1的R或S异构体的结合能和构型,L-S、L-R结合能的差异,反映出样品的R或S异构体与CSP-6之间作用力的差异,若能结合大量的数据并配合样品出峰顺序的测试,将会有助于此类固定相的设计和手性识别机理的认识。
-
-
[1]
Silvia R, Anna R, Joseph J P. Enantiomers Separation by Nano-liquid Chromatography:Use of a Novel Sub-2μm Vancomycin Silica Hydride Stationary Phase[J]. J Chromatogr A, 2015, 1381: 149-159. doi: 10.1016/j.chroma.2015.01.015
-
[2]
Elodie L, Claude V, Saïd Y. Design of Experiments for Enantiomeric Separation in Supercriticalfluid Chromatography[J]. J Pharm Biomed Anal, 2016, 120: 297-305. doi: 10.1016/j.jpba.2015.12.041
-
[3]
Patel D C, Wahab M F, Armstrong D W. Advances in High-throughput and High-efficiency Chiral Liquid Chromatographic Separations[J]. J Chromatogr A, 2016, 1467: 2-18. doi: 10.1016/j.chroma.2016.07.040
-
[4]
曹志刚, 李来生, 程彪平. β-环糊精液相色谱固定相拆分和测定梨中烯唑醇对映体含量[J]. 分析测试学报, 2016,35,(1): 16-22. CAO Zhigang, LI Laisheng, CHENG Biaoping. Separation and Determination of Diniconazole Enantiomers in Pear on β-Cyclodextrin-based Stationary Phase by HPLC[J]. J Instrum Anal, 2016, 35(1): 16-22.
-
[5]
Scriba G K E. Chiral Recognition in Separation Science[J]. J Chromatogr A, 2016, 1467: 56-78. doi: 10.1016/j.chroma.2016.05.061
-
[6]
宾琴, 付克勤, 张俊俊. 新型苯甘氨酸衍生物"刷型"手性固定相的制备及其应用[J]. 合成化学, 2015,23,(1): 1-6. BIN Qin, FU Keqin, ZHANG Junjun. Preparation and Application of Novel Brush-type Chiral Stationary Phases Based on Phenylglycine Derivatives[J]. Chinese J Synth Chem, 2015, 23(1): 1-6.
-
[7]
赫欣睿, 武中庸, 叶永丽. 高效液相色谱法测定氨基酸的研究进展[J]. 分析测试学报, 2016,35,(7): 922-928. HE Xinrui, WU Zhongyong, YE Yongli. Research Progress on Detection of Amino Acids by High Performance Liquid Chromatography[J]. J Instrum Anal, 2016, 35(7): 922-928.
-
[8]
常银霞, 周玲玲, 向兰. D-苯甘氨酸手性固定相的制备及对多种手性化合物的拆分[J]. 分析测试学报, 2007,26,(1): 107-109. CHANG Yinxia, ZHOU Lingling, XIANG Lan. Separation of Various Racemates Using D-Phenylglycine as Chiral Stationary Phase[J]. J Instrum Anal, 2007, 26(1): 107-109.
-
[9]
沈从华, 李萍, 唐涛. 一种内嵌三嗪环酰胺极性基团新型固定相的制备及其在碱性化合物分离中的应用[J]. 色谱, 2013,31,(11): 1035-1039. SHEN Conghua, LI Ping, TANG Tao. Preparation of a New Stationary Phase with s-Triazine and Amide Embedded and Its Application in Separation of Basic Compounds[J]. Chinese J Chromatogr, 2013, 31(11): 1035-1039.
-
[10]
汪权, 王坤, 孙乐花. 2, 4, 6-三氨基酸取代-1, 3, 5-均三嗪衍生物的合成研究[J]. 化学试剂, 2012,34,(12): 1148-1150. WANG Quan, WANG Kun, SUN Lehua. Synthesis of 2, 4, 6-Tris(amino acids)-1, 3, 5-triazine[J]. Chem Reag, 2012, 34(12): 1148-1150.
-
[11]
Chen Z L, Fuyumuro T, Watabe K. Influence of Spacers and Organic Modifiers on Chromatographic Behaviors on Chiral Diamide Stationary Phase with N-(3, 5-Dimethylbenzoyl)-d-phenylglycine[J]. Anal Chim Acta, 2004, 518: 181-189. doi: 10.1016/j.aca.2004.05.039
-
[12]
农蕊瑜, 孔娇, 章俊辉. 手性金属-有机骨架材料{[Co(L-trp)(bpe)(H2O)]·H2O·NO3}n用于高效液相色谱的拆分性能[J]. 高等学校化学学报, 2016,37,(1): 19-25. doi: 10.7503/cjcu20120521NONG Ruiyu, KONG Jiao, ZHANG Junhui. Chiral Metal-organic Framework {[Co(L-trp)(bpe)(H2O)]·H2O·NO3}n Used for High Performance Liquid Chromatographic Separation[J]. Chem J Chinese Univ, 2016, 37(1): 19-25. doi: 10.7503/cjcu20120521
-
[13]
魏恩棋, 李利荣, 吴宇峰. 水体中硝基芳烃类有机污染物分析方法研究进展[J]. 分析测试学报, 2016,35,(8): 1071-1078. WEI Enqi, LI Lirong, WU Yufeng. Progress on Analysis Methods for Nitroaromatic Pollutants in Water Matrix[J]. J Instrum Anal, 2016, 35(8): 1071-1078.
-
[14]
刘玉, 张同来, 杨利. QuEChERS-超高效液相色谱法同时测定硝基酚类物质方法的研究[J]. 含能材料, 2015,23,(1): 73-79. doi: 10.11943/j.issn.1006-9941.2015.01.015LIU Yu, ZHANG Tonglai, YANG Li. Simultaneous Determination of 14 Nitrophenol Compounds by QuEChERS-Ultra Performance Liquid Chromatography[J]. Chinese J Energ Mater, 2015, 23(1): 73-79. doi: 10.11943/j.issn.1006-9941.2015.01.015
-
[15]
苟高章, 王泽锋, 黄兆龙. Gaussian 09软件在电子圆二色谱教学中的应用[J]. 化学教育, 2016,37,(2): 61-64. GOU Gaozhang, WANG Zefeng, HUANG Zhaolong. Application of Gaussian 09 Software in Electronic Circular Dichroism Spectroscopy Teaching[J]. Chinese J Chem Edu, 2016, 37(2): 61-64.
-
[1]
-
表 1 邻、间和对硝基苯酚在CSP-1~3、6~8上的分离结果
Table 1. Separations of the regioisomers of o-, m-, p-nitrophenol on CSP-1~3, 6~8
CSP1 CSP2 CSP3 CSP-6 CSP-7 CSP-8 to 6.62 14.8 5.63 9.72 7.33 5.08 tm 18.6 28.4 13.1 17.8 14.3 16.9 tp 30.1 - 15.7 21.2 24.8 24.2 Ro, m 1.52 1.34 2.68 2.87 1.74 3.20 Rm, p 0.81 - 0.68 1.06 1.11 1.17 Ro, p 1.94 - 2.53 4.24 2.08 4.11 *V(n-hexane):V(isopropyl alcohol)=95:5. 表 2 所制备CSP-1~CSP-10对手性化合物的拆分结果
Table 2. Separation of the racemates on CSP-1~CSP-10
CSP 1 2 3 4 5 6 k1′ α k1′ α k1′ α k1′ α k1′ α k1′ α CSP-1 0.79 1.23 0.77 1.09 1.27 1.00 1.18 1.00 1.26 1.00 13.4 1.00 CSP-2 0.69 1.19 0.86 1.22 1.41 1.08 1.66 1.00 1.63 1.00 13.3 1.06 CSP-3 0.85 1.00 1.27 1.18 2.35 1.10 2.19 1.00 2.49 1.00 3.38 1.00 CSP-4 0.86 1.25 0.82 1.15 1.42 1.04 2.11 1.00 1.70 1.11 - - CSP-5 1.18 1.06 1.12 1.13 1.96 1.00 2.09 1.00 2.09 1.00 13.2 1.00 CSP-6 1.03 1.26 1.00 1.12 1.62 1.04 2.16 1.00 2.02 1.00 11.2 1.00 CSP-7 0.57 1.18 0.63 1.08 0.95 1.00 1.03 1.00 0.93 1.00 8.52 1.09 CSP-8 0.56 1.00 0.53 1.00 1.00 1.00 1.14 1.05 0.84 1.00 3.42 1.08 CSP-9 0.73 1.14 0.65 1.14 - - 0.96 1.00 - - - - CSP-10 1.40 1.36 0.81 1.10 - - 1.30 1.05 - - - -* Mobile phase:V(n-hexane):V(isopropanol)=95:5; detection wavelength:254 nm; *-:no elution; flow rate:0.5 mL/min. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 2
- 文章访问数: 1449
- HTML全文浏览量: 82





 下载:
下载:



 下载:
下载:

