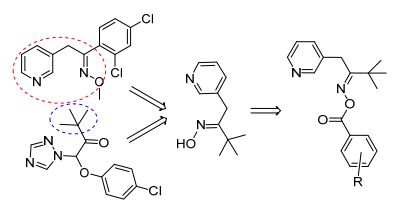
 图式 1
目标化合物的设计思路
Scheme1.
Design strategy of the target compounds
图式 1
目标化合物的设计思路
Scheme1.
Design strategy of the target compounds

Citation: Zan Ningning, Zhang Yulei, Zhang Shuai, Liu Si, Jiang Lin. Synthesis of Novel 3, 3-Dimethyl-1-(pyridin-3-yl) butan-2-one Oxime Esters and Evaluation of Their Antifungal Activity[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2767-2771. doi: 10.6023/cjoc201705009

3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟酯的合成及抑菌活性
English
Synthesis of Novel 3, 3-Dimethyl-1-(pyridin-3-yl) butan-2-one Oxime Esters and Evaluation of Their Antifungal Activity
-
Key words:
- pyridine
- / ketones
- / oxime
- / carboxylic acids
- / synthesis design
- / antifungal activity
-
吡啶衍生物具有优良和广谱的生物活性, 如抑菌[1]、抗炎[2]、抗癌[3]、抗病毒[4]、杀虫[5]、除草[6]等活性, 广泛应用于农药和医药领域.另一方面, 吡啶是苯的电子等排体, 但其疏水性常数比苯低得多, 因此吡啶衍生物往往具有活性更高、毒性低、内吸性强、选择性好等优点[7].最近十几年来已开发出18种含吡啶结构的农药品种[7], 其中包括高效杀菌剂啶斑肟、啶氧菌酯、啶酰菌胺等.
肟类化合物(肟醚和肟酯)具有杀菌[8]、抗炎[9]、抗病毒[10]、抗痉挛[11]、杀虫[12]等生物活性.该类化合物还有高效、低毒、低残留等特点, 作为一类农药和医药活性物质得到较广泛的应用.目前农药市场中, 肟类农药主要是含肟醚结构的化合物, 如杀菌剂啶斑肟、肟菌酯、肟醚菌胺, 除草剂肟草酮, 杀虫剂肟醚菊酯等, 但鲜有肟酯类农药品种.为发现高活性的肟酯类杀菌剂, 许多化学工作者开展了很有价值的研究.例如, 2012年, Naik等[13]设计合成了一系列含香兰素结构的吡啶酮肟酯, 其中2个化合物对黄曲霉菌、金孢子菌、白色念珠菌有很好的抑制作用, 与对照药剂氟康唑活性相当.最近, 薛伟等[14]以姜黄素为先导, 设计合成了6种含杂环的戊二烯酮肟酯, 其中4种化合物对小麦赤霉病菌、苹果腐烂病菌有中等抑制活性.为寻找具有优良杀菌活性的含吡啶结构的肟酯类化合物, 本文以啶斑肟为先导化合物, 再结合三唑类杀菌剂三唑酮的结构, 设计合成了12种结构新颖的3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟酯(3a~3l), 并初步测试了目标化合物的对灰霉菌、菌核菌的抑制活性.设计思路见Scheme 1.
1 结果与讨论
1.1 合成与波谱
3-甲基吡啶在强碱二异丙基氨基锂(LDA)作用下转化为3-吡啶甲基锂, 后者与特戊酸乙酯加成生成3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮(1), 1在碱性介质中与盐酸羟胺反应得到中间体酮肟(2).最后, 该酮肟与取代苯甲酸在DCC/HOBt作用下直接缩合生成目标化合物3(合成路线见Scheme 2).在吡啶甲基锂的制备中, 文献报道反应温度一般在-30~-78 ℃[15], 但是在本实验中, 我们发现温度可以上升至-10~-15℃, 使操作更加方便.此外, 我们采用肟与取代苯甲酸在DCC/HOBt催化下直接合成目标化合物, 收率在90%~95%之间.
在1H NMR谱中, 化学位移δ在1.25~1.31之间的单峰为叔丁基上甲基质子的共振吸收, δ在3.89~3.93的单峰是与吡啶环相连的亚甲基质子信号, 而苯环和吡啶环上质子的共振吸收出现在δ 6.87~8.54处. 13C NMR中, 羰基的共振吸收出现在δ 171.8~172.9处, 叔丁基季碳的信号出现在δ 38附近. IR谱中, 在1746~1758 cm-1之间的强峰为酯羰基的伸缩振动, 而1605~1622 cm-1处的中等强度的峰属于C=N和C=C伸缩振动, 肟酯基N—O—C的伸缩振动吸收位于1241~1286 cm-1之间.
1.2 抑菌活性
由表 1可见, 目标化合物3h和3j对菌核菌有较强的抑制活性, EC50值分别为5.07和4.81 µg/mL, 其活性明显高于商品化杀菌剂三唑酮(EC50=11.69 μg/mL), 但低于百菌清(EC50=3.52 μg/mL).另一方面, 3h和3j对灰霉菌显示出良好的抑制活性, EC50值分别为4.98和5.44 µg/mL, 其活性高于百菌清(EC50=6.28 µg/mL); 3l对灰霉菌也有较高的抑制活性, EC50值为6.34 µg/mL, 表明活性与百菌清相近; 这三种化合物的活性均高于三唑酮(EC50=10.41 µg/mL).
Compd. R EC50a/(µg•mL-1) S. sclerotiorum B. cinerea 3a H 24.62 (18.82~32.20) 64.59 (51.91~80.35) 3b 2-CH3 42.09 (34.88~50.80) 46.44 (43.61~49.43) 3c 3-CH3 18.83 (16.91~20.95) 37.74 (31.08~45.83) 3d 4-CH3 15.77 (15.18~16.39) 8.00 (6.99~9.17) 3e 2-CH3O 62.02 (59.00~65.19) 71.78 (64.60~79.76) 3f 3-CH3O 25.13 (20.85~30.29) 67.13 (62.18~72.46) 3g 4-CH3O 11.89 (11.15~12.69) 35.32 (34.09~36.59) 3h 4-Br 5.07 (4.31~5.98) 4.98 (4.55~5.44) 3i 2-Cl 43.80 (32.69~58.68) 52.51 (41.48~66.46) 3j 4-Cl 4.81 (3.87~5.97) 5.44 (5.08~5.83) 3k 2, 4-Cl 25.80 (21.91~30.37) 46.92 (38.82~56.69) 3l 3, 4-Cl 9.51 (7.19~12.60) 6.34 (5.64~7.13) Triadimefon 11.69 (10.85~12.61) 10.41 (8.22~13.19) Chlorothalonil 3.52 (2.63~4.90) 6.28 (4.32~8.05) a 95% CL: 95% confidence interval. 通过分析化合物的抑菌活性, 发现苯环中取代基的类型和位置对活性有显著影响.取代基处于苯环对位时, 化合物的抑菌活性高于在邻位或间位的类似物(例如3b~3d, 3e~3g和3i~3j).总体来看, 苯环对位含有Cl或Br原子的化合物具有较好的抑菌活性.
2 结论
以3-甲基吡啶、特戊酸乙酯、盐酸羟胺和取代苯甲酸等为原料, 经加成、肟化和酯化等三步反应, 合成了12种新型的3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟酯.该方法反应条件比较温和、收率高.测试了目标化合物对菌核菌、灰霉菌的离体抑制活性, 获得几种对菌核菌和灰霉菌有较高抑制的化合物, 为开展具有杀菌活性的吡啶类化合物的设计、合成提供了有益参考.
3 实验部分
3.1 仪器与试剂
北京泰克仪器有限公司X-5精密显微熔点测定仪(温度计未校正); 美国Nicolet 380型傅里叶变换红外光谱仪(KBr压片法); 美国Mercury Plus-400型核磁共振仪(CDCl3为溶剂, TMS为内标); 德国Elementar公司VarioEL型元素分析仪; GXZ型智能光照培养箱.试剂为市售分析纯或化学纯.
3.2 实验方法
3.2.1 3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮(1)的合成
在装有N2保护装置、冰盐浴冷却的50 mL二颈烧瓶中, 加入二异丙基氨基锂(10 mL, 2 mol•L-1庚烷/四氢呋喃/乙苯溶液), 待温度降至-10~-15℃, 电磁搅拌下向瓶中缓慢滴加3-甲基吡啶(1.88 g, 20 mmol), 继续搅拌1 h.在此温度下缓缓滴加特戊酸乙酯(2.60 g, 20 mmol)后, 升至室温, 并将反应混合物置于超声波反应器(300 W)反应30 min, 加水(10 mL)淬灭反应, 用乙酸乙酯提取(20 mL×2).有机相用无水Na2SO4干燥, 减压脱溶剂得粗产物.以石油醚/乙酸乙酯(V:V=3:1) 为洗脱剂, 硅胶柱层析进行纯化得到化合物1, 浅黄色油状物, 产率85%.1H NMR(CDCl3, 400 MHz) δ: 1.30 [s, 9H, C(CH3)3], 3.81 (s, 2H, CH2), 7.24~7.27 (m, 1H, Py-H), 7.54 (d, J=4.0 Hz, 1H, Py-H), 8.41 (s, 1H, Py-H), 8.55 (d, J=4.0 Hz, 1H, Py-H); IR (KBr) v: 2954, 1689 cm-1. Anal. calcd for C11H15NO: C 74.54, H 8.53, N 7.90; found C 74.46, H 8.34, N 7.87.
3.2.2 3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(2)的合成
25 mL烧瓶中加入化合物1 (1.77 g, 10 mmol)、盐酸羟胺(0.70 g, 10 mmol)和3 mL吡啶.将反应混合物置于80℃的水浴中加热搅拌3 h, 反应完毕, 减压蒸除吡啶, 残余物用乙酸乙酯提取(20 mL), 无水Na2SO4干燥, 旋蒸除去溶剂.粗产物经柱层析提纯[石油醚/乙酸乙酯(V:V=5:1)], 得酮肟2.白色固体, 产率89%. m.p. 121.2~122.3 ℃; 1H NMR (CDCl3, 400 MHz) δ: 1.13 [s, 9H, C(CH3)3], 3.79 (s, 2H, CH2), 7.20~8.53 (m, 4H, Py-H), 9.15 (s, 1H, OH); IR (KBr) v: 3170, 1636 cm-1. Anal. calcd for C19H22N2O2: C 68.72, H 8.39, N 14.57; found C 68.46, H 8.24, N 14.87.
3.2.3 目标化合物3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟酯(3)的合成
25 mL烧瓶中加入酮肟2 (0.59 g, 3 mmol)、取代苯甲酸(3 mmol), 用10 mL干燥的二氯甲烷溶解, 然后加入二环己基碳二亚胺(DCC, 0.62 g, 3 mmol)和1-羟基苯并三唑(HOBt, 0.41 g, 3 mmol).反应混合液室温下搅拌2 h.反应完毕, 过滤除去固体, 滤液脱溶剂得粗产物.以石油醚/乙酸乙酯(V:V=3:1) 为洗脱剂, 硅胶柱层析进行纯化得目标化合物3a~3l.
O-苯甲酰基-3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(3a):白色固体, 产率91%. m.p. 79.8~80.5 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.29 [s, 9H, C(CH3)3], 3.94 (s, 2H, CH2), 7.21~7.75 (m, 7H, Py-H+Ph-H), 8.47 (d, J=3.6 Hz, 1H, Py-H), 8.55 (s, 1H, Py-H); 13C NMR (100 MHz, CDCl3) δ: 172.3, 163.6, 149.6, 147.9, 135.1, 133.2, 131.7, 129.3, 128.8, 128.5, 123.6, 38.9, 30.5, 27.8; IR (KBr) v: 1739, 1615, 1248 cm-1. Anal. calcd for C18H20N2O2: C 72.95, H 6.80, N 9.45; found C 72.85, H 6.85, N 9.75.
O-(2-甲基苯甲酰基)-3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(3b):浅黄色油状物, 产率94%. [n]D201.5728. 1H NMR (400 MHz, CDCl3) δ: 1.29 [s, 9H, C(CH3)3], 2.54 (s, 3H, CH3), 3.90 (s, 2H, CH2), 7.07~7.49 (m, 6H, Py-H+Ph-H), 8.47 (d, J=3.2 Hz, 1H, Py-H), 8.51 (s, 1H, Py-H); 13C NMR (100 MHz, CDCl3) δ: 171.9, 164.4, 149.5, 147.7, 140.7, 135.3, 132.2, 131.8, 131.7, 129.8, 128.0, 125.7, 123.6, 38.8, 30.6, 27.9, 21.5; IR (KBr) v: 1741, 1615, 1245 cm-1. Anal. calcd for C19H22N2O2: C 73.52, H 7.14, N 9.03; found C 73.36, H 7.24, N 8.82.
O-(3-甲基苯甲酰基)-3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(3c):白色固体, 产率90%. m.p. 62.2~62.8 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.30 [s, 9H, C(CH3)3], 2.30 (s, 3H, CH3), 3.93 (s, 2H, CH2), 7.20~7.52 (m, 6H, Py-H+Ph-H), 8.48 (d, J=3.2 Hz, 1H, Py-H), 8.55 (s, 1H, Py-H); 13C NMR (100 MHz, CDCl3) δ: 172.1, 163.8, 149.5, 147.8, 138.3, 135.1, 134.0, 131.8, 129.9, 128.7, 128.4, 126.5, 123.6, 38.9, 30.6, 27.8, 21.2; IR (KBr) v: 1741, 1615, 1265 cm-1. Anal. calcd for C19H22N2O2: C 73.52, H 7.14, N 9.03; found C 73.61, H 7.25, N 9.15.
O-(4-甲基苯甲酰基)-3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(3d):白色固体, 产率93%. m.p. 99.7~100.5 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.29 [s, 9H, C(CH3)3], 2.36 (s, 3H, CH3), 3.92 (s, 2H, CH2), 7.13~7.63 (m, 6H, Py-H+Ph-H), 8.47 (d, J=3.2 Hz, 1H, Py-H), 8.55 (s, 1H, Py-H); 13C NMR (100 MHz, CDCl3) δ: 172.0, 163.7, 149.5, 147.8, 144.0, 135.1, 131.8, 129.4, 129.2, 125.9, 123.6, 38.8, 30.5, 27.8, 21.7; IR (KBr) v: 1731, 1610, 1261 cm-1. Anal. calcd for C19H22N2O2: C 73.52, H 7.14, N 9.03; found C 73.46, H 7.34, N 8.87.
O-(2-甲氧基苯甲酰基)-3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(3e):白色固体, 产率92%. m.p. 56.2~56.8 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.25 [s, 9H, C(CH3)3], 3.62 (s, 3H, OCH3), 3.92 (s, 2H, CH2), 6.87~7.61 (m, 6H, Py-H+Ph-H), 8.45 (d, J=4.4 Hz, 1H, Py-H), 8.52 (s, 1H, Py-H); 13C NMR (100 MHz, CDCl3) δ: 172.1, 164.2, 158.8, 149.8, 147.7, 135.5, 133.8, 131.9, 123.4, 120.2, 118.8, 111.7, 110.0, 55.5, 38.8, 30.6, 28.0; IR (KBr) v: 1738, 1615, 1286 cm-1. Anal. calcd for C19H22N2O3: C 69.92, H 6.79, N 8.58; found C 69.75, H 6.62, N 8.64.
O-(3-甲氧基苯甲酰基)-3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(3f): 白色固体, 产率92%. m.p. 49.7~50.8 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.29 [s, 9H, C(CH3)3], 3.71 (s, 3H, OCH3), 3.93 (s, 2H, CH2), 7.03~7.48 (m, 6H, Py-H+Ph-H), 8.46 (d, J=4.8 Hz, 1H, Py-H), 8.54 (s, 1H, Py-H); 13C NMR (100 MHz, CDCl3) δ: 172.2, 163.5, 159.5, 149.5, 147.9, 135.0, 131.6, 130.1, 129.5, 123.6, 121.7, 119.8, 113.7, 55.3, 38.9, 30.5, 27.8; IR (KBr) v: 1743, 1615, 1272 cm-1. Anal. calcd for C19H22N2O3: C 69.92, H 6.79, N 8.58; found C 69.74, H 6. 70, N 8.44%.
O-(4-甲氧基苯甲酰基)-3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(3g):白色固体, 产率92%. m.p. 58.5~60.1 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.28 [s, 9H, C(CH3)3], 3.82 (s, 3H, CH3), 3.92 (s, 2H, CH2), 6.81~7.70 (m, 6H, Py-H+Ph-H), 8.47 (d, J=3.6 Hz, 1H, Py-H), 8.55 (s, 1H, Py-H); 13C NMR (100 MHz, CDCl3) δ: 171.8, 163.5, 163.4, 149.6, 147.8, 135.1, 131.9, 131.4, 123.6, 121.0, 113.7, 55.4, 38.8, 30.5, 27.8; IR (KBr) v: 1739, 1605, 1251 cm-1. Anal. calcd for C19H22N2O3: C 69.92, H 6.79, N 8.58; found C 69.66, H 6.53, N 8.64.
O-(4-溴苯甲酰基)-3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(3h):浅黄色固体, 产率91%. m.p. 88.2~89.6 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.29 [s, 9H, C(CH3)3], 3.91 (s, 2H, CH2), 7.21~7.56 (m, 6H, Py-H+Ph-H), 8.48 (d, J=3.2 Hz, 1H, Py-H), 8.53 (s, 1H, Py-H); 13C NMR (100 MHz, CDCl3) δ: 172.5, 163.0, 149.5, 148.0, 135.0, 131.9, 131.6, 130.8, 128.4, 127.7, 123.6, 38.9, 30.6, 27.8; IR (KBr): 1746, 1621, 1248 cm-1. Anal. calcd for C18H19Br-N2O2: C 57.61, H 5.10, N 7.47; found C 57.43, H 5.12, N 7.57%.
O-(2-氯苯甲酰基)-3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(3i):白色固体, 产率91%. m.p. 94.6~95.2 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.27 [s, 9H, C(CH3)3], 3.90 (s, 2H, CH2), 7.18~7.47 (m, 6H, Py-H+Ph-H), 8.45 (d, J=4.8 Hz, 1H, Py-H), 8.47 (s, 1H, Py-H); 13C NMR (100 MHz, CDCl3) δ: 172.7, 163.2, 149.6, 147.8, 135.2, 133.2, 132.7, 131.6, 131.0, 130.9, 129.2, 126.6, 123.5, 38.9, 30.7, 27.9; IR (KBr) v: 1750, 1610, 1241 cm-1. Anal. calcd for C18H19ClN2O2: C 65.35, H 5.79, N 8.47; found C 65.43, H 5.89, N 8.57.
O-(4-氯苯甲酰基)-3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(3j):白色固体, 产率95%. m.p. 97.4~98.0 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.30 [s, 9H, C(CH3)3], 3.93 (s, 2H, CH2), 7.21~7.64 (m, 6H, Py-H+Ph-H), 8.48 (d, J=4.8 Hz, 1H, Py-H), 8.54 (s, 1H, Py-H); 13C NMR (100 MHz, CDCl3) δ: 172.5, 162.8, 149.5, 147.9, 139.7, 135.0, 131.6, 130.7, 128.9, 127.2, 123.6, 38.9, 30.6, 27.8; IR (KBr) v: 1746, 1622, 1249 cm-1. Anal. calcd for C18H19Cl-N2O2: C 65.35, H 5.79, N 8.47; found C 65.46, H 5.43, N 5.87.
O-(2, 4-二氯苯甲酰基)-3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(3k):浅黄色油状物, 产率93%. [n]D201.5796. 1H NMR (400 MHz, CDCl3) δ: 1.28 [s, 9H, C(CH3)3], 3.89 (s, 2H, CH2), 7.19~7.45 (m, 5H, Py-H+Ph-H), 8.47 (s, 2H, Py-H); 13C NMR (100 MHz, CDCl3) δ: 172.9, 162.3, 149.4, 147.8, 138.5, 135.3, 134.5, 132.1, 131.6, 130.8, 127.4, 127.1, 123.6, 39.0, 30.8, 28.0; IR (KBr) v: 1758, 1623, 1267 cm-1. Anal. calcd for C18H18Cl2N2O2: C 59.19, H 4.97, N 7.67; found C 59.32, H 4.82, N 7.57.
O-(3, 4-二氯苯甲酰基)-3, 3-二甲基-1-(吡啶-3-基)-丁-2-酮肟(3l):白色固体, 产率94%. m.p. 96.8~97.3 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.31 [s, 9H, C(CH3)3], 3.91 (s, 2H, CH2), 7.23~7.70 (m, 5H, Py-H+Ph-H), 8.50 (d, J=3.6 Hz, 1H, Py-H), 8.52 (s, 1H, Py-H); 13C NMR (100 MHz, CDCl3) δ: 172.9, 161.7, 149.3, 148.1, 137.9, 134.9, 133.0, 131.5, 131.2, 130.7, 128.6, 128.3, 123.6, 38.9, 30.7, 27.7; IR (KBr) v: 1748, 1619, 1270 cm-1. Anal. calcd for C18H18Cl2N2O2: C 59.19, H 4.97, N 7.67; found C 59.26, H 4.73, N 7.64.
3.3 抑菌活性测试
采用菌丝生长速率法测定目标化合物的离体抑菌活性[16].以茄子菌核菌(S. sclerotiorum)和番茄灰霉菌(B. cinerea)为测试菌种, 在预试验的基础上, 选择各供试化合物生长抑制率在10%~90%范围内的五个浓度梯度的PDA(马铃薯-葡萄糖-琼脂培养基)含药平板, 并将其置于培养皿中固化.将供试菌种的菌饼反接到含药平板中央, 置于(25±1) ℃的培养箱中培养72 h.以加入等体积无菌水的培养基为空白对照, 以杀菌剂三唑酮(triadimefon)、百菌清(四氯间苯二腈, chlorothalonil)为对照药剂.每处理重复3次.用十字交叉法测量菌落直径, 每个菌落测量2次, 以其平均值代表菌落的大小, 按以下公式计算抑制率, 最后通过(DPS)分析软件求出EC50值.试验结果见表 1.
菌落扩散直径=菌落平均直径-菌饼直径
抑制率(%)=(对照菌落扩散直径-处理菌落扩散直径)/(对照菌落扩散直径)×100%.
辅助材料(Supporting Information) 目标化合物3a~3l的1H NMR和13C NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
张燕, 王宝雷, 詹益周, 张丽媛, 李永红, 李正名, 高等学校化学学报, 2016, 37, 1100. doi: 10.7503/cjcu20160042Zhang, Y.; Wang, B.-L.; Zhan, Y.-Z.; Zhang, L.-Y.; Li, Y.-H.; Li, Z.-M. Chem. J. Chin. Univ. 2016, 37, 1100(in Chinese). doi: 10.7503/cjcu20160042
-
[2]
Liu, W.-K.; Zhou, J.-P.; Zhang, T.; Zhu, H.-Y.; Qian, H.; Zhang, H.-B.; Huang, W.-L.; Gust, R. Bioorg. Med. Chem. Lett. 2012, 22, 2701. doi: 10.1016/j.bmcl.2012.03.002
-
[3]
陈凑喜, 魏梦雪, 李学强, 李天才, 周学章, 有机化学, 2015, 35, 835. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344750.shtmlChen, C.-X.; Wei, M.-X.; Li, X.-Q.; Li, T.-C.; Zhou, X.-Z. Chin. J. Org. Chem. 2015, 35, 835(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344750.shtml
-
[4]
Li, T.-X.; Zhang, J.; Pan, J.-K.; Wu, Z.-X.; Hu, D.-Y.; Song, B.-A. Eur. J. Med. Chem. 2017, 125, 657. doi: 10.1016/j.ejmech.2016.09.069
-
[5]
许天明, 姬文娟, 蔡飞, 邢家华, 孔小林, 农药学学报, 2012, 14, 131. doi: 10.3969/j.issn.1008-7303.2012.02.03Xu, T.-M.; Ji, W.-J.; Cai, F.; Xing, J.-H.; Kong, X.-L. Chin. J. Pestic. Sci. 2012, 14, 131(in Chinese). doi: 10.3969/j.issn.1008-7303.2012.02.03
-
[6]
戴红, 陈佳, 洪宇, 袁斌颖, 陈雨蒙, 石玉军, 马瑞媛, 梁志鹏, 石健, 有机化学, 2017, 37, 739. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345757.shtmlDai, H.; Chen, J.; Hong, Y.; Yuan, B.-Y.; Chen, Y.-M.; Shi, Y.-J.; Ma, R.-Y.; Liang, Z.-P.; Shi, J. Chin. J. Org. Chem. 2017, 37, 739(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345757.shtml
-
[7]
Guan, A.-Y.; Liu, C.-L.; Sun, X.-F.; Xie, Y.; Wang, M.-A. Bioorg. Med. Chem. 2016, 24, 342. doi: 10.1016/j.bmc.2015.09.031
-
[8]
Liu, X.-H.; Cui, P.; Song, B.-A.; Bhadury, P. S.; Zhu, H.-L.; Wang, S.-F. Bioorg. Med. Chem. 2008, 16, 4075. doi: 10.1016/j.bmc.2008.01.035
-
[9]
Hwang, T.-L.; Wang, W.-H.; Wang, T.-Y.; Yu, H.-P.; Hsieh, P.-W. Bioorg. Med. Chem. 2015, 23, 1123. doi: 10.1016/j.bmc.2014.12.056
-
[10]
Li, N.; Li, Z.; Wang, K.-L.; Liu, Y.-X.; Li, Y.-Q.; Wang, Q.-M. Bioorg. Med. Chem. 2016, 24, 474. doi: 10.1016/j.bmc.2015.08.015
-
[11]
Karakurt, A.; Alagöz, M. A.; Sayoglu, B.; Çalıs, Ü.; Dalkara, S. Eur. J. Med. Chem. 2012, 57, 275. doi: 10.1016/j.ejmech.2012.08.037
-
[12]
Liu, A.; Wang, X.; Chen, C.; Pei, H.; Mao, C.; Wang, Y.; He, H.; Huang, L.; Liu, X.; Hu, Z.; Ou, X.; Huang, M.; Yao, J. Pest. Manage. Sci. 2009, 65, 229. doi: 10.1002/ps.v65:3
-
[13]
Harini, S. T.; Kumar, H. V.; Rangaswamy, J.; Naik, N. Bioorg. Med. Chem. Lett. 2012, 22, 7588. doi: 10.1016/j.bmcl.2012.10.019
-
[14]
夏丽娟, 王晓斌, 谢艳, 王晓燕, 肖维, 钟新敏, 黄民国, 薛伟, 应用化学, 2017, 34, 316. doi: 10.11944/j.issn.1000-0518.2017.03.160219Xia, L.-J.; Wang, X.-B.; Xie, Y.; Wang, X.-Y.; Xiao, W.; Zhong, X.-M.; Huang, M.-G.; Xue, W. Chin. J. Appl. Chem. 2017, 34, 316(in Chinese). doi: 10.11944/j.issn.1000-0518.2017.03.160219
-
[15]
Gedig, T.; Dettner, K.; Seifert, K. Tetrahedron 2007, 63, 2670. doi: 10.1016/j.tet.2007.01.024
-
[16]
孙家隆, 慕卫, 农药实验技术与指导, 化学工业出版社, 北京, 2009, pp. 228~229.Sun, J.-L.; Mu, W. Pesticide Science Experimental Techniques and Guidance, Chemical Industry Press, Beijing, 2009, pp. 228~229(in Chinese).
-
[1]
-
表 1 化合物3a~3l的抑菌活性
Table 1. Antifungal activity for the target compounds 3a~3l
Compd. R EC50a/(µg•mL-1) S. sclerotiorum B. cinerea 3a H 24.62 (18.82~32.20) 64.59 (51.91~80.35) 3b 2-CH3 42.09 (34.88~50.80) 46.44 (43.61~49.43) 3c 3-CH3 18.83 (16.91~20.95) 37.74 (31.08~45.83) 3d 4-CH3 15.77 (15.18~16.39) 8.00 (6.99~9.17) 3e 2-CH3O 62.02 (59.00~65.19) 71.78 (64.60~79.76) 3f 3-CH3O 25.13 (20.85~30.29) 67.13 (62.18~72.46) 3g 4-CH3O 11.89 (11.15~12.69) 35.32 (34.09~36.59) 3h 4-Br 5.07 (4.31~5.98) 4.98 (4.55~5.44) 3i 2-Cl 43.80 (32.69~58.68) 52.51 (41.48~66.46) 3j 4-Cl 4.81 (3.87~5.97) 5.44 (5.08~5.83) 3k 2, 4-Cl 25.80 (21.91~30.37) 46.92 (38.82~56.69) 3l 3, 4-Cl 9.51 (7.19~12.60) 6.34 (5.64~7.13) Triadimefon 11.69 (10.85~12.61) 10.41 (8.22~13.19) Chlorothalonil 3.52 (2.63~4.90) 6.28 (4.32~8.05) a 95% CL: 95% confidence interval. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 4
- 文章访问数: 2137
- HTML全文浏览量: 237



 下载:
下载:

 下载:
下载:

