 图1
LDHs的X射线衍射谱图(A)和PNIPA/LDHs复合水凝胶的红外光谱(B)
Figure1.
XRD spectrum of Mg-Al-LDHs1(A) and FTIR spectra of PNIPA/LDHs hydrogels(B)
图1
LDHs的X射线衍射谱图(A)和PNIPA/LDHs复合水凝胶的红外光谱(B)
Figure1.
XRD spectrum of Mg-Al-LDHs1(A) and FTIR spectra of PNIPA/LDHs hydrogels(B)

Citation: DUAN Yuanshou, JIA Fengxia, WANG Shuo, LI Lifang. Synthesis and Thermosensitivity of Poly(N-isopropylacrylamide)/Hydrotalite Hydrogel[J]. Chinese Journal of Applied Chemistry, 2018, 35(1): 102-108. doi: 10.11944/j.issn.1000-0518.2018.01.170034

聚N-异丙基丙烯酰胺/类水滑石复合水凝胶的制备及温敏性
-
关键词:
- 聚N-异丙基丙烯酰胺
- / 类水滑石
- / 水凝胶
- / 温敏性
English
Synthesis and Thermosensitivity of Poly(N-isopropylacrylamide)/Hydrotalite Hydrogel
-
Key words:
- poly-N-isopropylacrylamide
- / layered double hydroxides
- / hydrogel
- / thermosensitivity
-
温敏性水凝胶属于智能水凝胶的一种[1-3]。其中,物理性水凝胶属于原位水凝胶的一种,是以氢键、盐键、静电引力、范德华力、π-π共轭等作用形成凝胶的[4],可实现可逆的溶胶-凝胶(sol-gel)相转变过程,具有良好的可注射性,可广泛地应用在医疗整形、软骨重建、药物控释、心脏修复、紧急止血等领域[5-7],因而备受关注。在软骨重建组织工程修复过程中,传统温敏水凝胶多用化学交联剂交联形成,属于体型高分子,不具可注射性,增加了操作的难度。与传统温敏水凝胶相比,可注射水凝胶生物活性高,不仅能增强生物相容性,提高细胞粘附性,提供细胞生长的微环境,而且具有成本低、塑型方便、操作便利、手术难度低、患者痛苦少等优点[8-9]。
聚合物/无机纳米复合材料兼具高分子材料密度低、耐磨、耐腐蚀等特点以及纳米无机颗粒的表面效应强、力学性能好的特点[10-14]。聚N-异丙基丙烯酰胺(PNIPA)水凝胶具有良好的温敏性,其最低临界溶解温度(LCST)与人体生理学温度接近,且具有良好的生物相容性[15],但其力学强度较低,不能胜任组织工程的需要。类水滑石(LDHs)是具有特有六角形片状晶体结构的双金属氢氧化物,具有片层电荷密度可调、层间阴离子可调的特点,也具有良好的生物相容性和生物可降解性。功能化修饰后的LDHs可在很多高分子聚合物中实现纳米分散,从而显著提高聚合物的机械及力学性能[16]。
本文中,我们以LDHs纳米粒子为交联剂,通过引发自由基聚合,合成了PNIPA/LDHs复合水凝胶,研究了LDHs片层组成及添加量对复合水凝胶温敏性能的影响。以期制备得到温敏性好、可逆性好、开发前景优的水凝胶材料。
1 实验部分
1.1 试剂和仪器
N-异丙基丙烯酰胺(NIPA,≥98%)购自上海阿达玛斯公司;过硫酸钾(KPS,≥99.5%)和四甲基乙二胺(TEMED,≥99%)购自上海阿拉丁化学试剂有限公司;无水乙醇(≥99.7%)、氢氧化钠、硝酸铝和硝酸镁,均为分析纯,购自天津市凯通化学试剂有限公司。
Nicolet380型傅里叶变换红外光谱仪(FT-IR, 美国Thermo Nicolet公司);UV-2450型紫外可见分光光度计(日本岛津公司);SU8020型扫描电子显微镜(SEM, 日本日立公司);ALPHA-2-4LD型真空冷冻干燥机(德国Christ公司);D8 Advance型X射线衍射仪(XRD, 德国Bruker公司);DTG-60A/60AH型热重分析仪(日本岛津公司);Q10型示差扫描量热仪(DSC, 美国TA公司)。
1.2 实验方法
1.2.1 Mg-Al-LDHs的制备
按照文献[17]的方法,采用混合共沉淀法制备Mg-Al-LDHs。将初始原料比n[Mg(NO3)2]:n[Al(NO3)3]=3:1的合成LDHs标记为LDHs1,将n[Mg(NO3)2]:n[Al(NO3)3]=2:1记做LDHs2。
1.2.2 PNIPA/LDHs复合凝胶的制备
称取0.6 g的NIPA、0.01 g的KPS到磨口圆底烧瓶中,再分别加入1、2、4和6 mL质量分数为6%的LDHs溶液,用2次重蒸水补加至总质量为6 g。低温超声震荡2~4 min至药品完全溶解。N2气保护下,向体系中加入6 μL TEMED,并迅速密封整个装置,强烈搅拌15 s后,置于20 ℃恒温水浴中,反应19 h。反应完成后,将凝胶浸泡在重蒸水中反复洗涤5次,每隔8 h,换1次重蒸水,以除去体系中未反应的小分子物质。复合水凝胶以合成时原料中LDHs种类及所占质量分数表示,如PNIPA/LDHs1-2%等。
1.2.3 水凝胶的理化性质
LDHs样品的XRD分析是根据合成样品的特征衍射峰,证实LDHs的存在。实验采用Cu靶Kα射线,40 kV管电压,λ=0.145 nm,管电流30 mA。FT-IR用以比较原材料NIPA、LDHs和复合水凝胶的功能基团,确定水凝胶中LDHs的掺入。水凝胶使用前完全干燥,与KBr充分研磨,压片后测定。热重分析主要用于证实水凝胶中LDHs的存在,升温速率为20 ℃/min。DSC升温速率为5 ℃/min。SEM观察是先将复合水凝胶置于1 cm×1 cm×5 cm的玻璃模具中冷冻定型(常压-25 ℃,初冻4 h),取出在真空冷冻干燥机中冷冻干燥(-80 ℃,40 h),然后于液氮中淬断,断面喷金后观察。
1.2.4 复合水凝胶的温敏性测定
复合水凝胶的温敏性采用透光率法[5]。将复合水凝胶密封于石英比色皿中,置于28 ℃的恒温水浴中恒温10 min,保证水凝胶的温度达到平衡。取出迅速擦干,置于紫外可见扫描分光光度计中,测定500 nm处透光率。调节恒温槽温度每次升高1 ℃,重复以上操作。
1.2.5 复合水凝胶的热可逆性
将复合水凝胶密封于石英比色皿中,依次置于20、40 ℃的恒温水浴中,恒温10 min,迅速取出擦干,测其500 nm处的透光率。冷热循环次数为5。
1.2.6 胶凝化时间的测定
胶凝化时间采用试管倾倒法测定。将装有复合水凝胶的具塞平底试管倒置于37 ℃的恒温水浴中,观察复合凝胶的相转变行为,以试管倒置凝胶不流动判定为已经固化,将所需时间作为胶凝化时间。
2 结果与讨论
2.1 PNIPA/LDHs复合水凝胶的结构分析
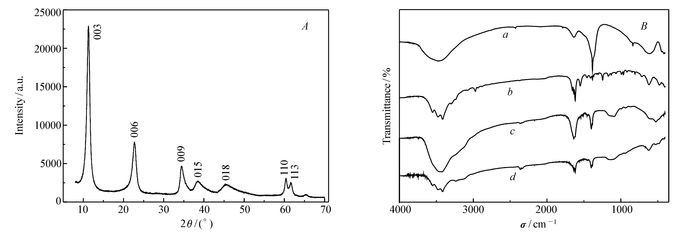
通过XRD和FTIR研究了水凝胶的结构。LDHs1样品的XRD图谱如图 1A所示。由图 1A可见,所合成的样品具有类水滑石样品在003、006和009晶面的特征衍射峰,且峰形尖锐,表明所合成的样品晶形单一,结构良好[17]。由合成PNIPA/LDHs复合水凝胶的过程发现,凡加有LDHs的体系,均能形成水凝胶,无需再加交联剂;但未加有LDHs的体系,则不能形成水凝胶。说明LDHs在PNIPA聚合时起到了交联剂的作用。
 图1
LDHs的X射线衍射谱图(A)和PNIPA/LDHs复合水凝胶的红外光谱(B)
Figure1.
XRD spectrum of Mg-Al-LDHs1(A) and FTIR spectra of PNIPA/LDHs hydrogels(B)
图1
LDHs的X射线衍射谱图(A)和PNIPA/LDHs复合水凝胶的红外光谱(B)
Figure1.
XRD spectrum of Mg-Al-LDHs1(A) and FTIR spectra of PNIPA/LDHs hydrogels(B)
图 1B给出了PNIPA/LDHs复合水凝胶及两种原材料LDHs和NIPA的红外图谱。由LDHs的红外图谱可以看出,3450 cm-1附近的宽峰来自于水滑石层板及层间水的νOH对称收缩振动,与自由羟基(>3650 cm-1)相比,LDHs的νOH对称收缩有较小的数值,表示LDHs的片层和层间水的羟基均以氢键相连[18];在1637、1385、1000~500 cm-1处的吸收峰分别为νOH的弯曲振动峰,—NO3的对称伸缩吸收峰和水滑石的骨架振动[19]。LDHs的红外图谱中未见O—C—O的对称或不对称伸缩振动峰(应该出现在1355和1500 cm-1附近),说明所合成样品中未有CO2的进入[20]。NIPA样品在3450 cm-1附近出现的钝峰,为νN—H的伸缩振动,在1622 cm-1附近的峰为典型的酰胺Ⅰ带νC=O的伸缩振动峰,1553 cm-1是酰胺Ⅱ带N—H的弯曲振动峰,1379 cm-1附近的小峰则归因于异丙基中的甲基变形振动,1247 cm-1处是酰胺Ⅲ的N—H弯曲的特征吸收峰[5]。PNIPA/LDHs复合水凝胶在1629 cm-1仍保留酰胺Ⅰ带νC=O的较强吸收峰,但酰胺Ⅱ带N—H的弯曲振动峰消失,在1400 cm-1处出现了—NO3的对称伸缩吸收峰,表示LDHs在复合水凝胶中的存在。在1141~1086 cm-1附近出现一个大的较宽吸收峰,归因于异丙基基团的C—H拉伸振动。与NIPA特征酰胺吸收峰相比,酰胺Ⅱ带N—H弯曲振动峰的消失,可表明PNIPA与LDHs或水分子间氢键的形成。所以LDHs对PNIPA的交联,可能是由氢键、静电引力等弱相互作用引起的,不属于作用力较强的化学交联。
通过SEM研究了水凝胶的微观形貌,如图 2所示。由图 2可以看出,在没有添加任何制孔剂的情况下,所合成的水凝胶具有一定的孔洞结构。孔洞结构可为移植细胞的迁移、增殖提供空间,提高细胞存活性[21]。
2.2 PNIPA/LDHs复合水凝胶的温敏性能
温度敏感性是温敏性智能高分子水凝胶的重要特征。将实验所合成的PNIPA/LDHs复合材料采用紫外可见分光光度计测定透光率的方法研究温敏性,结果如图 3所示。可见,所示复合水凝胶均具有温敏性。在温度较低范围,T<33 ℃时,复合水凝胶外观呈透明液体,透光率较高且变化不大,当温度升高到33 ℃后,透光率急剧下降,样品外观逐渐变至不透明的白色固态。所有样品均有相同的变化趋势。由图 3还可以看出,水凝胶的透光率亦受LDHs片层组成及n(Mg):n(Al)的影响。n(Mg):n(Al)=3:1的PNIPA/LDHs1系列样品均有较高的透光率,并显示出随着LDHs含量的增加透光率减小的趋势。透光率的变化实际是PNIPA亲水亲油性或最低临界溶解温度(LCST)随温度的改变。在LCST以下,PNIPA中酰胺基以氢键形式与溶剂水分子有较强的作用,PNIPA水溶性好,所以呈液态;在LCST以上,PNIPA与水分子相互作用降低,PNIPA分子间或与LDHs间作用增强,相互交联形成网状结构,因此颜色和流动性均发生改变。随PNIPA/LDHs1中LDHs质量分数的增加透光率降低,说明无机LDHs的加入,会影响透光性。值得注意的是,实验条件下不同LDHs含量的PNIPA/LDHs1透光率转折点温度均相同,说明所制备的复合材料的温敏性取决于PNIPA,与LDHs质量分数无关,也与LDHs片层金属摩尔比无关。
将复合PNIPA/LDHs1-2%分别置于20、40 ℃的恒温水浴中,测其透光率随循环次数的变化,以测试复合水凝胶温敏可逆性,结果如图 4所示。可见,复合水凝胶的透光率具有相当好的可逆性。当冷热循环次数为5时,其在高低温时的透光率非常稳定。说明温敏特性没有变化,所以制备的复合水凝胶是一种稳定可逆的温敏材料。由此sol-gel过程的多次转变,也可以说明所合成的水凝胶是由非化学键交联而形成的。可以推知,所合成的PNIPA为线型高分子结构,在较低温度时,侧链上的酰胺基团多以氢键与水分子结合,柔性较强,呈溶液状态,而温度升高时,水分子热运动增强,导致水分子与酰胺基之间的氢键作用减弱,PNIPA上羰基受到LDHs层板所带正电荷的吸引,呈较规整的刚性排列,并与LDHs片层上羟基间形成氢键,整个体系变成以LDHs为交联剂、失去流动性的固体状态。
胶凝时间也是智能温敏材料的一个重要指标,表示了对温度响应时间的长短。LDHs质量分数及金属片层组成对复合水凝胶胶凝时间的影响如图 5所示。可见,LDHs含量和金属片层组成对复合水凝胶溶液的凝胶化时间影响不大,基本均在100 s左右,温度响应性好。
2.3 PNIPA/LDHs复合水凝胶的热稳定性
图 6是LDHs和NIPA及水凝胶的TG/DTA图。由图 6A可见,NIPA失重主要发生在150 ℃左右,亦即此温度下就会发生NIPA结构的分解;LDHs的失重则分成不甚明显的3段,第1次失重发生于50~150 ℃之间,主要是LDHs吸附水分的失去,发生于300 ℃以后的失重主要是LDHs层间水和片层结构的破坏[17]。复合水凝胶300 ℃前质量的缓慢下降可归因于吸附水的失去,而其第1次明显失重则发生在300 ℃,表示复合凝胶结构的分解。到达600 ℃时,复合水凝胶仍有少量物质剩余,而不像NIPA一样全部分解,表示LDHs虽经多次洗涤,并没有全部失去。由图 6B可以看出,原料NIPA的吸热峰主要在150 ℃左右,而表示失去层间水和结构破坏的LDHs吸热峰主要是在330和480 ℃,复合水凝胶的主要吸热峰则在400和520 ℃左右,由此看见,复合水凝胶的吸热峰比NIPA提高了近250 ℃,表明LDHs粒子可明显改善水凝胶的热稳定性能。
通过DSC考察LDHs含量和片层组成对LCST的影响,如图 7所示。可见,随着LDHs含量的增加,复合凝胶的吸热峰温度稍有增加,而随n(Mg):n(Al)的减小,吸热峰值稍有减小。说明LDHs粒子交联的PNIPA/LDHs复合凝胶,其LCST主要由PNIPA决定,LDHs的存在,对其LCST影响不大。这个结论与前面透光率实验基本一致,但透光率实验温度设置跨度较大(1 ℃),所以才掩盖了LDHs含量和组成所造成的影响。
3 结论
本文采用自由基引发聚合合成了有机无机复合水凝胶PNIPA/LDHs,该水凝胶采用物理交联方式,具有温度响应快和可逆的特点,其LCST主要取决于PNIPA结构,随LDHs质量分数的增加有较小的增加,但LDHs质量分数和组成对复合水凝胶的透光率影响较大,LDHs的存在使PNIPA/LDHs复合水凝胶的热稳定性大大增强。制备得到的PNIPA/LDHs复合水凝胶有望做可注射性软骨支架材料,应用于人体组织工程,进行软骨损伤修复或重建。
-
-
[1]
Li L, Gu J, Zhang J. Injectable and Biodegradable pH-Responsive Hydrogels for Localized and Sustained Treatment of Human Fibrosarcoma[J]. ACS Appl Mater Interfaces, 2015, 7(15): 8033-8040. doi: 10.1021/acsami.5b00389
-
[2]
Andhariya N, Chudasama B, Mehta R V. Biodegradable Thermoresponsive Polymeric Magnetic Nanoparticles:A New Drug Delivery Platform for Doxorubicin[J]. J Nanopart Res, 2011, 13(4): 1677-1688. doi: 10.1007/s11051-010-9921-6
-
[3]
He T, Zou C, Song L. Improving Antiadhesion Effect of Thermosensitive Hydrogel with Sustained Release of Tissue-type Plasminogen Activator in a Rat Repeated-injury Model[J]. ACS Appl Mater Interfaces, 2016, 8(49): 33514-33520. doi: 10.1021/acsami.6b13184
-
[4]
Ding X, Wang Y. Weak Bond-based Injectable and Stimuli Responsive Hydrogels for Biomedical Applications[J]. J Mater Chem B, 2017, 5: 887-906. doi: 10.1039/C6TB03052A
-
[5]
Ren Z, Wang Y, Ma S. Effective Bone Regeneration Using Thermosensitive Poly(N-Isopropylacrylamide) Grafted Gelatin as Injectable Carrier for Bone Mesenchymal Stem Cells[J]. ACS Appl Mater Interfaces, 2015, 7(34): 19006-19015. doi: 10.1021/acsami.5b02821
-
[6]
Yang J, Lith R V, Baler K. A Thermoresponsive Biodegradable Polymer with Intrinsic Antioxidant Properties[J]. Biomacromolecules, 2014, 15(11): 3942-3952. doi: 10.1021/bm5010004
-
[7]
Kumar R A, Sivashanmugam A, Deepthi S. Injectable Chitin-poly(ε-Caprolactone)/Nanohydroxyapatite Composite Microgels Prepared by Simple Regeneration Technique for Bone Tissue Engineering[J]. ACS Appl Mater Interfaces, 2015, 7(18): 9399-9409. doi: 10.1021/acsami.5b02685
-
[8]
Choi B, Kim S, Lin B. Cartilaginous Extracellular Matrix-modified Chitosan Hydrogels for Cartilage Tissue Engineering[J]. ACS Appl Mater Interfaces, 2014, 6(22): 20110-20121. doi: 10.1021/am505723k
-
[9]
Xuan S, Lee C U, Chen C. Thermoreversible and Injectable ABC Polypeptoid Hydrogels:Controlling the Hydrogel Properties Through Molecular Design[J]. Chem Mater, 2016, 28(3): 727-737. doi: 10.1021/acs.chemmater.5b03528
-
[10]
Cui Z, Milani A H, Greensmith P J. A Study of Physical and Covalent Hydrogels Containing pH Responsive Microgel Particles and Graphene Oxide[J]. Langmuir, 2014, 30(44): 13384-13393. doi: 10.1021/la5032015
-
[11]
Xavier J R, Thakur T, Desai P. Bioactive Nanoengineered Hydrogels for Bone Tissue Engineering:A Growth-factor-free Approach[J]. ACS Nano, 2015, 9(3): 3109-3118. doi: 10.1021/nn507488s
-
[12]
Li W, Wang J, Ren J. 3D Graphene Oxide Polymer Hydrogel:Near-Infrared Light-triggered Active Scaffold for Reversible Cell Capture and on-Demand Release[J]. Adv Mater, 2013, 25(46): 6737-6743. doi: 10.1002/adma.v25.46
-
[13]
Bordes P, Pollet E, Avérous L. Nano-biocomposites:Biodegradable Ployester/nanoclay Systems[J]. Prog Polym Sci, 2009, 34(2): 125-155. doi: 10.1016/j.progpolymsci.2008.10.002
-
[14]
France K J D, Chan K J W, Cranston E D. Enhanced Mechanical Properties in Cellulose Nanocrystal-poly(Oligoethylene Glycol Methacrylate) Injectable Nanocomposite Hydrogels Through Control of Physical and Chemical Cross-Linking[J]. Biomacromolecules, 2016, 17: 649-660. doi: 10.1021/acs.biomac.5b01598
-
[15]
Patenaude M, Hoare T. Injectable, Degradable Thermoresponsive Poly(N-Isopropylacrylamide) Hydrogels[J]. ACS Macro Lett, 2012, 1(3): 409-413. doi: 10.1021/mz200121k
-
[16]
Shu Y, Yin P, Liang B. Bioinspired Design and Assembly of Layered Double Hydroxide/poly(Vinyl Alcohol) Film with High Mechanical Performance[J]. ACS Appl Mater Interfaces, 2014, 6(17): 15154-15161. doi: 10.1021/am503273a
-
[17]
Xu M, Li L, Xu J. Synthesis and Characterization of Alkyl Polyglycoside Intercalated Layered Double Hydroxides[J]. J Disper Sci Technol, 2011, 32(7): 1008-1013. doi: 10.1080/01932691.2010.497458
-
[18]
Velu S, Ramkumar V, Abathodharanan N. Effect of Interlayer Anions on the Physicochemical Properties of Zinc-Aluminum Hydrotalcite-like Compounds[J]. J Mater Sci, 1997, 32(4): 957-964. doi: 10.1023/A:1018561918863
-
[19]
Aisawa S, Ohnuma Y, Hirose K. Intercalation of Nucleotides into Layered Double Hydroxides by Ion-exchange Reaction[J]. Appl Clay Sci, 2005, 28(1): 137-145.
-
[20]
Khassin A A, Yurieva T M, Kustova G N. Cobalt-Aluminum Co-precipitated Catalystsand Their Performance in the Fischer-tropsch Synthesis[J]. J Mol Catal A-Chem, 2001, 168(1/2): 193-207.
-
[21]
Dong R, Zhao X, Guo B. Self-healing Conductive Injectable Hydrogels with Antibacterial Activity as Cell Delivery Carrier for Cardiac Cell Therapy[J]. ACS Appl Mater Interfaces, 2016, 8(27): 17138-17150. doi: 10.1021/acsami.6b04911
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 2
- 文章访问数: 1554
- HTML全文浏览量: 295








 下载:
下载:






 下载:
下载:

