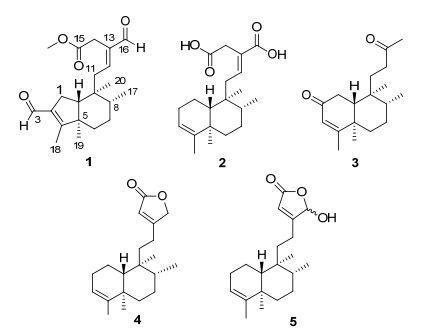
 图1
化合物1~5的结构
Figure1.
Structures of compounds 1~5
图1
化合物1~5的结构
Figure1.
Structures of compounds 1~5

Citation: Li Xiaobao, Chen Guangying, Shao Taiminga, Song Xiaoping, Han Changri, Yu Zhangxin. Clerodane Diterpenes from the Roots of Polyalthia laui[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2763-2766. doi: 10.6023/cjoc201705035

海南暗罗根克罗烷型二萜化学成分研究
English
Clerodane Diterpenes from the Roots of Polyalthia laui
-
Key words:
- Polyalthia laui
- / clerodane diterpenes
- / cytotoxicities
-
海南暗罗(Polyalthia laui)为番荔枝科暗罗属(Polyalthia)植物, 是一种乔木.该属植物全球大约有120余种, 主要分布于从泰国、越南、印度到菲律宾的热带和亚热带地区[1].我国有17种, 主要产自与台湾、海南、广东等南部地区.海南暗罗是海南的特有物种, 一直以来对治疗痛经、梅核气、气滞腹痛等疾病有较好的疗效[2, 3].截至目前, 国内外学者已从暗罗属植物中得到二萜类、三萜类、番荔枝内酯类、生物碱等多种化学成分[4~6].但对海南暗罗的化学成分研究报道还很少, 只有我们课题组前期对其萜类成分进行了报道[7, 8].为了探索其代谢产物的多样性以及筛选出具有更好生物活性的天然产物, 我们对海南暗罗根化学成分进行了系统研究, 从中获取了5个克罗烷型二萜类化合物(图 1): (4→2) 重排-2, 13-二甲酰基-克罗烷-2, 12E-二双键-15-甲酯(1)、克罗烷-3, 12E-二双键-15, 16-二甲酸(2)、14, 15-降二碳克罗烷-3-双键-2, 13-二酮(3)、克罗烷-3, 13Z-二双键-15, 16-内酯(4)、16-羟基克罗烷-3, 13Z-二双键-15, 16-内酯(5).其中化合物1~2为新化合物.化合物1~5的体外细胞毒活性筛选结果表明, 它们对4种肿瘤细胞株(Hela、A549、MCF-7和HL-60) 均显示出了一定的体外生长抑制活性, 其IC50值为13.22~37.16 μmol/L.其中化合物2对肺腺细胞(A549) 和乳腺癌细胞(MCF-7) 的生长抑制活性都强于阳性对照药顺铂.
1 结果与讨论
1.1 化合物1的结构鉴定
化合物1:无色油状物, 易溶于氯仿.其HR(ESI)MS显示该化合物的分子式为C21H31O4 ([M+ H]+ 347.2216, 计算值为347.2217), 不饱和度为7. IR光谱中, 1691和2923 cm-1处吸收带显示, 该化合物存在共轭醛官能团. 1H NMR谱(表 1)给出5个甲基信号[δH 0.84 (d, J=6.4 Hz, 3H), 0.94 (s, 3H), 0.96 (s, 3H), 2.03 (s, 3H), 3.66 (s, 3H)], 2个次甲基信号[δH 1.41~1.46 (m, 1H)和1.61~1.64 (m, 1H)]; 在低场区给出2个醛氢信号[δH 9.41 (s, 1H)和9.95 (s, 1H)], 1个烯氢信号[δH 6.76 (t, J=7.6 Hz, 1H)], 另外还给出10个质子信号. 13C NMR和DEPT谱(表 1), 共给出21个碳信号, 其中包括2个醛基, 1个羰基, 1个三取代双键, 1个四取代双键及9个sp3碳原子.此外, 9个sp3碳原子分别为2个季碳, 2个次甲基和5个甲基.以上数据表明该化合物是一个重排的克罗烷型二萜类化合物[9].分析发现, 其1H NMR和13C NMR谱数据与(4→2) 重排-2, 13-二甲酰基-克罗烷-2, 12E-二双键-14-甲酸[8]的数据非常相似.主要区别在于化合物1多了一个甲氧基信号[δH3.66 (s, 3H)和δC 52.3], 推测化合物(4→2) 重排-2, 13-二甲酰基-克罗烷-2, 12E-二双键-14-甲酸中的羟基在1中被甲酯化.以上推测通过HMBC谱(图 2) H-OCH3与C-15 (δC 170.6) 的强相关信号得以证实.在NOESY谱(图 2)中, CH3-17/ CH3-19/CH3-20之间NOE相关确定了CH3-17, CH3-19和CH3-20在同一平面; 其相对构型与(4→2) 重排-2, 13-二甲酰基-克罗烷-2, 12E-二双键-15-甲酯一致.至此完整确定了该化合物的结构, 命名为(4→2) 重排-2, 13-二甲酰基-克罗烷-2, 12E-二双键-15-甲酯.
 表 1
化合物1 (CDCl3)和2 (CD3OD)的1H (400 MHz)和13C (100 MHz) NMR数据
Table 1.
1H (400 MHz) and 13C (100 MHz) NMR data of compounds 1 (CDCl3) and 2 (CD3OD)
表 1
化合物1 (CDCl3)和2 (CD3OD)的1H (400 MHz)和13C (100 MHz) NMR数据
Table 1.
1H (400 MHz) and 13C (100 MHz) NMR data of compounds 1 (CDCl3) and 2 (CD3OD)
Position 1 2 δH (J in Hz) δC δH (J in Hz) δC 1 2.21 t (13.6), 2.31 dd (13.6, 6.0) 26.5 (CH2) 1.50~1.54 m, 1.92~1.96 m 19.9 (CH2) 2 137.0 (C) 1.98~2.02 m 27.7 (CH2) 3 9.95 s 188.7 (CH) 5.16 s 121.6 (CH) 4 171.5 (C) 145.0 (C) 5 51.0 (C) 39.5 (C) 6 1.36~1.39 m, 1.61~1.64 m 33.9 (CH2) 1.21~1.24 m, 1.72~1.77 m 37.8 (CH2) 7 1.51~1.53 m, 1.55~1.58 m 28.4 (CH2) 1.43~1.46 m, 1.47~1.50 m 28.6 (CH2) 8 1.41~1.46 m 39.0 (CH) 1.51~1.54 m 38.6 (CH) 9 39.7 (C) 41.6 (C) 10 1.61~1.64 m 55.2 (CH) 1.37 dd (11.6, 1.2) 49.2 (CH) 11 2.36 br d (7.6) 39.7 (CH2) 2.35 dd (16.0, 8.0) 2.24 dd (16.0, 8.0) 38.4 (CH2) 12 6.76 t (7.6) 153.3 (CH) 7.02 t (8.0) 143.0 (CH) 13 138.2 (C) 128.5 (C) 14 3.32 s 29.8 (CH2) 3.35 br s 33.3 (CH2) 15 170.6 (C) 174.8 (C) 16 9.41 s 193.7 (CH) 170.7 (C) 17 0.84 d (6.4) 15.7 (CH3) 0.87 d (6.0) 16.7 (CH3) 18 2.03 s 9.8 (CH3) 1.57 s 18.2 (CH3) 19 0.94 s 17.0 (CH3) 1.02 s 20.3 (CH3) 20 0.96 s 17.6 (CH3) 0.83 s 18.1 (CH3) OCH3 3.66 s 52.3 (CH3) 1.2 化合物2的结构鉴定
化合物2:无色油状物, 易溶于甲醇.其HR(ESI)MS给出该化合物的分子式为C20H31O4([M+ H]+ 335.2217, 计算值为335.2217), 不饱和度为6. IR光谱中, 1699, 2926和3439 cm-1处吸收带显示, 该化合物存在α, β-不饱羰基官能团. 1H NMR谱显示有4个甲基信号[δH 0.83 (s, 3H), 0.87 (d, J=6.0 Hz, 3H), 1.02 (s, 3H), 1.57 (s, 3H)] (表 1); 2个次甲基信号[1.37 (dd, J=11.6, 1.2 Hz, 1H)和1.51~1.54 (m, 1H)], 低场区显示2个烯氢信号[δH 5.16 (br s, 1H), 7.02 (t, J=8.0 Hz, 1H)], 另外还给出12个质子信号.在13C NMR谱和DEPT谱(表 1)中, 共显示20个碳信号.其中包括4个sp2和2个sp3季碳, 2个sp2和2个sp3 CH, 6个sp3 CH2以及4个甲基.仔细分析发现, 其1H NMR和13C NMR数据与克罗烷-3, 12E-二双键-15-甲酸-16-醛基[10]的数据非常类似.主要区别在于化合物2少了一个醛基信号且分子量比克罗烷-3, 12E-二双键-15-甲酸-16-醛基多了16个单位, 推测克罗烷-3, 12E-二双键-15-甲酸-16-醛基中的醛基在2中被羧基(δC 170.7) 取代.以上推测通过HMBC谱(图 3) H-12和H-14与C-16的相关信号证实.化合物2的相对构型可以通过NOESY相关(图 3)与克罗烷-3, 12E-二双键-15-甲酸-16-醛基一致.因此, 化合物被确定为克罗烷-3, 12E-二双键-15, 16-二甲酸.
除新化合物1和2外, 还得到已知化合物3~5, 经1H/13C NMR分析以及光谱数据与文献对比, 分别鉴定为14, 15-降二碳克罗烷-3-双键-2, 13-二酮[11]、克罗烷-3, 13Z-二双键-15, 16-内酯(4)[12]、16-羟基克罗烷-3, 13Z-二双键-15, 16-内酯(5)[12].其中化合物3是较为少见的降碳克罗烷型二萜.
采用噻唑蓝(MTT)比色法[13]对化合物1~5进行了4种常见的人体肿瘤细胞株的细胞毒活性评估, 以顺铂为阳性对照药物.结果表明所有化合物都具有一定的细胞毒活性, 其IC50值为13.22~37.16 μmol/L(表 2).其中化合物2对肺腺细胞(A549) 和乳腺癌细胞(MCF-7) 的生长抑制活性都强于阳性对照药.
化合物 IC50/(μmol•L-1) Hela A549 MCF-7 HL-60 1 33.72 27.81 31.95 25.97 2 27.75 13.22 20.28 25.12 3 22.86 30.45 37.16 37.06 4 33.52 35.20 36.82 27.30 5 32.01 36.84 33.56 35.68 顺铂 12.19 15.37 32.62 2.06 2 结论
运用硅胶柱色谱、凝胶柱色谱、反相柱色谱等分离方法, 从海南暗罗根中分离得到5个克罗烷型二萜类化合物: (4→2) 重排-2, 13-二甲酰基-克罗烷-2, 12E-二双键-15-甲酯(1)、克罗烷-3, 12E-二双键-15, 16-二甲酸(2)、14, 15-降二碳克罗烷-3-双键-2, 13-二酮(3)、克罗烷-3, 13Z-二双键-15, 16-内酯(4)、16-羟基克罗烷-3, 13Z-二双键-15, 16-内酯(5).其中化合物1~2为新化合物, 化合物3是较为少见的降碳克罗烷型二萜.对化合物1~5进行了4种常见人体肿瘤细胞株的细胞毒活性筛选, 结果表明所有化合物都具有一定的细胞毒活性, 其IC50值为13.22~37.16 μmol/L.其中化合物2对肺腺细胞(A549) 和乳腺癌细胞(MCF-7) 的生长抑制活性都强于阳性对照药.
3 实验部分
3.1 仪器与试剂
JASCO DIP-370型数字式旋光仪; Bio-Rad FTS-135型红外光谱仪; Bruker AV-400 MHz型核磁共振仪; LCMS-IT-TOF超高效液相色谱-高分辨质谱联用仪(日本岛津公司); Thermo Nicolet 6700(美国Nicolet公司); 半制备高效液相色谱仪Agilent 1260 infinity; 葡聚糖凝胶Sephadex LH-20[安法玛西亚技术(上海)有限公司]; 反相硅胶RP-18 (Merck公司); 柱层析硅胶和薄层层析硅胶板(青岛海洋化工厂); 色谱试剂均为分析纯.
3.2 植物材料
海南暗罗药材采自海南省昌江县霸王岭自然保护区, 经海南师范大学生命科学学院钟琼芯副教授鉴定为番荔枝科暗罗属植物海南暗罗(Polyalthia laui Merr.), 标本(No. HAN20140418) 现存于海南师范大学热带药用植物化学教育部重点实验室.
3.3 提取与分离
海南暗罗根(12.1 kg)用75%的乙醇溶液浸泡3次, 每次5 d.收集提取液, 真空浓缩后得到浸膏(721.3 g), 将浸膏分散在水中依次用石油醚/乙酸乙酯等极性溶剂进行多次萃取, 得到乙酸乙酯部位浸膏(182.6 g).对乙酸乙酯部位浸膏进行硅胶柱层析(100~200目), 以溶剂CHCl3/MeOH (V:V=100:1~1:100) 进行梯度洗脱, 得到7个组分(Fr.1~Fr.7). Fr.2 (32.5 g)经过硅胶柱层析(200~300目, 300~400目)用石油醚/乙酸乙酯(V:V=100:1~1:100) 进行反复分离, 再用反相硅胶[V(MeOH):V(H2O)=5:100~100:1]洗脱, 得到5个组分Fr.2.1~Fr.2.5. Fr.2.1 (1.1 g)经凝胶柱层析[Sephadex LH-20, V(CHCl3):V(MeOH)=1:1]纯化得到化合物3 (6.4 mg)和4 (11.2 mg). Fr.2.2 (5.8 g)经过反复硅胶柱层析[200~300目, 300~400目, V(CHCl3):V(MeOH)=15:1]得到3个组分Fr.2.2a~Fr.2.2c. Fr.3.2a (1.5 g)经反相硅胶柱层析[V(MeOH):V(H2O)=1:3]纯化后得到化合物1 (4.3 mg)和5 (12.4 mg), Fr.3.2b (0.61 g)经半制备型高效液相色谱仪Waters XBridge C18 (250 mm×10 mm, 5 μm, 55% CH3CN/H2O)分离得到化合物2 (7.8 mg).
(4→2) 重排-2, 13-二甲酰基-克罗烷-2, 12E-二双键-15-甲酯(1):无色油状物; [α]D25+25.8 (c 0.2, CHCl3); UV (CH3OH) λmax [log ε/(L•mol-1•cm-1)]: 234 (2.56) nm; 1H NMR和13C NMR (400/100 MHz, CDCl3)数据见表 1; IR (KBr) νmax: 2923, 1691, 1645, 1552, 1428, 1248, 1135, 758, 472 cm-1; HRESIMS calcd for C21H31O4 [M+H]+ 347.2217, found 347.2216.
克罗烷-3, 12E-二双键-15, 16-二甲酸(2):无色油状物; [α]D25-21.3 (c 0.2, CHCl3); UV (CH3OH) λmax [log ε/(L•mol-1•cm-1)]: 238 (2.52) nm; 1H NMR和13C NMR (400/100 MHz, CD3OD)数据见表 1; IR (KBr) νmax3439, 2926, 1699, 1642, 1557, 1385, 1185, 751, 475 cm-1; HRESIMS calcd for C20H31O4 [M+H]+ 335.2217, found 335.2217.
3.4 活性测试
细胞毒活性采用MTT比色法进行测试:取对数生长期细胞培养于96孔培养板内, 每孔100 μL(含1000~2000个肿瘤细胞).给药组加入含有不同浓度化合物, 每药设4~5个剂量组, 每组至少设3个平行孔.对照组加入与化合物等体积的溶剂.置于5% CO2培养箱中于37 ℃培养, 4 d后弃去培养液, 每孔加入200 μL 0.2% MTT溶液.再在37 ℃下保温4 h, 弃去上清液, 每孔加入二甲基亚砜(DMSO) 150 μL溶解甲臜颗粒, 轻度振荡后, 用酶标仪在参考波长450 nm、检测波长570 nm条件下测定光密度值(OD).绘制曲线, 计算IC50值.
辅助材料(Supporting Information) 化合物1和2的1H NMR、13C NMR、135-DEPT、1H-1H COSY、HSQC、HMBC、NOESY和HRESIMS谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Padmaa, M. P.; Khosa, R. L. J. Pharm. Res. 2009, 2, 594.
-
[2]
Kirtikar, K. R.; Basu, B. D. Indian Medicinal Plants, International Book Distributors, Dehradun, 1995, 562.
-
[3]
Goyal, M. M.; Gupta, A. Indian J. Pharmacol. 1987, 19, 216.
-
[4]
Panthama, N.; Chang, F. R.; Lee, T. H.; Panthama, N. J. Nat. Prod. 2010, 73, 1366. doi: 10.1021/np1001913
-
[5]
Phadnis, A. P.; Patwardhan, S. A.; Dhaneshwar, N. N.; Tavale, S. S.; Row, T. N. G. Phytochemistry 1988, 27, 2899. doi: 10.1016/0031-9422(88)80684-8
-
[6]
Lee, T. H.; Wang, M. J.; Chen, P. Y.; Wu, T. Y.; Wen, W. C.; Tsai, F. Y. J. Nat. Prod. 2009, 72, 1960. doi: 10.1021/np900207z
-
[7]
李小宝, 宋小平, 陈光英, 韩长日, 陈文豪, 郑彩娟, 宋鑫明, 有机化学, 2013, 33, 1333. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract343418.shtmlLi, X. B.; Song, X. P.; Chen, G. Y.; Han, C. R.; Chen, W. H.; Zheng, C. J.; Song, X. M. Chin. J. Org. Chem. 2013, 33, 1333(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract343418.shtml
-
[8]
Yu, Z. X.; Fu, Y. H.; Chen, G. Y.; Song, X. P.; Han, C. R.; Li, X. B.; Song, X. M.; Wu, A. Z.; Chen, S. C. Fitoterapia 2016, 111, 36. doi: 10.1016/j.fitote.2016.03.017
-
[9]
Bohlmann, F.; Singh, P.; Singh, R. K.; Joshi, K. C.; Jakupovic, J. Phytochemistry 1985, 24, 1114. doi: 10.1016/S0031-9422(00)83202-1
-
[10]
Kijjoa, A.; Pinto, M. M. M.; Pinto, P. M. M.; Herz, W. Phytochemistry 1993, 34, 457. doi: 10.1016/0031-9422(93)80030-V
-
[11]
He, H. P.; Shen, Y. M.; Zuo, G. Y.; Yang, X. S.; Hao, X. J. Helv. Chim. Acta 2003, 86, 3187. doi: 10.1002/(ISSN)1522-2675
-
[12]
Hara, N.; Asaki, H.; Fujimoto, Y.; Gupta, Y. K.; Singh, A. K. Phytochemistry 1995, 38, 189. doi: 10.1016/0031-9422(94)00583-F
-
[13]
Mosmann, T. J. Immunol. Methods 1983, 65, 55. doi: 10.1016/0022-1759(83)90303-4
-
[1]
-
表 1 化合物1 (CDCl3)和2 (CD3OD)的1H (400 MHz)和13C (100 MHz) NMR数据
Table 1. 1H (400 MHz) and 13C (100 MHz) NMR data of compounds 1 (CDCl3) and 2 (CD3OD)
Position 1 2 δH (J in Hz) δC δH (J in Hz) δC 1 2.21 t (13.6), 2.31 dd (13.6, 6.0) 26.5 (CH2) 1.50~1.54 m, 1.92~1.96 m 19.9 (CH2) 2 137.0 (C) 1.98~2.02 m 27.7 (CH2) 3 9.95 s 188.7 (CH) 5.16 s 121.6 (CH) 4 171.5 (C) 145.0 (C) 5 51.0 (C) 39.5 (C) 6 1.36~1.39 m, 1.61~1.64 m 33.9 (CH2) 1.21~1.24 m, 1.72~1.77 m 37.8 (CH2) 7 1.51~1.53 m, 1.55~1.58 m 28.4 (CH2) 1.43~1.46 m, 1.47~1.50 m 28.6 (CH2) 8 1.41~1.46 m 39.0 (CH) 1.51~1.54 m 38.6 (CH) 9 39.7 (C) 41.6 (C) 10 1.61~1.64 m 55.2 (CH) 1.37 dd (11.6, 1.2) 49.2 (CH) 11 2.36 br d (7.6) 39.7 (CH2) 2.35 dd (16.0, 8.0) 2.24 dd (16.0, 8.0) 38.4 (CH2) 12 6.76 t (7.6) 153.3 (CH) 7.02 t (8.0) 143.0 (CH) 13 138.2 (C) 128.5 (C) 14 3.32 s 29.8 (CH2) 3.35 br s 33.3 (CH2) 15 170.6 (C) 174.8 (C) 16 9.41 s 193.7 (CH) 170.7 (C) 17 0.84 d (6.4) 15.7 (CH3) 0.87 d (6.0) 16.7 (CH3) 18 2.03 s 9.8 (CH3) 1.57 s 18.2 (CH3) 19 0.94 s 17.0 (CH3) 1.02 s 20.3 (CH3) 20 0.96 s 17.6 (CH3) 0.83 s 18.1 (CH3) OCH3 3.66 s 52.3 (CH3) 表 2 化合物1~5细胞毒活性测试结果
Table 2. Cytotoxic activities of compounds 1~5
化合物 IC50/(μmol•L-1) Hela A549 MCF-7 HL-60 1 33.72 27.81 31.95 25.97 2 27.75 13.22 20.28 25.12 3 22.86 30.45 37.16 37.06 4 33.52 35.20 36.82 27.30 5 32.01 36.84 33.56 35.68 顺铂 12.19 15.37 32.62 2.06 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 1862
- HTML全文浏览量: 205




 下载:
下载:


 下载:
下载:

