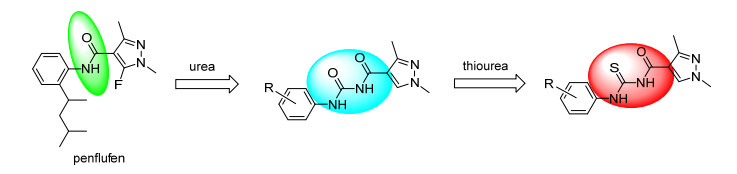
 图1
目标化合物的设计策略
Figure1.
Design strategy of title compounds
图1
目标化合物的设计策略
Figure1.
Design strategy of title compounds

Citation: Sun Nabo, Shen Zhonghua, Zhai Zhiwen, Han Liang, Weng Jianquan, Tan Chengxia, Liu Xinghai. Design, Synthesis, Fungicidal Activity and Docking Study of Acyl Thiourea Derivatives Containing Pyrazole Moiety[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2705-2710. doi: 10.6023/cjoc201704032

新型吡唑酰基硫脲类化合物的设计合成、杀菌活性与分子对接研究
English
Design, Synthesis, Fungicidal Activity and Docking Study of Acyl Thiourea Derivatives Containing Pyrazole Moiety
-
Key words:
- pyrazole
- / acyl thiourea
- / synthesis
- / fungicidal activity
- / docking
-
琥珀酸脱氢酶抑制剂作用于病原菌线粒体呼吸电子传递链上的琥珀酸脱氢酶或琥珀酸-泛醌还原酶, 是被国际杀菌剂抗性行动委员会(FRAC)新划分出来的一类作用机制和抗性机理相似的化合物[1].自从20世纪60年代莠锈灵(carboxin)和氧化莠锈灵(oxycarboxin)问世后, 靶向琥珀酸脱氢酶的杀菌剂已成为农业生产上的一类非常重要的品种.近年来, 一大批新颖结构的该类杀菌剂被开发出来[2], 如联苯吡菌胺、氟唑环菌胺、氟唑菌酰胺、吡唑萘菌胺、吡噻菌胺、呋吡菌胺、苯并烯氟菌唑等.该类杀菌剂分子结构变化比较大, 且近年来发现的大多含吡唑环[3~5], 如杨光富课题组[6, 7]利用药效团片段虚拟筛选(PFVS)方法创制出了新吡唑酰胺琥珀酸脱氢酶抑制剂:氟苯醚酰胺.本课题组也设计合成了多个系列的长链吡唑酰胺类化合物, 发现该类化合物具有很好的杀线虫活性[8~12]和杀菌活性[13, 14].另一方面, 硫脲类化合物因具有除草[15]、杀虫[16]、杀菌[17]、灭蚊[18]、抗癌[19]等多样性的生物活性而受到广泛关注.本课题组在商品化琥珀酸脱氢酶抑制剂和前期工作[20~25]的基础上, 将脲结构变换成硫脲结构[26], 合成了11个未见报道的吡唑酰基脲类新化合物6a~6k, 设计思路如图 1所示.
1 结果与讨论
1.1 合成
目标化合物的合成路线如Scheme 1所示.以乙酰乙酸乙酯与原甲酸三乙酯为原料, 经过缩合、环化两步反应制得关键中间体1-甲基-3-甲基-1H-吡唑-4-甲酸乙酯(2), 然后进行水解反应得到1-甲基-3-甲基-1H-吡唑-4-甲酸(3).再是与氯化试剂二氯亚砜反应得到吡唑酰氯4, 未经纯化直接用于下一步反应.在制备酰氯的过程中, 二氯亚砜既是反应物又充当溶剂.反应结束后, 需将多余的二氯亚砜除净, 否则对后续的酰基异硫氰酸酯的制备有较大的影响; 同时通过加入PEG-600, 可以提高酰基异硫氰酸酯的转化率.由于生成的酰基异硫氰酸酯易发生聚合或者水解, 在反应制备得到吡唑酰基异硫氰酸酯后, 及时与取代的胺反应, 产生氯化铵沉淀, 可以进行过滤除去.最终得到的吡唑酰基硫脲纯度高, 且易于通过重结晶进一步纯化.
合成的化合物6a~6k的核磁共振谱、高分辨质谱符合Scheme 1所示结构.以高活性化合物6k的波谱数据为例进行说明, 化学位移δ在9.01 (CONHCS)和11.91 (ArNH)处的单峰分别为酰基硫脲桥上两个N—H的质子信号峰, 后者的位移稍大一些是由于ArNH中的NH可以和羰基中的氧原子形成分子内氢键, 形成较稳定的六元环状结构; δ 7.96处的单峰为吡唑环上氢的质子信号峰; δ 3.89和2.54处的单峰分别为吡唑环上相连的N-甲基和C-甲基上氢的质子信号峰; 其余分别为苯环上氢的质子信号峰和两个乙基的质子信号峰; 同时高分辨质谱结果显示与分子量保持一致.
1.2 生物活性
番茄早疫病菌(Alternaria solani)、小麦赤霉病菌(FusaHum graminearum)、马铃薯晚疫病菌(Phytophthora infestans)、辣椒疫霉病菌(Phytophthora capsici)、黄瓜灰霉病菌(Botrytis cinerea)、油菜菌核病菌(Sclerotinia sclerotiorum)、水稻纹枯病菌(Thanatephorus cucumeris)、花生褐斑病菌(Cercospora arachidicola)、苹果轮纹病菌(Botryospuaeria berengeriana)的杀菌活性列于表 1, 测试浓度为50 μg/mL.由表 1可知, 在50 μg/mL的浓度下, 11个新吡唑酰基硫脲化合物对供试菌种均表现出一定的抑制活性.但整体来看, 在11个新化合物中, 化合物6k表现出较好的杀菌活性, 尤其是对于苹果轮纹病的抑制活性与对照药氟唑菌酰胺相当, 同时对花生褐斑病(70.0%)、黄瓜枯萎病(61.1%)、水稻纹枯病(69.8%)和番茄早疫病(64.5%)等也有中等的抑制活性.此外, 化合物6a, 6b, 6g和6i对苹果轮纹病也同样表现出了较好的杀菌活性(73%~85%).对番茄早疫病, 大部分化合物具有中等的抑制活性.如化合物6a, 6f, 6g, 6h, 6i, 6j和6k对番茄早疫病的抑制活性达中等(42%~65%), 逊于对照药氟唑菌酰胺(88.9%).对于油菜菌核病, 部分化合物表现出中等强度的杀菌活性, 如化合物6a (53.8%), 6b (53.8%), 6c (69.2%)和6g (57.7%).对于黄瓜灰霉病, 化合物6a (61.0%)和6b (61.0%)的抑制活性与对照药氟唑菌酰胺(63.6%)相当, 化合物6c (48.8%)和6g (56.1%)也表现出了中等强度的抑制活性.对于小麦赤霉病、马铃薯晚疫病、辣椒疫霉病, 对照药氟唑菌酰胺几乎无抑制作用, 而化合物6a~6e对辣椒疫霉病具有中等强度的抑制活性(42%~50%), 其它两个菌种也几乎没有活性.从表 2可以看出化合物6b和6k对苹果轮纹病具有优异的抑制活性, 对苹果轮纹病的EC50为10.41和9.28 μg/mL, 与对照药氟唑菌酰胺相比(EC50=7.93 μg/mL)活性相当.从目标化合物结构和杀菌活性的关系可以看出(表 1), 当苯环的靠近硫脲桥的附近有大体积的取代基时, 对苹果轮纹病的活性优于其他化合物; 而当含氟的取代基变换为三氟甲基时, 其活性降低, 说明电负性增大不利于提高活性.
Compd. R 番茄早疫 小麦赤霉 马铃薯晚疫 辣椒疫霉 油菜菌核 黄瓜灰霉 水稻纹枯 黄瓜枯萎 花生褐斑 苹果轮纹 6a 2-F 38.7 27.3 18.9 47.6 53.8 61.0 11.6 11.1 30.0 76.9 6b 3-F 48.4 12.1 24.3 47.6 53.8 61.0 12.8 16.7 50.0 84.6 6c 3, 4-F2 38.7 12.1 21.6 42.9 69.2 48.8 12.8 11.1 20.0 65.4 6d 2, 6-F2 32.3 45.5 16.2 42.9 19.2 22.0 17.4 27.8 20.0 53.8 6e 2-OCF3 29.0 15.2 21.6 45.2 38.5 24.4 17.4 22.2 20.0 46.2 6f 2-CF3 41.9 21.2 13.5 42.9 19.2 24.4 16.3 38.9 50.0 65.4 6g 2-CH3 45.2 21.2 16.2 50.0 57.7 56.1 23.3 22.2 10.0 73.1 6h 3, 5-(CH3)2 45.2 15.2 16.2 31.0 15.4 12.2 16.3 44.4 40.0 61.5 6i 4-Et 48.4 36.4 18.9 38.1 26.9 29.3 11.6 33.3 30.0 73.1 6j 2, 3, 4-F3 48.4 21.2 13.5 38.1 38.5 24.4 34.9 11.1 10.0 69.2 6k 2, 6-Et2 64.5 30.3 29.7 38.1 38.5 22.0 69.8 61.1 70.0 96.2 氟唑菌酰胺 88.9 30.3 29.7 38.1 96.4 63.6 88.4 44.4 100 84.6 Compd. y=a+bx r EC50/(μg·mL-1) 6b y=1.6661x+3.2750 0.9937 10.41 6k y=2.2238x+2.8481 0.9936 9.28 氟唑菌酰胺 y=1.1363x+3.9777 0.9825 7.93 1.3 分子对接
从PDB库(http://www.rcsb.org)下载琥珀酸脱氢酶与萎锈灵的复合晶体(PDB:2FBW)的PDB文件.蛋白结构的预处理在Discovery Studio 2.5软件中进行, 同时对目标化合物6k进行结构优化, 采用CDOCK模块进行分子对接, 输出20个对接结果, 选取打分最高的对接构象进行分析.本工作采用结合萎锈灵的琥珀酸脱氢酶复合物晶体结构作为对象进行分子对接研究[27, 28].如图 2所示, 目标化合物6k与SDH的相互作用图.其中, 目标化合物6k脲桥上的氨基和吡唑环上的氮原子分别与C链上的Ser39和His42残基形成氢键作用, 同时吡唑环与B链的His216形成π-π相互作用, 苯环与C链的Ile40形成σ-π相互作用.而商品化的先导化合物penflufen仅存在两个氢键, 分别是氟原子与C链上的Ser39和氧原子与B链的Trp173残基形成氢键作用.从图 2可见, 化合物6k与penflufen与酶的结合位点邻近B链和C链区域, 尤其是都与Ser39形成氢键.同时, 化合物6k引入硫脲桥之后, 化合物6k与酶之间形成了更为稳定的π-π相互作用, 这可能是化合物6k具有较高的杀菌活性的原因.
2 结论
本文以乙酰乙酸乙酯为原料, 经多步反应合成出一系列新型吡唑酰基硫脲类化合物, 目标化合物经核磁共振氢谱和高分辨质谱分析确定其结构.以番茄早疫病菌(Alternaria solani)、小麦赤霉病菌(Fusahum graminearum)、马铃薯晚疫病菌(Phytophthora infestans)、辣椒疫霉病菌(Phytophthora capsici)、黄瓜灰霉病菌(Botrytis cinerea)、油菜菌核病菌(Sclerotinia sclerotiorum)、水稻纹枯病菌(Thanatephorus cucumeris)、花生褐斑病菌(Cercospora arachidicola)、苹果轮纹病菌(Botryospuaeria berengeriana)分别进行了杀菌活性筛选.结果显示大部分化合物对苹果轮纹病菌具有较好的杀菌活性, 尤其是化合物6k可以作为先导化合物进一步优化.
3 实验部分
3.1 仪器与试剂
北京泰克仪器有限公司X-4数字显示显微熔点仪温度计未校正; BRUKER 400 MHz和500 MHz核磁共振仪(CDCl3为溶剂, TMS为内标); 安捷伦LC-QTOF-MS高分辨质谱仪.试剂均采用分析纯试剂.未经处理, 直接使用.
3.2 实验方法
关键中间体1, 2, 3, 4参考文献方法[26, 13]合成.
3.2.1 目标化合物6a~6k的合成
将吡唑酰氯化合物4 (1.58 g, 10 mmol)加入到无水丙酮(20 mL)中, 加入硫氰酸铵(0.99 g, 13 mmol), 反应体系即刻有沉淀生成并变成红色, 室温搅拌1 h后反应体系变为黄色, 继续反应1 h, 反应停止, 抽滤除去固体杂质, 减压蒸馏得淡黄色固体吡唑酰基异硫氰酸酯5, 无需纯化直接用于下一步反应.
将0.36 g (2 mmol)吡唑酰基异硫氰酸酯溶于7 mL的CH2Cl2中, 滴入2 mmol的取代苯胺(对于固体的取代苯胺, 将其溶于CH2Cl2后再滴入), 加完后室温搅拌12 h, 生成固体, 抽滤, CH2Cl2洗涤, 干燥, 得系列化合物6a~6k.
N-(2-氟苯基)-1, 3-二甲基-1H-吡唑-4-酰基硫脲(6a):褐色固体, 产率60%. m.p. 144~146 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.56 (s, 3H, CH3), 3.92 (s, 3H, CH3), 7.17~7.26 (m, 4H, Ph), 7.96 (s, 1H, CH), 8.33 (t, J=7.2 Hz, 1H, Ph), 8.93 (s, 1H, NH), 12.67 (s, 1H, NH); 13C NMR (125 MHz, CDCl3) δ: 13.53, 38.37, 111.48, 115.56, 115.71, 124.19, 127.05, 128.01, 134.74, 135.24, 149.55, 150.98, 154.35, 156.31, 164.14, 164.46, 180.55; HRMS calcd for C13H14FN4OS [M+H]+ 293.0867, found 293.0860.
N-(3-氟苯基)-1, 3-二甲基-1H-吡唑-4-酰基硫脲(6b):褐色固体, 产率57.5%. m.p. 136~138 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.55 (s, 3H, CH3), 3.93 (s, 3H, CH3), 6.99~7.01 (m, 1H, Ph), 7.06~7.08 (m, 1H, Ph), 7.39 (t, J=2.0 Hz, 1H, Ph), 7.73 (d, J=10.0 Hz, 1H, Ph), 7.93 (s, 1H, CH), 8.79 (s, 1H, NH), 12.73 (s, 1H, NH); 13C NMR (125 MHz, CDCl3) δ: 13.51, 38.67, 108.99, 109.20, 110.53, 111.04, 111.24, 111.54, 112.68, 112.85, 120.24, 130.15, 130.22, 134.69, 135.23, 134.68, 135.23, 139.60, 149.53, 150.91, 160.66, 162.59, 163.99, 164.44, 179.51; HRMS calcd for C13H14FN4OS [M+H]+ 293.0867, found 293.0891.
N-((3, 4-二氟苯基)-1, 3-二甲基-1H-吡唑-4-酰基硫脲(6c):褐色固体, 产率60.7%. m.p. 155~157 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.54 (s, 3H, CH3), 3.92 (s, 3H, CH3), 7.14~7.22 (m, 2H, Ph), 7.78~7.82 (m, 1H, Ph), 7.94 (s, 1H, CH), 8.86 (s, 1H, NH), 12.64 (s, 1H, NH); 13C NMR (125 MHz, CDCl3) δ: 13.50, 38.35, 111.52, 112.20, 112.37, 114.14, 114.30, 117.07, 117.22, 121.77, 134.69, 135.22, 149.52, 150.91, 163.90, 164.43, 180.04; HRMS calcd for C13H13F2N4OS [M+H]+ 311.0773, found 311.0768.
N-(2, 6-二氟苯基)-1, 3-二甲基-1H-吡唑-4-酰基硫脲(6d):淡黄色固体, 产率46.7%. m.p. 163~164 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.56 (s, 3H, CH3), 3.93 (s, 3H, CH3), 7.04 (t, J=8.4 Hz, 2H, Ph), 7.33~7.40 (m, 1H, Ph), 7.91 (s, 1H, CH), 8.96 (s, 1H, NH), 11.83 (s, 1H, NH); 13C NMR (125 MHz, CDCl3) δ: 13.52, 38.79, 111.46, 111.74, 111.93, 116.11, 129.28, 129.36, 129.44, 134.75, 151.03, 156.99, 157.02, 158.97, 159.01, 163.70, 182.47; HRMS calcd for C13H13F2N4OS [M+H]+ 311.0773; found 311.0771.
N-(2-三氟甲氧基苯基)-1, 3-二甲基-1H-吡唑-4-酰基硫脲(6e):淡黄色固体, 产率50.6%. m.p. 111~113 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.57 (s, 3H, CH3), 3.93 (s, 3H, CH3), 7.31~7.33 (m, 1H, Ph), 7.37~7.41 (m, 2H, Ph), 7.94 (s, 1H, CH), 8.57 (d, J=8.4 Hz, 1H, Ph), 8.81 (s, 1H, NH), 12.90 (s, 1H, NH); 13C NMR (125 MHz, CDCl3) δ: 13.45, 38.79, 111.40, 121.48, 127.20, 127.41, 127.65, 131.02, 134.80, 135.24, 141.22, 150.98, 164.36, 180.47; HRMS (ESI) calcd for C14H14F3N4O2S [M+H]+ 359.0784, found 359.0792.
N-(2-三氟甲基苯基)-1, 3-二甲基-1H-吡唑-4-酰基硫脲(6f):淡黄色固体, 产率55.3%. m.p. 147~148 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.56 (s, 3H, CH3), 3.92 (s, 3H, CH3), 7.46 (t, J=7.6 Hz, 1H, Ph), 7.65 (t, J=8.0 Hz, 1H, Ph), 7.75 (t, J=8.0 Hz, 1H, Ph), 7.92 (t, J=8.4 Hz, 1H, Ph), 7.96 (s, 1H, CH), 8.98 (s, 1H, NH), 12.55 (s, 1H, NH); 13C NMR (125 MHz, CDCl3) δ: 13.51, 38.37, 111.40, 126.09, 126.13, 127.63, 130.96, 132.74, 134.82, 135.95, 150.99, 164.39, 181.98; HRMS (ESI) calcd for C14H14F3-N4OS [M+H]+ 343.0835, found 343.0827.
N-(2-氯苯基)-1, 3-二甲基-1H-吡唑-4-酰基硫脲(6g):淡黄色固体, 产率56.3%. m.p. 175~176 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.57 (s, 3H, CH3), 3.93 (s, 3H, CH3), 7.25~7.27 (m, 1H, Ph), 7.37 (d, J=8.0 Hz, 1H, Ph), 7.48~7.51 (m, 1H, Ph), 7.94 (s, 1H, CH), 8.31~8.33 (m, 1H, Ph), 8.85 (s, 1H, NH), 12.69 (s, 1H, NH); 13C NMR (125 MHz, CDCl3) δ: 13.54, 38.79, 111.48, 111.57, 127.20, 127.23, 128.07, 128.22, 128.35, 129.18, 129.44, 134.79, 135.24, 135.41, 150.96, 164.13, 164.46, 180.62; HRMS (ESI) calcd for C13H14ClN4OS [M+H]+ 309.0571, found 309.0564.
N-(3, 5-二甲基苯基)-1, 3-二甲基-1H-吡唑-4-酰基硫脲(6h):淡黄色固体, 产率64.7%. m.p. 142~143 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.36 (s, 3H, CH3), 2.55 (s, 3H, CH3), 3.92 (s, 3H, CH3), 6.86 (s, 1H, Ph), 7.31 (s, 2H, Ph), 7.92 (s, 1H, CH), 8.77 (s, 1H, NH), 12.48 (s, 1H, NH); 13C NMR (125 MHz, CDCl3) δ: 13.53, 20.85, 38.38, 111.63, 120.82, 121.61, 126.08, 127.59, 134.62, 135.26, 137.82, 149.55, 150.86, 164.13, 164.47, 179.06; HRMS (ESI) calcd for C15H19N4OS [M+H]+ 303.1274, found 303.1276.
N-(4-乙基苯基)-1, 3-二甲基-1H-吡唑-4-酰基硫脲(6i):褐色固体, 产率55.2%. m.p. 89~90 ℃; 1H NMR (500 MHz, DCCl3) δ: 1.26 (t, J=4.0 Hz, 3H, CH3), 2.54 (s, 3H, CH3), 2.66~2.70 (m, 2H, CH2), 3.91 (s, 3H, CH3), 7.25 (d, J=8.5 Hz, 2H, Ph), 7.94 (s, 1H, CH), 8.86 (s, 1H, NH), 12.50 (s, 1H, NH); 13C NMR (125 MHz, CDCl3) δ: 13.52, 15.50, 27.69, 38.38, 111.65, 123.31, 124.25, 127.85, 127.95, 134.61, 135.25, 135.65, 141.76, 149.76, 150.83, 164.05, 164.46, 179.30; HRMS calcd for C15H19N4OS [M+H]+ 303.1274, found 303.1276.
N-(2, 3, 4-三氟苯基)-1, 3-二甲基-1H-吡唑-4-酰基硫脲(6j):褐色固体, 产率42.2%. m.p. 171~172 ℃; 1H NMR (400 MHz, CDCl3) δ: 2.55 (s, 3H, CH3), 3.92 (s, 3H, CH3), 7.00~7.06 (m, 1H, Ph), 7.86~7.90 (m, 1H, Ph), 7.91 (s, 1H, CH), 8.87 (s, 1H, NH), 12.52 (s, 1H, NH); 13C NMR (125 MHz, CDCl3) δ: 13.52, 38.79, 111.42, 111.61, 111.72, 123.01, 123.07, 124.35, 124.43, 134.76, 135.24, 146.64, 147.84, 151.04, 163.90, 181.63; HRMS calcd for C13H12F3N4OS [M+H]+ 329.0678, found 329.0672.
N-(2, 6-二乙基苯基)-1, 3-二甲基-1H-吡唑-4-酰基硫脲(6k):淡黄色固体, 产率50.5%. m.p. 111~112 ℃; 1H NMR (400 MHz, CDCl3) δ: 1.26 (t, J=7.5 Hz, 6H, 2CH3), 2.54 (s, 3H, CH3), 2.66~2.69 (m, 4H, 2CH2), 3.89 (s, 3H, CH3), 7.19 (d, J=8.0 Hz, 2H, Ph), 7.32 (t, J=7.5 Hz, 1H, Ph), 7.96 (s, 1H, CH), 9.01 (s, 1H, NH), 11.91 (s, 1H, NH); 13C NMR (125 MHz, CDCl3) δ: 13.55, 14.39, 14.48, 24.26, 24.51, 38.77, 111.662, 126.16, 127.87, 133.87, 134.72, 134.91, 140.72, 141.19, 150.84, 164.15, 181.38; HRMS calcd for C17H23N4OS [M+H]+ 331.1587, found 331.1588.
3.2.2 生物活性测试
试验对象:番茄早疫病菌(Alternaria solani)、小麦赤霉病菌(Fusahum graminearum)、马铃薯晚疫病菌(Phytophthora infestans)、辣椒疫霉病菌(Phytophthora capsici)、黄瓜灰霉病菌(Botrytis cinerea)、油菜菌核病菌(Sclerotinia sclerotiorum)、水稻纹枯病菌(Thanatephorus cucumeris)、黄瓜枯萎病菌(Fusarium oxysporum)、花生褐斑病菌(Cercospora arachidicola)、苹果轮纹病菌(Botryospuaeria berengeriana).
试验处理:化合物1用DMF溶解成1% EC备用.采用菌丝生长抑制法, 评价供试化合物在50 μg/mL剂量下对10种试验靶标的室内杀菌活性, 活性测试结果如表 1所示.
辅助材料(Supporting Information) 化合物6a~6k的1H NMR和HRMS图谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Russell, P E. Outlooks Pest Manage. 2009, 20, 122.
-
[2]
Mu, J. X.; Shi, Y. X.; Yang, M. Y.; Sun, Z. H.; Liu, X. H.; Li, B. J.; Sun, N. B. Molecules 2016, 21, 68. doi: 10.3390/molecules21010068
-
[3]
Elbe, H.-L.; Rieck, H.; Dunkel, R.; Wachendorff-Neumann, U.; Mauler-Machnik, A.; Kuck, K.-H.; Kugler, M.; Jaetsch, T. WO 2002008195, 2002[Chem. Abstr. 2002, 136, 151162].
-
[4]
Elbe, H.-L.; Rieck, H.; Dunkel, R.; Zhu-Ohlbach, Q.; Mauler-Machnik, A.; Wachendorff-Neumann, U.; Kuck, K.-H. WO 2003010149, 2003[Chem. Abstr. 2003, 136, 137308].
-
[5]
Du, S.; Tian, Z.; Yang, D.; Li, X.; Li, H.; Jia, C.; Che, C.; Wang, M.; Qin, Z. Molecules 2015, 20, 8395. doi: 10.3390/molecules20058395
-
[6]
Xiong, L.; Zhu, X. L.; Shen, Y. Q.; Wishwajith, W. K. W. M.; Li, K.; Yang, G. F. Eur. J. Med. Chem. 2015, 95, 424. doi: 10.1016/j.ejmech.2015.03.060
-
[7]
Xiong, L.; Zhu, X. L.; Gao, H. W.; Fu, Y.; Hu, S. Q.; Jiang, L. N.; Yang, W. C; Yang, G. F. J. Agric. Food Chem. 2015, 64, 4830.
-
[8]
Liu, X. H.; Zhao, W.; Shen, Z. H.; Xing, J. H.; Yuan, J.; Yang, G.; Xu, T. M.; Peng, W. L. Bioorg. Med. Chem. Lett. 2016, 26, 3626. doi: 10.1016/j.bmcl.2016.06.004
-
[9]
Zhao, W.; Xing, J. H.; Xu, T. M.; Peng, W. L.; Liu, X. H. Front. Chem. Sci. Eng. 2017, 11, 363. doi: 10.1007/s11705-016-1595-x
-
[10]
Zhao, W.; Shen, Z. H.; Xu, T. M.; Peng, W. L.; Liu, X. H. Lett. Drug Des. Discovery 2017, 14, 323. doi: 10.2174/1570180813666160930164327
-
[11]
Zhao, W.; Shen, Z. H.; Xing, J. H.; Yang, G.; Xu, T. M.; Peng, W. L.; Liu, X. H. Chem. Pap. 2017, 71, 921. doi: 10.1007/s11696-016-0012-8
-
[12]
Zhao, W.; Shen, Z. H.; Xing, J. H.; Xu, T. M.; Peng, W. L.; Liu, X. H. Chin. J. Struct. Chem. 2017, 36, 423.
-
[13]
Liu, X. H.; Tan, C. X.; Weng, J. Q. Phosphorus, Sulfur Silicon Relat. Elem. 2011, 186, 558. doi: 10.1080/10426507.2010.508060
-
[14]
翟志文, 汪乔, 沈钟华, 谭成侠, 翁建全, 刘幸海, 有机化学, 2017, 37, 232. http://sioc-journal.cn/Jwk_yjhx/CN/Y2017/V37/I1/232Zhai, Z. W.; Wang, Q.; Shen, Z. H.; Tan, C. X.; Weng, J. Q.; Liu, X. H. Chin. J. Org. Chem. 2017, 37, 232 http://sioc-journal.cn/Jwk_yjhx/CN/Y2017/V37/I1/232
-
[15]
陈伟, 魏巍, 吴长春, 李玉新, 李永红, 于淑晶, 李正名, 有机化学, 2015, 35, 1576. doi: 10.6023/cjoc201501032Chen, W.; Wei, W.; Wu, C. C.; Li, Y. X.; Li, Y. H.; Yu, S. J.; Li, Z. M. Chin. J. Org. Chem. 2015, 35, 1576. doi: 10.6023/cjoc201501032
-
[16]
陈有为, 万莹莹, 刘巧霞, 刘敬波, 熊丽霞, 于淑晶, 李正名, 有机化学, 2015, 35, 882. http://sioc-journal.cn/Jwk_yjhx/CN/Y2015/V35/I4/882Chen, Y. W.; Wan, Y. Y.; Liu, Q. X.; Liu, J. B.; Xiong, L. X.; Yu, S. J.; Li, Z. M. Chin. J. Org. Chem. 2015, 35, 882 http://sioc-journal.cn/Jwk_yjhx/CN/Y2015/V35/I4/882
-
[17]
李成坤, 姜林, 王悦, 万福贤, 张沛之, 李映, 崔紫宁, 有机化学, 2014, 34, 2296. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344544.shtmlLi, C. K.; Jiang, L.; Wang, Y.; Wan, F. X.; Zhang, P. Z.; Li, Y.; Cui, Z. N. Chin. J. Org. Chem. 2014, 34, 2296 http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344544.shtml
-
[18]
Liu, X. H.; Wang, Q.; Sun, Z. H.; Wedge, D. E.; Becnel, J. J.; Estep, A. S.; Tan, C. X.; Weng, J. Q. Pest Manage. Sci. 2017, 73, 953. doi: 10.1002/ps.2017.73.issue-5
-
[19]
Chen, J. N.; Wang, X. F.; Li, T.; Wu, D. W.; Fu, X. B.; Zhang, G. J.; Shen, X. C.; Wang, H. S. Eur. J. Med. Chem. 2016, 107, 12. doi: 10.1016/j.ejmech.2015.10.045
-
[20]
Liu, X. H.; Zhai, Z. W.; Xu, X. Y.; Yang, M. Y.; Sun, Z. H.; Weng, J. Q.; Tan, C. X.; Chen, J. Bioorg. Med. Chem. Lett. 2015, 25, 5524. doi: 10.1016/j.bmcl.2015.10.064
-
[21]
Zhai, Z. W.; Shi, Y. X.; Yang, M. Y.; Zhao, W.; Sun, Z. H.; Weng, J. Q.; Tan, C. X.; Liu, X. H.; Li, B. J.; Zhang, Y. G. Lett. Drug Des. Discovery 2016, 13, 521. doi: 10.2174/157018081306160618181757
-
[22]
Liu, X. H.; Tan, C. X.; Weng, J. Q. Phosphorus, Sulfur Silicon Relat. Elem. 2011, 186, 552. doi: 10.1080/10426507.2010.508059
-
[23]
Zhang, L. J.; Yang, M. Y.; Sun, Z. H.; Tan, C. X.; Weng, J. Q.; Wu, H. K.; Liu, X. H. Lett. Drug Des. Discovery 2014, 11, 1107. doi: 10.2174/1570180811666140610212731
-
[24]
Liu, X. H.; Fang, Y. M.; Xie, F.; Zhang, R. R.; Shen, Z. H.; Tan, C. X.; Weng, J. Q.; Xu, T. M.; Huang, H. Y. Pest Manage. Sci. 2017, 73, 1900. doi: 10.1002/ps.2017.73.issue-9
-
[25]
Yan, S. L.; Yang, M. Y.; Sun, Z. H.; Min, L. J.; Tan, C. X.; Weng, J. Q.; Wu, H. K.; Liu, X. H. Lett. Drug Des. Discovery 2014, 11, 940. doi: 10.2174/1570180811666140423222141
-
[26]
孙娜波, 沈钟华, 翟志文, 武宏科, 翁建全, 谭成侠, 刘幸海, 有机化学, 2017, 37, 2044. doi: 10.6023/cjoc201702003Sun, N. B.; Shen, Z. H.; Zhai, Z. W.; Wu, H. K.; Weng, J. Q.; Tan, C. X.; Liu, X. H. Chin. J. Org. Chem. 2017, 37, 2044. doi: 10.6023/cjoc201702003
-
[27]
Zhao, W.; Shen, Z. H.; Xu, T. M.; Peng, W. L.; Liu, X.-H. J. Heterocycl. Chem. 2017, 54, 1751. doi: 10.1002/jhet.v54.3
-
[28]
Liu, X. H.; Zhao, W.; Shen, Z. H.; Xing, J. H.; Xu, T. M.; Peng, W. L. Eur. J. Med. Chem. 2017, 125, 881. doi: 10.1016/j.ejmech.2016.10.017
-
[1]
-
表 1 目标化合物的杀菌活性(抑制率/%)
Table 1. Fungicidal activity of title compounds (inhibition rate/%)
Compd. R 番茄早疫 小麦赤霉 马铃薯晚疫 辣椒疫霉 油菜菌核 黄瓜灰霉 水稻纹枯 黄瓜枯萎 花生褐斑 苹果轮纹 6a 2-F 38.7 27.3 18.9 47.6 53.8 61.0 11.6 11.1 30.0 76.9 6b 3-F 48.4 12.1 24.3 47.6 53.8 61.0 12.8 16.7 50.0 84.6 6c 3, 4-F2 38.7 12.1 21.6 42.9 69.2 48.8 12.8 11.1 20.0 65.4 6d 2, 6-F2 32.3 45.5 16.2 42.9 19.2 22.0 17.4 27.8 20.0 53.8 6e 2-OCF3 29.0 15.2 21.6 45.2 38.5 24.4 17.4 22.2 20.0 46.2 6f 2-CF3 41.9 21.2 13.5 42.9 19.2 24.4 16.3 38.9 50.0 65.4 6g 2-CH3 45.2 21.2 16.2 50.0 57.7 56.1 23.3 22.2 10.0 73.1 6h 3, 5-(CH3)2 45.2 15.2 16.2 31.0 15.4 12.2 16.3 44.4 40.0 61.5 6i 4-Et 48.4 36.4 18.9 38.1 26.9 29.3 11.6 33.3 30.0 73.1 6j 2, 3, 4-F3 48.4 21.2 13.5 38.1 38.5 24.4 34.9 11.1 10.0 69.2 6k 2, 6-Et2 64.5 30.3 29.7 38.1 38.5 22.0 69.8 61.1 70.0 96.2 氟唑菌酰胺 88.9 30.3 29.7 38.1 96.4 63.6 88.4 44.4 100 84.6 表 2 化合物6b和6k对苹果轮纹病的EC50值
Table 2. EC50 of compounds 7b and 7k
Compd. y=a+bx r EC50/(μg·mL-1) 6b y=1.6661x+3.2750 0.9937 10.41 6k y=2.2238x+2.8481 0.9936 9.28 氟唑菌酰胺 y=1.1363x+3.9777 0.9825 7.93 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 8
- 文章访问数: 1650
- HTML全文浏览量: 164




 下载:
下载:


 下载:
下载:

