 图式1
1, 1'-联异喹啉的合成
Scheme1.
Synthesis of 1, 1'-biisoquinolines
图式1
1, 1'-联异喹啉的合成
Scheme1.
Synthesis of 1, 1'-biisoquinolines

Citation: Lü Xia, Meng Tianzhuo, Zheng Bo, Zhang Yi, Wu Jiajia, Shi Xiaoxin. Synthesis of 1, 1'-Biisoquinolines via Cu-Catalyzed Oxidative Aromatization[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2663-2668. doi: 10.6023/cjoc201704007

通过铜催化氧化芳构化合成1, 1'-联异喹啉
-
关键词:
- 1, 1'-联异喹啉
- / Bischler-Napieralski环化
- / 铜催化
- / 氧化
- / 芳构化
English
Synthesis of 1, 1'-Biisoquinolines via Cu-Catalyzed Oxidative Aromatization
-
Key words:
- 1, 1'-biisoquinolines
- / Bischler-Napieralski cyclization
- / copper catalysis
- / oxidation
- / aromatization
-
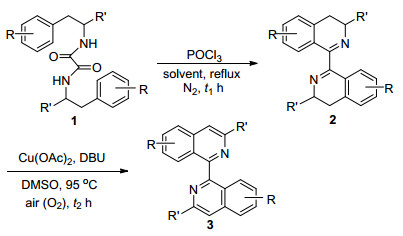
1, 1'-联异喹啉是一类非常重要的具有C2对称性的含氮杂环化合物, 已经被广泛地用作双齿配体与金属络合或者用于均相催化反应中[1].然而, 到目前为止已知的合成1, 1'-联异喹啉的方法非常有限, 试剂昂贵且不易放大, 因此发展一种实用的高效合成1, 1'-联异喹啉的新方法很有意义.文献中已报道的合成1, 1'-联异喹啉方法主要分为两类:一类是1-卤代-异喹啉在金属催化下发生偶联得到1, 1'-联异喹啉[2]; 另一类是八氢-1, 1'-联异喹啉或四氢-1, 1'-联异喹啉通过钯催化脱氢生成1, 1'-联异喹啉[3].因为3, 3', 4, 4'-四氢-1, 1'-联异喹啉可方便地通过N, N'-二苯乙基草酰胺的Bischler-Napieralski[4]环化反应制备得到, 所以3, 3', 4, 4'-四氢-1, 1'-联异喹啉的高效催化芳构化可能是一种合成1, 1'-联异喹啉的比较理想的方法.文献中使用昂贵的钯试剂作为四氢/或八氢-1, 1'-联异喹啉的脱氢芳构化催化剂, 而且所需钯催化剂用量较大, 存在严重的局限性.本文中我们报道一种以廉价的Cu(OAc)2作催化剂, 以空气作为绿色氧化剂的3, 3', 4, 4'-四氢-1, 1'-联异喹啉的氧化芳构化方法, 可方便地制备1, 1'-联异喹啉.
1 结果与讨论
本文采用的合成路线如Scheme 1所示, N, N'-二苯乙基草酰胺1首先在氮气保护下于乙腈或甲苯中回流条件下与6.0 equiv. POCl3发生Bischler-Napieralski环化反应, 生成3, 3', 4, 4'-四氢-1, 1'-联异喹啉(2).化合物2在0.3 equiv. Cu(OAc)2和0.3 equiv. DBU (1, 8-二氮杂双环[5,4,0]十一烯-7) 催化下于二甲基亚砜(DMSO)中95 ℃下发生空气氧化芳构化反应, 生成1, 1'-联异喹啉(3).共合成了10个各种取代的1, 1'-联异喹啉(3a~3j), 结果如表 1所示.从表 1中可以看出:当苯环上没有强供电子基(OMe)时(表 1, Entries 1, 2), 草酰胺1a和1b的Bischler-Napieralski环化反应需要较高的反应温度, 因此反应宜在甲苯中回流(110 ℃), 而后续的3, 3', 4, 4'-四氢-1, 1'-联异喹啉2a和2b的铜催化空气氧化芳构化反应较快; 当苯环上有强供电子基(OMe)时(表 1, Entries 3~10), 草酰胺1c~1j的Bischler-Napieralski环化反应需要相对较低的反应温度, 反应仅需在乙腈中回流(81 ℃), 而后续的3, 3', 4, 4'-四氢-1, 1'-联异喹啉2a~2j的铜催化空气氧化芳构化反应相对较慢.另外, 值得注意的是表 1中所制的中间体3, 3', 4, 4'-四氢-1, 1'-联异喹啉2a~2j含有少量的(约5%)双键异构化产物2, 3, 4, 4'-四氢-1, 1'-联异喹啉[5], 但这些双键异构化产物无需分离除去, 因为它们也能发生铜催化空气氧化芳构化反应生成相应的1, 1'-联异喹啉.
上述合成1, 1'-联异喹啉的二步总收率偏低, 这主要是由于草酰胺1的Bischler-Napieralski环化反应收率通常偏低[5, 6, 7a].但当我们用经柱层析纯化过的中间体3, 3', 4, 4'-四氢-1, 1'-联异喹啉2为原料进行醋酸铜催化氧化芳构化反应时, 该芳构化反应的收率很高.我们以纯净的四氢-1, 1'-联异喹啉2f为原料, 对其铜催化氧化芳构化反应进行了条件优化, 考察了溶剂、胺及铜试剂对反应的影响, 结果如表 2所示.从表 2中可以看出:在无铜催化剂存在下, 反应几乎不发生(表 2, Entry 1);在DMSO中, 四种铜催化剂都能使反应发生, 以很高的收率得到1, 1'-联异喹啉3f(表 2, Entries 2~5), 而用Cu(OAc)2作催化剂时, 收率最佳; Cu(OAc)2的最佳用量为0.3 equiv. (30 mol%), 当减少催化剂用量时, 反应需提高温度才能完成(表 2, Entries 5~7);当反应在二甲基甲酰胺(DMF)、1, 4-二氧六环(1, 4-dioxane)、乙腈或丙醇中进行时, 收率仅为中等(表 2, Entries 8~11);当使用二异丙基乙胺(DIPEA)、三乙胺、对二甲胺基吡啶(DMAP)或吡啶作配体时, 反应收率也仅为中等(表 2, Entries 12~15).
 表 2
铜催化氧化芳构化的反应条件优化
Table 2.
Optimization of reaction conditions for the copper-catalyzed oxidative aromatization
表 2
铜催化氧化芳构化的反应条件优化
Table 2.
Optimization of reaction conditions for the copper-catalyzed oxidative aromatization

Entry Catalyst (equiv.) Base (equiv.) Solvent T/℃ t/h Yield a/% 1 None DBU(0.3) DMSO 95 8 0 2 CuBr2(0.3) DBU(0.3) DMSO 95 8 95 3 CuCl2(0.3) DBU(0.3) DMSO 95 8 96 4 Cu2SO4(0.5) DBU(0.5) DMSO 95 10 93 5 Cu(OAc)2(0.3) DBU(0.3) DMSO 95 6 98 6 Cu(OAc)2(0.2) DBU(0.2) DMSO 105 6 94 7 Cu(OAc)2(0.1) DBU(0.1) DMSO 120 6 90 8 Cu(OAc)2(0.3) DBU(0.3) DMF 95 10 85 9 Cu(OAc)2(0.3) DBU(0.3) 1, 4-Dioxane 101b 6 76 10 Cu(OAc)2(0.3) Cu(OAc)2(0.3) DBU(0.3) DBU(0.3) CH3CN PrOH 81b 10 81 11 Cu(OAc)2(0.3) DBU(0.3) PrOH 97b 8 70 12 Cu(OAc)2(0.5) DIPEAc (0.5) DMSO 95 8 60 13 Cu(OAc)2(0.5) Et3N(0.5) DMSO 95 8 75 14 Cu(OAc)2(0.5) DMAPd(0.5) DMSO 95 8 83 15 Cu(OAc)2(0.5) Pyridine(0.5) DMSO 95 8 81 aIsolated yield. bRefluxing. cN, N-Diisopropyl N-ethyl amine. d4-N, N-Dimethylaminopyridine. 2 结论
报道了一种简便实用的合成1, 1'-联异喹啉的新方法.首先N, N'-二苯乙基草酰胺1与POCl3发生经典的Bischler-Napieralski环化反应, 得到3, 3', 4, 4'-四氢-1, 1'-联异喹啉2; 然后该中间体2在Cu(OAc)2催化下发生氧化芳构化反应生成1, 1'-联异喹啉3.该方法利用空气为洁净氧化剂, 廉价的醋酸铜为催化剂, 经济、环保, 可用于制备各种取代的1, 1'-联异喹啉.其中, 3, 3', 4, 4'-四氢-1, 1'-联异喹啉的铜催化氧化芳构化反应是首次发现, 未见文献报道.
3 实验部分
3.1 仪器与试剂
熔点测定使用Mel-TEMP II熔点仪测定; 红外光谱采用Nicolet Magna IR-550型红外光谱仪测定; 核磁共振氢谱和碳谱采用Bruker AM-400型核磁共振仪测定, TMS为内标; 高分辨质谱采用HP5989A高分辨质谱仪测定.所有试剂均为市售分析纯, 未经进一步纯化. N, N'-二苯乙基草酰胺(1a~1j)可按文献方法[7]制备得到.
3.2 实验方法
室温下, 向搅拌着的N, N'-二苯乙基草酰胺1 (10 mmol)的甲苯(10 mL)或乙腈(10 mL)的混浊液中滴加三氯氧磷(60 mmol), 滴加完毕后, 将混合液在氮气保护下加热至回流, 回流时间(t1/h)如表 1所示.然后将反应混合物冷却至室温, 将其慢慢倒入搅拌着的碎冰(150 g)和水(30 mL)的混合物中.完毕后, 加入石油醚(100 mL), 继续搅拌30 min后静止分层.用分液漏斗分出水层, 弃去石油醚层.向水层中慢慢加入碳酸钾粉末, 将水相调至碱性(pH=9~10), 再用乙酸乙酯萃取水相3次(100 mL×3).合并有机相后, 加入活性炭(1 g)和无水硫酸镁(5 g), 室温下剧烈搅拌5 h.抽滤, 减压浓缩蒸除乙酸乙酯得到3, 3', 4, 4'-四氢-1, 1'-联异喹啉2的粗产物, 该粗产物不需分离直接用于下步反应.
将上述2的粗产物溶于DMSO (15 mL), 加入Cu(OAc)2 (3.0 mmol)和DBU (3.0 mmol).将所得溶液转移到三颈瓶中, 并加热至95 ℃.然后在此温度下搅拌反应, 反应时间(t2/h)如表 1所示.将反应液冷却至室温, 并倒入乙酸乙酯(120 mL)和水(100 mL)的混合液中, 搅拌15 min后静止分层.用分液漏斗分出有机层, 水相用乙酸乙酯(60 mL)再萃取一次.合并有机相后用无水硫酸镁干燥, 抽滤, 减压浓缩蒸除乙酸乙酯得到1, 1'-联异喹啉3的粗产物, 该粗产物经柱层析[洗脱液: V(EtOAc):V(CH2Cl2)=1:6~1:2]分离得到化合物3.
1, 1'-联异喹啉(3a):淡黄色固体, 产率70%, m.p. 180~181 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.71 (d, J=5.7 Hz, 2H), 7.94 (d, J=8.3 Hz, 2H), 7.81 (d, J=5.7 Hz, 2H), 7.75 (d, J=8.6 Hz, 2H), 7.70 (dd, J=8.3, 8.5 Hz, 2H), 7.47 (dd, J=8.6, 8.5 Hz, 2H); 13C NMR (100 MHz, CDCl3) δ: 158.12, 141.95, 136.85, 130.37, 127.82, 127.57, 127.19, 126.93, 121.08; IR (KBr) ν: 3050, 2101, 1637, 1620, 1557, 1318, 1123, 927, 829, 749, 636, 566, 443 cm-1; HRMS (ESI) calcd for C18H13N2 [M+H]+ 257.1079, found 257.1070.
7, 7'-二甲基-1, 1'-联异喹啉(3b):白色固体, 产率72%, m.p. 128~129 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.65 (d, J=5.6 Hz, 2H), 7.84 (d, J=8.4 Hz, 2H), 7.76 (d, J=5.6 Hz, 2H), 7.53 (d, J=8.4 Hz, 2H), 7.48 (s, 2H), 2.37 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 157.58, 141.15, 137.61, 135.24, 132.73, 128.03, 126.76, 125.80, 120.81, 21.99;IR (KBr film) ν: 3051, 2916, 2130, 1627, 1587, 1549, 1501, 1439, 1303, 1144, 839, 647, 500, 465 cm-1; HRMS (ESI) calcd for C20H17N2 [M+H]+ 285.1392, found 285.1395.
7, 7'-二甲氧基-1, 1'-联异喹啉(3c):白色固体, 产率74%, m.p. 125~126 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.60 (d, J=5.6 Hz, 2H), 7.84 (d, J=9.0 Hz, 2H), 7.73 (d, J=5.6 Hz, 2H), 7.37 (dd, J=9.0, 2.4 Hz, 2H), 7.10 (d, J=2.4 Hz, 2H), 3.68 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 158.51, 156.52, 140.15, 132.83, 128.90, 128.51, 123.54, 120.83, 104.68, 55.28; IR (KBr) ν: 3042, 2922, 2834, 2052, 1624, 1506, 1441, 1387, 1231, 1150, 1033, 904, 835, 646 cm-1; HRMS (ESI) calcd for C20H17N2O2 [M+H]+ 317.1290, found 317.1291.
6, 6'-二甲氧基-1, 1'-联异喹啉(3d):黄色固体, 产率82%, m.p. 183~184 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.60 (d, J=5.7 Hz, 2H), 7.68 (d, J=5.7 Hz, 2H) 7.64 (d, J1=9.2 Hz, 2H), 7.15 (d, J=2.5 Hz, 2H), 7.08 (dd, J=9.2, 2.5 Hz, 2H), 3.94 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 160.79, 157.61, 142.56, 138.95, 129.06, 123.58, 120.49, 120.28, 104.31, 55.51; IR (KBr) ν: 3012, 2934, 2830, 2037, 1623, 1558, 1468, 1402, 1264, 1246, 1135, 1027, 922, 860, 637, 565 cm-1; HRMS (ESI) calcd for C20H17N2O2 [M+H]+ 317.1290, found 317.1293.
6, 6'-二乙氧基-1, 1'-联异喹啉(3e):白色固体, 产率84%, m.p. 178~179 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.59 (d, J=5.8 Hz, 2H), 7.65 (d, J=5.8 Hz, 2H), 7.62 (d, J=9.3 Hz, 2H), 7.13 (d, J=2.4 Hz, 2H), 7.07 (dd, J=9.3 Hz, 2.4 Hz, 2H), 4.17 (q, J=7.0 Hz, 4H), 1.47 (t, J=7.0 Hz, 6H); 13C NMR (100 MHz, CDCl3) δ: 160.12, 157.65, 142.52, 138.95, 129.03, 123.50, 120.71, 120.20, 104.94, 63.77, 14.65; IR (KBr) ν: 3055, 2982, 2109, 1620, 1554, 1461, 1386, 1336, 1245, 1141, 1041, 924, 832, 723, 641, 566 cm-1; HRMS (ESI) calcd for C22H21N2O2 [M+H]+ 345.1603, found 345.1604.
6, 6', 7, 7'-四甲氧基-1, 1'-联异喹啉(3f):淡黄色固体, 产率85%, m.p. 219~220 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.57 (d, J=5.5 Hz, 2H), 7.65 (d, J=5.6 Hz, 2H), 7.18 (s, 2H), 7.14 (s, 2H), 4.06 (s, 6H), 3.74 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 155.79, 152.96, 150.25, 140.94, 134.13, 123.73, 119.77, 105.24, 104.84, 56.09, 55.79; IR (KBr) ν: 3051, 2991, 2834, 2167, 1623, 1508, 1479, 1435, 1254, 1149, 1118, 932, 851, 762 cm-1; HRMS (ESI) calcd for C22H21N2O4 [M+H]+ 377.1501, found 377.1496.
6, 6', 7, 7', 8, 8'-六甲氧基-1, 1'-联异喹啉(3g):白色固体, 产率88%, m.p. 201~202 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.43 (d, J=5.7 Hz, 2H), 7.52 (d, J=5.7 Hz, 2H), 6.97 (s, 2H), 4.01 (s, 6H), 3.77 (s, 6H), 3.17 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 158.91, 156.33, 149.54, 141.86, 141.32, 134.62, 118.70, 118.55, 101.20, 60.77, 60.28, 55.94; IR (KBr) ν: 3050, 2938, 2105, 1612, 1552, 1469, 1420, 1312, 1267, 1231, 1143, 1116, 1017, 853, 639 cm-1; HRMS (ESI) calcd for C24H25N2O6 [M+H]+ 437.1713, found 437.1709.
5, 5', 6, 6', 7, 7'-六甲氧基-1, 1'-联异喹啉(3h):白色固体, 产率86%, m.p. 195~196 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.56 (d, J=5.7 Hz, 2H), 7.96 (d, J=5.7 Hz, 2H), 6.99 (s, 2H), 4.09 (s, 6H), 4.00 (s, 6H), 3.74 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 155.94, 153.77, 146.73, 144.11, 140.30, 129.44, 124.85, 115.00, 101.47, 61.66, 61.20, 55.84; IR (KBr) ν: 3006, 2941, 2114, 1619, 1472, 1261, 1121, 1032, 918, 823, 725, 566 cm-1; HRMS (ESI) calcd for C24H25N2O6 [M+H]+ 437.1713, found 437.1704.
6, 6', 7, 7'-四甲氧基-[1, 1'-联异喹啉]-3, 3'-二羧酸甲酯(3i):黄色固体, 产率78%, m.p. 267~268 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.56 (s, 2H), 7.78 (s, 2H), 7.28 (s, 2H), 4.07 (s, 6H), 4.00 (s, 6H), 3.85 (s, 6H); 13C NMR (100 MHz, CDCl3) δ: 166.59, 154.22, 153.31, 152.23, 138.90, 134.33, 125.91, 123.38, 106.19, 106.15, 56.25, 55.96, 52.72;IR (KBr) ν: 3015, 2948, 2108, 1707, 1618, 1508, 1423, 1260, 1154, 1124, 1004, 927, 905, 731, 567 cm-1; HRMS (ESI) calcd for C26H25N2O8 [M+H]+ 493.1611, found 493.1612.
6, 6', 7, 7'-四甲氧基-[1, 1'-联异喹啉]-3, 3'-二羧酸丙酯(3j):白色固体, 产率76%, m.p. 229~230 ℃; 1H NMR (400 MHz, CDCl3) δ: 8.51 (s, 2H), 7.84 (s, 2H), 7.28 (s, 2H), 4.37 (t, J=6.9 Hz, 4H), 4.06 (s, 6H), 3.86 (s, 6H), 1.79~1.85 (m, 4H), 1.00 (t, J=7.4 Hz, 6H); 13C NMR (100 MHz, CDCl3) δ: 165.96, 154.34, 153.24, 152.11, 139.18, 134.30, 125.89, 123.17, 106.36, 106.10, 67.08, 56.24, 56.06, 22.18, 10.43; IR (KBr) ν: 3016, 2964, 2924, 2102, 1734, 1618, 1508, 1423, 1205, 1151, 1127, 1030, 921, 731, 566 cm-1; HRMS (ESI) calcd for C30H33N2O8 [M+H]+ 549.2237, found 549.2230.
辅助材料(Supporting Information)产物1, 1'-联异喹啉3a~3j的1H NMR、13C NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Dai, L.; Zhou, Z.; Zhang, Y.; Ni, C.; Zhang, Z.; Zhou, Y. J. Chem. Soc., Chem. Commun. 1987, 1760.
(b) Maeda, K.; Matsuyama, Y.; Isozaki, K..; Yamada, S.; Mori, Y. J. Chem. Soc., Perkin Trans. 21996, 121.
(c) Yu, W.-Y.; Fung, W.-H.; Zhu, J.-L.; Cheung, K.-K.; Ho, K.-K.; Che, C.-M. J. Chin. Chem. Soc. 1999, 46, 341.
(d) Ashby, M. T.; Alguindigue, S. S.; Schwane, J. D.; Daniel, T. A. Inorg. Chem. 2001, 40, 6643.
(e) Nakajima, M.; Saito, M.; Uemura, M.; Hashimoto, S. Tetrahedron Lett. 2002, 43, 8827.
(f) Glazer, E. C.; Tori, Y. Angew. Chem., Int. Ed. 2002, 41, 4022.
(g) Frediani, P.; Giannelli, C.; Salvini, A.; Ianelli, S. J. Organomet. Chem. 2003, 667, 197.
(h) Zhao, Q.; Liu, S.; Shi, M.; Wang, C.; Yu, M.; Li, L.; Li, F.; Yi, T.; Huang, C. Inorg. Chem. 2006, 45, 6152.
(i) Durola, F.; Sauvage, J.-P.; Wenger, O. S. Chem. Commun. 2006, 171.
(j) Durola, F.; Hanss, D.; Roesel, P.; Sauvage, J.-P.; Wenger, O. S. Eur. J. Org. Chem. 2007, 125. -
[2]
(a) Case, F. H. J. Org. Chem. 1952 17, 471.
(b) Iyoda, M.; Otsuka, H.; Sato, K.; Nisato, N.; Oda, M. Bull. Chem. Soc. Jpn. 1990, 63, 80.
(c) Chang, Y. M.; Lee, S. H.; Cho, M. Y.; Yoo, B. W.; Rhee, H. J.; Lee, S. H.; Yoon, C. M. Synth. Commun. 2005, 35, 1851.
(d) Schwab, P. F. H.; Fleiscker, F.; Michl, J. J. Org. Chem. 2002, 67, 443.
(e) Malkov, A. V.; Westwater, M.-M.; Gutnov, A., Ramirez-Lopez, P.; Friscourt, F.; Kadlcikova, A.; Hodacova, J.; Rankovic, Z.; Kotora, M.; Kocovsky, P. Tetrahedron 2008, 64, 11335.
(f) Kammer, S.; Kelling, A.; Baier, H.; Mickler, W.; Dosche, C.; Rurack, K.; Kapp, A.; Lisdat, F.; Holdt, H.-J. Eur. J. Inorg. Chem. 2009, 4648. -
[3]
(a) Nielsen, A. T. J. Org. Chem. 1970, 35, 2498.
(b) Yao, Q. J.; Khong, D. T.; Gao, Q.; Judeh, Z. M. A. Synthesis 2014, 46, 1793. -
[4]
(a) Bischler, A.; Napieralski, B. Chem. Ber. 1893, 26, 1903.
(b) Whaley, W. M.; Govindachari, T. R. In Organic Reactions, Ed.:Adams, R., John Wiley and Sons, New York, 1951, Vol. VI, p. 74.
(c) Zhu, R.; Xu, Z.; Ding, W.; Liu, S.; Shi, X.; Lu, X. Chin. J. Chem. 2014, 32, 1039. -
[5]
Kuo, C.-Y.; Wu, M.-J.; Liu, C.-C. Eur. J. Med. Chem. 2010, 45, 55. doi: 10.1016/j.ejmech.2009.09.023
-
[6]
(a) Qi, G. ; Ji, Y. Q. ; Judeh, Z. M. A. Tetrahedron 2010, 66, 4195.
(b) Siegfried, V. M. -A. ; Hilpert, H. ; Rey, M. ; Dreiding, A. S. Helv. Chim. Acta 1980, 63, 938. -
[7]
(a) Roding, M. J. ; Seo, H. ; Hirsch-Weil, D. ; Abboud, K. A. ; Hong, S. Tetrahedron: Asymmetry 2011, 22, 1097.
(b) Blay, G. ; Fernandez, I. ; Maco-Aleixandre, A. ; Pedro, J. R. Tetrahedron: Asymmetry 2005, 16, 1207.
(c) Li, X. ; Chen, X. -Y. ; Yuan, Q. -L. ; Zhang, D. -F. ; Huang, B. -T. Chin. J. Org. Chem. 2006, 26, 1100(in Chinese).
(李选, 陈晓影, 袁荞龙, 张丹枫, 黄葆同, 有机化学, 2006, 26, 1100. )
-
[1]
-
表 1 各种取代的1, 1'-联异喹啉3a~3j的合成
Table 1. Synthesis of various substituted 1, 1'-biisoquinolines 3a~3j

表 2 铜催化氧化芳构化的反应条件优化
Table 2. Optimization of reaction conditions for the copper-catalyzed oxidative aromatization

Entry Catalyst (equiv.) Base (equiv.) Solvent T/℃ t/h Yield a/% 1 None DBU(0.3) DMSO 95 8 0 2 CuBr2(0.3) DBU(0.3) DMSO 95 8 95 3 CuCl2(0.3) DBU(0.3) DMSO 95 8 96 4 Cu2SO4(0.5) DBU(0.5) DMSO 95 10 93 5 Cu(OAc)2(0.3) DBU(0.3) DMSO 95 6 98 6 Cu(OAc)2(0.2) DBU(0.2) DMSO 105 6 94 7 Cu(OAc)2(0.1) DBU(0.1) DMSO 120 6 90 8 Cu(OAc)2(0.3) DBU(0.3) DMF 95 10 85 9 Cu(OAc)2(0.3) DBU(0.3) 1, 4-Dioxane 101b 6 76 10 Cu(OAc)2(0.3) Cu(OAc)2(0.3) DBU(0.3) DBU(0.3) CH3CN PrOH 81b 10 81 11 Cu(OAc)2(0.3) DBU(0.3) PrOH 97b 8 70 12 Cu(OAc)2(0.5) DIPEAc (0.5) DMSO 95 8 60 13 Cu(OAc)2(0.5) Et3N(0.5) DMSO 95 8 75 14 Cu(OAc)2(0.5) DMAPd(0.5) DMSO 95 8 83 15 Cu(OAc)2(0.5) Pyridine(0.5) DMSO 95 8 81 aIsolated yield. bRefluxing. cN, N-Diisopropyl N-ethyl amine. d4-N, N-Dimethylaminopyridine. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 6
- 文章访问数: 1526
- HTML全文浏览量: 126


 下载:
下载:
 下载:
下载:

